高温胁迫对枣苗生理特性的影响
2018-05-08樊丁宇
靳 娟,杨 磊,樊丁宇,郝 庆
(新疆农业科学院园艺作物研究所/农业部新疆地区果树科学观测实验站,乌鲁木齐 830091)
0 引 言
【研究意义】枣(ZiziphusjujubaMill.)为鼠李科(Rhamnaceae)枣属(ZizyphusMill)植物,是中国最早栽培的果树之一,也是我国的第一大干果树种[1-2]。新疆是枣的主产区之一,2015年底新疆红枣种植面积约为4.95×105hm2,总产量约为3.05×106t,枣产业为带动新疆经济的发展起着重要作用[3]。【前人研究进展】40℃高温造成‘翠冠’梨和‘园黄’梨叶绿体、线粒体等细胞器数量、形态和结构发生显著变化[4],甚至改变葡萄[5-6]、猕猴桃[7]等果树叶片的气孔特征,降低灰枣[8]、砂梨[9]等果树的光合速率。高温还会造成梨[10]、枣[11]、葡萄[12]叶片细胞膜透性增大,膜脂过氧化加剧。此外,高温胁迫下活性氧的积累促使猕猴桃[13]、苹果[14]、葡萄[15]等果树的SOD、POD和CAT等抗氧化酶活性增强,以减轻高温胁迫的伤害。【本研究切入点】近年来新疆频繁出现超过40℃的短期极端高温天气[16],对枣树的危害严重,表现为大面积“焦花”、落花落果、果面灼伤、产量和品质下降等现象。研究高温胁迫对枣叶片生理生化指标的影响。【拟解决的关键问题】以酸枣和灰枣穴盘苗为材料,测定枣叶片在高温胁迫下的细胞膜透性、丙二醛(MDA)含量、渗透调节物质、抗氧化酶活性以及光合色素含量的变化,研究枣实生苗对高温胁迫的适应机制,为制定防御高温胁迫的策略提供理论参考。
1 材料与方法
1.1 材 料
挑选健康饱满、大小一致的酸枣和灰枣种子,室温清水浸泡24 h促进种子发芽。种子催芽后播种于基质中培养。待幼苗十四叶一心时,于2017年5月30日挑选长势基本一致的植株置于人工智能气候培养箱(上海一恒科学仪器有限公司制造),培养箱条件设置:昼/夜为14 h/10 h,温度为30℃/20℃,相对湿度为80%左右,光合有效辐射为100 μmol/(m2·s)。
于2017年6月6日选择生长一致的植株进行高温处理,高温胁迫期间湿度保持在80%左右,处理温度为45℃/35℃,光暗周期为14 h/ 10 h。材料在人工培养箱内随机排列,高温胁迫期间每天20:00浇1次水,保证水分充足,并按照顺序变换位置以保证生长条件一致。于高温处理0、1、3和5 d采集叶片,取样时间定为16:00,3次重复,叶片经液氮速冻后保存于-80℃冰箱中。
1.2 方 法
1.2.1 相对电导率和MDA含量测定
叶片相对电导率参考李合生[17]的方法,使用DDS-307A型电导率仪测定。MDA含量参照Herth和Paker[18]的方法测定。
1.2.2 渗透调节物质含量测定
可溶性糖、可溶性蛋白和脯氨酸含量参照邹琦[19]的方法测定。
1.2.3 抗氧化酶活性测定
SOD活性测定采用氮蓝四唑光化还原法[20]。POD活性测定采用愈创木酚氧化法[21]。CAT活性测定采用紫外分光光度法[22]。
1.2.4 光合色素含量测定
光合色素含量参照Arnon[23]的方法测定。
1.3 数据处理
采用Microsoft Excel 2016软件进行数据处理,Origin Pro 8.0软件作图,利用SPSS 17.0软件进行方差分析。表中数据以“平均值±标准差”表示。
2 结果与分析
2.1高温胁迫对枣苗相对电导率和MDA含量的影响
研究表明,与对照(0 d)相比,45℃高温处理第1 d和第3 d酸枣幼苗叶片相对电导率没有显著差异,处理第5 d相对电导率显著提高18.1%。灰枣实生苗叶片相对电导率在处理第3 d和5 d较对照分别显著提高25.4%和37.9%。随着高温处理时间的延长,酸枣叶片MDA含量变化不显著,而灰枣实生苗叶片MDA含量在处理第1 d、3 d和5 d较对照分别显著提高70.4%、121.8%和174.3%,在高温胁迫下,酸枣叶片细胞膜稳定性较灰枣实生苗强,细胞膜损坏程度小,叶片受高温伤害的程度轻。图1
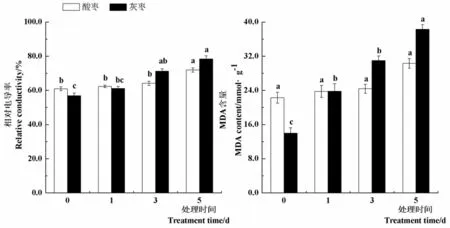
注:柱形图上不同小写字母表示同一品种不同处理间差异显著(P< 0.05),下同
Note: Different letters in the column indicate significant difference among different treatment of the same variety (P< 0.05) , the same as below
图1 高温胁迫下枣叶片相对电导率和丙二醛含量变化
Fig.1 Effect of high temperature stress on relative conductivity and MDA content of jujube leaves
2.2 高温胁迫对枣苗渗透调节物质含量的影响
研究表明,与对照相比,酸枣和灰枣实生苗叶片可溶性糖含量均在高温处理第1 d显著下降,较对照分别降低13.3%和87.6%,之后显著上升。高温处理下酸枣和灰枣实生苗叶片中可溶性蛋白含量变化不大,均在高温处理第5 d达到最大值,分别为4.477和4.212 mg/g。高温处理第3 d和5 d酸枣和灰枣实生苗叶片中脯氨酸含量较对照均显著升高,其中酸枣分别提高82.5%和230.3%,灰枣实生苗分别提高59.5%和211.6%,由此可以说明,酸枣和灰枣实生苗主要是通过提高叶片中可溶性糖和脯氨酸含量来抵御高温胁迫的。图2
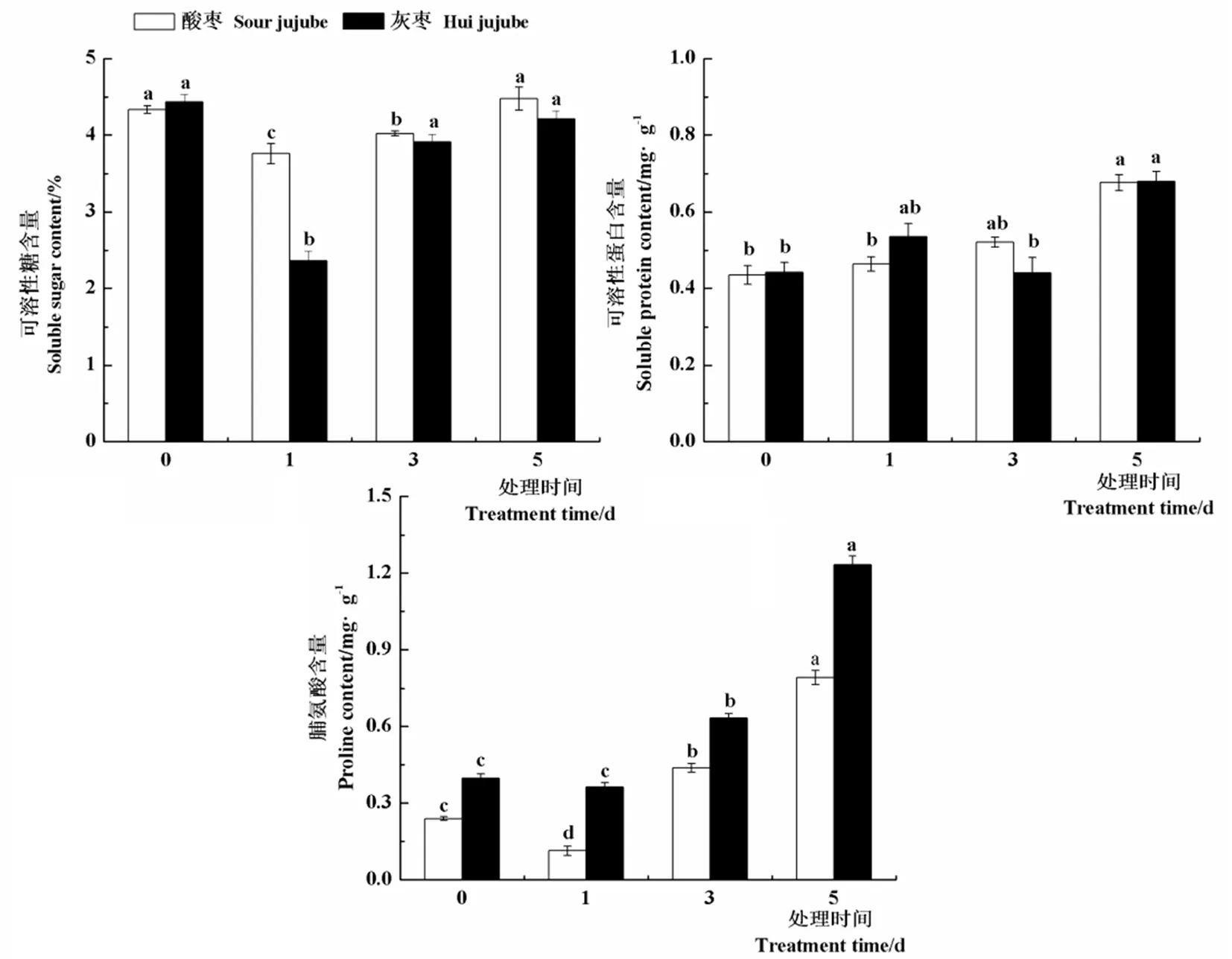
图2 高温胁迫下枣叶片可溶性糖、可溶性蛋白及脯氨酸含量变化
Fig.2 Effect of high temperature stress on soluble sugar, soluble protein and proline content of jujube leaves
2.3 高温胁迫对枣苗3种抗氧化酶活性的影响
研究表明,与对照相比,随着高温处理时间的延长,酸枣叶片SOD活性显著升高,处理第1 d、3 d和5 d叶片SOD活性较对照分别提高28.9%、61.7%和65.3%;灰枣实生苗SOD活性表现出先下降后上升的趋势。高温处理下酸枣和灰枣实生苗POD活性变化不大,均在高温处理第5 d达到最大值,分别为592.92和575.97 U/(g·min)。与对照相比,随着高温处理时间的延长,酸枣和灰枣实生苗CAT活性均显著升高,高温处理第1 d、3 d和5 d酸枣叶片CAT活性分别比对照提高18.2%、67.3%和92.7%,灰枣实生苗叶片CAT活性分别比对照提高66.6%、92.5%和200.0%。由此可以看出,高温胁迫下,酸枣和灰枣实生苗叶片通过保持较高的SOD和CAT活性来减轻高温胁迫的伤害。图3
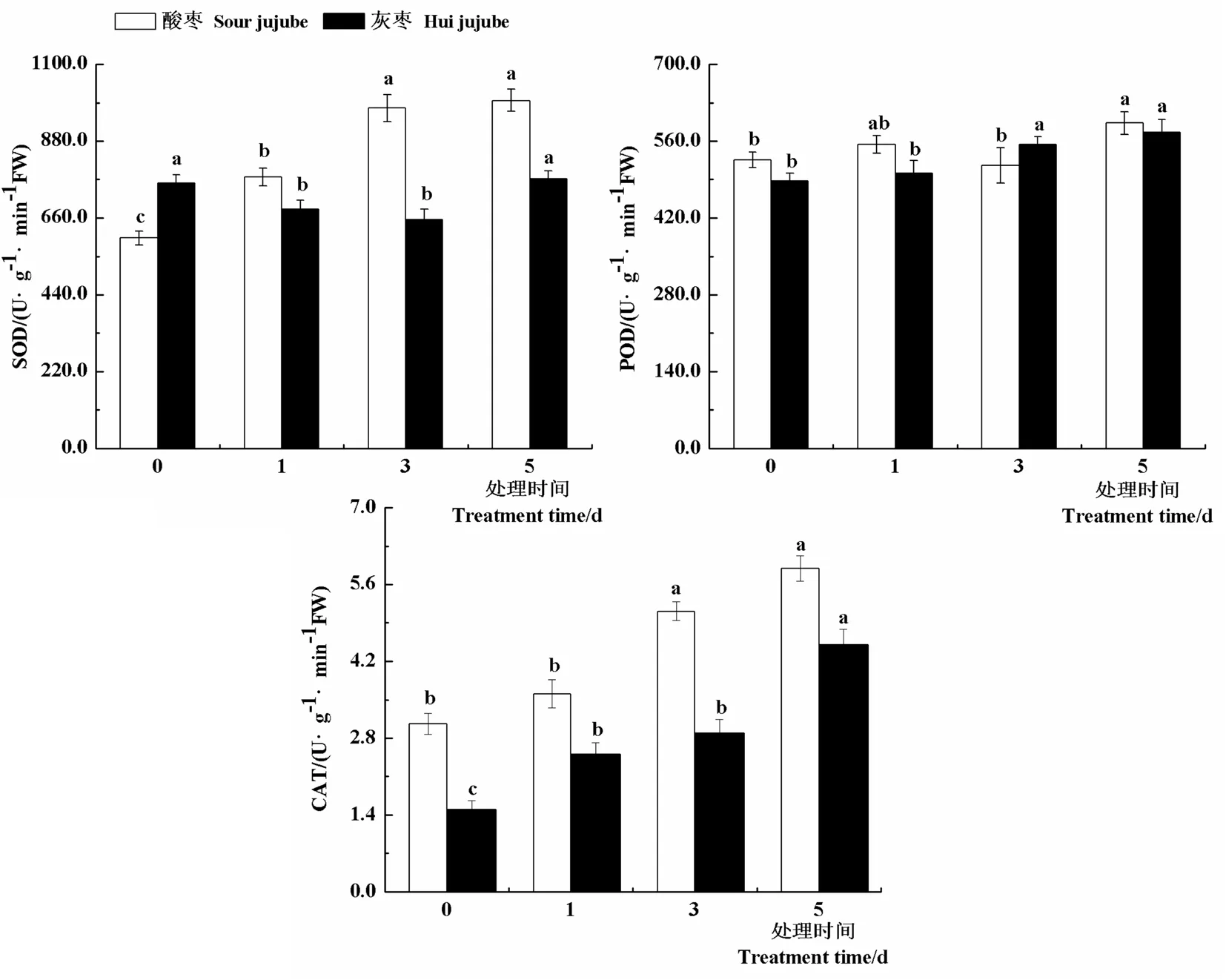
图3 高温胁迫下枣叶片抗氧化酶活性变化
Fig.3 Effect of high temperature stress on antioxidant enzyme activity of jujube leaves
2.4 高温胁迫对枣苗光合色素含量的影响
在逆境条件下,植物的光合功能降低常常与光合色素的变化有关。研究表明,高温处理1 d后,酸枣和灰枣实生苗叶片中叶绿素a、叶绿素b、叶绿素总量和类胡萝卜素含量较对照没有显著差异,之后显著下降,高温处理5 d后酸枣和灰枣实生苗叶片中叶绿素a含量分别比对照降低13.8%和25.2%,叶绿素b含量分别比对照降低30.7%和34.6%,叶绿素总量分别比对照降低21.1%和24.1%,类胡箩卜素含量分别比对照降低18.0%和33.9%。随着高温胁迫时间的延长,酸枣和灰枣实生苗叶片光合色素含量显著下降,光合作用受到抑制。图4
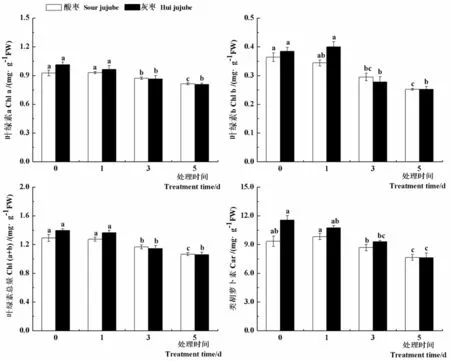
图4 高温胁迫下枣叶片光合色素变化
Fig.4 Effect of high temperature stress on the photosynthetic pigments of jujube leaves
3 讨 论
在逆境胁迫下,植物体内活性氧(ROS)会大量积累,活性氧代谢系统失去平衡,ROS攻击细胞内不饱和脂肪酸,膜脂过氧化加剧,导致膜系统损伤和细胞伤害,植物生理代谢受阻,严重时导致植株死亡[24-25]。高温胁迫下植物体内活性氧积累的直接表现为细胞膜透性增加[26]。高温胁迫下梨[10]、枣[11]、葡萄[12]等果树叶片细胞膜透性增大,植株受到伤害。研究结果显示,高温处理不同时间下,酸枣叶片相对电导率仅在处理第5 d 显著增加,MDA含量变化不显著,而灰枣实生苗叶片相对电导率和MDA含量随着高温处理时间的延长逐渐升高,说明在高温胁迫下,酸枣幼苗叶片细胞膜稳定性较灰枣实生苗强,受高温伤害的程度轻。
超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)等抗氧化酶活性与植物的耐热性密切相关[27]。‘海沃德’猕猴桃叶片SOD、POD、CAT、APX活性在高温胁迫初期均呈上升趋势,随处理时间延长,活性下降[14]。40℃高温胁迫下‘嘎啦’苹果叶片APX、GR等酶活性显著高于对照,在处理4 h达到峰值,之后下降[15]。王进等[10]研究发现高温胁迫下黄花梨和绿宝石梨叶片的SOD、CAT、POD活性先降后升再下降。试验中,与对照相比,随着高温处理时间的延长,酸枣苗叶片SOD和CAT活性显著升高,灰枣实生苗SOD活性先下降后上升,CAT活性显著升高,表明酸枣和灰枣实生苗均可通过提高体内SOD和CAT活性来清除活性氧,减轻高温伤害。
高温胁迫下,植物细胞能主动合成糖类、脯氨酸、可溶性蛋白、甜菜碱等物质,以增加细胞溶质浓度,降低渗透势,缓和高温胁迫[28]。Van等[29]研究发现44℃高温胁迫下四季杧和台农一号杧2种杧果叶片可溶性糖、可溶性蛋白和脯氨酸含量均出现不同程度的上升,并且台农一号杧的游离脯氨酸含量和可溶性糖含量积累高于四季杧。42℃高温胁迫下葡萄叶片脯氨酸含量明显高于对照,可溶性糖含量随胁迫时间的延长呈现先降低后升高再降低的趋势[30]。试验中,酸枣和灰枣实生苗叶片可溶性糖含量先下降后上升,可能是由于酸枣和灰枣实生苗突然受到胁迫时体内产生的活性氧远远超过其正常歧化能力,造成细胞内各种功能破坏,生理代谢紊乱,可溶性糖含量下降,之后可溶性糖含量逐渐上升,这说明酸枣和灰枣实生苗可通过提高可溶性糖含量来保护其内部组织,减轻高温伤害。此外,高温处理下酸枣和灰枣实生苗叶片中可溶性蛋白含量变化不大,酸枣和灰枣实生苗脯氨酸含量在高温处理第3 d和5 d显著升高,高温胁迫可以诱导脯氨酸的积累,在枣实生苗抵御高温胁迫过程中起到积极的作用。
光合作用是植物对温度变化最为敏感的代谢反应[31]。高温会导致叶绿素分解,植物光合能力下降[32]。类胡萝卜素既可参与植物的光合作用,还可吸收细胞内剩余能量,淬灭活性氧,防止膜脂过氧化[33]。高温处理降低了酸枣和灰枣实生苗叶片叶绿素a、叶绿素b、叶绿素总量和类胡萝卜素含量,且酸枣苗叶片中光合色素含量下降幅度小于灰枣实生苗。
4 结 论
4.1 与对照相比,高温胁迫下,酸枣叶片相对电导率仅在高温胁迫第5 d显著提高18.1%,叶片MDA含量变化不显著,灰枣实生苗叶片相对电导率在高温胁迫第3 d和5 d分别提高25.4%和37.9%,叶片MDA含量随着胁迫时间的延长较对照提高了70.4%~174.3%。
4.2 与对照相比,随着高温胁迫时间的延长,酸枣叶片脯氨酸含量提高82.5%~230.3%,可溶性糖含量先下降后上升,SOD活性提高28.9%~65.3%,CAT活性提高18.2%~92.7%;灰枣实生苗叶片脯氨酸含量提高59.5%~211.6%,可溶性蛋白、SOD活性先下降后上升,CAT活性提高66.6%~200.0%。高温胁迫对酸枣和灰枣实生苗可溶性蛋白、POD活性影响不大。此外,高温处理下酸枣CAT活性始终高于灰枣实生苗。
4.3 高温胁迫5 d后,酸枣和灰枣实生苗叶片中叶绿素a、叶绿素b含量、叶绿素总量和类胡箩卜素含量显著降低,其中酸枣分别降低13.8%、30.7%、21.1%和18.0%,灰枣实生苗分别降低25.2%、34.6%、24.1%和33.9%。
随着高温胁迫时间的延长,酸枣和灰枣实生苗叶片可溶性糖、脯氨酸、SOD和CAT活性均提高,光合色素含量均下降,并且酸枣叶片细胞膜稳定性较灰枣实生苗强,光合色素下降幅度较灰枣实生苗小,耐热性较灰枣实生苗强。
参考文献(References)
[1] 曲泽洲, 王永蕙, 彭士琪, 等. 中国果树志·枣卷[M]. 北京:中国林业出版社, 1993:5-7.
QU Ze-zhou, WANG Yong-hui, PENG Shi-qi, et al. (1993).China'sfruittrees·Jujubevolume[M]. Beijing: China Forestry Press: 5-7.(in Chinese)
[2] Liu, M. J., Zhao, Z. H., & Liu, M. J. (2009). Germplasm resources and production of jujube in china.ActaHorticulturae, 840(840): 25-32.
[3]新疆维吾尔自治区统计局.新疆统计年鉴[J].北京:中国统计出版社, 2016: 372-373.
Statistics Bureau of Xinjiang Uyghur Autonomous Region. (2016).Xinjiangstatisticalyearbook[J]. Beijing: China Statistics Press: 372-373. (in Chinese)
[4] Liu, D. F., Zhang, D., Liu, G. Q., Hussain, S., & Teng, Y. W. (2013). Influence of heat stress on leaf ultrastructure, photosynthetic performance, and ascorbate peroxidase gene expression of two pear cultivars (pyrus pyrifolia).JournalofZhejiangUniversity.science.b,14(12):1,070-1,083.
[5] Luo, H. B., Ma, L., Xi, H. F., Duan, W., Li, S. H., & Loescher, W., et al. (2011). Photosynthetic responses to heat treatments at different temperatures and following recovery in grapevine (vitis amurensis l.) leaves.PlosOne, 6(8): e23033.
[6]张睿佳, 李瑛, 虞秀明, 等. 高温胁迫与外源油菜素内酯对'巨峰'葡萄叶片光合生理和果实品质的影响[J].果树学报, 2015, 32(4): 590-596.
ZHANG Rui-Jia, LI Ying, YU Xiu-ming, et al. (2015). Effects of heat stress and exogenous brassinolide on photosynthesis of leaves and berry quality of'Kyoho'grapevine [J].JournalofFruitScience, 32(4): 590-596. (in Chinese)
[7]王振兴, 艾军, 陈丽, 等. 软枣猕猴桃叶片光系统Ⅱ活性对不同温度的响应[J].西北植物学报, 2015, 35(2): 329-334.
WANG Zhen-xing, AI Jun, CHEN Li, et al. (2015). Activity of photosystems Ⅱ in leaves ofActinidiaargutaunder different temperature treatments [J].ActaBot.Boreal.-Occident.Sin. , 35(2): 329-334.(in Chinese)
[8]徐斌, 白克力·塔西铁木尔, 车凤斌, 等.不同温度环境下灰枣光合特征日变化的研究[J].新疆农业科学, 2015, 52(12): 2 222-2 229.
XU Bin, Baikeli Taximuer, CHE Feng-bin, et al. (2015).Study on the photosynthetic characteristics diurnal variation of huizao under different temperatures[J].XinjiangAgriculturalSciences, 52(12):2,222-2,229.(in Chinese)
[9]计玮玮, 邱翠花, 焦云, 等.高温强光胁迫对砂梨叶片光合作用、D1蛋白和Deg1蛋白酶的影响[J].果树学报, 2012, 29(5):794-799.
JI Wei-wei, QIU Cui-hua, JIAO Yun, et al. (2012). Effects of high temperature and strong light on photosynthesis,D1 protein, and the Deg1 protease in pear (Pyrus pyrifolia) leaves [J].JournalofFruitScience, 29(5):794-799.(in Chinese)
[10]王进, 欧毅, 武峥, 等.高温胁迫对早熟梨生理效应和早期落叶的影响[J].西南农业学报, 2011, 24(2):546-551.
WANG Jin, OU Yi, WU Zheng, et al. (2011). Effects of high temperature stress on physiological indicators, early defoliation pf early maturing pear [J].SouthwestChinaJournalofAgriculturalSciences, 24(2):546-551.(in Chinese)
[11]田彩萍, 姚延梼.高温胁迫对枣树幼苗生长发育的影响[J].天津农业科学, 2011, 17(3):15-17.
TIAN Cai-ping, YAO Yan-tao. (2011). Effect of heat stress on physiological index of jujube [J].TianjinAgriculturalSciences, 17(3):15-17. (in Chinese)
[12]孙军利, 赵宝龙, 郁松林.外源水杨酸 (SA) 对高温胁迫下葡萄幼苗耐热性诱导研究[J].水土保持学报, 2014, 28(3): 290-294.
SUN Jun-li, ZHAO Bao-long, YU Song-lin. (2014). Study of exogenous salicylic acid (SA) on the heat tolerance in grape seedlings under high temperature stress [J].JournalofSoilandWaterconservation, 28(3):290-294.(in Chinese)
[13]耶兴元, 马锋旺, 王顺才, 等.高温胁迫对猕猴桃幼苗叶片某些生理效应的影响[J].西北农林科技大学学报, 2004, 32(12):33-37.
YE Xing-yuan, MA Feng-wang, WANG Shun-cai, et al. (2004). Physiological effects of kiwifruit lamina under high temperature stress[J].JournalofNorthwestSci-TechUniv.ofAgri.andFor. , 32(12):33-37.(in Chinese)
[14] YH Ma, FW Ma, JK Zhang, MJ Li, YH Wang, & D Liang. (2008). Effects of high temperature on activities and gene expression of enzymes involved in ascorbate-glutathione cycle in apple leaves.PlantScience,175(6):761-766.
[15]孙军利, 赵宝龙, 郁松林. 外源水杨酸对高温胁迫下葡萄几种抗氧化酶活性和抗氧化物含量的影响[J].植物生理学报, 2014, 50(7):1 014-1 018.
SUN Jun-li, ZHAO Bao-long, YU Song-lin. (2014). Effect of exogenous salicylic acid on antioxidant enzymes activities and Antioxidants contents in grape seedlings under high temperature stress [J].PlantPhysiologyJournal, 50(7):1,014-1,018.(in Chinese)
[16]王鹏祥, 杨金虎. 中国西北近45a来极端高温事件及其对区域性增暖的响应[J].中国沙漠, 2007, 27(4):649-655.
WANG Peng-xiang, YANG Jin-hu. (2007). Extreme high temperature events and response to regional warming in recent 45 years in northwest China [J].JournalofDesertResearch, 27(4):649-655. (in Chinese)
[17]李合生.植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2006: 261-263.
LI He-sheng. (2006).Plantphysiologicalandbiochemicalprinciplesandexperimentaltechniques[M]. Beijing: Higher Education Press: 261-263. (in Chinese)
[18] Heath, R. L., & Packer, L. (1968). Photoperoxidation in isolated chloroplasts. i. kinetics and stoichiometry of fatty acid peroxidation.ArchivesofBiochemistry&Biophysics, 125(1): 189-198.
[19]邹琦.植物生理学实验指导[M].北京:中国农业出版社, 2004: 111-130.
ZOU Qi. (2004).Experimentalguidanceofplantphysiology[M]. Beijing: China Agriculture Press: 111-130. (in Chinese)
[20]王爱国, 罗广华, 邵从本, 等. 大豆种子超氧物歧化酶的研究[J]. 植物生理学报, 1983, 9(1):77-84.
WANG Ai-guo, LUO Guang-hua, SHAO Cong-ben, et al. (1983). A study of superoxide dismutase of soybean seeds [J].JournalofPlantPhysiology, 9(1):77-84.(in Chinese)
[21] Omran, R. G. (1980). Peroxide levels and the activities of catalase, peroxidase, and indoleacetic acid oxidase during and after chilling cucumber seedlings.PlantPhysiology, 65(2): 407-408.
[22]郝建军, 康宗利, 于洋. 植物生理实验技术[M]. 北京:化学工业出版社, 2006.
HAO Jian-jun, KANG Zong-li,YU Yang. (2006).Plantphysiologyexperimenttechnology[M]. Beijing: Chemical Industry Press.(in Chinese)
[23] Arnon, D. I. (1949). Copper enzymes in isolated chloroplasts. polyphenoloxidase in beta vulgaris.PlantPhysiology, 24(1): 1-15.
[24] Apel, K., & Hirt, H. (2004). Reactive oxygen species: metabolism, oxidative stress, and signal transduction.AnnualReviewofPlantBiology,55(x): 373-399.
[25] Miller, G., Shulaev, V., & Mittler, R. (2008). Reactive oxygen signaling and abiotic stress.PhysiologiaPlantarum, 133(3): 481-489.
[26] Yin, H., Chen, Q., & Yi, M. (2008). Effects of short-term heat stress on oxidative damage and responses of antioxidant system in lilium longiflorum.PlantGrowthRegulation, 54(1): 45-54.
[27] Almeselmani, M., Deshmukh, P. S., Sairam, R. K., Kushwaha, S. R., & Singh, T. P. (2006). Protective role of antioxidant enzymes under high temperature stress.PlantScience, 171(3): 382-388.
[28] Chen, T. H., & Murata, N. (2002). Enhancement of tolerance of abiotic stress by metabolic engineering of betaines and other compatible solutes.CurrentOpinioninPlantBiology, 5(3):250-257.
[29]VAN TOAN CAN,罗聪,何新华,等. 高温胁迫对杧果幼苗生理生化指标的影响[J]. 热带作物学报,2016,37(1):53-58.
CAN VAN TOAN, LUO Cong, HE Xin-hua, et al. (2016). Effect of high temperature stress on physiology indices of mango seedlings [J].ChineseJournalofTropicalCrops, 37(1):53-58.(in Chinese)
[30]汤照云, 吕明, 张霞, 等. 高温胁迫对葡萄叶片三项生理指标的影响[J].石河子大学学报, 2006, 24(2): 198-200.
TANG Zhao-yu, LÜ Ming, ZHANG Xia, et al. (2006). High temperature physical coercion to several indicators of the impact of grape leaves[J].JournalofShiheziUniversity, 24(2): 198-200.(in Chinese)
[31] Virginia, W. (2011). How plants cope with temperature stress.BMCBiology, 9(1): 1-4.
[32]孙山,李鹏民,刘庆忠,等. 高灌越橘光合作用对若干环境因子的响应[J].园艺学报,2007,34 (1):67-70.
SUN Shan,LI Peng-min,LIU Qing-zhong,et al. (2007). Response of photosynthesis to some environmental factors of high-bush blueberry cultivars [J].ActaHorticulturaeSinica, 34(1):67-70. (in Chinese)
[33] Willekens, H., Van, C. W., Van, M. M., Inze, D., Langebartels, C., & Jr, S. H. (1994). Ozone, sulfur dioxide, and ultraviolet b have similar effects on mrna accumulation of antioxidant genes in nicotiana plumbaginifolia l.PlantPhysiology, 106(3):1,007-1,014.
