早期胃食管结合部癌的内镜表现及其与浸润深度的关系
2018-05-08
近年来,远端胃癌的发病率逐渐下降,胃食管结合部癌(adenocarcinomas of the esophagogastric junction,AEG)的发病率则逐年上升[1-3]。据安徽省肿瘤年报[4]显示,2011年和2012年,安徽省50%以上的胃癌患者病变发生在胃食管结合部。因此,早期发现并诊断AEG尤为重要。同时,随着内镜治疗技术的发展,对没有淋巴结转移、浸润较浅的早期AEG,可在内镜下切除,术前对病变浸润深度的准确评估,对选择合理的治疗方法极为关键。为进一步了解早期AEG的内镜特点及其与病变浸润深度的相关性,本研究回顾性分析安徽医科大学第一附属医院诊治的早期AEG患者的临床资料,以期为临床诊治提供参考。
1 资料与方法
1.1 研究对象 收集2013年8月至2016年12月安徽医科大学第一附属医院所有经胃镜检查考虑为早期胃食管结合部癌的患者临床资料,所有患者均经内镜黏膜下剥离术(endoscopic submueosaI dissection,ESD)或外科手术治疗,术后病理证实为早期胃食管结合部癌,共计101例。
1.2 病变位置 采用Siewert分型[5-6]:AEGⅠ型,肿瘤中心位置在食管胃连接部上1~5 cm 范围内;AEGⅡ型,肿瘤中心位置在食管胃连接部上 1 cm 和下 2 cm 之间;AEG Ⅲ型,肿瘤中心位置在食管胃连接部下2~5 cm 范围内。同时,根据内镜下病变的位置,进一步分为前壁、后壁、大弯及小弯侧。
1.3 内镜肉眼分型 肉眼分型[7]:Type0-I浅表隆起型,Type0-II 浅表平坦型[进一步分为0-IIa(平坦隆起型),0-IIb(平坦型),0-IIc(平坦凹陷型)],Type0-III 浅表凹陷型。本研究将I和IIa型统称为隆起型,将IIc和III型统称为凹陷型。
1.4 浸润深度 根据术后病理结果,并依据日本早期胃癌浸润深度分期[8],分为黏膜层(mucosa,M)及黏膜下层(submucosa,SM)。SM可进一步分为SM1(病灶侵犯至黏膜下,距黏膜层﹤500 μm)和SM2(病灶至黏膜层距离≥500 μm)。
1.5 组织学分型 根据患者术后病理分为:高级别上皮内瘤变,分化型癌(包括高-中分化管状腺癌、乳头状腺癌),未分化型癌(包括低分化腺癌、未分化癌、印戒细胞癌、黏液癌)。
1.6 AEG浸润深度预测评分 采用早期胃癌浸润深度预测评分系统(depth-predicting score,DPS)[9]评价,并根据病变部位的内镜表现进行评分,最终与病理结果进行比较。DPS评分标准:①表面显著发红为1分;②表面不整为1分;③病变长径≥30 mm为2分;④边缘隆起为2分。相加后最终评分≥3分,提示病变累及黏膜下层。
1.7 统计学方法 应用SPSS 21.0软件进行统计分析,计数资料用率表示,率的比较采用χ2检验或Fisher确切概率法,应用logistic回归进行多因素分析筛选出早期胃食管结合部癌浸润深度的独立危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 共纳入AEG患者101例,其中,男性80例,平均年龄(65.14±7.17)岁,女性21例,平均年龄(63.90±7.29)岁。病变位置以AEG Ⅱ型居多,共75例(74.3%),AEG Ⅲ型26例(25.7%),无AEG I型患者。病变好发部位以后壁最常见,共69例(68.3%),其次为小弯侧、大弯、前壁。详见表1。

表1 患者一般资料比较[例(%)]
2.2 内镜表现 病变形态以凹陷型居多,共66例(65.3%),常表现为黏膜发红、充血水肿,伴或不伴有表面糜烂、黏膜粗糙、颗粒感、结节样等改变,触之易出血。窄带成像技术(narrow-band imaging,NBI)放大见病变局部腺管不规则或缺失,有扭曲、扩张的新生肿瘤血管。病灶边缘多不规整、有隆起,与正常组织边界分界清晰。典型病例见图1。
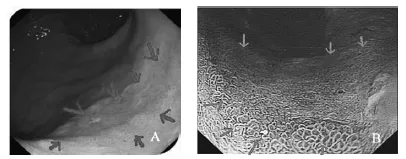
图1 早期胃食管结合部癌的典型图片
2.3 浸润深度与临床病理特征的单因素和多因素分析 不同年龄和分化程度及是否黏膜发红、表面粗糙、边缘隆起间浸润深度差异有统计学意义(P<0.05)。详见表2。通过logistic回归分析,纳入单因素分析中有统计学意义的指标,发现边缘隆起、分化程度低是影响肿瘤浸润深度的独立危险因素。详见表3。

表2 影响肿瘤浸润的单因素分析结果[例(%)]

表2续

表3 影响浸润深度的logistic回归分析
2.4 DPS评分对浸润深度判断的准确性 101例病例中,共判断错误13例,DPS判断的准确率为87.13%。其中,分化型AEG共94例,判断错误9例,诊断过度4例,诊断不足5例,DPS准确率达90.43%;未分化型AEG共7例,判断错误4例,系诊断不足,DPS准确率为42.86%。
3 讨论
近年来,在美国、日本及我国部分地区,AEG的发生呈上升趋势[1,6]。在我国陕西、甘肃、青海和新疆等胃癌高发区,尤其是农村地区,AEG发病率占胃癌发病比例的 30%~47%,且有持续上升趋势。此外,2006~2008 年河北磁县、涉县,河南林州和山东肥城等AEG发病数占胃癌发病数的53.6%[10-12]。而根据安徽医科大学第一附属医院2013~2016年统计的接受ESD治疗的早期胃癌患者中,58%为AEG。
本研究发现,早期AEG多见于高龄男性患者,病灶多位于食管胃连接部上 1 cm 和下 2 cm 之间的后壁,其次为食管胃连接部下2 cm的小弯、前壁、大弯处,与有关文献[13-14]报道一致。AEG镜下表现与早期胃癌相似,以凹陷型最常见,常表现为黏膜发红、充血水肿,伴或不伴有表面糜烂、黏膜粗糙、颗粒感、结节样等改变,触之易出血。NBI放大可见病变局部腺管不规则或缺失,有扭曲、扩张的新生肿瘤血管生成。病灶边缘多不规整、有隆起,与正常组织分界清晰。因此,临床工作者要提高警惕,对早期AEG高发部位进行全面排查;对内镜下发红、凹陷等部位进行活检,避免漏诊、误诊。
本研究中,单因素结果分析发现,患者高龄、病变黏膜发红、表面粗糙、边缘隆起,分化程度低对肿瘤的浸润深度有影响。对这些影响因素行多因素分析后发现,病灶边缘隆起、分化程度低是影响浸润深度的独立危险因素。即当病变周围有隆起或病理提示分化程度低时,常提示肿瘤浸润已较深,其原因目前尚不明确,有待进一步研究。而性别、病灶位置及内镜下分型无对肿瘤浸润深度无明显影响,但有研究[15]发现浸润深度与内镜下分型相关,且凹陷型病灶更易浸及黏膜下层。对于这种差别,考虑可能与本研究样本量较小有关。
对病变浸润深度进行评估是内镜治疗极为重要的一步,但目前,对浸润深度的判断尚无金标准,更多的是依赖医生的经验,有较大的主观性。Abe等[9]根据病变不同浸润深度的内镜特点提出了判断早期胃癌浸润深度的评分标准,即DPS评分标准,准确率达82.5%~84.8%。本研究结果显示,DPS评分对分化型AEG浸润深度判断的准确率高达90.43%(85/94),对未分化型AEG的判断准确率只有42.86%(3/7),提示DPS评分对分化型早期AEG浸润深度的判断准确性高,且减少了主观性。但因未分化型癌早期呈浸润性、破坏性增生,病变表面的黏膜上皮尚未受到影响,形态改变并不明显;DPS评分系统更强调病变表面的形态改变,故应用于未分化型AEG时,其总体评分较低,故DPS评分不适用于未分化型胃食管结合部癌的浸润深度评估。因此,DPS评分对于早期分化型AEG的浸润深度判断有重要价值,值得进一步研究。本研究尚有不足之处,一是样本量较少,二是参与研究的医师仅通过内镜图片及描述来判断浸润深度,非亲自操作内镜并动态观察,可能对结果有一定影响。
综上所述,对早期AEG的高发位置应特别注意观察,对于病变部位有易出血、表面发红、粗糙、边缘隆起等表现时,要提高警惕,仔细观察,尽早活检。同时,也要综合患者的年龄、病变的形态、病理类型等辅助使用DPS评分系统以提高早期AEG判断的准确率。
[1] KUSANO C, GOTODA T, KHOR C J, et al. Changing trends in the proportion of adenocarcinoma of the esophagogastric junction in a large tertiary referral center in Japan[J]. J Gastroenterol Hepatol, 2008, 23(11): 1662-1665.
[2] STEIN H J, FEITH M, SIEWERT J R. Cancer of the esophagogastric junction[J]. Surg Oncol, 2000, 9(1):35.
[3] 邵大川, 钱军. 食管胃结合部腺癌的诊治现状及研究进展[J]. 中华全科医学, 2014, 12(9):1469-1471.
[4] 2015安徽省肿瘤登记年报[M].合肥:安徽省疾病预防控制中心,2015:39-41.
[5] BAI J G, LV Y, DANG C X. Adenocarcinoma of the esophagogastric junction in China according to Siewert's classification.[J]. Jpn J Clin Oncol, 2006, 36(6):364.
[6] 李德关, 李永翔. 食管胃结合部腺癌的手术治疗进展[J]. 安徽医学, 2014,35(6):854-857.
[7] Japan Esophageal Society. Japanese classification of esophageal cancer, 11th edition: part II and III[J]. Esophagus, 2017, 14(1):37-65.
[8] Japanese Gestric Cancer Association. Japanese classification of gastric carcinoma - 2nd english edition[J]. GastricCancer, 1998, 1(1):10-24.
[9] ABE S, ODA I, SHIMAZU T, et al. Depth-predicting score for differentiated early gastric cancer.[J]. Gastric Cancer, 2011, 14(1):35-40.
[10]李军, 何永明, 江海东,等. 四川盐亭与河北磁县1988~2007年贲门癌发病趋势分析[J]. 中国肿瘤, 2013, 22(5):344-349.
[11]王立东, 郑树. 河南食管癌高发区人群食管和贲门癌变机制[J]. 郑州大学学报(医学版), 2002, 37(6):717-729.
[12]彭侠彪, 陈万青, 陈志峰,等. 中国贲门癌流行概况[J/CD]. 中华普通外科学文献(电子版), 2014(2):61-64.
[13]秦东媛, 陈星, 原丽莉. 贲门癌380例临床病例分析[J]. 中华消化内镜杂志, 2015, 32(5):327-329.
[14]王国清, 魏文强, 郝长青,等. 贲门癌高发位点的发现及其在上消化道癌内镜筛查中的作用和临床意义[J/CD]. 食管外科电子杂志, 2013,1(4):150-154.
[15]朱阳春, 李茂森. 早期贲门癌内镜下表现与浸润深度的研究[J]. 中华消化内镜杂志, 1997,14(3):178.
