超高效液相色谱-串联质谱内标法同时测定地表水中7种微囊藻毒素
2018-05-07许燕娟石浚哲
沈 斐, 许燕娟, 姜 晟, 赵 斌, 石浚哲
(1.无锡市环境监测中心站,江苏无锡 214121;2.江南大学环境与土木工程学院,江苏无锡 214122;3.江苏省环境监测中心,江苏南京 210036)
藻毒素是有害蓝藻水华中出现频率最高、造成危害最严重的污染物,目前已成为全球性的环境问题。微囊藻毒素(Microcystins,MC)是一类具有生物活性的环状七肽化合物,是水华蓝藻产生的细胞内毒素,它在细胞内合成,细胞破裂后释放到水体中,具有强烈促癌作用[1],同时也是污染范围最广、研究最多的藻毒素[2]。WHO于2004年在《饮用水卫生准则》中规定MC-LR在饮用水中浓度不得高于1 μg/L。鉴于微囊藻毒素的毒性及危害,我国国家标准《地表水环境质量标准》(GB 3838-2002)和2006年新颁布的《生活饮用水卫生标准》(GB 5749-2006)已将MC-LR列入其中,控制限值为1 μg/L。目前,测定微囊藻毒素的方法主要有高效液相色谱(HPLC)[3 - 4]、液相色谱-串联质谱(LC-MS/MS)[5]和酶联免疫分析(ELISA)[6]等。LC-MS/MS法具有高灵敏度、高选择性等特点,现已广泛应用于微囊藻毒素的测定。
目前LC-MS/MS测定水中微囊藻毒素基本上采用的是外标法定量[7]。由于常用的外标法定量方法中标样和待测样是独立进行实验的,实验间的偶然误差无法消除。除此以外,LC-MS/MS测定过程中标样和待测样对于不同基质所带来的干扰较为敏感,基质的不同会对实验结果产生一定的误差,而合适的内标在一定条件下可以减少基质所带来的影响[8]。由于藻毒素同位素内标物目前还无商品化的产品,亮氨酸脑啡肽的环状结构与藻毒素相似,已经应用于微囊藻毒素的测定[9 - 10]。本文研究建立了超高效液相色谱-串联质谱(UPLC-MS/MS)测定MC-LR、MC-RR、MC-YR、MC-LA、MC-LY、MC-LW和MC-LF 7种微囊毒素,并采用亮氨酸脑啡肽作为内标物,使用内标法进行定量分析,除此以外还对上述7种微囊藻毒素的子离子进行了探索。本研究在不需要对水样进行繁杂前处理的前提下,只需通过0.22 μm滤膜过滤,利用超高效液相色谱快速的分离能力,在4 min内即可同时获知7种物质的含量。方法具有快速、操作简便、效率高、重复性好等特点,能够更好地反映样品的真实性和代表性,并且检出限完全满足《地表水环境质量标准》(GB 3838-2002)的排放限值,特别适用于环境突发事件的应急监测,为及时反映污染情况及政府部门快速作出应急措施提供参考。
1 实验部分
1.1 仪器、试剂及材料
超高效液相色谱-串联质谱联用系统,Acquity系列超高效液相色谱仪(美国,Waters公司);API4000+串联质谱仪(美国,AB Sciex公司);Mili-Q去离子水发生器(美国,Millipore公司);0.22 μm 聚醚飒(PES)针式滤头(上海安谱科学仪器有限公司)。
甲醇、乙腈(色谱纯,德国CNW科技公司);甲酸(美国Sigma-Aldrich公司); 微囊毒素:MC-LR、MC-RR、MC-YR、MC-LA、MC-LY、MC-LW和MC-LF(99%,瑞士Alexis Biochemicals);亮氨酸脑啡肽(上海吉尔生化有限公司)。实验用水为去离子水。
1.2 样品采集及前处理
用500 mL棕色玻璃瓶采集满瓶水样(不留顶空),采集后的水样在4 ℃暗处储存,当天分析。样品过0.22 μm水相滤头后,加入亮氨酸脑啡肽内标溶液,直接进样。由于微囊藻毒素具有弱疏水性,分子中的氨基及羧基又具有一定极性,在滤膜过滤过程中可能通过氢键吸附在滤膜表面,造成损失[11]。本实验采用聚醚飒(PES)针式滤头过滤样品[11 - 12],其测试结果和加标回收率并无明显差别,适合方法要求。
1.3 仪器分析条件
色谱条件:采用Waters公司 Acquity BEH130 C18柱(100×2.1 mm,1.7 μm),以含0.1%甲酸水溶液(A)和含0.1%甲酸的乙腈(B)作流动相,流速0.4 mL/min,柱温40.0 ℃。梯度洗脱程序:0~1 min 20%B;1~2.5 min,20%~95%B;2.5~3.5 min 95%B;3.5~3.6 min 95%~20%B;3.5~4 min 20%B。进样量为10 μL。
质谱条件:采用多反应监测(MRM)模式,使用ESI+离子源,最佳喷雾电压为5 500 V,气帘气(Curtain GAS)为20 psi,雾化气(GSl)为55 psi,辅助加热气(GS2)为60 psi,喷针温度(TEM)为450 ℃。特征离子的选取用针泵直接进样,经过对去簇电压和碰撞能量等因素的优化,确定了质谱分析参数,列于表1。
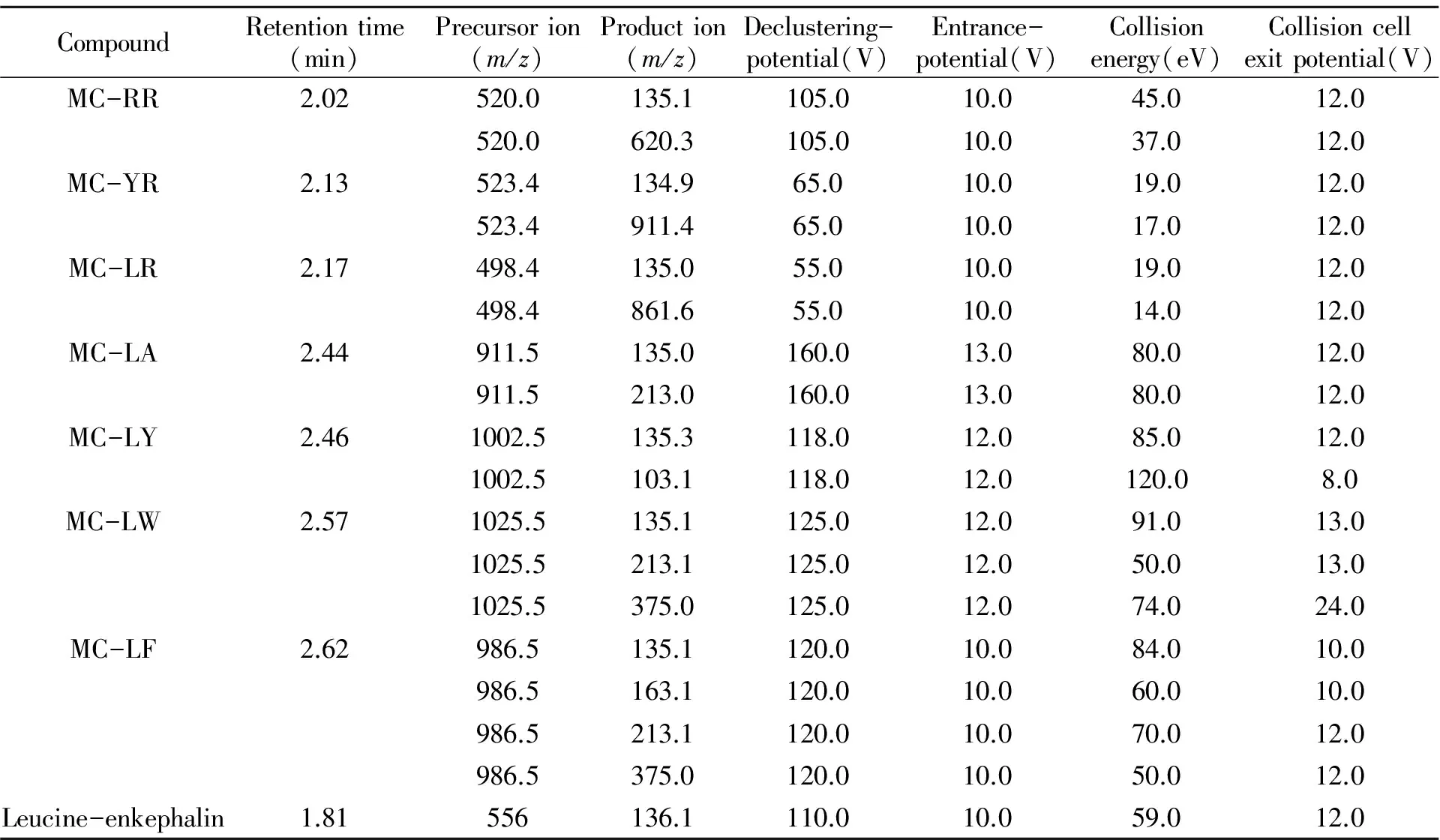
表1 保留时间与质谱分析参数Table 1 Retention time and parameters of MRM
2 结果与讨论
2.1 色谱条件

图1 标准混合溶液的色谱图Fig.1 The chromatogram of standards mixture
有报道利用甲醇/乙腈(40/60,V/V)作为流动相能很好地将7种微囊藻毒素完全分离[9]。虽然甲醇/乙腈(40/60,V/V)能够将混合物很好地分离,但是由于样品是水样,纯有机溶剂在混合样品时容易导致混合不均匀,压力不稳,引起精密度变差及线性范围变窄。纯水和甲醇作为流动相虽然能够提高离子在质谱上的响应,但是系统压力较高,纯水和乙腈作为流动相能够控制超高效液相色谱的系统压力,故本实验选择乙睛-水反相体系作为流动相。由于待测物均以正离子状态进行检测,因此在流动相中加入适量酸可以提高目标化合物的离子化效率,增加响应值,特别是有助于藻毒素[M+2H]2+和[M+H]+母离子的形成,增强检测的灵敏度。选择0.1%甲酸最为合适,当甲酸的含量大于0.1%时,对于灵敏度及色谱峰形并未有区别。在梯度洗脱条件中,起始流动相采用高比例的水相有助于目标物与环境基体物质分离,防止基质效应,影响目标物的电离效率[13 - 14]。色谱图见图1。
2.2 质谱条件
根据微囊藻毒素的理化性质和化学结构,选择ESI源作离子源,正模式分析。配制浓度为100 μg/L藻毒素的标准溶液,采用针泵直接连接质谱样品传输管(针泵流速为10 μL/min)进行一级质谱扫描,确定各物质的准分子离子峰,然后分别以其准分子离子为母离子,通过氢气碰撞产生碎片离子进行二级质谱扫描,选择丰度较高的1到2种碎片离子作为定性与定量离子。母离子见表1,其中MC-LR、MC-YR常见的母离子[M+H]+分别为m/z996.0和m/z1046.0,实际测试过程中发现MC-LR母离子[M+2H]2+(m/z498.4)和MC-YR母离子(m/z523.4)响应更高,灵敏度更高。在7种微囊藻毒素的各个子离子响应:MC-LR(135.0>861.6)、MC-YR(134.9>911.4)、MC-RR(135.1>620.3)、MC-LA(135.1>213)、MC-LA(135.3>103.1)、MC-LW(135.1>213.1>375.0)和MC-LF (135.1>163.1>213.1>375.0),见图2。微囊藻毒素的共有基团Adda的甲氧基键断裂形成的特征碎片离子(m/z135)相对于其他特征碎片离子响应更高,所以本文选择了m/z135作为定量离子。实际实验中,采取定量离子时可以采用响应更高的离子,以便提高物质的检出限以及定量的准确度,其它离子可以作为定性离子。

图2 标准溶液子离子色谱图:(a) 微囊藻毒素-LR;(b) 微囊藻毒素-YR;(c) 微囊藻毒素-RR;(d) 微囊藻毒素-LA;(e) 微囊藻毒素-LY;(f) 微囊藻毒素-LW;(g) 微囊藻毒素-LFFig.2 The chromatograms of product ions:(a)microcystin-LR;(b) microcystin-YR;(c) microcystin-RR;(d) microcystin-LA;(e) microcystin-LY;(f) microcystin-LW;(g) microcystin-LF
2.3 标准曲线绘制
配制藻毒素混合标准溶液并直接进样,以目标组分的响应值(y)对相应的质量浓度(x,μg/L)绘制标准曲线。在水中添加低浓度标准溶液,按样品步骤处理后分析,计算标准偏差s,方法检出限(MDL)按MDL=s×t(n-1,0.95)计算。式中,t(n-1,0.95)为置信度95%、自由度(n-1)时的t值;n为重复样品数,结果见表2。如表2所见,内标法绘制标准曲线时,相关系数能达到0.998以上;方法检出限为0.143~0.468 μg/L,满足日常对微囊藻毒素检测的要求。

表2 标准曲线、相关系数与检出限(n=7)Table 2 Linear regression equations,correlation coefficients and detection limits for microcystins(n=7)
2.4 方法的精密度和准确度
在空白水样中添加不同浓度水平的标准溶液,按上述方法进行测定,每个浓度水平行测定7次,计算回收率及相对标准偏差(RSD),结果见表3。结果表明,空白水样的加标测定值的相对标准偏差(RSD)小于7.63%,回收率大于88%,满足日常测定要求。
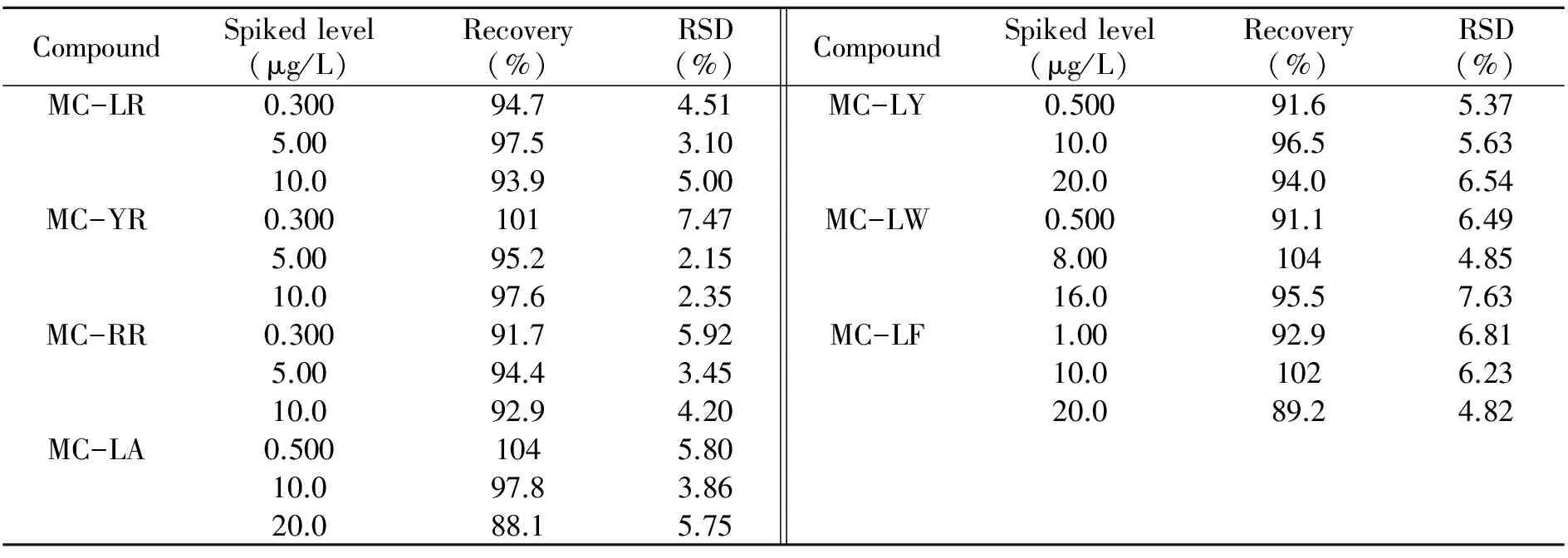
表3 回收率和精密度测定(n=7)Table 3 Recoveries and repeatability spiked at three levels(n=7)
2.5 实际水样的测试
采集某地表水及饮用水多个点位的水样和人工培养铜绿微囊藻样品,进行实际样品分析。样品1#~4#为某湖水不同点位的微囊藻毒素测定结果。5#和6#为人工培养铜绿微囊藻的微囊藻毒素浓度。

表4 实际水样的测定结果(μg/L)Table 4 Results of real sample detection(μg/L)
ND:not detected.
3 结论
以亮氨酸脑啡肽作为内标物,采用UPLC-MS/MS内标法测定地表水中7种微囊藻,取得了良好的分析结果。该分析方法仅需4 min即可完成7种目标物的分离测定,适合藻毒素污染的应急突发事件和科学研究项目的快速定性定量测定。
参考文献:
[1] Zhao S J,Xie P,Li G Y,et al.Proteomics,2012,12(2):300.
[3] LIANG L L,GONG A J,LI H M,et al.Chinese Journal of Analytical Chemistry(梁丽丽,弓爱君,李红梅,等.分析化学),2010,38(8):740.
[4] Lalita N S,Sarika S M,Tapan C.Water Research,2006,40(19):3485.
[5] Liming C,Baifen H,Qi C,et al.Analytica Chimica Acta,2006,569(1-2):157.
[6] Tsutsumi T,Nagata S,Yoshida E,et al.Food AgricImmunol,2000,17:231.
[7] PÉREZ S,AGA D S.Trac Trends in Analytical Chemistry,2005,24(7):658.
[8] TRUFELLI H,PALMA P,FAMIGLINI G,et al.Mass Spectrometry Reviews,2011,30(3):491.
[9] XU W,CHEN Q,ZHANG T,et al.Analytica Chimica Acta,2008,626(1):28.
[10] LI H,PAN G,ZHANG H G.Environmental Chemistry(李宏,潘纲,张洪刚.环境化学),2014,33(12):2087.
[11] JIA Y L,CHEN W,ZHAO S,et al.Acta Hydrobiologica Sinica(贾云璐,陈伟,赵爽,等.水生生物学报),2014,38(1):87.
[12] XIONG J,QIAN S,XIE Y H,et al.Environmental Monitoring in China(熊杰,钱蜀,谢永洪,等.中国环境监测),2014,30(3):119.
[13] Li W,Duan J,Niu C,et al.Journal of Chromatographic Science,2011,49:665.
[14] Shen F,Wang L H,Zhou Q,et al.Water Air & Soil Pollution,2017,228(69):1.
