多壁碳纳米管修饰玻碳电极上绿原酸催化氧化谷胱甘肽
2018-05-07黄颖*,陈美
黄 颖*, 陈 美
(福建师范大学化学与材料学院,福建福州 350007)
还原型谷胱甘肽(GSH)由谷氨酸、半胱氨酸和甘氨酸组成,它是生物体内重要的含巯基活性物质,具有抗氧化、解毒、防辐射等功效[1],其含量的改变与阿尔茨海默氏症、痴呆、肌肉萎缩症等多种疾病有关[2],因此寻找一种快速、简便测定GSH的方法具有重大的意义。目前检测GSH的方法有高效液相色谱法、荧光法、毛细管电泳法、光谱法和电化学法等[3 - 7]。其中,电化学法因其具有设备简单、操作方便、响应迅速等优点已成为测定GSH的一种重要方法。但GSH在常规电极上有较高的过电位且电子转移速率较慢,导致其直接电化学测定困难,因此本文提出以绿原酸(CGA)为电催化媒介对GSH进行间接电化学测定。
多壁碳纳米管(MWCNTs)因具有较高比表面积、良好导电性和生物相容性等优点,已在电化学传感器方面得到广泛应用[8 - 10]。纳米Au具有金属导电性、催化活性及纳米材料的量子尺寸效应,被广泛应用于修饰电极[11]。本文合成了纳米Au-MWCNTs复合材料,并制备了Au-MWCNTs/GCE修饰电极。在该电极上以CGA为电催化媒介对GSH进行测定,与已报道的电化学方法[12 - 13]相比,本文所提出的方法具有检测限低、电极稳定性好等优点。
1 实验部分
1.1 仪器与试剂
CHI660D型电化学工作站(上海辰华仪器有限公司);pHS-3C型精密pH计 (上海大普仪器有限公司);KQ-218型超声清洗器(昆山市超声仪器有限公司);三电极体系:玻碳电极(GCE)或修饰电极为工作电极,Ag/AgCl(饱和KCl)为参比电极,铂丝电极为辅助电极。
还原型谷胱甘肽(GSH,Sigma公司);绿原酸(CGA,上海麦克林试剂公司);HAuCl4、NaBH4、柠檬酸钠(百灵威化学技术有限公司);多壁碳纳米管(MWCNTs)(>95%,深圳纳米技术有限公司);其余试剂均为分析纯。实验用水为二次蒸馏水。
1.2 MWCNTs的纯化
将50 mg MWCNTs 置于60 mL体积比为3∶1的HNO3与H2SO4混酸中,超声混合3 h,加入适量蒸馏水稀释,溶液冷却后抽滤,用蒸馏水洗涤至中性,然后在85 ℃下真空干燥12 h,得含氧功能团的MWCNTs。
1.3 Au-MWCNTs的制备
取适量的HAuCl4溶解在0.1 mol/L HCl中,并与一定体积的柠檬酸钠溶液混合搅拌,形成柠檬色溶液,再加入到纯化后的MWCNTs的圆底烧瓶中搅拌,将一定浓度的 NaBH4逐滴加入到圆底烧瓶中搅拌,用NaOH调节溶液pH为13,紧接着将混合溶液在90 ℃下搅拌回流6 h后,在10 000 r/min下离心分离,洗涤,最后在80 ℃下干燥12 h,得产品。
1.4 工作电极的制备
GCE以0.3、0.1、0.05 μm的Al2O3抛光粉依次抛光,用无水乙醇和水各超声清洗3 min后,浸入到0.5 mol/L H2SO4中,在-1.0~1.0 V电位区间以50 mV/s扫速进行循环伏安扫描直至伏安曲线稳定。把1 mg纯化后的MWCNTs和Au-MWCNTs分别分散在1 mL DMF中,超声20 min。将悬浮液10 μL分别滴涂在GCE表面,在室温下干燥得到MWCNTs/GCE和Au-MWCNTs/GCE。
1.5 实际样品分析
还原型谷胱甘肽滴眼液样品分析是将0.1 g GSH溶解在5 mL指定溶液中,用0.1 mol/L磷酸盐缓冲溶液(PBS,pH=6.0)将滴眼液稀释6 500倍后,用于电分析测定。
2 结果与讨论
2.1 透射电镜(TEM)表征
如图1所示,采用TEM对纯化后的MWCNTs和Au-MWCNTs复合材料进行了表征。由图1a可以看出,混酸处理后的MWCNTs长度较短,表面较粗糙,彼此之间的缠结较少,说明经过混酸氧化后的MWCNTs发生了较明显的短切现象。由图1b可以看出,MWCNTs表面的Au纳米粒子清晰可见,颗粒大小比较均匀,多为球型粒子,表明成功制备了Au-MWCNTs复合材料。

图1 MWCNTs(a)和Au-MWCNTs(b)的透射电镜(TEM)图Fig.1 TEM images of MWCNTs(a) and Au-MWCNTs(b)

图2 GCE(a)、MWCNTs/GCE(b)和Au-MWCNTs/GCE(c)在1 mmol/L [Fe(CN)6]4-/3- +0.5 mol/L KCl溶液中的循环伏安图(插图A:交流阻抗图;插图B:GCE(a)、MWCNTs/GCE(b)和Au-MWCNTs/GCE(c)上的Ip-v1/2关系图)Fig.2 CVs and Nyquist plots(inset A) of GCE(a),MWCNTs/GCE(b) and Au-MWCNTs/GCE(c) in 1 mmol/L [Fe(CN)6]4-/3- +0.5 mol/L KCl solution;Inset B:plot of Ip vs. v1/2 at GCE(a),MWCNTs/GCE(b) and Au-MWCNTs/GCE(c)scan rate:100 mV/s;requency range:0.1 - 105 Hz.
2.2 电极的表征
实验测定了不同电极对1 mmol/L [Fe(CN)6]4-/3-(含0.5 mol/L KCl)的循环伏安(CV)响应(图2)。与GCE相比,Au-MWCNTs/GCE和MWCNTs/GCE上的氧化还原峰电流分别增大了3倍和2倍,且氧化还原峰电位差(ΔEp)分别减少了10和6 mV,说明Au-MWCNTs复合材料更能有效增大电极有效表面积,提高电子转移速率。测定了不同扫速下不同电极在1 mmol/L [Fe(CN)6]4-/3-(含0.5 mol/L KCl)中的CV曲线,实验结果表明,电流响应值(Ip)与扫速平方根(v1/2)呈良好的线性关系。由Randles-Sevcik方程计算得有效表面积A:Ip=2.69×105n3/2AD1/2v1/2c。式中:n即为[Fe(CN)6]4-/3-电对的转移电子数且n=1,D为扩散系数且D=7.6×10-6cm2s-1,v为扫速,c为 [Fe(CN)6]4-/3-浓度且c=l mmol/L。图2插图B中曲线a、b、c分别表示GCE、MWCNTs/GCE和Au-MWCNTs/GCE的Ip-v1/2关系,由对应的直线斜率可得有效表面积分别为0.07、0.12和0.15 cm2。结果表明Au-MWCNTs复合膜能有效地增大玻碳电极有效表面积,使得电流响应增大。
为进一步研究电极的电化学性能,考察了不同电极在1 mmol/L [Fe(CN)6]4-/3-(含0.5 mol/L KCl)中的交流阻抗图。如图2插图A所示,在GCE(a)上出现明显圆弧形状,而在MWCNTs/GCE(b)和Au-MWCNTs/GCE(c)上圆弧很小且接近直线,并且Rct(Au-MWCNTs/GCE)比Rct(MWCNTs/GCE)更小,电子在Au-MWCNTs/GCE表面有较快的传递速率。以上结果进一步表明Au-MWCNTs复合材料具有优异的电化学性能。
2.3 GSH的电催化氧化行为
测定了不同电极在不同条件下的CV曲线(图3)。由图可知,电催化媒介CGA在GCE(a)、MWCNTs/GCE(b) 和Au-MWCNTs/GCE(c)上都出现明显的氧化还原峰,说明CGA具备良好的电化学活性。此外Au-MWCNTs/GCE(c) 上氧化还原峰电流大于GCE(a) 和MWCNTs/GCE(b) 的响应,说明Au-MWCNTs作为修饰材料能有效放大电流响应。在考察的电位范围内25 μmol/L GSH在Au-MWCNTs/GCE(d) 上未出现氧化还原峰,说明GSH在这种修饰电极上无明显电化学响应,难以实现对GSH的直接测定。于CGA溶液中加入GSH后,Au-MWCNTs/GCE(e) 上氧化峰电流明显增大,还原峰减小,说明CGA对GSH有电催化氧化作用。

图3 (A) 10 μmol/L CGA 在GCE(a)、MWCNTs/GCE(b)和Au-MWCNTs/GCE(c)上的循环伏安图;(B) 25 μmol/L GSH(d)和加入10 μmol/L CGA后(e)在Au-MWCNTs/GCE上的循环伏安图Fig.3 (A) CVs of 10 μmol/L CGA at GCE(a),MWCNTs/GCE(b) and Au-MWCNTs/GCE(c);(B) CVs of 25 μmol/L GSH in the absence(d) and presence of 10 μmol/L CGA(e) at Au-MWCNTs/GCEscan rate:50 mV/s.
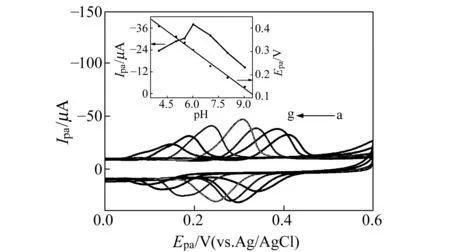
图4 不同pH下25 μmol/L GSH和10 μmol/L CGA在Au-MWCNTs/GCE上的循环伏安图(插图:pH与氧化峰电流和氧化峰电位的关系图)Fig.4 CVs of 25 μmol/L GSH with 10 μmol/L CGA at Au-MWCNTs/GCE in 0.1 mol/L PBS with different pH(Inset:Plot of Ipa and Epa vs.pH) a-g:4.0,5.0,5.5,6.0,7.0,8.0,9.0
2.4 pH的影响
在Au-MWCNTs/GCE上,考察了25 μmol/L GSH 和 10 μmol/L CGA在不同pH的PBS中的循环伏安行为。由图4可知,在pH=4.0~6.0范围内,氧化峰电流(Ipa)随pH增加而增大,在pH=6.0~9.0范围内,Ipa随pH增大而减小,GSH的Ipa在pH=6.0时最大,因此选择pH=6.0作为最佳实验条件。由图4插图可知,在 pH=4.0~9.0范围内,氧化峰电位(Epa)随pH增加而减小,其线性方程为:Epa=0.6317-0.054pH,R2=0.9920。斜率54 mV/pH与等电子等质子传递的理论值59 mV/pH接近,表明Au-MWCNTs/GCE上的化学反应是等质子等电子的完全不可逆过程。
2.5 塔菲尔法
在Au-MWCNTs/GCE上,于0.1~0.4 V电位范围,对15、20、25 μmol/L三种浓度GSH加入10 μmol/L CGA溶液进行Tafel曲线测定。在0.20~0.24 V电位范围logI与Ep呈良好线性关系,且斜率相差不大,求得Tafel平均斜率为9.9408 V-1。由于 CGA 在Au-MWCNTs/GCE上对GSH 的电催化氧化是完全不可逆的电化学过程,电荷传递系数α可由完全不可逆过程方程式计算:Ep=(blogv)/2+constant,式中:b即为Tafel斜率,根据b=n(1-α)F/2.303RT(温度T=298 K,n为电子转移个数,α为电荷传递系数,法拉第常数F=96487 C/mol),可计算得α=0.706(假设n=2)。
2.6 计时电流法

2.7 重现性、稳定性和选择性
用同一根新制的Au-MWCNTs/GCE,在25 μmol/L GSH的含10 μmol/L CGA的0.1 mol/L PBS(pH=6.0)中平行测定8次,氧化峰电流值的相对标准偏差(RSD) 为3.5%。采用同样的方法平行制备的5根Au-MWCNTs/GCE 在上述溶液中分别进行测定,实验得氧化峰电流的RSD为4.2%。将Au-MWCNTs/GCE放置在4 ℃冰箱中一周,两周和一个月后,对上述溶液进行测定,测得氧化峰电流分别为初始电流的95.4%、91.7%和90.3%。说明该电极的重现性和稳定性较好。另外,探究了一些常见干扰物对GSH测定的干扰。实验发现20倍浓度甘氨酸、缬氨酸、色氨酸、亮氨酸、苯丙氨酸、丙氨酸、半胱氨酸和氧化型谷胱甘肽对GSH的测定几乎不存在干扰。
2.8 线性范围及检测限
最佳实验条件下,采用差分脉冲伏安法(DPV)测定GSH在Au-MWCNTs/GCE上的线性范围及检测限。如图5所示,在5.0~30 μmol/L和0.1~5.0 μmol/L范围内,GSH的氧化峰电流(Ipa)与浓度(c)呈良好线性关系,其线性方程为:Ipa(μA)=-0.7000c(μmol/L)-20.2655(R2=0.9916,c:5.0~30.0 μmol/L,CGA=10 μmol/L);Ipa(μA)=-1.1603c(μmol/L)-18.1901(R2=0.9978,c:0.1~5.0 μmol/L,CGA=5 μmol/L)。计算得该方法的检测限(S/N=3)为0.034 μmol/L。
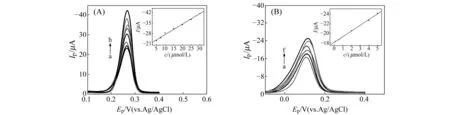
图5 (A) 10 μmol/L CGA和不同浓度GSH的0.1 mol/L PBS(pH=6.0)在Au-MWCNTs/GCE上的DPV图(插图:氧化峰电流与GSH浓度关系图);(B) 5 μmol/L CGA和不同浓度GSH的0.1 mol/L PBS(pH=6.0)在Au-MWCNTs/GCE上的DPV图(插图:氧化峰电流与GSH浓度关系图)Fig.5 (A) DPVs at Au-MWCNTs/GCE with 10 μmol/L CGA in 0.1 mol/L PBS (pH=6.0)(Inset:Plot of Ipa vs.cGSH);(B) DPVs at Au-MWCNTs/GCE with 5 μmol/L CGA in 0.1 mol/L PBS(pH=6.0)(Inset:Plot of Ipa vs.cGSH)cGSH:(A)a-h:0,5.0,7.5,10,15,20,25,30 μmol/L;(B) a-f:0,0.1,0.5,2.0,4.0,5.0 μmol/L.
2.9 实际样品的测定
在最佳实验条件下,用DPV法对谷胱甘肽滴眼液样品中GSH的含量进行测定,同时进行加标回收率实验。结果见表1。

表1 谷胱甘肽滴眼液中GSH含量测定(n=3)Table 1 Determination of GSH in glutathione eye drops(n=3)
3 结论
本文合成了Au-MWCNTs复合材料,并构建了Au-MWCNTs/GCE,建立了以CGA为电催化媒介在Au-MWCNTs/GCE上间接测定GSH的电化学方法。用 CV、EIS、CA、Tafel和DPV等方法研究了不同工作电极表面电化学特性,及GSH 在Au-MWCNTs/GCE上的电化学行为,优化了实验参数,并得到电化学动力学参数,绘制了GSH的工作曲线。此方法用于谷胱甘肽滴眼液中GSH含量测定,获得较好结果。
参考文献:
[1] Wang J,Wang K,Wang Y,Lin S Y,Zhao P,Jones G.Food Chem,2014,161:361.
[2] Duffy S L,Lagopoulos J,Hickie I B,Diamond K,Graeber M B,Lewis S J,Naismith S L.Alzheimer's & Dementia,2014,10(1):67.
[3] Hodakova J,Preisler J,Foret F,Kuban P.J Chromatogr A,2015,1391:102.
[4] Xu Y X,Zhang L,Liu Y,Jin Z Y,Zhao Q,Yang F,Xiao D.Biosens Bioelectron,2016,77:182.
[5] ZHAO S L,WU H Y,YANG J,et al.Journal of Analytical Science(赵绍林,吴惠毅,杨晋,等.分析科学学报),2011,27(6):770.
[6] HUANG Y T,HUANG Y,PAN F F.Journal of Instrumental Analysis(黄娅婷,黄颖,潘芳芳.分析测试学报),2014,33(6):714.
[7] Xu J C,Pan J,Zhang Y,Liu J B,Zeng L T,Liu X G.Sensors and Actuators B:Chemical,2017,238:58.
[8] SHANG Y H,LIU B,GU Y Z.Journal of Analytical Science(尚永辉,刘彬,古元梓.分析科学学报),2016,32(5):649.
[9] ZHANG X,ZENG T,HU C G,TIAN Q L.Journal of Analytical Science(张璇,曾婷,胡成国,田秋霖.分析科学学报),2015,31(4):450.
[10] HUANG Y,CHEN L F.Journal of Instrumental Analysis(黄颖,陈丽飞.分析测试学报),2016,35(7):819.
[11] WANG N,LI X R,WANG B B,NI R X,JI X P.Journal of Analytical Science(王娜,李献锐,王贝贝,倪瑞星,籍雪平.分析科学学报),2016,32(3):357.
[12] ZHANG Y M,DUAN C Q,GAO Z N.Journal of Instrumental Analysis(张艳梅,段成茜,高作宁.分析测试学报),2011,30(8):897.
[13] Yuan B Q,Zhang R C,Jiao X X,Li J,Shi H Z,Zhang D J.Electrochem Commun,2014,40:92.
