镰刀菌Q7-31T金属蛋白酶FQME14的分离纯化及鉴定
2018-05-07秦日甜卢玉丽梁高丽谢占玲雷亚男
秦日甜 卢玉丽 梁高丽 谢占玲,2 雷亚男
(1. 青海大学生态环境工程学院微生物实验室,西宁 810016;2. 青海省高原作物种质资源创新与利用重点实验室,西宁 810016;3. 西北农林科技大学,杨凌 712100)
有研究发现,在降解纤维素的过程中,纤维素酶与蛋白酶存在协同作用[1-2]。田飞等[3]利用比较蛋白质组学技术,对镰刀菌Q7-31T的植物细胞壁降解酶系组成进行研究,发现共有28种蛋白质,蛋白酶有6种,约占总蛋白数量的21%,其中3种为金属蛋白酶,分别属于M14家族和M28家族,2种为假定蛋白,1种为GMP合酶。前期已经成功分离纯化出Q7-31糖苷水解酶中内切葡聚糖酶Egn20[4]、Egn21[5]和木聚糖酶 Xyn9[6]。
金属蛋白酶是活性中心依赖于金属离子(大多为Zn2+),能高效水解蛋白质和多肽的一类蛋白酶,这类蛋白酶主要是中性蛋白酶,最适pH 7-8[7]。其存在范围广泛,目前发现植物、动物、微生物均可以分泌金属蛋白酶,其作用区域多样,在细胞内、细胞基质、细胞膜和细胞外均发现有一定数量且具有活性的金属蛋白酶[8],且其性质特异,具有重要的经济和应用价值。目前主要应用于洗涤剂、食品、化妆品及抗肿瘤等药物和疾病的机理研究等方面[9]。由于金属蛋白酶来源有限,限制了其进一步发展,而微生物所产胞外金属蛋白酶具有种类多,易分离,产量大等优势。细菌中许多属,如单胞菌属(Alteromonassp.)[10],沙雷氏菌属(Serratia marcescens)[11],嗜碱芽孢杆菌属(Bacillus halodurans)[12]等中都有产金属蛋白酶菌株的报道。报道发现真菌细胞壁酶系发达,其中一部分为金属蛋白酶,但目前挖掘关注点少。
本研究选取分离自青藏高原的一株能高效降解植物细胞壁的镰刀菌 Q7-31T 为材料,通过Sephacryl S-100凝胶过滤层析、DEAE Sepharose Fast Flow 离子交换层析、SDS-PAGE凝胶电泳等技术,分离纯化Q7-31T中蛋白酶,并对其酶学性质进行研究,旨在为蛋白酶研究以及蛋白酶在纤维素降解过程中的作用探究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种 镰刀菌Q7-31(青海大学生态环境工程学院微生物实验室2007年5月从青海湖地区分离得到)。和硫酸铵(天津市恒兴化学试剂制造有限公司),酪蛋白(北京索莱宝公司生产),蛋白胨(Sigma公司生产),葡萄糖(天津市大茂化学试剂厂),丙烯酰胺、考马斯亮蓝 R-250(上海华瞬生物工程有限公司),N,N,N’,N’-四甲基乙烯胺(TEMED),尿素(华美生物工程公司),甘氨酸、十二烷基硫酸钠(SDS)、三羟甲基氨基甲烷(Tris)、低分子量蛋白Marker(上海生工生物工程有限公司),Sephacry S-100、DEAE-Sepharose Fast Flow(Pharmacia公司)。
1.1.2 仪器 全温摇瓶柜HYG-A(太仓市实验设备厂);紫外可见光光度计UV-9200(北京瑞力利分析仪器公司);数显恒温水浴锅HH-6(国华电器有限公司);离心机TDL-40B(上海安亭科学仪器厂);电子精密天平(奥豪斯国际贸易有限公司);垂直电泳仪BG-ver MINI(北京百晶生物技术有限公司);电泳仪电源BG-Power300(北京百晶生物技术有限公司);pH计PH3-3C(上海盛磁仪器有限公司);自动部分收集器BSZ-160(上海青浦沪西仪器厂);SW-CJ-ZFD型双人单面净化工作台(苏州净化设备有限公司);梯度混合器TH-1 000(上海青浦沪西仪器厂)。
1.2 方法
1.2.1 菌株培养 从液体石蜡封存的菌种中挑取直径0.5 cm的琼脂块,接种到PDA平板培养基(马铃薯200 g,蔗糖20 g,琼脂15-20 g,蒸馏水1 000 mL)中心,25℃恒温培养箱中活化5 d;从菌落边缘切下直径1 cm的琼脂块,转接至液体种子培养基(葡萄糖20 g/L、蛋白胨3 g/L、Mendels营养盐:(NH4)2SO41.4 g/L、KH2PO42.0 g/L、 尿 素 0.3 g/L、CaCl20.3 g/L、MgSO40.3 g/L、FeSO45.0 mg/L、MnSO41.6 mg/L、ZnSO41.4 mg/L、CoCl22.0 mg/L,pH自然,装液量60 mL/150 mL),室温静置培养72 h;将液体种子培养基按10%的量接种至产酶液体发酵培养基(燕麦秸秆5 g/L、蛋白胨3 g/L、Mendels营养盐,pH自然,三角瓶装液量100 mL/250 mL),20℃,120 r/min摇床培养120 h。发酵液经8层无菌纱布过滤,得到粗酶液,4℃保存备用。
1.2.2 酶活力的测定 用福林-酚试剂法测定蛋白酶的活力[13]。采用2%酪蛋白为底物,反应时间为20 min,在一定pH值和40℃温度条件下,每分钟水解酪蛋白产生1 μg酪氨酸为一个蛋白酶活力单位U。采用DNS法(3',5' -二硝基水杨酸法)测定CMC酶、外切酶、木聚糖酶及燕麦秸秆酶的活力及还原性糖的产量。分别采用 0.5%羧甲基纤维素、0.5%微晶纤维素、0.5%木聚糖、0.5%燕麦秸秆为底物,反应时间为30 min,40℃,在 40℃下每分钟产生1 μmol 还原糖所需的酶液量为一个酶活力单位(U)。
1.2.3 蛋白含量测定 蛋白含量的测定采用Bradford法,标准曲线是以牛血清白蛋白为标准绘制。在1.5 mL 离心管中加入适当稀释的牛血清白蛋白200 μL,在加入1 mL G-250 考马斯亮蓝染液5-30 min内在595 nm下测定光吸收值。
1.2.4 蛋白酶的分离纯化
1.2.4.1 硫酸铵分级沉淀 将固体硫酸铵研磨细,缓慢加入粗酶液中,调节饱和度到10%-90%,充分混匀后,4℃ 静置过夜,随后4℃、12 000×g离心20 min收集沉淀;沉淀以pH7.5的Tris-HCl缓冲液重悬,4℃备用。
1.2.4.2 Sephacryl S-100葡聚糖凝胶层析 硫酸铵分级沉淀后的样品加入到Sephacry S-100葡聚糖凝胶层析柱(26 mm×700 mm),以Tris-HCl缓冲液(0.02 mol/L、pH 7.5)洗脱、流速为1.5 mL/min,每2 min收集1管。用核酸蛋白检测仪检测蛋白的分布,福林-酚试剂法检测蛋白酶的分布(方法如1.2.2、1.2.3所述)。
1.2.4.3 DEAE弱阴离子交换层析 取凝胶层析柱收集的蛋白酶活性部分,添加到DEAE琼脂糖凝胶弱阴离子交换柱(15 mm×50 mm)上,用含有NaCl(0.02 mol/L-1.0 mol/L,pH 7.5)的缓冲液做线性梯度洗脱(2 mL/min),用核酸蛋白检测仪检测蛋白分布,用福林酚法检测蛋白酶的分布(方法如1.2.2、1.2.3所述)。1.2.5 SDS-PAGE 以SDS-PAGE法[14]检测蛋白质的分子量。浓缩胶浓度5%,电泳电压为80 V;分离胶浓度为12%,电泳电压为120 V。
1.2.6 酶学性质研究
1.2.6.1 最适温度及稳定性测定 将2.0 %的干酪素溶液,分别在 4、10、20、30、40、50、60、70和80℃水浴中预热5 min,然后加入1 mL 酶液,水浴中保温10 min,采用福林-酚法测定酶活力,以确定最适温度;将1 mL 酶液分别在上述温度条件下保温30 min,将预热后的酶液加入到50℃预热的5 mL酪素溶液中,50℃保温10 min,采用福林酚法测酶活力,研究酶的热稳定性。
1.2.6.2 最适pH及稳定性测定 将2.0%的干酪素溶液处于不同pH的缓冲液中,pH范围为3. 0-10. 0,将1 mL 酶液加入到5 mL已在50℃水浴锅中预热的不同pH的干酪素溶液中,50℃保温10 min,然后用福林酚法,测定酶在不同 pH下的酶活力,以确定最适pH;将酶液加入到各pH值缓冲液中,室温保温30 min,然后用福林酚法测定蛋白酶的酶活力,研究酶的pH稳定性。
1.2.6.3 底物特异性测定 分别以2%的酪蛋白、胶原蛋白、卵清蛋白、牛血清白蛋白、头发(主要为角蛋白粗品)、蛋白胨及牛肉膏作为底物,将纯化的蛋白酶分别与不同的底物在pH 7.0,40℃条件下反应30 min,按照酶活力测定方法测定酶活性。以最高酶活力为100%,计算对不同底物的相对酶活。
1.2.6.4 米氏常数的测定 米氏常数Km的测定采用Lineweaver-burk法:固定酶浓度,在酶量不变的情况下改变底物酪蛋白的浓度,测定酶活力随底物浓度的改变而变化的情况。
1.2.6.5 金属离子对蛋白酶活力的影响 分别在酶液中加入不同金属离子化合物:Na+、K+、Zn2+、Fe2+、Mg2+、Mn2+、Ca2+,各种金属离子在反应体系中的终浓度达到4 mmol/L,pH调整到7.0,40℃处理30 min后,测定蛋白酶的酶活力。以未加金属离子的酶活力作为100%。
1.2.7 蛋白鉴定 蛋白的鉴定是由北京华大基因完成,具体的实验方法参照田飞等[1]的研究。对镰刀菌Q7-31菌株发酵液中所产的蛋白酶进行库中的鉴定,通过与质谱数据库比对分析,鉴定蛋白酶。
1.2.8 镰刀菌 Q7-31T 植物细胞壁降解酶系协同作用 在镰刀菌Q7-31T发酵培养的5 d内,分别以羧甲基纤维素(CMC)、微晶纤维素、燕麦秸秆、酪蛋白和木聚糖为底物,测出CMC酶、外切酶、纤维素酶、蛋白酶和木聚糖酶的酶学活性及总蛋白含量。
2 结果
2.1 发酵时间对菌株产酶的影响
用福林酚法测定不同培养时间下粗酶液的蛋白酶酶活。结果如图1所示,发酵液中蛋白酶活力呈现出先上升后下降的趋势。第6天的酶活是最高的,故选择产蛋白酶的最佳培养时间为第6天。

图1 发酵时间对菌株产蛋白酶的影响
2.2 镰刀菌Q7-31T金属蛋白酶的分离纯化
大部分蛋白样品在硫酸铵为10%-90%的饱和度条件下沉淀下来。蛋白样品以0. 02 mol/L pH7.5 Tris-HCl缓冲液重悬,取25 mL重悬液添加到Sephacry S-100葡聚糖凝胶柱进行初步分级分离,洗脱图谱如图2所示。主要有5个蛋白峰(P1、P2、P3、P4和P5),蛋白酶的酶活力主要集中在P3处。将P3处的样品收集、浓缩,上样到DEAE琼脂糖凝胶弱阴离子交换柱进一步分离纯化,洗脱图谱如图3所示,包括一个穿透峰(P6)和一个洗脱峰(P7),活性分析发现发现 P6处的蛋白样品有明显的蛋白酶酶活力,而P7处的蛋白样品无酶活力。对P6处样品进行SDS-PAGE检测(图4),发现为单一条带,经凝胶成像系统分析,分子量为30 kD,将该蛋白酶命名FQME14。

图2 Sephacryl S-100凝胶过滤洗脱图谱

图3 DEAE-Sepharose Fast Flow阴离子交换洗脱图谱

图4 镰刀菌Q7-31T金属蛋白酶的SDS-PAGE电泳图
以600 mL发酵液开始,蛋白酶FQME14从粗酶液到最后的纯化产物共纯化了8.64倍,回收率为3%,酶纯化后的比活力为2.85 U/mg,分离纯化结果如表1所示。
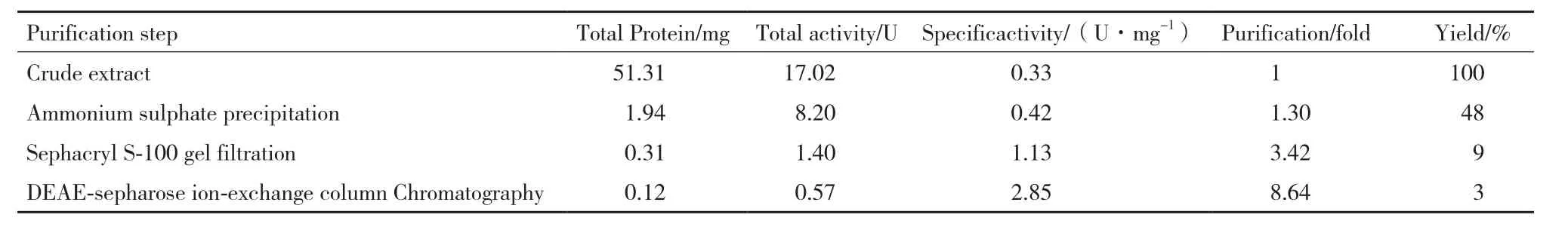
表 1 蛋白酶Protease Q7-31A的纯化
2.3 蛋白酶酶学性质分析
2.3.1 最适温度、pH及稳定性测定 FQME14 最适反应温度、pH 及其耐受情况如图5、6 所示。最适反应温度为40℃,最适反应pH 为7;纯化的酶在50℃以下恒温水浴仍能维持原有酶活力的80% 以上,温度超过50℃后,酶活力呈现出下降的趋势;pH 稳定性检测发现该酶在pH 5.0-pH 9.0之间具有较好的稳定性,相对酶活均超过80%,pH超过9.0之后,酶活出现下降的趋势。
2.3.2 金属离子对蛋白酶活力的影响 金属离子对蛋白酶活力的影响如图7所示,Mn2+和Co2+对酶活性有强烈的激活作用,对蛋白酶相对酶活均提高4-5倍;Fe2+、Mg2+、Na+、K+、Ca2+和 Zn2+对酶活性有不同等程度的抑制作用。
2.3.3 底物特异性测定 底物特异性测定如图8所示,蛋白酶的最适底物为酪蛋白,对牛血清白蛋白和卵清蛋白也有较高的降解能力。
2.3.4 蛋白酶的米氏常数测定 采用Lineweaverburk作图法得到1/V和1/S的关系曲线如图9所示,由此计算出蛋白酶的米氏常数为8.99 mg/mL,最大反应速度为 9.14 μg/(min·mL)。
2.4 蛋白酶的鉴定
对蛋白酶FQME14的蛋白样品进行SDS-PAGE电泳检测结果显示,蛋白酶FQME14的分子量为30 kD;进行串联质谱分析先通过一级质谱获得蛋白的肽指纹图谱(PMF),再选取有代表性的肽段,进一步破碎后进行二级质谱检测,质谱图如图10所示,二级质谱获得 2 段多肽序列:GSKPAIVFHGTVHAR和AKYSYTIELRDRGTYGFSLPANQIQPTVR;二级质谱结果结合母离子信息和PMF 的结果进行搜库(NCBI)比较,经 Mascot 搜索引擎检索,蛋白酶Q7-31A对应结果为M14家族蛋白酶(gi|342881706),与 hypothetical protein FOXB_06955(Sequence ID:EGU82539.1)94%相似;经Mascot搜索引擎检索,检索最高得分为62分(75为阳性结果),结合蛋白酶的酶学特性对应结果分析,该蛋白酶属于M14家族,是一种新的金属蛋白酶。
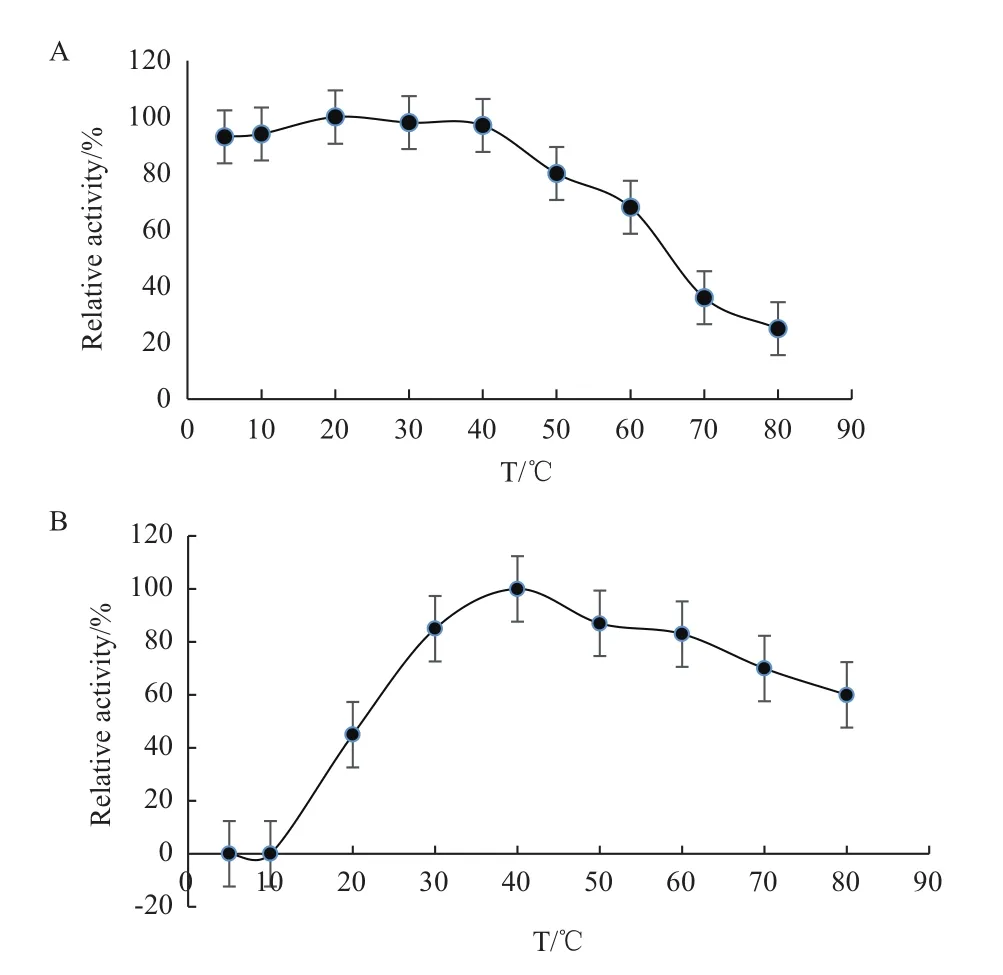
图5 金属蛋白酶FQME14的最适温度(A)和温度稳定性(B)
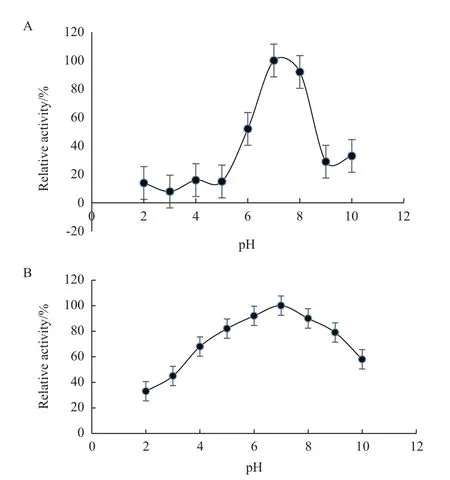
图6 蛋白酶的最适pH(A)和pH耐受性(B)
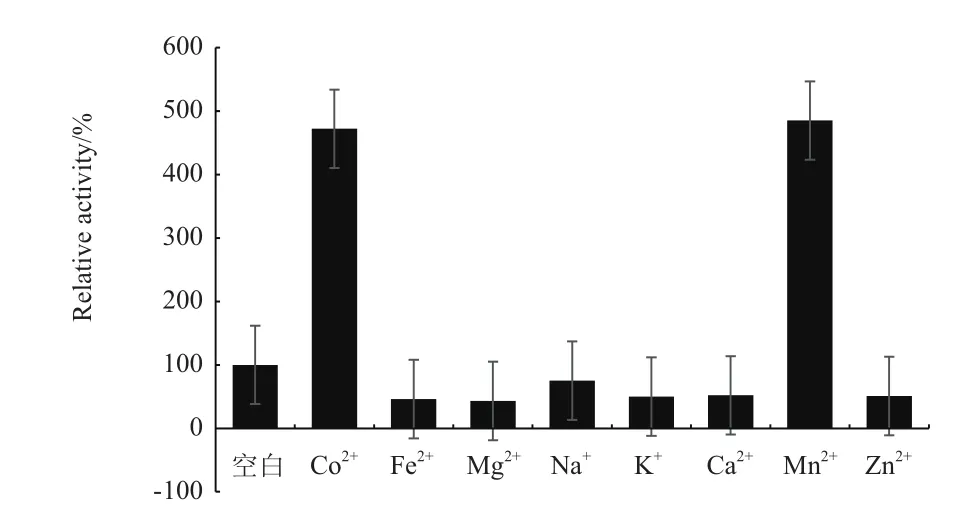
图7 金属离子对蛋白酶活力的影响

图8 蛋白酶底物特异性检测
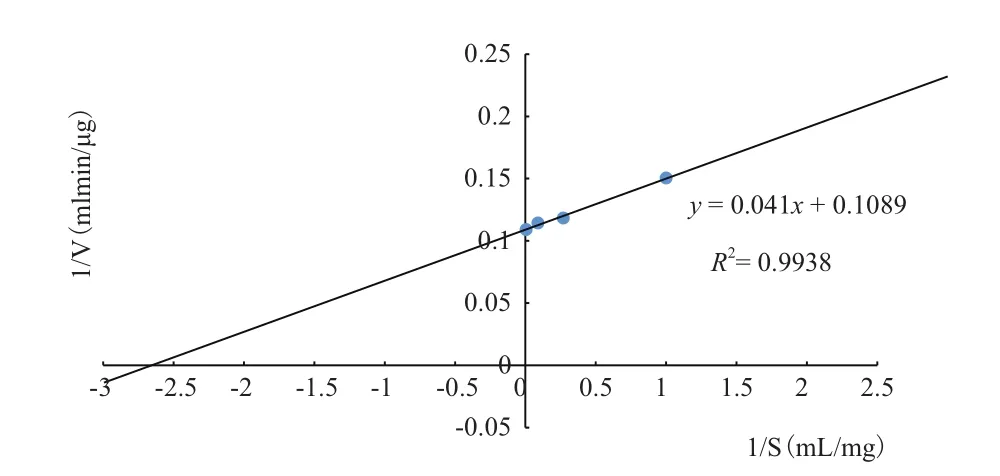
图9 Lineweaver-Burk双倒数曲线

图10 蛋白酶质谱鉴定图谱
2.5 镰刀菌Q7-31T植物细胞壁降解酶系协同作用
如图11所示,1-2 d CMC酶酶活远高于外切酶酶活。2-3 d,CMC酶活下降,外切酶酶活上升;3-5 d CMC酶酶活再次上升,外切酶酶活略有下降,蛋白酶酶活开始表现并上升趋势。

图11 发酵时间对菌株产酶的影响
3 讨论
经本次实验得出蛋白酶FQME14的最适pH 为7.0,为中性蛋白酶,是M14家族的一种新的金属蛋白酶。该金属蛋白酶具有较低的回收率,与Hang等[15]研究的金属蛋白酶相似,这可能与蛋白酶本身的自溶现象[16]有关。经酶学特性研究发现它的最适反应温度为40℃,在pH 5.0-9.0范围内酶活较稳定,温度在50℃以下保持较稳定的酶活,Mn2+和Co2+对它有激活的作用,Mg2+、Fe2+、K+、Ca2+、Zn2+和Na+对酶活有不同等程度的抑制作用,与Wu[17]和母智深等[18]的研究相似,而与Matsubara等[19]研究的金属蛋白酶有所不同,这可能是因为它们是不同的蛋白酶家族,也可能是由于产生于不同的微生物以及培养方式不同所导致。已知金属蛋白酶家族的活性中心均存在Zn2+,但是实验研究发现Zn2+对金属蛋白酶FQME14的酶活性具有抑制作用。目前研究[5-6,20]发现,在降解纤维素的过程中,纤维素酶与蛋白酶存在协同作用,但具体的作用机理尚不明确。在探究镰刀菌Q7-31T植物细胞壁降解酶系协同作用时,在发酵培养期间,总蛋白质含量变化主要与蛋白酶酶活变化相关,二者几乎同步,因此,推测在纤维素酶降解纤维素的过程中蛋白酶起调节CMC酶和外切酶活性的作用。纤维素酶降解机制的研究,一直是一个难点,本研究能丰富镰刀菌Q7-31T对植物细胞壁降酶系的信息,并为后期对镰刀菌高效降解纤维素机制的研究提供数据支持。
4 结论
从燕麦秸秆诱导发酵的镰刀菌Q7-31T粗酶液中分离纯化到一种新型的M14家族金属蛋白酶FQME14,并研究了其酶学性质。其相对分子质量为30 kD;最适反应温度40℃、最适pH7,在10-50℃、pH 5.0-9.0范围内具有80% 以上酶活力;Mn2+和Co2+对FQME14酶活性有较强激活作用,Fe2+、Mg2+、Na+、K+、Ca2+和 Zn2+对其酶活性质有不同程度的抑制作用。FQME14的最适底物为酪蛋白,对牛血清白蛋白和卵清蛋白也有较高的降解能力;米氏常数为8.99 mg/mL,最大反应速度为9.14 μg/(min·mL)。
[1] Gao PJ, Chen GJ, Wang TH, et al. Non-hydrolytic Disruption of crystalline structure of cellulose by cellulose binding domain and linker sequence of cellobiohydrolase I fromPenicillium janthinellum[J].Acta Biochim Biophys Sin, 2001, 33(1):13-18.
[2] 韩玮, 何明. 外源酶对秸秆堆肥进程的影响及腐熟度模糊评价[J]. 环境科学学报, 2015(11):3742-3749.
[3] Tian F, Xie ZL, Zhao LZ, et al. Comparative secretome analysis ofFusarium sp. Q7-31T during liquid fermentation using oat straw as a carbon source[J]. Ann Microbiol, 2015, 65(4):2131-2140.
[4] 田飞, 谢占玲, 郭璟, 等. 镰刀菌 Q7 -31T 内切葡聚糖酶 Egn20的分离纯化鉴定及酶学特性[J]. 微生物学报, 2015, 55(8):1042-1049.
[5] 常鑫园, 谢占玲, 张凤梅, 等. 镰刀菌Q7-31T内切葡聚糖酶Egn21的分离纯化及酶学性质[J]. 微生物学报, 2017, 57(1):33-42.
[6] 赵联正, 谢占玲, 赵 朋. 一种新的镰刀菌 Q7-31 木聚糖酶 Xyn9的分离纯化鉴定及酶学特性[J]. 江苏农业科学, 2015, 43(5):42-45.
[7] 李琳, 李海梅, 何胜华, 等. 蛋白酶和纤维素酶协同水解豆渣的工艺[J]. 食品研究与开发, 2012(7):147-150.
[8] Nickerson NN, Joag V, McGavin MJ. Rapid autocatalytic activation of the M4 metalloprotease aureolysin is controlled by a conserved Nterminal fungalysin-thermolysin-propeptide domain[J]. Mol Microbiol, 2008, 69(6):1530-1543.
[9] Rawlings ND, Waller M, Barrett AJ, Bateman A. MEROPS:The database of proteolytic enzymes, their substrates and inhibitors[J].Nucl Acids Res, 2014, 42(D1):D503-509.
[10] 荆谷, 冯静, 孔健, 等. 微生物金属蛋白酶的研究进展[J].生物工程进展, 2002, 22(1):56-63.
[11] Shibata M, Takahashi S, Sato R. A Novel Metalloproteinase,almelysin, from a marine bacterium,Alteromonassp. No. 3696:purification and characterization[J]. Bioscience, Biotechnology,and Biochemistry, 1997, 61(4):710-715.
[12] Tao K, Yu XQ, Liu Y, et al. Cloning, expression, and purification of insecticidal protein Pr596 from locust pathogenSerratia marcescensHR3[J]. Current Microbiology, 2007, 55(3):228-233.
[13] Lowry OH, Rosebrough NJ, Farr AL, et al. 福林酚试剂法测定蛋白质[J]. 食品与药品, 2011, 13(3):147-151.
[14] Yang XZ, Shi PG, Huang HQ, et al. Two xylose-tolerant GH43 biofunctional β-xylosidase/α-arabinosidases and one GH11 xylanase from Humicolainsolens and their synergy in the degradation of xylan[J]. Food Chemistry, 2014, 148:381-387.
[15] Hang F, Wang QB, Hong Q. Structural insight into a novel neutral metalloproteinase fromPaenibacillusspp. BD3526:Implications for mechanisms of rapid inactivation and calcium-dependent stability[J]. Int J Biol Macromol, 2017, 95:1082-1090.
[16] Wu JL, Wang S, Sun XY. Purification, characterization, and cDNA cloning of a matrix metalloproteinase from the skeletal muscle of silver carp(Hypophthalmichthys molitrix)with collagen degradation activity[J]. Process Biochemistry, 2016, 51(7):854-864.
[17] Wu JW, Chen XL. Extracellular metalloproteases from bacteria[J]. Appl Microbiol Biotechnol, 2011, 92(2):253-262.
[18] 母智深, 白英, 赵广华, 等. 荧光假单胞杆菌胞外蛋白酶的纯化及热稳定性[J]. 高等学校化学学报, 2009, 29(4):762-766.
[19] Matsubara H. Purification and assay of thermolysin[J]. Methods Enzymol, 1970, 19:642-651.
[20] 朱宁. 木质纤维素降解酶系在草本类生物质上的协作机制[D]. 北京:中国农业大学, 2016.
