肌少症对老年进展期胃癌患者根治性胃切除术后并发症的影响△
2018-05-07马亮亮张飞宇王速临
马亮亮 张飞宇 王速临 余 震
(温州医科大学附属第一医院胃肠外科 温州 325015)
肌少症是一种与年龄相关的,以进行性、全身广泛性骨骼肌质量减少和功能下降为特征的的综合征[1~2]。最近研究显示,肌少症与结直肠癌、胃癌术后不良预后相关[3],然而大多数研究仅使用骨骼肌质量减少单一指标来定义肌少症,忽视了骨骼肌功能的重要性。另外,肌少症与年龄相关,老年患者肌少症高发,而当前针对老年人相关的研究较少。因此,探究肌少症与老年患者术后并发症的相关性具有较大的临床意义。
1 资料与方法
1.1 纳入和排除标准
本研究纳入2015年8月~2017年4月间在温州医科大学附属第一医院胃肠外科接受限期胃癌手术的患者。纳入标准:(1)年龄大于或等于65岁;(2)美国麻醉医师协会(ASA)分级≤III;(3)经临床和细胞/病理学检查证实为进展期胃癌;(4)接受根治性胃切除术;(5)术前接受了腹部CT检查。排除标准包括:(1)接受非根治性手术患者;(2)患者由于身体残疾或者其他方面原因导致无法测量骨骼肌功能。本研究得到温州医科大学附属第一医院医学伦理委员会的授权,所有参与此项观察性研究的患者均于入院时签署知情同意书。
1.2 数据收集
本研究前瞻性的收集每位患者的以下临床数据:(1)临床病理信息,包括性别、年龄、身体质量指数(BMI)、血清白蛋白、血红蛋白、营养风险筛查2002(NRS 2002)评分、ASA等级、术前合并症(并且进行Charlson合并症指数评分)、术前腹部手术史、腰3骨骼肌指数(L3 SMI)、握力、步速、肌少症;(2)术后临床结局,包括术后并发症、术后住院时间、手术费用、30d内再入院。
1.3 肌少症的诊断
欧洲老年人肌少症工作组(EWGSOP)和亚洲肌少症工作组(AWGS)将肌少症定义为在骨骼肌质量减少的基础上,具有骨骼肌减少和/或身体活动能力减退二者中的任意一项[1,4]。本研究通过计算腰3(L3)平面骨骼肌指数(SMI)以反映骨骼肌质量。采用专业医学图像处理软件(version 3.0.11.3 BN17; INFINITT Healthcare Co., Ltd)测定各个患者的肌肉面积。
1.4 随访策略
对出院30d内的患者以电话随访的方式了解术后恢复情况。每10d一次电话随访,一旦发现患者有任何不适,马上来我院就诊。出院后2周后进行一次常规门诊复查。
1.5 统计学方法
正态分布的连续性变量描述为均数和标准差,采用独立样本t检验进行两组之间的比较。非正态分布的连续性变量描述为中位数和四分位间距,采用Mann-Whitney H检验进行两组之间的比较。分类变量之间的比较采用χ2检验或者Fisher’s确切检验。在术后并发症的相关因素进行分析时,将单因素分析中P值具有显著性趋势的因素(P<0.1)纳入多因素相关分析,采用logistic多因素回归分析得出术后并发症的独立危险因素。所有资料采用SPSS22.0进行统计分析,P<0.05(双侧)被认为有统计学意义。
2 结果
2.1 临床基本病理特征
2015年8月~2017年4月,总共纳入184名符合纳入标准的患者,患者的基本临床特征见表1。184名患者中,60人(32.6%)被诊断为肌少症。根据表1结果显示,与非肌少症患者相比,肌少症组的患者的年龄更高(中位数75岁vs71岁,P<0.05)、BMI更低(P<0.001)、术前白蛋白更低(P=0.008)、术前血红蛋白更低(P<0.001)、NRS 2002评分更高(P<0.001)。同时在肌少症相关指标(L3 SMI、握力、步速)上,肌少症组比非肌少症组均更低(P<0.05)。
表1 病人基本临床特征分析

因素总人数(n=184)肌少症(n=60)非肌少症(n=124)P年龄,中位数(IQR),年73(7)75(6)71(6.75)0.005∗性别女32(17.4)14(23.3)18(14.5)男152(82.6)46(76.7)106(85.5)0.139BMI,均值(SD),kg/m222.28(2.93)20.84(2.43)22.98(2.90)<0.001∗术前白蛋白,均值(SD),g/L36.30(4.38)35.08(4.11)36.89(4.41)0.052术前血红蛋白,均值(SD),g/L113.20(23.12)104.43(21.59)117.44(22.74)<0.001∗ASA等级I5(2.7)1(1.7)4(3.2)II127(69)39(65.0)88(71)III52(28.3)20(33.3)32(25.8)0.501NRS2002评分,中位数(IQR)2(2)3(3)2(1)<0.001∗Charlson合并症指数0134(72.8)42(70)92(74.2)136(19.6)13(21.7)23(18.5)≥214(7.6)5(8.3)9(7.3)0.835L3SMI,均值(SD)cm2/m239.57(8.12)33.55(5.02)42.48(7.73)<0.001∗握力,中位数(IQR),kg26.05(12.35)19.6(8.33)30(9.9)0.031∗步速,均值(SD),m/s0.90(0.21)0.76(0.19)0.97(0.19)0.006∗
注:除非特殊说明,括号内的数字表示百分比;*表示有统计学意义 (P<0.05)。SD:标准差;IQR:四分位间距;BMI:身体质量指数;ASA:美国麻醉医师协会。NRS:营养风险筛查;L3 SMI:第三腰椎骨骼肌指数。
2.2 术后临床结局
根据表2,肌少症组比非肌少症组肠梗阻发生率更高(P<0.05),呼吸系统并发症发生率更高(P<0.05)。此外,肌少症组比非肌少症组住院费用更高(P<0.05),出院后30天再入院的几率更大(P<0.05)。
表2 术后临床结局
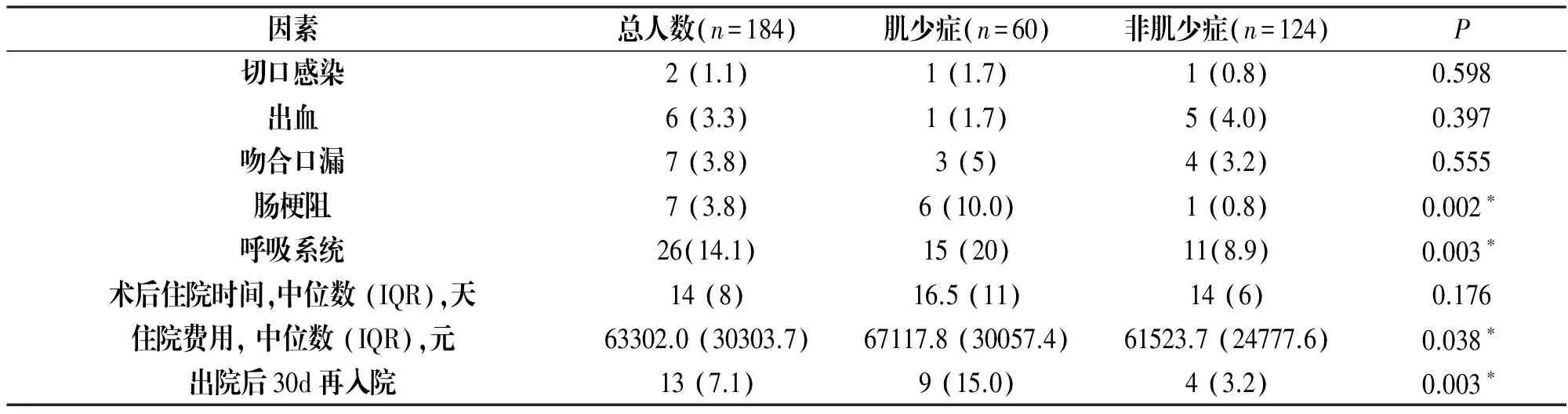
因素总人数(n=184)肌少症(n=60)非肌少症(n=124)P切口感染2(1.1)1(1.7)1(0.8)0.598出血6(3.3)1(1.7)5(4.0)0.397吻合口漏7(3.8)3(5)4(3.2)0.555肠梗阻7(3.8)6(10.0)1(0.8)0.002∗呼吸系统26(14.1)15(20)11(8.9)0.003∗术后住院时间,中位数(IQR),天14(8)16.5(11)14(6)0.176住院费用,中位数(IQR),元63302.0(30303.7)67117.8(30057.4)61523.7(24777.6)0.038∗出院后30d再入院13(7.1)9(15.0)4(3.2)0.003∗
注:*差别有统计学意义(P<0.05);IQR:四分位间距。
2.3 术后并发症的危险因素
对术后并发症进行单因素分析,结果表明,术后并发症与贫血(P=0.001)、charlson合并症指数(P=0.013)、肌少症(P<0.001)有关。多因素分析结果表明,charlson合并症指数≥2(OR:4.666, 95% CI:1.408-15.468,P=0.012)和肌少症(OR:3.357,95% CI:1.727-6.529,P=0.012)是术后并发症的独立危险因素,见表3。
表3 术后并发症的单因素和多因素分析
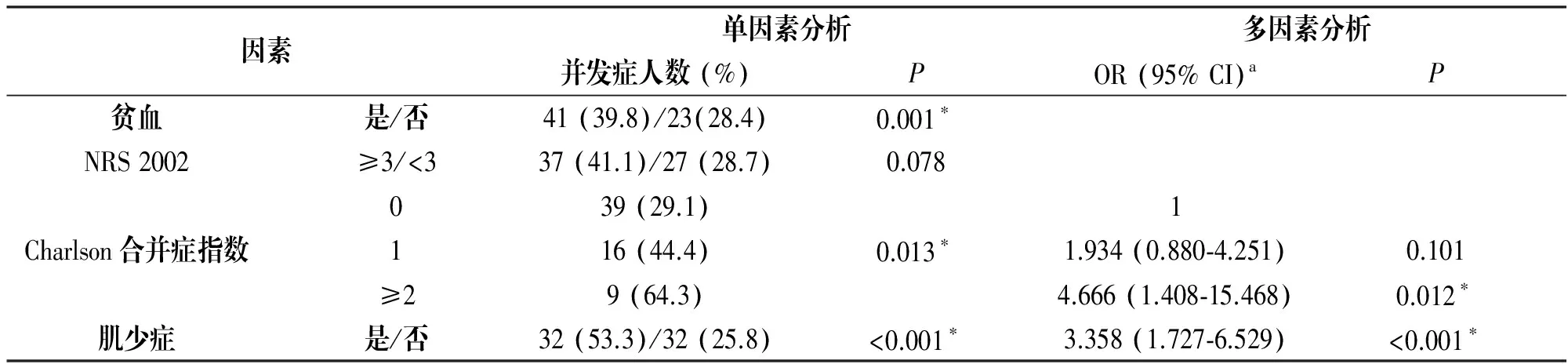
因素单因素分析多因素分析并发症人数(%)POR(95%CI)aP贫血是/否41(39.8)/23(28.4)0.001∗NRS2002≥3/<337(41.1)/27(28.7)0.078Charlson合并症指数039(29.1)1116(44.4)0.013∗1.934(0.880⁃4.251)0.101≥29(64.3)4.666(1.408⁃15.468)0.012∗肌少症是/否32(53.3)/32(25.8)<0.001∗3.358(1.727⁃6.529)<0.001∗
注:*差别有统计学意义(P<0.05);OR:相对风险度。
3 讨论
全世界每年大约新增90万名胃癌患者,每年有近70万人死于胃癌[5]。中国是胃癌的高发地区,很大一部分胃癌患者诊断时已处于进展期。近年来,由于手术器械、手术技术以及围手术期患者的管理的进步,胃癌患者的手术预后已经得到很大程度的提高。然而,对于老年患者,由于虚弱以及合并症的存在,术后并发症的发生率仍然不小[6]。因此,对老年患者进行术前评估,对于降低术后并发症的发生率很有必要。目前,老年人术前评估多采用美国老年病协会发布的术前评估指南,然而这些评估内容繁杂,需要消耗大量的时间,以至于在繁忙的外科诊疗中难以完成[7]。最近,大量的研究表明,肌少症可以作为术前评估工具对术后并发症进行预测[6]。
CT被公认为目前评估骨骼肌质量的金标准[8]。在临床工作中,胃癌患者术前常规进行CT扫描以确定肿瘤的大小和位置以及是否发生转移。因此,采用CT来评估骨骼肌质量并不额外增加患者医疗费用。由此可见,CT在评估胃肠道肿瘤患者的骨骼肌质量方面具有广泛的应用前景。
肌少症与肿瘤进展有关,相对于早期胃癌患者,肌少症在进展期胃癌中更为常见。肌少症导致术后并发症的原因可能有两点:(1)营养不良会增加术后并发症的发生率[9],该研究显示肌少症组有着更低的BMI(P<0.001),更低的白蛋白(P=0.008),更低的血红蛋白(P<0.001),更高的NRS 2002分数(P<0.001),这些都是常用的评估营养状态的指标。另外据报道骨骼肌质量也可以反映营养状态[10],因此肌少症相比常用的营养指标更能反映患者的营养不良,这也就解释了本文中肌少症是老年进展期胃癌患者术后的独立危险因素;(2)身体功能、日常的活动、活力的维持在很大程度上依赖骨骼肌力量[10]。骨骼肌力量又是肌少症的重要组成部分,当发生肌少症时,患者逐渐感觉虚弱,活动能力受限,进而影响术后恢复进程,因此探究肌少症对预测术后老年人的并发症可能很有意义。进一步分析表2,与非肌少症组相比,肌少症组在呼吸系统并发症增多,这与Nishigori T[11]的观点一致,这可能与呼吸肌及相关肌肉受肌少症影响,导致肺和吞咽功能受损有关,但具体机制目前暂不明[12]。Charlson合并症指数是指除基础疾病以外的其他器官或组织的损伤及异常,在老年患者中发生率较高。最近Chou WC等[13]认为Charlson合并症分数较高时,恶性肿瘤患者预后就较差。本次研究中,Charlson合并症指数≥2同样成为胃癌根治术后并发症的独立危险因素,对于预测术后并发症很有帮助。另外,本研究具有一定局限性,仅分析胃癌术后的短期临床结局,因此,肌少症对进展期胃癌患者根治术后远期临床结局的影响值得进一步探究。
肌少症不仅能反映患者的身体功能,还能反映机体的营养状态,同时有着相对客观性、易操作性与全面性等优点,能更好地预测接受根治性胃切除术老年进展期胃癌患者的术后并发症,希望肌少症未来能成为老年综合评估的一部分。
1 Fielding RA,Vellas B,Evans WJ,et al.Sarcopenia:an undiagnosed condition in older adults.Current consensus definition:prevalence,etiology,and consequences.International working group on sarcopenia.J Am Med Dir Assoc,2011,12(4):249~256.
2 Cruz-Jentoft AJ,Baeyens JP,Bauer JM,et al.Sarcopenia:European consensus on definition and diagnosis:Report of the European Working Group on Sarcopenia in Older People.Age Ageing.J Am Med Dir Assoc,2011,12(4):249~256.
3 Wang SL,Zhuang CL,Huang DD,et al.Sarcopenia Adversely Impacts Postoperative Clinical Outcomes Following Gastrectomy in Patients with Gastric Cancer:A Prospective Study.Ann Surg Oncol,2016,23(2):556~564.
4 Chen LK,Liu LK,Woo J,et al.Sarcopenia in Asia:consensus report of the Asian Working Group for Sarcopenia.J Am Med Dir Assoc,2014,15(2):95~101.
5 Parkin DM,Bray FI,Devesa SS.Cancer Burden in the year 2000.The Global Picture.Eur J Cancer,2001,37 Suppl 8:S4~66.
6 Zhou CJ,Chen FF,Zhuang CL,et al.Feasibility of Radical Gastrectomy for Elderly Patients with Gastric Cancer.Eur J Surg Oncol,2016,42(2):303~311.
7 Mohanty S,Rosenthal RA,Russell MM,et al.Optimal Perioperative Management of the Geriatric Patient:A Best Practices Guideline from the American College of Surgeons NSQIP and the American Geriatrics Society.J Am Coll Surg,2016,222(5):930~947.
8 Phillips SM.Nutritional Supplements in Support of Resistance Exercise to Counter Age-related Sarcopenia.Adv Nutr.2015.6(4):452~460.
9 Hall JC.Nutritional Assessment of Surgery Patients.J Am Coll Surg,2006,202(5):837~843.
10 Prado CM,Heymsfield SB.Lean Tissue Imaging:a New Era for Nutritional Assessment and Intervention.JPEN J Parenter Enteral Nutr,2014,38(8):940~953.
11 Nishigori T,Okabe H,Tanaka E,et al.Sarcopenia as a Predictor of Pulmonary Complications after Esophagectomy for Thoracic Esophageal Cancer.J Surg Oncol,2016,113(6):678~684.
12 Wakabayashi H,Sakuma K.Rehabilitation Nutrition for Sarcopenia with Disability:a Combination of both Rehabilitation and Nutrition care Management.J Cachexia Sarcopenia Muscle,2014,5(4):269~277.
13 Chou WC,Liu KH,Lu CH,et al.To Operate or Not:Prediction of 3-Month Postoperative Mortality in Geriatric Cancer Patients.J Cancer,2016,7(1):14~21.
