MicroRNA-21靶调控NCM460细胞ROCK1基因上调occludin表达*
2018-05-07刘志华
李 超, 刘 敏, 刘志华
(中山大学附属第六医院结直肠外科, 广东省胃肠病学研究所, 广东 广州 510655)
目前肠屏障功能调节的研究主要集中在益生菌及其活性成分、致病菌及相关成分和炎症介质等方面[1-2],对于其机制的研究仍有一定的局限[3]。微小RNA(microRNA,miRNA,miR)近几年的研究主要集中在肿瘤[4-6]、心血管疾病[7]以及神经系统疾病[8]等,而其对肠屏障功能的影响研究较少[9]。研究表明,miR-21可激活肠上皮细胞内的丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)/细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路,抑制第10号染色体缺失的磷酸酶-张力蛋白同源物(phosphatase and tensin homolog deleted on chromosome 10,PTEN)/磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)信号通路,且PTEN/PI3K信号通路活化被认为参与了肠上皮机械屏障的调节[10]。miR-21是否通过其它途径影响肠上皮机械屏障仍不明确。生物信息学分析表明,miR-21的预测靶基因包括Rho蛋白家族中的一些成员,如ROCK1。有研究表明,Rho蛋白家族中ROCK1参与调节紧密连接(tight junction,TJ)相关蛋白——闭合蛋白(occludin)的表达与沉积[11]。肠上皮机械屏障主要包括肠上皮细胞及细胞间紧密连接蛋白,occludin是重要的细胞间紧密连接蛋白。据此,我们假设miR-21可能通过靶向调控ROCK1而调节肠屏障功能相关蛋白occludin。在此基础上,我们拟通过细胞水平上调或下调miR-21观察肠上皮细胞的功能表型改变,进而采用生物信息学方法预测miR-21的靶基因,并通过萤光素酶报告基因进行验证。从而明确miR-21对肠屏障功能的影响,推测可能的机制。
材 料 和 方 法
1 细胞
人正常结肠上皮细胞系NCM460购于INCELL;人胚肾细胞株293T由中山大学附属第六医院胃肠病研究所提供。
2 主要仪器及试剂
NanoDrop 2000超微量分光光度计、CO2培养箱和生物安全柜(Thermo);ABI 7500荧光定量PCR仪和普通PCR仪(Applied Biosystems);Model 680酶标仪和蛋白转印系统(BIO-RAD);DMI4000B自动智能数字相差荧光倒置显微镜(Leica);G:BOX/HR-E-M自动凝胶成像系统(Syngene);倒置相差生物显微镜(Nikon);萤光素酶分析仪(BMG Labtech)。
胎牛血清(fetal bovine serum,FBS)和DMEM高糖培养基(Gibco);Lipofectamine 2000 Reagent、Opti-MEM培养基、TRIzol、RevertAid First Strand cDNA Synthesis Kit、miRNA qPCR Kit、Platinum PCR SuperMix-UDG、TaqMan MicroRNA Reverse Transcription Kit、PowerUpTMSYBR® Green Master Mix、高保真DNA聚合酶和T4 DNA链接酶(Invitrogen);兔抗ROCK1、 occludin和β-actin 多克隆抗体(CST); II抗和Wizard®基因组DNA纯化试剂盒(弗德生物);Dual-Luciferase Reporter Assay System、EcoR V、NheI、HindIII、EcoR I和DpnI(Promega);DNA凝胶回收试剂盒(Tiangen);质粒提取试剂盒(MN);KOD -Plus- Neo DNA Polymerase(TOYOBO);miR-21 mimics和inhibitors(广州锐博生物)。所用引物及测序由Invitrogen公司根据设计合成。
3 主要方法
3.1hsa-miR-21慢病毒载体的构建 表达载体pGIPZ的酶切采用BamH I和XhoI完成。对酶切产物电泳,随后回收产物片段,长度约11 kb。扩增目的基因所用引物设计如下,hsa-miR-21-BamH I-R: 5’-ATTCTGATCAGGATCCCTAAGTGCCACCAGACAGAAG-3’;hsa-miR-21-XhoI-F: 5’-CAACAGAAGGCTCGAGGATCTTAACAGGCCAGAAATG-3’;miR30-F: 5’-ATGAGGCTTCAGTACTTTACAG-3’;WPRE-R: 5’-CATAGCGTAAAAGGAGCAACA-3’。随后PCR扩增目的基因片段,将扩增的目的基因与线性载体进行同源重组,再将连接产物与DH5α细胞进行转化,最终获得阳性克隆送测序。最终将包装好的慢病毒感染NCM460细胞,构建稳定转染细胞株,荧光显微镜下观察可见到细胞发出绿色荧光,表示感染成功。
3.2miR-213’UTR载体构建 在NCBI上选取并分析目的基因序列,扩增引物序列如下,ROCK1XhoI: 5’-ccgctcgagGCCTGCTTTCGCCTGCTGTC-3’; ROCK1NotI-R:5’-ataagaatgcggccgcTCTATGGGAGTAGTATTT-
TTATTATTCCAATTG-3’。随后在人基因组上通过PCR 钓取目的基因,再将PCR产物切胶回收并纯化,将连接产物转化,平板选取单克隆提取质粒酶切后送测序,BLAST比对测序结果。采用同样方法构建ROCK1 3’UTR突变载体。
3.3miRNA与目的质粒共同转染NCM460细胞 阳离子脂质体法行细胞转染:转染的前 1 d,将NCM460细胞按照每孔2×104在24孔板上铺板;转染当天,NCM460细胞生长融合度应为50%~60%。转染前1 h弃去旧培养基,PBS洗2次,每孔加入300 μL Opti-MEM培养基,放回CO2培养箱;每孔加入1 μL Lipofectamine 2000,加入Opti-MEM培养基至终体积50 μL,在室温下静置约5 min;每个孔用加入20 μmol/L的miR-21 mimic 1 μL、miR-21 inhibitor 2 μL和0.5 μg质粒,再加入Opti-MEM至总体积50 μL,室温下静置5 min;混匀,室温静置20 min;将转染混合液按每孔100 μL加入24孔板,轻轻混匀孔板;放回细胞培养箱中孵育约5 h后,丢弃原培养基,替换为新鲜的完全培养基。
3.4双萤光素酶报告基因检测 转染48 h后,弃去培养基,PBS洗2次,按每孔100 μL加入PLB(passive lysis buffer),摇床中轻微振摇,室温15 min后收集细胞裂解液。随后使用萤光素酶分析仪检测荧光强度:设置程序:首先预读2 s,然后读值10 s,LAR II和Stop & Glo® Reagent进样量设定为每次100 μL。分别将已加入细胞裂解液的发光板(每样品20 μL)、Stop & Glo® Reagent和 LAR II放入萤光素酶分析仪中。按照萤光素酶分析仪操作说明书运行程序,读取数值并保存数据。
3.5细胞RNA提取及qPCR TRIzol提取细胞RNA,NanoDrop 2000检测A260、A280及其比值,确定RNA的浓度及纯度。PCR 引物设计通过软件Primer 5并参考相关文献,并在NCBI Primer BLAST进行比对。β-actin 上游引物:5’-TCAAGATCATTGCTCCTCCTGAG-3’;β-actin 下游引物:5’-ACATCTGCTGGAAGGTGGACA-3’; ROCK1 上游引物:5’-GGTGGTCGGTTGGGGTATTTT-3’;ROCK1 下游引物:5’-CGCCCTAACCTCACTTCCC-3’;occludin 上游引物:5’-TTGAAAGTCCACCTCCTTACAGA-3’;occludin 下游引物:5’-CCGGATAAAAAGAGTACGCTGG-3’。将提取RNA进行反转录合成cDNA后,按照20 μL反应体系步骤加样,依说明程序进行qPCR反应(严格按照说明书进行)。以β-actin为内参照,每个样本设3个复孔检测。结果用公式2-ΔΔCt计算差异值,以对空白对照组细胞为校正样本,将内参照表达值设为1,其余样本与之相比得出的数值即为差异值。
3.6Western blot 检测蛋白表达水平 收集细胞,采用细胞裂解液提取蛋白,BCA法测定蛋白浓度,根据样品蛋白浓度计算上样量,Marker上样3 μL。经SDS-PAGE后,用电转仪转膜至硝酸纤维素膜上。室温5% BSA封闭2 h,I 抗孵育过夜,TBST漂洗3次,加入标记 II 抗稀释液室温孵育1 h,TBST漂洗4次,化学发光显像后分析结果。
4 统计学处理
用SPSS 22.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,两组间比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1 在NCM460细胞中过表达miR-21后occludin蛋白表达上调
采用miR-21过表达慢病毒转染NCM460细胞,使用嘌呤霉素筛选得到miR-21过表达细胞株,稳定转染的NCM460细胞表达绿色荧光蛋白,可发出绿色荧光。采用qPCR检测各组细胞的miR-21相对表达量,结果显示,miR-21过表达的NCM460细胞株中miR-21的表达量显著高于对照组(P<0.05),表明miR-21在miR-21过表达NCM460细胞株中的表达显著上调,见图1A。同时采用Western blot检测2组细胞中occludin的蛋白表达水平发现,miR-21过表达细胞株中occludin蛋白的表达显著高于对照组(P<0.01),提示在NCM460细胞中过表达miR-21可上调occludin蛋白表达,见图1B。
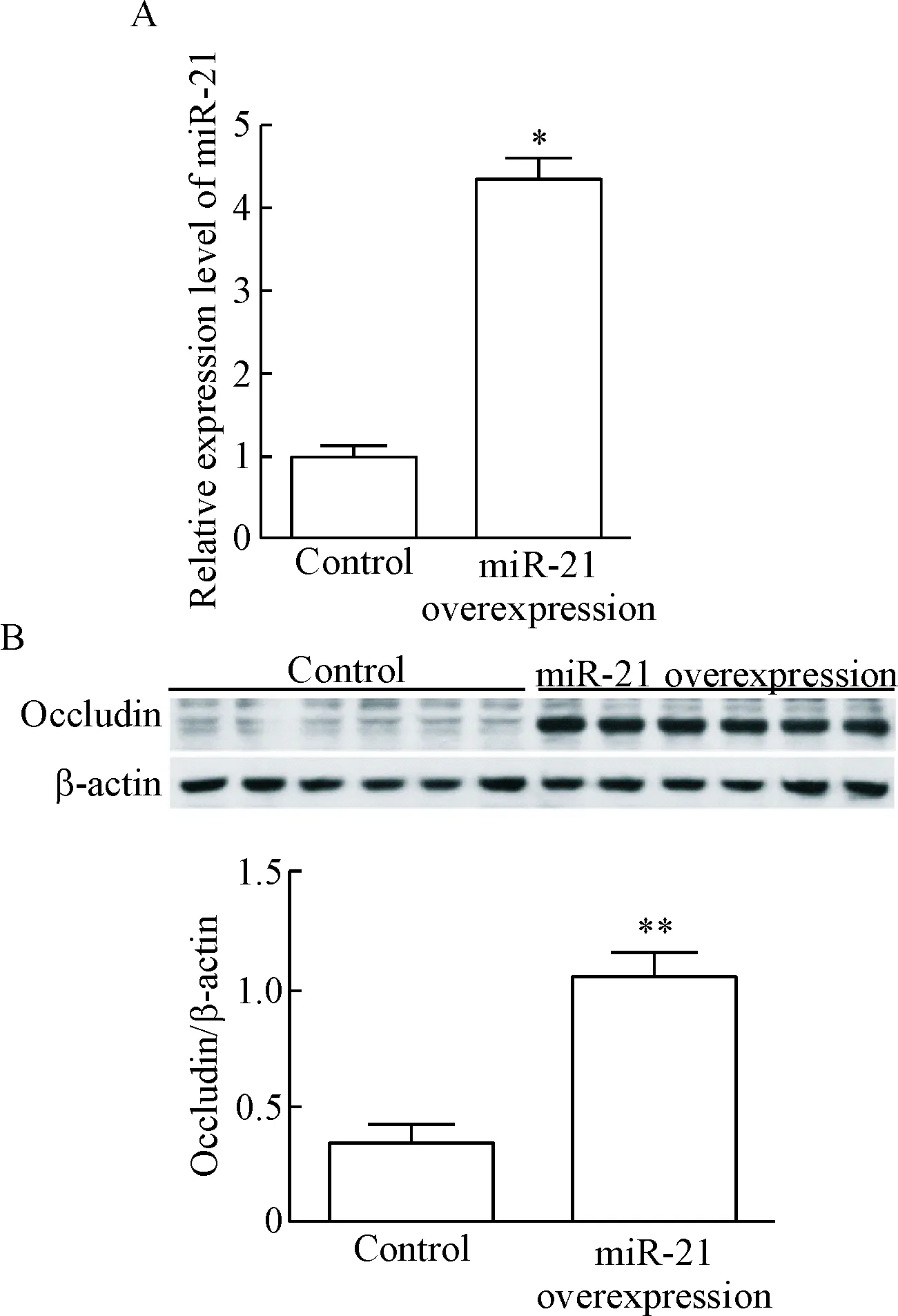
Figure 1. The expression levels of miR-21 and occludin in miR-21-overexpressing NCM460 cells. A: the expression of miR-21 determined by qPCR; B: the result of Western blot for determining the protein level of occludin. Mean±SD.n=3 .*P<0.05vscontrol group.
图1miR-21过表达的NCM460细胞miR-21表达水平及occludin蛋白表达水平
2 miR-21的靶基因预测
根据TargetScan(http://www.targetscan.org/)、 PicTar(http://pictar.mdc-berlin.de/)、miRmap(http://mirmap.ezlab.org/)、miRanda(http://www.microrna.org/microrna/)和miRbase(http://www.mirbase.org/)5个数据库预测hsa-miR-21作用的靶基因。通过生物信息学分析,根据不同软件预测的靶基因的差异与miR-21和对应基因3’非编码区配对种子序列的保守性,对靶基因进行打分排序,结果发现Reck、Tgfbi、Ntf3、Arhgap24、Arhgap27、ROCK1、Cdc42和PTEN等靶基因得分较高。同时文献分析表明,Rho激酶相关蛋白家族Rho-ROCK在肠屏障损伤中作用较为明确,而ROCK蛋白为同时作为Rho蛋白的重要底物且ROCK1分布于神经以外组织。因此,拟选取ROCK1作为miR-21的潜在靶基因。
3 在NCM460细胞中过表达miR-21可下调ROCK1的mRNA和蛋白水平
采用miR-21 mimic转染NCM460细胞24 h后用qPCR分别检测miR-21及ROCK1的相对表达水平,结果显示,与对照组相比,miR-21 mimic转染NCM460细胞24 h后miR-21相对表达水平显著升高(P<0.05), 而此时miR-21 mimics转染组ROCK1的mRNA相对水平显著降低(P<0.01), 表明miR-21过表达可在细胞水平显著下调ROCK1的mRNA水平,见图2A、B。48 h后,miR-21 mimics转染组NCM460细胞的ROCK1蛋白表达水平亦显著下调(P<0.01),见图2C。

Figure 2. The expression levels of miR-21 (A), ROCK1 mRNA (B) and ROCK1 protein (C) in NCM460 cells transfected with miR-21 mimic. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图2转染miR-21mimic的NCM460细胞中miR-21和ROCK1mRNA及蛋白的表达水平
4 在NCM460细胞中抑制miR-21可上调ROCK1的mRNA和蛋白水平
采用miR-21 inhibitor转染NCM460细胞24 h后,用qPCR分别检测miR-21及ROCK1的mRNA的相对表达水平,结果显示miR-21 inhibitor转染NCM460细胞24 h后miR-21相对表达水平明显降低(P<0.05), 而此时miR-21 inhibitor转染组ROCK1的mRNA相对水平上升(P<0.05), 表明在NCM460细胞中抑制miR-21表达可在细胞水平显著上调ROCK1的mRNA水平,见图3A。48 h后,miR-21 inhibitor转染组NCM460细胞的ROCK1蛋白表达水平亦显著上调(P<0.01),见图3B。
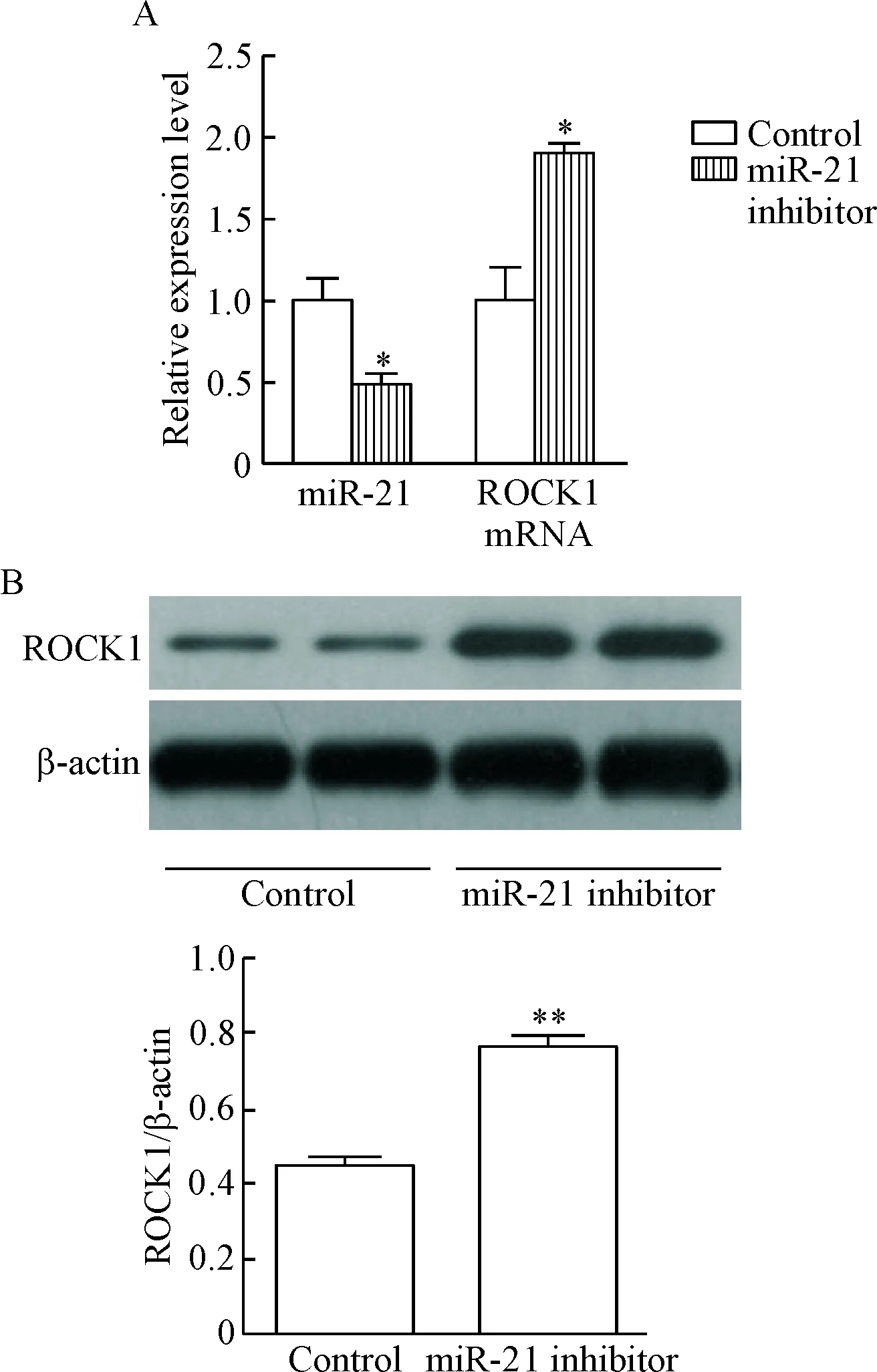
Figure 3. The expression levels of miR-21, ROCK1 mRNA (A) and ROCK1 protein (B) in NCM460 cells transfected with miR-21 inhibitor. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图3转染miR-21inhibitor的NCM460细胞miR-21和ROCK1mRNA及蛋白的表达水平
5 萤光素酶报告基因实验验证ROCK1为miR-21的靶基因
利用miRBase查找miR-21(miR-21-5p)的序列,在NCBI上查询ROCK1的mRNA序列(NM_005406.2)并选取其3’UTR序列部分,将两者采用NCBI的BLAST进行比对,预测miR-21在ROCK1 mRNA的3’UTR上的可能结合序列,结果可见ROCK1 mRNA的3’UTR中42~48 nt含有miR-21的调控位点,见图4A。通过RT-PCR方法将含有该调控位点的片段以及调控位点突变的片段克隆至psiCHECK-2表达载体,在NCM460细胞中过表达miR-21,利用双萤光素酶报告基因实验分析miR-21对调控位点的作用,结果发现miR-21通过调控该位点进而显著影响了报告基因的表达,同时对ROCK1突变3’UTR片段无明显调控作用,证明内源性miR-21可以有效抑制报告基因表达,即ROCK1为miR-21的靶基因,见图4B。
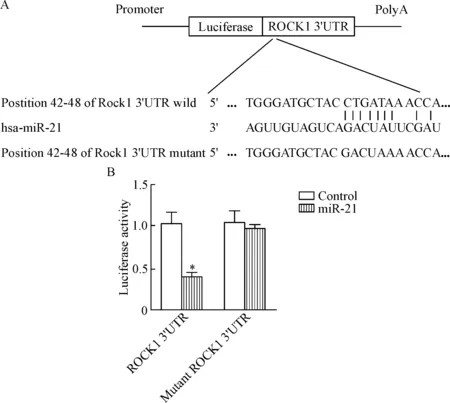
Figure 4.ROCK1 was verified as the target gene of miR-21. A: the predicted binding site of miR-21 on ROCK1 3’UTR; B: dual-luciferase reporter assay. Mean±SD.n=3.*P<0.05vscontrol group.
图4验证ROCK1为miR-21靶基因
讨 论
本课题组既往研究发现,某些miRNA参与了肠道屏障功能的调节[12]。在本研究中,我们提出假说miR-21通过靶向调控ROCK1进而调节TJ相关蛋白occludin,是肠屏障功能的保护因素。为验证假说,我们首先通过体外实验检测miR-21对细胞肠屏障相关表型是否影响加以验证,为此选择了NCM460细胞系作为我们的实验对象。NCM460和FHC细胞等是较为常见的人正常结肠上皮细胞系,可排除肠道肿瘤细胞、未成熟或分化不够的原代上皮或永生化细胞系带来的干扰。通过构建hsa-miR-21过表达慢病毒载体转染NCM460细胞系得到miR-21过表达NCM460细胞,通过qPCR检测发现其miR-21表达情况较对照组显著升高约为对照组的4倍以上,证明miR-21过表达NCM460细胞系构建成功,进而通过Western blot检测其TJ相关蛋白occludin表达情况,结果发现miR-21过表达NCM460细胞其occludin表达上调,与假设一致,说明miR-21能够上调TJ蛋白表达进而维持肠屏障正常功能。该实验存在一定的局限性,一是未构建miR-21抑制表达细胞系,二是只检测了主要的TJ蛋白,其它TJ蛋白以及肠上皮细胞凋亡情况未进行检测。针对第一点,后续我们将通过在体实验进一步补充完善。Occludin是经典的肠上皮细胞间紧密连接蛋白,在肠屏障功能维持方面起了较为重要重要的作用,其它的TJ蛋白还有ZO-1、ZO-2和ZO-3,20种异构体以上的claudin蛋白以及其它一些非典型蛋白。进一步通过生物信息学分析与文献查找,选取ROCK1作为miR-21的靶基因进行下一步研究。生物信息学分析方法可参考前述。miRNA的调控特点是“多对多”,事实上生物信息学方法可以预测出相当数量的靶基因,而动物miRNA的互补程度低,因此程序算法的预测结果理论上也会较多。结合打分情况,我们发现Rho-ROCK蛋白家族[13]在预测结果中出现概率较高,包括(1)Rho-GTP酶超家族成员:Rho、Rac以及Cdc42等;(2)GTP酶活化蛋白(GTPase activating protein, GAP):Arhgap22和Arhgap24等;(3)Rho亚家族下游效应分子:Rho激酶1即ROCK1。GAP是Rho-GTP酶的负调因子,通过加速Rho-GTP酶水解,使其失活。参与Rho-GTP酶活性调节的还有:鸟苷酸交换因子(guanine-nucleotide exchanging factors,GEFs)以及GDP解离抑制因子(GDP dissociation inhibitor,GDI),其中前者为正向调节,后者为负向调节抑制Rho-GTP酶活性。而ROCK1作为Rho蛋白家族的下游底物,显然其作用较为明确,而ROCK的底物包括肌球蛋白轻链以及内收蛋白[11]等,参与细胞骨架调整、细胞收缩和肿瘤细胞浸润,同时参与了微管以及F-actin的极化调节[14]。有研究证实ROCK通过影响IECs的F-actin结构引起肠上皮通透性增加,也有研究发现Rho信号通路的激活通过磷酸化肌球蛋白,可使肠上皮细胞间TJ蛋白ZO-1及occludin发生改变,继而引起肠屏障通透性增加与功能紊乱[15]。因此,我们选取ROCK的异构体ROCK1作为miR-21的靶基因进行研究。通过在细胞水平转染miR-21 mimic及inhibitor上调和下调NCM460细胞系的miR-21水平,qPCR及Western blot检测发现miR-21过表达引起ROCK1的mRNA降解,蛋白水平表达下调;相反miR-21表达抑制引起ROCK1 mRNA与蛋白表达上调,可以看出miR-21能影响ROCK1的表达。为确定其是否为miR-21的靶基因,我们采用萤光素酶报告基因实验进行验证,发现相比较于转染克隆有ROCK1突变型3’UTR的序列,在转染克隆有野生型ROCK1 3’UTR质粒中,miR-21组的萤光素酶相对活性较对照组低。因此我们得出结论,miR-21在细胞水平对肠屏障的结构起到维持作用,而ROCK1是miR-21的靶基因,miR-21可能通过Rho-ROCK1通路进而影响肠屏障相关蛋白occludin的表达。
[参考文献]
[1] Liu ZH, Huang MJ, Zhang XW, et al. The effects of perioperative probiotic treatment on serum zonulin concentration and subsequent postoperative infectious complications after colorectal cancer surgery: a double-center and double-blind randomized clinical trial[J]. Am J Clin Nutr, 2013, 97(1):117-126.
[2] 姜海平, 刘春安, 王达安. 谷氨酰胺强化的肠外营养对普外科全身炎症反应综合征的影响[J]. 中国病理生理杂志, 2003, 19(6):847-848.
[3] Whelan K, Myers CE. Safety of probiotics in patients receiving nutritional support: a systematic review of case reports, randomized controlled trials, and nonrandomized trials[J]. Am J Clin Nutr, 2010, 91(3):687-703.
[4] He L, Thomson JM, Hemann MT, et al. A microRNA polycistron as a potential human oncogene[J]. Nature, 2005, 435(7043):828-833.
[5] O’Donnell KA, Wentzel EA, Zeller KI, et al. c-Myc-regulated microRNAs modulate E2F1 expression[J]. Nature, 2005, 435(7043):839-843.
[6] Qian D, Chen K, Deng H, et al. MicroRNA-374b suppresses proliferation and promotes apoptosis in T-cell lymphoblastic lymphoma by repressing AKT1 and Wnt-16[J]. Clin Cancer Res, 2015, 21(21):4881-4891.
[7] Chen JF, Murchison EP, Tang R, et al. Targeted deletion of Dicer in the heart leads to dilated cardiomyopathy and heart failure[J]. Proc Natl Acad Sci U S A, 2008, 105(6):2111-2116.
[8] Maes OC, Chertkow HM, Wang E, et al. MicroRNA: implications for Alzheimer disease and other human CNS disorders[J]. Curr Genomics, 2009, 10(3):154-168.
[9] Kalla R, Ventham NT, Kennedy NA, et al. MicroRNAs: new players in IBD[J]. Gut, 2015 64(3):504-517.
[10] Mihaescu A, Santen S, Jeppsson B, et al. p38 mitogen-activated protein kinase signalling regulates vascular inflammation and epithelial barrier dysfunction in an experimental model of radiation-induced colitis[J]. Br J Surg, 2010, 97(2):226-234.
[11] Marchiando AM, Shen L, Graham WV, et al. The epithelial barrier is maintained byinvivotight junction expansion during pathologic intestinal epithelial shedding[J]. Gastroenterology, 2011, 140(4):1208-1218.
[12] Zhang B, Tian Y, Jiang P, et al. MicroRNA-122a regulates zonulin by targeting EGFR in intestinal epithelial dysfunction[J]. Cell Physiol Biochem, 2017, 42(2):848-858.
[13] 朱 正, 梁英锐, 邱红明. Rho蛋白家族的生物活性[J]. 国外医学: 生理、病理科学与临床分册, 2002, 22(3):251-254.
[14] Nakahara S, Tsutsumi K, Zuinen T, et al. FilGAP, a Rho-ROCK-regulated GAP for Rac, controls adherens junctions in MDCK cells[J]. J Cell Sci, 2015, 128(11):2047-2056.
[15] Segain JP, Raingeard DLBD, Sauzeau V, et al. Rho kinase blockade prevents inflammation via nuclear factor kappa B inhibition: evidence in Crohn's disease and experimental colitis[J]. Gastroenterology, 2003, 124(5):1180-1187.
