Salubrinal通过调节破骨细胞发育改善骨关节炎胫骨平台不均匀沉降
2018-05-07高哲李心乐李杰张平
高哲,李心乐,2,李杰 ,2,张平 ,2△
骨关节炎(osteoarthritis,OA)是最常见的全关节病,流行病学调查显示世界范围内有超过7亿人口患有OA[1]。其是导致残疾的主要原因,给家庭和社会带来了巨大的经济负担[2-3]。OA的主要特征为软骨下骨的异常骨重建、内外侧胫骨平台不均匀沉降和软骨的损伤。在OA疾病中,软骨和软骨下骨形成一个整体并相互影响,在OA发病机制中发挥关键作用[4]。软骨下骨的病变加重了关节软骨的病理改变,加速了OA的病程进展[5]。本课题组前期研究表明,在OA动物模型中破骨细胞活性及功能明显增高,破骨细胞活性升高与软骨病变和软骨下骨的骨吸收呈正相关[6]。有研究显示,在OA动物和患者的软骨下骨中,抗酒石酸酸性磷酸酶(TRAP)染色的阳性细胞数均显著增多[7]。另外,张英泽院士在2014年提出不均匀沉降理论,即由于关节病变引起的承重骨受力不均导致不均匀沉降现象。膝关节胫骨平台的软骨下骨为松质骨区,也是负重面最大的部位,这样的解剖生理特征导致膝关节炎多发生胫骨平台内外侧不均匀沉降现象[8]。因此,本课题组推测,抑制异常破骨细胞活性、纠正异常骨重建和胫骨平台内外侧不均匀沉降现象可能是治疗OA的一种方法。
Salubrinal是一种化学合成剂,能抑制真核翻译起始因子2α(eIF2α)的去磷酸化水平[9]。本课题组前期工作证实,Salubrinal可促进骨创伤的愈合[10],抑制破骨细胞的发育[11],可用于治疗骨质疏松[12]和股骨头坏死[13]。还有研究显示,Salubrinal可通过下调核因子-κB(NF-κB)信号、抑制基质金属蛋白酶-13(MMP-13)的表达和活性,对OA软骨的损伤有保护作用[14-15]。但其对OA软骨下骨的治疗作用以及是否能改变不均匀沉降现象尚不清楚。本研究采用手术切除小鼠膝关节内侧半月板建立OA模型,造成膝关节稳定性失衡,观察胫骨平台病理改变和Salubrinal对小鼠OA的治疗效果,以期为OA的治疗提供更多依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 30只SPF级雌性C57BL/6小鼠,约14周龄,体质量18~20 g,由中国人民解放军军事医学科学院实验动物中心提供。每笼5只小鼠,自由摄取饲料和水。所有实验根据天津医科大学实验动物管理规定进行,并经天津医科大学伦理委员会批准。
1.1.2 主要试剂 Salubrinal购自英国Tocris Bioscience公司。细胞因子购自美国PeproTech公司。α-MEM培养基购自美国Gibco公司。胎牛血清、青霉素、链霉素和胰蛋白酶购自美国Invitrogen公司。番红O染料、萘酚AS-MX磷酸盐(Naphthol AS-MX phosphate)、快速红TR盐(Fast red TR salt)、结晶紫、TRAP染色试剂盒等其他化学品购自美国Sigma公司。
1.1.3 染液配制 1%番红O:5 g番红O染料+500 mL蒸馏水。TRAP染液:0.2 mol/L醋酸盐缓冲液50 mL+萘酚AS-MX磷酸盐25 mg+快速红TR盐55 mg。0.5%结晶紫染液:500 mg结晶紫+25 mL甲醇+75 mL蒸馏水。
1.1.4 主要仪器 石蜡切片机(RM2255)购自德国Leica公司。倒置相差显微镜(CKX41SF)及普通双目正置显微镜(BX41-12H02)购自日本Olympus公司。
1.2 方法
1.2.1 动物分组 采用随机数字表法将30只C57BL/6雌性小鼠分为假手术(Sham)组、OA组、OA+Salubrinal药物治疗(OA+Sal)组,每组10只。
1.2.2 动物模型制备 用1.5%异氟烷麻醉小鼠,于膝关节内侧打开关节腔,使用手术显微镜和显微外科技术切除内侧半月板。对于Sham组,只切开关节内侧皮肤。术后使用丁丙诺啡盐酸盐镇痛抗感染。
1.2.3 给药方法 手术造模后,给予OA+Sal组小鼠皮下注射Salubrinal(1 mg/kg),每日1次,连续2周。同时给予Sham组及OA组小鼠等量的生理盐水。
1.2.4 组织学分析
1.2.4.1 组织处理 脱颈法处死小鼠后,剥离小鼠后腿,剔除皮肤、软组织及韧带,保留完整腿骨及膝关节囊。将膝关节标本在10%中性甲醛溶液中固定2d,并在14%乙二胺四乙酸(EDTA)中脱钙2周,梯度乙醇脱水、透明,石蜡包埋标本,冠状位组织切片,厚度为5 μm。
1.2.4.2 番红O染色 组织切片经二甲苯脱蜡、梯度乙醇水化后,1%番红O染液染色30 min,脱水、透明后树胶封片,显微镜下观察组织病理形态学改变,评估关节软骨及软骨下骨板(SBP)的组织学改变。每张切片在胫骨平台的软骨区域分别从内外侧的承重区选取3个400倍视野。通过国际骨关节炎研究协会(OARSI)评分对软骨损伤进行评分,测量钙化软骨厚度(CC)和全层关节软骨厚度(TAC),并计算钙化软骨与关节软骨的比值(CC/TAC),评估软骨病变。测量SBP厚度,评估软骨下骨板的变化。
1.2.4.3 TRAP染色 组织切片经二甲苯脱蜡、梯度乙醇水化后,放入配置好的TRAP染液中染色60 min,脱水、透明后水溶性封片剂封片,显微镜下观察软骨下骨组织病理形态学改变,评估软骨下骨的骨面积分数和破骨细胞数量的变化。每张切片在胫骨平台的软骨下骨部分分别从内外侧的承重区选取3个200倍视野,计算单位面积内的骨面积分数(B.Ar/T.Ar)和TRAP染色阳性细胞长度占骨小梁长度的百分比(Oc.S/BS)。
1.2.4.4 内外侧胫骨平台倍数变化分析 为了比较内外侧胫骨平台的病变程度和疗效,采用OA组每个标本OARSI评分和B.Ar/T.Ar的评估值除以Sham组对应指标的均值,计算OA小鼠相对于Sham小鼠内外侧胫骨平台的变化倍数。同样,用OA+Sal组每个标本OARSI评分和B.Ar/T.Ar的评估值除以OA组对应指标的均值,计算Salubrinal对OA小鼠内外侧胫骨平台的恢复倍数。进而比较内外侧胫骨平台倍数变化。
1.2.5 细胞学分析
1.2.5.1 收集骨髓来源细胞 小鼠安乐死后,用含有胎牛血清(FBS)的Iscove’s MEM冲洗双侧髂骨,收集骨髓来源的细胞,低密度梯度离心法分离出骨髓单个核细胞,并在显微镜下用血球计数板进行计数,用于以下细胞实验。
1.2.5.2 破骨细胞形成实验 将分离出的骨髓单个核细胞均匀混悬于α-MEM培养液,种入96孔板中,密度为1×105/孔,置于37℃,5%CO2培养箱中培养3d。培养液中含有10%FBS、30 μg/L小鼠巨噬细胞集落刺激因子(M-CSF)和20 μg/L小鼠核因子kappa-B配体的受体激活因子(RANKL)。在第4 天,更换为含有 10%FBS,30 μg/L M-CSF 和 60 μg/L RANKL的α-MEM培养基,第6天按照TRAP染色试剂盒说明书进行TRAP染色。显微镜下观察、拍片,每孔随机选取5个200倍视野,测量胞核>3个的融合破骨细胞的面积,计算单位面积内融合破骨细胞所覆盖的区域Oc.Ar(%)。
1.2.5.3 破骨细胞迁移实验 使用transwell实验评估破骨细胞的迁移能力。诱导骨髓来源的单个核细胞形成前破骨细胞,培养液为含10%FBS和30 μg/L M-CSF的α-MEM培养基,置于37℃,5%CO2培养箱中培养4d。迁移实验采用transwell小室(小孔直径8 μm)进行检测。在transwell小室外加入含有1%胎牛血清白蛋白(BSA)和30 μg/L M-CSF的α-MEM培养基,诱导小室壁内无营养条件的前破骨细胞迁移至小室壁外。将前破骨细胞种入transwell小室内,密度为1×105/孔,置于37℃,5%CO2培养箱中培养6h。常温下0.5%结晶紫染液染色30 min,显微镜下观察、拍片,每孔随机选取5个200倍视野,计数视野内迁移的前破骨细胞的数量(migrated cells/FV),代表破骨细胞的迁移能力。
1.2.5.4 破骨细胞黏附实验 为了测定破骨细胞的黏附性,将骨髓来源的单个核细胞诱导形成前破骨细胞,方法同上。将前破骨细胞种入1%明胶包被好的96孔板中,密度为1×105/孔,培养液为含10%FBS和30 μg/L M-CSF的α-MEM培养基,放入37℃,5%CO2培养箱内孵育1h。用无水甲醇在室温下固定15 min,0.5%结晶紫染液染色,显微镜下观察、拍片,每孔随机选取5个200倍视野,计数视野内黏附的前破骨细胞的数量(Adherent cells/FV),代表破骨细胞的黏附能力。
1.3 统计学方法 采用SPSS 19.0统计软件进行统计学分析。计量资料以均数±标准差(±s)表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析(ANOVA),组间多重比较行LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Salubrinal对OA小鼠内侧胫骨平台软骨损伤的改善作用 番红O组织学染色结果显示,与Sham组相比,OA组小鼠内侧胫骨平台软骨表面不连续,软骨层着色变浅,大量基质丢失,软骨细胞数目减少,并有大量软骨细胞出现肥大和凋亡,软骨病变范围>50%,OARSI评分显著升高(P<0.05);透明软骨(HC)明显变薄,钙化软骨增厚,CC/TAC显著增高(P<0.05)。经Salubrinal治疗后,OA+Sal组小鼠内侧胫骨平台软骨表面连续,抑制了基质丢失,软骨层着色得到改善,软骨细胞肥大和凋亡明显减少,软骨病变范围<25%,OARSI评分显著降低(P<0.05)、CC/TAC得到恢复(P<0.05)。见表1、图1。
Tab.1 Comparison of injury condition of medial tibial plateau cartilage between three groups表1 各组小鼠内侧胫骨平台软骨损伤情况比较(n=10,±s)

Tab.1 Comparison of injury condition of medial tibial plateau cartilage between three groups表1 各组小鼠内侧胫骨平台软骨损伤情况比较(n=10,±s)
*P<0.05;a与Sham组比较,b与OA组比较,P<0.05
组别Sham组OA组OA+Sal组F OARSI评分(分)0.80±0.13 11.35±1.46a 4.70±0.30ab 37.900*CC/TAC(%)49.11±1.14 61.62±1.16a 48.19±1.17b 42.310*
2.2 Salubrinal对OA小鼠外侧胫骨平台软骨的保护作用 番红O组织学染色结果显示,与Sham组相比,OA组小鼠外侧胫骨平台软骨有轻微纤维化表现,染色变浅,软骨病变范围为10%~25%,OARSI评分显著升高(P<0.05);钙化软骨增厚,CC/TAC明显增高(P<0.05)。经Salubrinal治疗后,OA+Sal组小鼠外侧胫骨平台软骨细胞恢复正常,表面完整、无纤维化表现,OARSI评分显著降低(P<0.05),CC/TAC也得到纠正(P<0.05)。见图2、表2。

Fig.1 Morphological examination of the medial tibial plateau cartilage with Safranine O staining(× 400)图1 胫骨平台内侧软骨组织形态学结果(番红O染色,×400)

Fig.2 Morphological examination of the lateral tibial plateau cartilage with Safranine O staining(× 400)图2 胫骨平台外侧软骨组织形态学结果(番红O染色,×400)
Tab.2 Comparison of injury condition of lateral tibial plateau cartilage between three groups表2 各组小鼠外侧胫骨平台软骨损伤情况比较(n=10,±s)

Tab.2 Comparison of injury condition of lateral tibial plateau cartilage between three groups表2 各组小鼠外侧胫骨平台软骨损伤情况比较(n=10,±s)
*P<0.05;a与Sham组比较,b与OA组比较,P<0.05
组别Sham组OA组OA+Sal组F OARSI评分(分)0.60±0.16 3.50±0.58a 1.20±0.11ab 18.610*CC/TAC(%)41.44±2.29 49.75±2.12a 41.68±1.86b 5.086*
2.3 Salubrinal对OA小鼠内侧胫骨平台软骨下骨异常骨重建的纠正作用 TRAP组织学染色结果显示,与Sham组相比,OA组小鼠内侧胫骨平台向远侧端塌陷,软骨下骨B.Ar/T.Ar明显增加,TRAP阳性细胞比例(Oc.S/BS)显著增高(P<0.05)。经Salubrinal治疗后,OA+Sal组小鼠内侧胫骨平台无塌陷,软骨下骨B.Ar/T.Ar明显恢复(P<0.05),TRAP阳性细胞减少,Oc.S/BS显著降低(P<0.05)。SBP厚度各组间差异无统计学意义(P>0.05)。见表3、图3。
Tab.3 Comparison of the pathological changes in medial tibial plateau subchondral bone between three groups表3 各组小鼠内侧胫骨平台软骨下骨病理改变情况比较(n=10,±s)
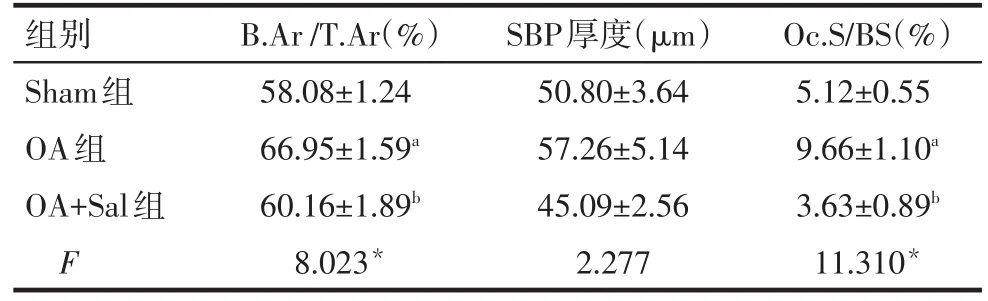
Tab.3 Comparison of the pathological changes in medial tibial plateau subchondral bone between three groups表3 各组小鼠内侧胫骨平台软骨下骨病理改变情况比较(n=10,±s)
*P<0.05;a与Sham组比较,b与OA组比较,P<0.05
组别Sham组OA组OA+Sal组F B.Ar/T.Ar(%)58.08±1.24 66.95±1.59a 60.16±1.89b 8.023*SBP厚度(μm)50.80±3.64 57.26±5.14 45.09±2.56 2.277 Oc.S/BS(%)5.12±0.55 9.66±1.10a 3.63±0.89b 11.310*
2.4 Salubrinal对OA小鼠外侧胫骨平台软骨下骨异常骨吸收的抑制作用 TRAP组织学染色结果显示,与Sham组相比,OA组小鼠外侧胫骨平台软骨下骨未出现塌陷,但骨小梁变细且出现横向走行,B.Ar/T.Ar和SBP厚度明显降低(P<0.05),Oc.S/BS显著增加(P<0.05)。经Salubrinal治疗后,OA+Sal组小鼠外侧胫骨平台软骨下骨小梁恢复正常,B.Ar/T.Ar和SBP明显恢复(P<0.05),TRAP阳性细胞减少,Oc.S/BS显著降低(P<0.05)。见表4、图4。
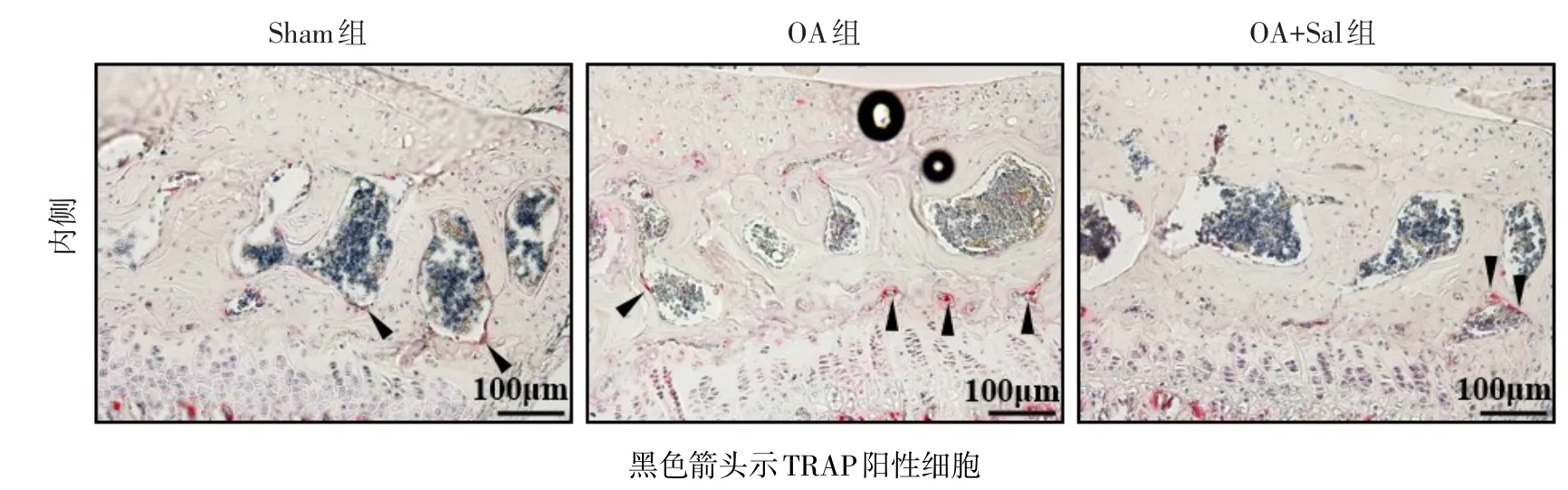
Fig.3 Morphological observation of the medial tibial plateau subchondral bone with TRAP staining(× 200)图3 胫骨平台内侧软骨下骨组织形态学结果(TRAP染色,×200)
Tab.4 Comparion of the pathological changes in lateral tibial plateau subchondral bone between three groups表4 各组小鼠外侧胫骨平台软骨下骨病理改变情况比较(n=10,±s)
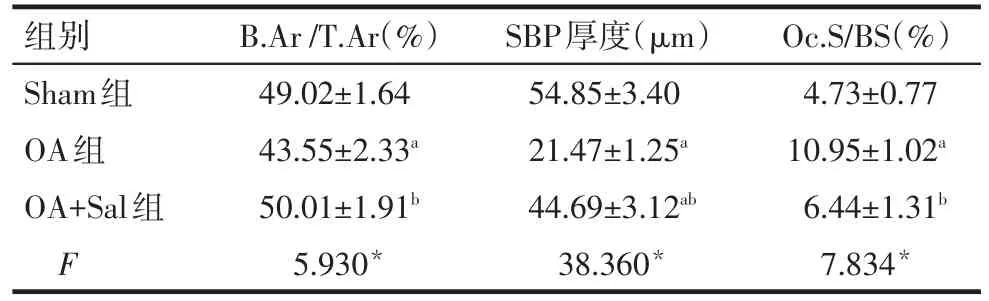
Tab.4 Comparion of the pathological changes in lateral tibial plateau subchondral bone between three groups表4 各组小鼠外侧胫骨平台软骨下骨病理改变情况比较(n=10,±s)
*P<0.05;a与Sham组比较,b与OA组比较,P<0.05
组别Sham组OA组OA+Sal组F B.Ar/T.Ar(%)49.02±1.64 43.55±2.33a 50.01±1.91b 5.930*SBP厚度(μm)54.85±3.40 21.47±1.25a 44.69±3.12ab 38.360*Oc.S/BS(%)4.73±0.77 10.95±1.02a 6.44±1.31b 7.834*
2.5 OA小鼠内侧胫骨平台的病理改变较外侧严重 在OA小鼠的内外侧胫骨平台中均发生了软骨下骨重建和软骨损伤。与Sham组相比,OA小鼠OARSI评分和B.Ar/T.Ar在内侧胫骨平台的倍数变化明显高于外侧胫骨平台(P<0.05)。与OA组相比,OA+Sal组小鼠内外侧胫骨平台OARSI评分的倍数变化差异无统计学意义(P>0.05),而B.Ar/T.Ar在内侧胫骨平台的倍数变化明显低于外侧胫骨平台(P<0.05)。见表5。
Tab.5 Comparison of the cartilage and subchondral bone fold changes between medial and lateral tibial plateau表5 内外侧胫骨平台软骨、软骨下骨的倍数变化比较(n=10,±s)

Tab.5 Comparison of the cartilage and subchondral bone fold changes between medial and lateral tibial plateau表5 内外侧胫骨平台软骨、软骨下骨的倍数变化比较(n=10,±s)
*P<0.05
组别内侧胫骨平台外侧胫骨平台t OA组/Sham组倍数变化OARSI评分14.19±1.83 5.83±0.97 4.033*B.Ar/T.Ar 1.15±0.03 0.89±0.02 7.938*OA+Sal组/OA组倍数变化OARSI评分0.41±0.03 0.34±0.03 1.631 B.Ar/T.Ar 0.89±0.03 1.14±0.04 5.142*
2.6 Salubrinal对OA破骨细胞过度分化的抑制作用 骨髓来源细胞实验结果显示,与Sham组比较,OA组破骨细胞发育迅速,大的融合细胞显著增多,定量分析融合破骨细胞所覆盖的区域显示Oc.Ar明显增大(P<0.05);破骨细胞的迁移和黏附细胞数量也显著增加(P<0.05)。经Salubrinal治疗后,OA+Sal组有效抑制了破骨细胞的发育,减缓了破骨细胞的融合,Oc.Ar明显减小(P<0.05),破骨细胞的迁移和黏附细胞数量也显著降低(P<0.05),见表6、图5。
Tab.6 Comparion of formation,migration and adhesion of osteoclasts between three groups表6 各组小鼠破骨细胞形成、迁移、黏附能力的比较(n=10,±s)
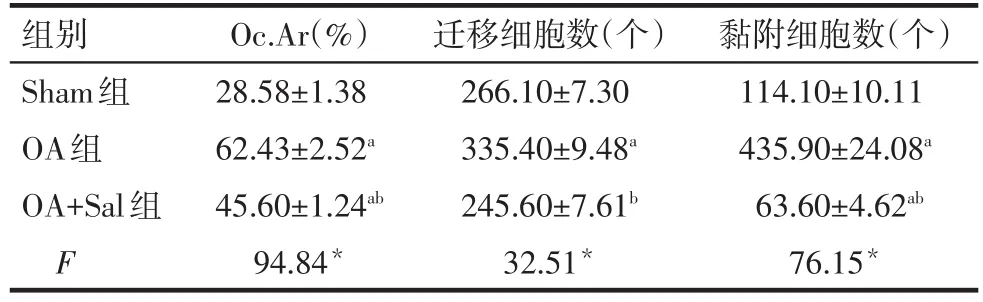
Tab.6 Comparion of formation,migration and adhesion of osteoclasts between three groups表6 各组小鼠破骨细胞形成、迁移、黏附能力的比较(n=10,±s)
*P<0.05;a与Sham组比较,b与OA组比较,P<0.05
组别Sham组OA组OA+Sal组F Oc.Ar(%)28.58±1.38 62.43±2.52a 45.60±1.24ab 94.84*迁移细胞数(个)266.10±7.30 335.40±9.48a 245.60±7.61b 32.51*黏附细胞数(个)114.10±10.11 435.90±24.08a 63.60±4.62ab 76.15*
3 讨论
3.1 破骨细胞活性升高导致的骨重建在OA发生发展中有重要作用 很多研究认为,软骨下骨和间充质干细胞中破骨细胞活性增加导致的骨重建在骨关节炎软骨退变的起始和进展中有关键作用[16-18]。本研究结果显示,在手术切除膝关节内侧半月板诱发的OA小鼠模型中,软骨下骨中破骨细胞活性明显增高,骨髓来源的破骨细胞的发育显著加快,内侧胫骨平台软骨下骨B.Ar/T.Ar增高,与此相对应的外侧胫骨平台出现了SBP变薄,B.Ar/T.Ar降低,内外侧胫骨平台软骨下骨出现异常骨重建,OARSI评分、CC/TAC增高,关节软骨受到了明显的损伤。Salubrinal明显降低了软骨下骨中Oc.S/BS和骨髓来源的破骨细胞的形成、迁移、黏附能力,降低了内侧胫骨平台B.Ar/T.Ar,增加了外侧胫骨平台SBP厚度和B.Ar/T.Ar,明显抑制了胫骨平台软骨下骨的骨重建,OARSI评分和CC/TAC也明显恢复。结果表明,OA中破骨细胞异常活跃,导致了异常骨重建的发生,并加速了关节软骨的病变。Salubrinal可明显抑制破骨细胞的异常活跃,通过抑制破骨细胞发育来调节软骨下骨异常骨重建,保持软骨下骨的骨形态,从而延缓了OA关节软骨的病变。
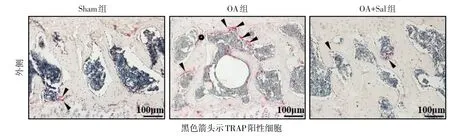
Fig.4 Morphological observation of the lateral tibial plateau subchondral bone with TRAP staining(× 200)图4 胫骨平台外侧软骨下骨组织形态学结果(TRAP染色,×200)
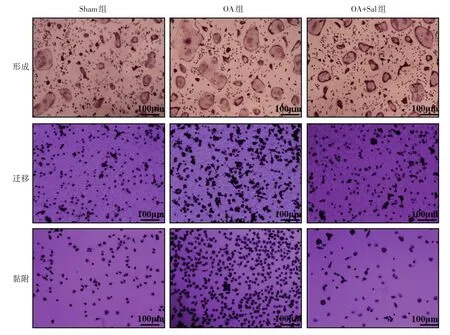
Fig.5 Pictures showing formation,migration and adhesion of osteoclasts(× 200)图5 破骨细胞的形成、迁移、黏附功能(×200)
3.2 OA胫骨平台内外侧软骨下骨出现了不均匀沉降 张英泽院士提出膝关节的胫骨平台是负重面最大的关节,由于内侧无骨性阻挡,且外侧有腓骨支撑,负重点向内侧偏移,因此内外侧平台发生不均匀沉降[8]。本研究选取冠状位切片,分别观测OA模型小鼠内外侧胫骨平台的病理改变及治疗效果。相比矢状位切片观测结果更加完善,可以在同一截面对胫骨平台内外侧进行比较分析,更好地观察分析胫骨平台内外侧不均匀沉降现象,避免了只能观测一侧的局限性。研究中发现,OA小鼠的内外侧胫骨平台软骨下骨发生了不同变化。与Sham组相比,OA小鼠的内侧胫骨平台B.Ar/T.Ar明显增加,而外侧B.Ar/T.Ar和SBP均明显降低。内外侧胫骨平台软骨、软骨下骨的倍数变化分析显示,OA组内侧OARSI评分和B.Ar/T.Ar的倍数变化明显大于外侧。笔者分析是由于关节内侧半月板切除,稳定性失衡,负重点向内侧偏移,内侧负荷异常增加而外侧胫骨平台出现了失重,导致的不均匀沉降现象。
3.3 Salubrinal改善OA不均匀沉降 张院士通过腓骨近端截骨手术降低胫骨平台外侧高度,减轻膝关节内侧关节面的生物应力,防止胫骨平台继续发生不均匀沉降[8]。本研究采用Salubrinal对OA小鼠进行治疗。Salubrinal降低了内侧胫骨平台B.Ar/T.Ar,抑制了平台向远侧端的塌陷,增加了外侧胫骨平台SBP厚度和B.Ar/T.Ar,显著纠正了OA小鼠内外侧胫骨平台的不均匀病变,明显抑制了软骨下骨的异常骨重建,改善了OA小鼠膝关节的不均匀沉降。使用Salubrinal治疗OA避免了手术风险,为其他原因导致的不能手术治疗的患者提供了治疗的可能。本实验采用OA小鼠模型进行了研究,接下来还需进一步的临床实验进行验证。
综上所述,在OA动物模型中Salubrinal抑制了OA中破骨细胞的异常发育,调节了内外侧胫骨平台软骨下骨的不均衡改变,抑制了异常骨重建和不均匀沉降。本研究为治疗OA提供了新思路,通过调控破骨细胞发育、改善异常骨重建和不均匀沉降有望成为治疗OA的新方法。
[1]Poole AR.Current opinion:where are we in our understanding and treatment of osteoarthritis? [J].Swiss Med Wkly,2016,146:w14340.doi:10.4414/smw.2016.14340.
[2]Kim JH,Jeon J,Shin M,et al.Regulation of the catabolic cascade in osteoarthritis by the zinc-ZIP8-MTF1 axis[J].Cell,2014,156(4):730-743.doi:10.1016/j.cell.2014.01.007.
[3]Thomas AC,Hubbard-Turner T,Wikstrom EA,et al.Epidemiology of posttraumatic osteoarthritis[J].J Athl Train,2017,52(6):491-496.doi:10.4085/1062-6050-51.5.08.
[4]Goldring SR,Goldring MB.Changes in the osteochondral unit during osteoarthritis: structure, function and cartilage-bone crosstalk[J].Nat Rev Rheumatol,2016,12(11):632-644.doi:10.1038/nrrheum.2016.148.
[5]Adebayo OO,Ko FC,Wan PT,et al.Role of subchondral bone properties and changes in development of load-induced osteoarthritis in mice[J].Osteoarthritis Cartilage,2017,25(12):2108-2118.doi:10.1016/j.joca.2017.08.016.
[6]Li X,Yang J,Liud,et al.Knee loading inhibits osteoclast lineage in a mouse model of osteoarthritis[J].Sci Rep,2016,6:24668.doi:10.1038/srep24668.
[7]Bertuglia A,Lacourt M,Girard C,et al.Osteoclasts are recruited to the subchondral bone in naturally occurring post-traumatic equine carpal osteoarthritis and may contribute to cartilage degradation[J].Osteoarthritis Cartilage,2016,24(3):555-566.doi:10.1016/j.joca.2015.10.008.
[8]张英泽,李存祥,李冀东,等.不均匀沉降在膝关节退变及内翻过程中机制的研究[J].河北医科大学学报,2014,35(2):218-219.Zhang YZ,Li CX,Li JD,et al.Study on the mechanism of nonuniform settlement in knee joint degeneration and genu varum[J].Journal of Hebei Medical University,2014,35(2):218-219.doi:10.3969/j.issn.1007-3205.2014.02.037.
[9]Boyce M,Bryant KF,Jousse C,et al.A selective inhibitor of eIF2 alpha dephosphorylation protects cells from ER stress[J].Science,2005,307(5711):935-939.doi:10.1126/science.1101902.
[10]Zhang P,Hamamura K,Jiang C,et al.Salubrinal promotes healing of surgical wounds in rat femurs[J].J Bone Miner Metab,2012,30(5):568-579.doi:10.1007/s00774-012-0359-z.
[11]Yokotah,Hamamura K,Chen A,et al.Effects of salubrinal on development of osteoclasts and osteoblasts from bone marrowderived cells[J].BMC Musculoskelet Disord,2013,14:197.doi:10.1186/1471-2474-14-197.
[12]Li J,Yang S,Li X,et al.Role of endoplasmic reticulum stress in disuse osteoporosis[J].Bone,2017,97:2-14.doi:10.1016/j.bone.2016.12.009.
[13]Liud,Zhang Y,Li X,et al.eIF2α signaling regulates ischemic osteonecrosis through endoplasmic reticulum stress[J].Sci Rep,2017,7(1):5062.doi:10.1038/s41598-017-05488-6.
[14]Hamamura K,Lin CC,Yokotah.Salubrinal reduces expression and activity ofMMP13 in chondrocytes [J].Osteoarthritis Cartilage,2013,21(5):764-772.doi:10.1016/j.joca.2013.02.657.
[15]Hamamura K,Nishimura A,Iino T,et al.Chondroprotective effects of Salubrinal in a mouse model of osteoarthritis[J].Bone Joint Res,2015,4(5):84-92.doi:10.1302/2046-3758.45.2000378.
[16]Wang T,Wen CY,Yan CH,et al.Spatial and temporal changes of subchondralbone proceed to microscopic articularcartilage degeneration in guinea pigs with spontaneous osteoarthritis[J].Osteoarthritis Cartilage,2013,21(4):574-581.doi:10.1016/j.joca.2013.01.002.
[17]Hunter DJ,Zhang Y,Niu J,et al.Increase in bone marrow lesions associated with cartilage loss:a longitudinal magnetic resonance imaging study of knee osteoarthritis[J].Arthritis Rheum,2006,54(5):1529-1535.doi:10.1002/art.21789.
[18]Stupina TA,Stepanov MA,Teplen’kii MP.Role of subchondral bone in the restoration of articular cartilage[J].Bull Exp Biol Med,2015,158(6):820-823.doi:10.1007/s10517-015-2870-4.
