阿尔茨海默病早期诊断研究进展
2018-05-07孙梦莎顾鸣敏
孙梦莎 顾鸣敏
阿尔茨海默病(AD)是老年人群最常见的神经变性病,随着人口老龄化的加剧,其发病率逐年升高。根据《2009年世界阿尔茨海默病报告》数据,预计截至2030年全球阿尔茨海默病患者将达65.70×106例,截至2050年将达115.40×106例,尤其在中低收入国家的增长速度更快[1]。绝大多数患者未接受正规检查和诊断,因此未得到治疗,其中缺乏有效检测方法是最大障碍。迄今尚未发现一种足够准确的方法可以早期诊断并预测痴呆。
我国主要采用简易智能状态检查量表(MMSE)进行阿尔茨海默病早期筛查,但筛查出的患者多已进展至中至重度症状,较短时间内即出现认知功能明显减退[2]。美国最新的阿尔茨海默病诊断标准指出,阿尔茨海默病是包括轻度认知损害(MCI)在内的连续病程,并强调生物学标志物可以用于诊断阿尔茨海默病[3⁃4]。病程中出现神经退行性变和早期临床症状即可诊断为轻度认知损害[5],由于阿尔茨海默病时期的50%病理改变在轻度认知损害时期即已发生,因此,生物学标志物可能诊断疾病并预测疾病进展[6]。
阿尔茨海默病包括病理生理学阶段和临床阶段,且病理改变开始时间较临床症状出现时间约早10年甚至更长[7]。一项针对早发型阿尔茨海默病的横断面研究显示,预期临床症状出现前25年脑脊液β⁃淀粉样蛋白42(Aβ42)水平即开始下降;预期临床症状出现前15年脑脊液tau蛋白水平升高,11C⁃匹兹堡复合物B(11C⁃PIB)PET可检测到脑组织Aβ沉积,脑萎缩加速;预期临床症状出现前10年出现脑组织葡萄糖低代谢和情景记忆障碍[8]。本文总结阿尔茨海默病早期检测与诊断方法,主要从阿尔茨海默病基因突变分析、影像学和生物学标志物测定如外周血和脑脊液检测等方面进行概述。
一、基因突变分析
近10年来,阿尔茨海默病遗传学和基因组学研究取得重大突破。研究显示,常染色体显性遗传性家族性阿尔茨海默病(FAD)仅占全部阿尔茨海默病的小部分,而占绝大部分的散发性阿尔茨海默病是多种易感基因共同作用的结果[9⁃10]。无痴呆人群也可以检测到易感基因位点,易感基因可能在疾病早期即已发挥作用,且疾病晚期在认知损害方面具有更高的易感性。尽管对于携带者而言,单一易感基因的作用较小,但全基因组中多种易感等位基因累加则使个体处于高危状态[11]。评价总遗传风险与阿尔茨海默病前期临床和影像学表现相关性的研究显示,多基因风险评分有助于鉴别诊断和预测阿尔茨海默病患病风险人群[9]。除4种已确定的阿尔茨海默病相关基因外,近年采用全基因组相关性研究(GWAS)发现新的基因位点,可能成为疾病诊断的生物学标志物。
1.APP、PS⁃1、PS⁃2、ApoE 等 Aβ代谢相关基因
既往研究显示,β⁃淀粉样前体蛋白(APP)、早老素1(PS⁃1)、早老素 2(PS⁃2)基因突变可以导致早发性阿尔茨海默病(EOAD),而载脂蛋白E(ApoE)基因与晚发性阿尔茨海默病(LOAD)相关[10]。APP、PS⁃1、PS⁃2基因突变导致Aβ生成并沉积,ApoE基因参与脂质运输,影响Aβ清除,其中,ApoEε4等位基因与阿尔茨海默病密切相关,其频率在晚发性阿尔茨海默病患者中明显升高[12]。簇集素(CLU)基因与ApoE基因相似,参与Aβ构型转变,抑制其沉积。α2巨球蛋白(A2M)基因通过结合Aβ以减少其沉积,其突变时减慢Aβ清除速度。既往研究显示,A2M基因外显子2缺失可以使阿尔茨海默病患病风险增加数倍[13]。因此,进行上述基因检测可以早期预测阿尔茨海默病。
2.Tau、PIN1等tau蛋白相关基因 Tau蛋白是微管相关蛋白(MAP),其翻译后修饰异常与阿尔茨海默病发病有关,过磷酸化表达可以降低其与微管的亲和力,导致神经原纤维缠结(NFTs)形成。尽管尚未确定tau基因突变与早发性阿尔茨海默病的关系,但是确定其可以导致一系列晚发性阿尔茨海默病[14]。绝大多数tau基因错义突变可以降低tau蛋白与微管的亲和力,尤其是外显子10突变,其次是外显子9和12突变,而外显子13突变的影响较小;尚有一些错义突变可以直接刺激tau蛋白形成纤维丝[15]。因此对上述基因突变进行早期检测和干预,可以减少神经细胞和神经胶质细胞变性以及阿尔茨海默病的发病。此外,肽基脯氨酰基顺反异构酶(PPIase)可以特异性调节某些磷酸化蛋白构象变化,而阿尔茨海默病患者发生PPIase蛋白氧化抑制,从而无法调节过磷酸化的tau蛋白构象,使其恢复生物学功能[16]。研究显示,PIN1基因多态性加速神经退行性变和临床病程,其中⁃842C>G单核苷酸多态性(SNP)参与轻度认知损害到阿尔茨海默病的转变[16],对早期诊断阿尔茨海默病具有一定意义。
3.CR1、CD33等免疫应激反应相关基因 当细胞外积聚Aβ时,小胶质细胞进行吞噬,同时触发炎症反应过程,启动自身免疫应激反应。补体系统长期激活和炎症反应与阿尔茨海默病的神经病理学过程有关,全基因组相关性研究显示,补体受体1(CR1)基因多态性与晚发性阿尔茨海默病相关;阿尔茨海默病患者发生小胶质细胞TYRO蛋白酪氨酸激酶结合蛋白(TYROBP)和髓样细胞触发性受体2(TREM2)基因突变,突变的TREM2基因和表达上调的CD33基因可以抑制Aβ清除,从而增加阿尔茨海默病患病风险[17⁃18]。
4.其他阿尔茨海默病相关基因多态性 研究显示,亦有一些基因多态性与阿尔茨海默病的患病风险相关,例如,位于第12号染色体的低密度脂蛋白受体相关蛋白1(LRP1)基因是阿尔茨海默病的危险因素,可以调节ApoE相关轴突生长和APP相关神经元代谢,增加Aβ生成和延缓Aβ清除;肿瘤坏死因子⁃α(TNF⁃α)和前列腺素内过氧化物合成酶2(PTGS2)基因通过炎症反应以增加阿尔茨海默病患病风险[19⁃20]。Meta分析显示,白细胞介素(IL)基因多态性与阿尔茨海默病患病风险相关[21]。
晚近出现很多关于阿尔茨海默病患病风险基因位点的研究报道,详见表1,这些基因检测对早期诊断和预测阿尔茨海默病发生与发展有一定作用。
二、影像学检查
影像学技术的发展对阿尔茨海默病的诊断与预后判断具有重要意义。目前临床最常用的影像学方法主要是MRI和PET。
1.MRI检查 MRI是在外加磁场作用下激发人体内氢原子核吸收能量而产生跃迁,射频(RF)脉冲停止后由于不同内部结构产生不同衰减而发射特定频率信号,经仪器接收后处理绘制出内部结构图像的影像学技术。MRI对软组织具有较好的分辨力,可以检测出阿尔茨海默病患者脑萎缩如脑室扩大、脑沟增宽等。研究显示,轻度认知损害进展至阿尔茨海默病的过程中出现胼胝体萎缩,且女性轻度认知损害进展期胼胝体萎缩速度快于轻度认知损害非进展期,因此,胼胝体萎缩可能成为预测轻度认知损害进展至阿尔茨海默病的标记,尤其是女性患者[30]。神经病理学和结构性 MRI(sMRI)研究显示,内侧颞叶是阿尔茨海默病最早受累脑区,且轻度认知损害期即检出海马和内嗅皮质(EC)体积缩小,海马旁回体积稍缩小;此外,外侧颞叶萎缩也可能预测轻度认知损害进展至阿尔茨海默病[31]。胼胝体、杏仁体、海马等不同部位变化和变化速度可以用来鉴别阿尔茨海默病与其他神经变性病及其病程阶段。扩散张量成像(DTI)是在MRI基础上施加多方向扩散敏感梯度而获得图像的技术,对脑白质微结构改变十分敏感。研究显示,DTI可以鉴别诊断阿尔茨海默病患者、轻度认知损害患者与正常人群[32];阿尔茨海默病和轻度认知损害患者胼胝体和扣带回部分各向异性(FA)值差异有统计学意义,可以作为早期诊断阿尔茨海默病和评价病程进展的指标[33]。fMRI可以检测神经功能连接改变,研究显示,额叶、顶叶、扣带回和内侧颞叶功能连接改变可以早期识别轻度认知损害[34]。

表1 阿尔茨海默病相关易感基因Table 1. Susceptibility genes associated with AD
2.PET显像 PET显像是利用同位素示踪原理,显示示踪剂分布和变化的一项功能成像技术。近年来,PET显像预测轻度认知损害进展至阿尔茨海默病业已成为研究热点,主要有18F⁃脱氧葡萄糖(18F⁃FDG)PET和 Aβ⁃PET。(1)18F⁃FDG PET:阿尔茨海默病患者脑组织葡萄糖代谢变化的最早证据来自 1983 年 de Leon 等[35]的研 究,他们 采用18F⁃FDG PET检测脑组织葡萄糖代谢率,并认为葡萄糖代谢率与认知功能相关。后续研究显示,阿尔茨海默病轻中度阶段颞顶叶、后扣带回和楔前叶葡萄糖代谢降低;进展期额叶葡萄糖代谢降低;阿尔茨海默病患者脑组织葡萄糖代谢降低区域主要集中于脑桥、感觉运动皮质(SMC)、初级视觉皮质、基底节、丘脑和小脑,与其他类型痴呆有所不同[36]。因此提出,18F⁃FDG PET显示的内侧颞叶葡萄糖低代谢是诊断轻度认知损害敏感性和特异性较高的方法[31]。但是由于既往18F⁃FDG PET研究缺乏标准化诊断程序,目前证据不支持其作为轻度认知损害患者的常规临床检测项目[37],因此,将18F⁃FDG PET 诊断程序标准化是前提。(2)Aβ⁃PET:是一项与 Aβ结合的示踪剂成像技术。一项关于正常老年人群的生物学标志物研究显示,Aβ沉积与脑结构和神经功能改变有关,且与轻度认知损害或阿尔茨海默病的病理改变相一致[7]。一项11C⁃PIB PET 研究显示,存在 Aβ沉积的51例轻度认知损害患者中29例(56.86%)进展至阿尔茨海默病,而无Aβ沉积的17例轻度认知损害患者中1例(5.88%)进展至阿尔茨海默病;75~89岁存在Aβ沉积的轻度认知损害患者若已出现情景记忆障碍,其从轻度认知损害进展至阿尔茨海默病的概率上升至80%[38]。脑组织Aβ沉积是阿尔茨海默病发病的标记,其在无症状阶段即已对认知功能产生影响,先于脑组织葡萄糖代谢改变;至疾病中后期,葡萄糖代谢降低更加显著,与进行性认知功能障碍密切相关[39]。因此,Aβ⁃PET 适用于阿尔茨海默病的早期诊断,而18F⁃FDG PET适用于病程进展的监测。一项研究比较18F⁃FDG PET、11C⁃PIB PET与MRI在轻度认知损害进展至阿尔茨海默病的预测价值,结果显示,MRI的预测准确度最高,为67%;且三者任意组合中MRI联合11C⁃PIB PET的预测准确性最高,为76%;而11C⁃PIB PET的敏感性最高,18F⁃FDG PET 最低[40]。总之,通过各种 PET显像技术的联合以实现阿尔茨海默病的早期诊断是可行的。目前,大多数PET显像研究均针对Aβ沉积特征,示踪剂还包括18F⁃Florbetaben、18F⁃Flutemetamol和18F⁃Florbetapir[41]。期待越来越多针对神经退行性变、神经炎症反应和神经递质传递障碍的影像学研究出现。
三、生物学标志物
阿尔茨海默病的病理改变并不局限于脑组织,其他组织中也可以观察到相关分子病理改变。生物学标志物可以提高早期诊断的准确性,主要包括外周血、脑脊液和尿液生物学标志物(表2)。
1.Aβ和tau蛋白测定 目前的脑脊液生物学标志物有较高的准确性,如脑脊液总tau蛋白(t⁃tau)、磷酸化tau蛋白(p⁃tau)升高和Aβ42降低是早期鉴别诊断阿尔茨海默病与其他痴呆的有效生物学标志物[42]。研究显示,阿尔茨海默病患者脑脊液检查较Aβ⁃PET 更早检出 Aβ沉积[52]。Palmqvist等[53]发现,脑脊液Aβ水平异常患者脑组织Aβ沉积速度与脑脊液和Aβ⁃PET均异常患者相近,是脑脊液和Aβ⁃PET均正常患者的3倍以上,且脑脊液和Aβ⁃PET均异常患者在海马结构方面的恶化更严重,提示其更接近阿尔茨海默病,故脑脊液生物学标志物可以更好地早期诊断阿尔茨海默病。多项研究比较轻度认知损害进展期与稳定期患者脑脊液tau蛋白和Aβ42表达变化,其结果显示,轻度认知损害进展期患者脑脊液 tau 蛋白显著升高,Aβ42显著下降[54⁃55]。Olsson等[43]认为,脑脊液t⁃tau 蛋白、p⁃tau 蛋白和 Aβ42可以较好地区分阿尔茨海默病患者与正常对照者以及轻度认知损害进展期与稳定期,血浆t⁃tau蛋白可以较好地区分阿尔茨海默病患者与正常对照者。阿尔茨海默病患者血小板中不同类型tau蛋白比例与正常对照者不同[56],故血小板tau蛋白水平也可能成为阿尔茨海默病早期诊断的生物学标志物。血小板APP异构体蛋白表达变化与阿尔茨海默病相关,阿尔茨海默病患者高相对分子质量APP异构体/低相对分子质量APP异构体比值下降,且下降程度与疾病严重程度相关,有较好敏感性和特异性[44]。

表2 外周血和脑脊液生物学标志物Table 2. Peripheral blood and CSF biomarkers
2.免疫炎症和氧化应激相关因子测定 免疫炎症相关因子在阿尔茨海默病发生与发展中发挥重要作用,包括白细胞介素家族、转化生长因子(TGF)家族和肿瘤坏死因子(TNF)家族等。有研究显示,阿尔茨海默病患者脑脊液TGF⁃β水平升高,而IL⁃6、IL⁃1β和 TNF⁃α无明显变化[45];阿尔茨海默病患者外周血 IL⁃6、IL⁃1β、IL⁃12、IL⁃18、TGF⁃β和 TNF⁃α水平升高,而 IL⁃4、IL⁃8、IL⁃10、干扰素⁃γ(INF⁃γ)和 C⁃反应蛋白(CRP)无明显变化。近年有研究显示,脑脊液免疫炎症相关神经颗粒素和几丁质酶⁃3样蛋白⁃1(CHI3L1/YKL⁃40)水平升高可以反映阿尔茨海默病病程[46]。氧化应激相关因子有助于早期诊断阿尔茨海默病,氧化、过氧化和超氧化过程可以导致蛋白质、脂质、DNA等改变,其活动度和产物水平在阿尔茨海默病患者、轻度认知损害患者和正常对照者中存有差异,如轻度认知损害患者和阿尔茨海默病患者超氧化物歧化酶(SOD)活性较正常对照者降低,丙二醛(MDA)水平较正常对照者升高[57]。
3.微小RNA测定 近年越来越多研究显示,微小 RNA(miRNA)可以影响 APP、PS⁃1、PS⁃2和淀粉样前体蛋白β位点剪切酶⁃1β(BACE⁃1)基因在脑组织中的表达变化,对神经生长分化起重要作用[58]。阿尔茨海默病患者海马组织miRNA⁃9、miRNA⁃128、miRNA⁃146a表达上调,尤以miRNA⁃146a与脑组织炎症反应的关系最密切[47⁃48]。脑脊液可检出52种miRNA,与正常对照者相比较,阿尔茨海默病患者miRNA⁃15a⁃5p 和 let⁃7i⁃5p表达上调,miRNA⁃29c⁃3p表达下调[49],表明脑脊液miRNA表达变化可以鉴别诊断阿尔茨海默病。Kiko等[59]研究显示,与正常对照者相比,阿尔茨海默病患者脑脊液miRNA⁃29a和miRNA⁃29b表达上调,miRNA⁃34a、miRNA⁃125b和miRNA⁃146a表达下调。此外,阿尔茨海默病患者脑脊液 miRNA⁃199b⁃5p、miRNA⁃22⁃5p 和 miRNA⁃206表达亦上调[49]。外周血miRNA表达变化也可以为阿尔茨海默病的临床预测提供参考。晚近研究显示,与阿尔茨海默病易感性相关的7种miRNA中,miRNA⁃9⁃5p、miRNA⁃106a⁃5p、miRNA⁃106b⁃5p 和miRNA⁃107表达下调可以增加阿尔茨海默病患病风险,其中miRNA⁃106a⁃5p作为预测因素,其灵敏度68%,特异度 93%;miRNA⁃29a⁃3p、miRNA⁃125a⁃3p和 miRNA⁃125b⁃5p 则无明显变化[50]。外周血可以检出168种miRNA,与正常对照者相比,阿尔茨海默病患者 miRNA⁃590⁃5p和 miRNA⁃142⁃5p表达上调,miRNA⁃194⁃5p 表达下调[49]。目前研究最多的 6 种miRNA 为 miRNA⁃9、miRNA⁃125b、miRNA⁃146a、miRNA⁃181c、let⁃7g⁃5p 和 miRNA⁃191⁃5p,最有希望成为早期诊断阿尔茨海默病的生物学标志物[51]。尽管目前对miRNA的研究尚不充分,仍待更大规模临床研究的验证,但是未来有望可以通过几种miRNA组合以诊断不同类型痴呆。
4.检测技术 除生物学标志物外,检测技术也应受到重视。小分子或蛋白质检测通常采用质谱法(MS),免疫分析如酶联免疫吸附试验(ELISA)或两种方法形成酶联免疫质谱测定技术。近年出现多种超灵敏检测平台,如单分子计数(SMC)、单分子阵列(Simoa)、免疫磁减量(IMR)等,不仅适用于血液检测,也适用于脑脊液低水平生物学标志物检测。如采用Simoa法测定血清Aβ和t⁃tau蛋白以预测神经功能,采用IMR法测定血浆t⁃tau蛋白以区分阿尔茨海默病患者与正常对照者[60]。采用SMC法可以检出阿尔茨海默病患者脑脊液高水平视锥蛋白样蛋白1,也可以检出脑脊液低水平Aβ低聚物以区分阿尔茨海默病患者、轻度认知损害患者与正常对照者[61]。上述检测技术尚未普及,但前景可观。
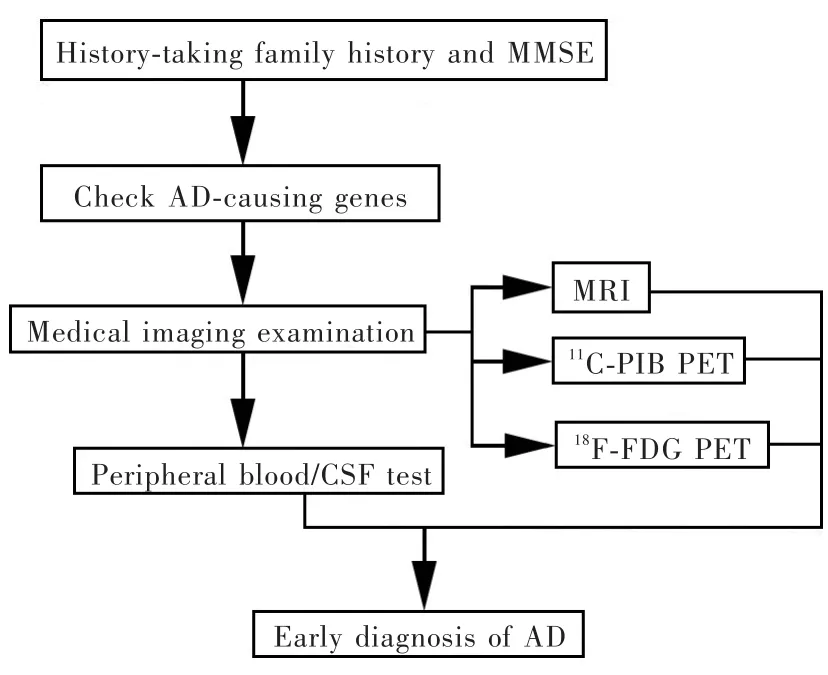
图1 阿尔茨海默病早期诊断流程图Figure 1 Flow diagram of AD's early diagnosis.
四、问题与展望
上述检测方法可以辅助判断阿尔茨海默病病理学过程,有助于其早期诊断,但存在以下不足:首先,由于基因的复杂性和样本量的局限性,晚发性阿尔茨海默病相关基因位点有待验证。其次,影像学检查不如生物学标志物敏感性高,而脑脊液采集存在一定风险,外周血检测尚不成熟。而且,生物学标志物的特异性方面存在局限性,如18F⁃FDG PET显像,葡萄糖代谢是非特异性指标,多种原因如缺血、炎症反应等均可以影响葡萄糖代谢,可能与阿尔茨海默病病程无直接关系[62]。此外,生物学标志物虽然可以在无症状阶段进行预测,但单一指标一般不足以确定为一种疾病,结果可能与预测方向存在差异[7]。因此,多方面、多指标相结合进行诊断至关重要。人为因素也不可忽视,不同研究团队对一些潜在生物学标志物的研究可能由于地域局限性和技术方法的不同而存在争议,尚待扩大样本量并统一研究方法以期获得一致性结论。
本文总结较为综合的阿尔茨海默病早期诊断方法,参见图1。对临床前阿尔茨海默病或轻度认知损害患者进行早期诊断,首先应询问患者或知情人相关病史,基于提供的信息和MMSE量表进行认知功能评价。如果患者有阿尔茨海默病家族史或年龄<65岁即有认知损害倾向,从其外周血中提取基因组DNA以检测是否携带致病性基因,包括APP、PS⁃1和 PS⁃2。若无明显临床症状,则应进行影像学检查,首选11C⁃PIB PET,且与MRI相结合准确性较高。如果需要更加精细地诊断与预测,可以采集脑脊液进行检查。外周血检测尚待更多研究和验证,虽然前景广阔,但目前笔者仍推荐通过MRI、11C⁃PIB PET和脑脊液检查相结合的方法进行阿尔茨海默病早期诊断。
[1]Alzheimer's Disease International.World AlzheimerReport 2009[R].London:ADI,2009:1⁃94.
[2]Peng D,Shi Z,Xu J,Shen L,Xiao S,Zhang N,Li Y,Jiao J,Wang YJ,Liu S,Zhou Y,Zhang X,Gu XH,Yang CC,Wang Y,Jiao B,Tang B,Wang J,Yu T,Ji Y.Demographic and clinical characteristics related to cognitive decline in Alzheimer disease in China:a multicenter survey from 2011 to 2014[J].Medicine,2016,95:E3727.
[3]Ji Y.A 200⁃year history of Alzheimer's disease[J].Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2014,14:156⁃160[.纪勇.阿尔茨海默病 200年[J].中国现代神经疾病杂志,2014,14:156⁃160.]
[4]Tian JZ,Shi J,Zhang XK,Ni JN,Zhang BL,Wang YY.The interpretation of latest diagnostic criteria for Alzheimer's disease in 2011[J].Zhongguo Yi Xue Qian Yan Za Zhi(Dian Zi Ban),2011,3:91⁃100[.田金洲,时晶,张学凯,倪敬年,张伯礼,王永炎.2011年美国阿尔茨海默病最新诊断标准解读[J].中国医学前沿杂志(电子版),2011,3:91⁃100.]
[5]Alberta MS,Dickson D,Dubois B,Feldman HH,Fox NC,Gamst A,Holtzman DM,Jagust WJ,Petersen RC,Snyder PJ,Carrillo MC,ThiesB,PhelpsCH.Thediagnosisofmild cognitive impairment due to Alzheimer's disease:recommendations from the National Institute on Aging⁃Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease[J].Alzheimers Dement,2011,7:270⁃279.
[6]Okello A,Koivunen J,Edison P,Archer HA,Turkheimer FE,Någren K,Bullock R,Walker Z,Kennedy A,Fox NC,Rossor MN,Rinne JO,Brooks DJ.Conversion of amyloid positive and negative MCI to AD over 3 years:an11C ⁃PIB PET study[J].Neurology,2009,73:754⁃760.
[7]Sperling RA,Aisen PS,Beckett LA,Bennett DA,Craft S,Fagan AM,Iwatsubo T,Jack CR Jr,Kaye J,Montine TJ,Park DC,Reiman EM,Rowe CC,Siemers E,Stern Y,Yaffe K,Carrillo MC,Thies B,Morrison⁃BogoradM,Wagster MV,Phelps CH. Toward defining the preclinical stages of Alzheimer's disease: recommendations from the National Institute on Aging⁃Alzheimer'sAssociation workgroupson diagnostic guidelines for Alzheimer's disease[J].Alzheimers Dement,2011,7:280⁃292.
[8]Bateman RJ,Xiong C,Benzinger TL,Fagan AM,Goate A,Fox NC,Marcus DS,Cairns NJ,Xie X,Blazey TM,Holtzman DM,Santacruz A,Buckles V,Oliver A,Moulder K,Aisen PS,Ghetti B,Klunk WE,McDade E,Martins RN,Masters CL,Mayeux R,Ringman JM,Rossor MN,Schofield PR,Sperling RA,Salloway S,Morris JC;Dominantly Inherited Alzheimer Network.Clinical and biomarker changes in dominantly inherited Alzheimer's disease[J].N Engl J Med,2012,367:795⁃804.
[9]Mormino EC,Sperling RA,Holmes AJ,Buckner RL,De Jager PL, Smoller JW, Sabuncu MR; Alzheimer's Disease Neuroimaging Initiative.Polygenic risk of Alzheimer disease is associated with early⁃and late⁃life processes[J].Neurology,2016,12:481⁃488.
[10]Li XQ,Cao YP.Research status of familial Alzheimer's disease[J].Guo Ji Shen Jing Bing Xue Shen Jing Wai Ke Xue Za Zhi,2014,41:156⁃159[.李兴强,曹云鹏.家族性阿尔茨海默病研究现状[J].国际神经病学神经外科学杂志,2014,41:156⁃159.]
[11]Wray NR,Goddard ME,Visscher PM.Prediction of individual genetic risk to disease from genome⁃wide association studies[J].Genome Res,2007,17:1520⁃1528.
[12]Liu SL,Zhang T,Zhang YJ,Yue W,Shi ZH,Guan YL,Liu S,Wang XD,Ji Y.Meta⁃analysis on correlation between genetic polymorphism of ApoE and late onset Alzheimer's disease in Chinese population[J].Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2016,16:30⁃37[.刘淑玲,张婷,张雅静,岳伟,石志鸿,管雅琳,刘帅,王晓丹,纪勇.中国人群ApoE基因多态性与迟发性阿尔茨海默病关系的Meta分析[J].中国现代神经疾病杂志,2016,16:30⁃37.]
[13]Zhang W,Wu N,Zhao XD.Research progressofgene mechanism of Alzheimer's disease[J].Xian Dai Yi Yao Wei Sheng,2007,23:2112⁃2113[.张薇,吴娜,赵旭东.阿尔茨海默病发生的基因机制研究进展[J].现代医药卫生,2007,23:2112⁃2113.]
[14]Herrup K.Reimagining Alzheimer's disease:an age⁃based hypothesis[J].J Neurosci,2010,30:16755⁃16762.
[15]Goedert M,Spillantini MG.Tau mutations in frontotemporal dementia FTDP⁃17 and their relevance for Alzheimer's disease[J].Biochim Biophys Acta,2000,1502:110⁃121.
[16]Arosio B,Segat L,Milanese M,Galimberti L,Calabresi C,Zanetti M,Trabattoni D,Annoni G,Crovella S,Vergani C.PIN⁃1 promoter polymorphisms in mild cognitive impairment and susceptibility to Alzheimer's disease:a preliminary report[J].Aging Clin Exp Res,2007,19:406⁃409.
[17]Rosenthal SL,Kamboh MI.Late⁃onset Alzheimer's disease genes and the potentially implicated pathways[J].Curr Genet Med Rep,2014,2:85⁃101.
[18]Naj AC,Jun G,Beecham GW,Wang LS,Vardarajan BN,Buros J,Gallins PJ,Buxbaum JD,Jarvik GP,Crane PK,Larson EB,Bird TD,Boeve BF,Graff⁃Radford NR,De Jager PL,Evans D,Schneider JA,Carrasquillo MM,Ertekin⁃Taner N,Younkin SG,CruchagaC,KauweJS,NowotnyP,KramerP,HardyJ,Huentelman MJ,Myers AJ,Barmada MM,Demirci FY,Baldwin CT,Green RC,Rogaeva E,St George⁃Hyslop P,Arnold SE,Barber R,Beach T,Bigio EH,Bowen JD,Boxer A,Burke JR,Cairns NJ,Carlson CS,Carney RM,Carroll SL,Chui HC,Clark DG,Corneveaux J,Cotman CW,Cummings JL,DeCarli C,DeKosky ST,Diaz⁃Arrastia R,Dick M,Dickson DW,Ellis WG,FaberKM,Fallon KB,Farlow MR,FerrisS,Frosch MP,Galasko DR,Ganguli M,Gearing M,Geschwind DH,Ghetti B,Gilbert JR,Gilman S,Giordani B,Glass JD,Growdon JH,Hamilton RL,Harrell LE,Head E,Honig LS,Hulette CM,Hyman BT,JichaGA,Jin LW,Johnson N,Karlawish J,Karydas A,Kaye JA,Kim R,Koo EH,Kowall NW,Lah JJ,Levey AI,Lieberman AP,Lopez OL,Mack WJ,Marson DC,Martiniuk F,Mash DC,Masliah E,McCormick WC,McCurry SM,McDavid AN,McKee AC,Mesulam M,Miller BL,Miller CA,Miller JW,Parisi JE,Perl DP,Peskind E,Petersen RC,Poon WW,Quinn JF,Rajbhandary RA,Raskind M,Reisberg B,Ringman JM,Roberson ED,RosenbergRN,SanoM,Schneider LS,Seeley W,Shelanski ML,Slifer MA,Smith CD,Sonnen JA,Spina S,Stern RA,Tanzi RE,Trojanowski JQ,TroncosoJC,VanDeerlin VM,VintersHV,VonsattelJP,Weintraub S,Welsh⁃Bohmer KA,Williamson J,Woltjer RL,Cantwell LB,Dombroski BA,Beekly D,Lunetta KL,Martin ER,Kamboh MI,Saykin AJ,Reiman EM,Bennett DA,Morris JC,Montine TJ,Goate AM,Blacker D,Tsuang DW,Hakonarson H,Kukull WA,Foroud TM,Haines JL,Mayeux R,Pericak⁃Vance MA,Farrer LA,Schellenberg GD.Common variants at MS4A4/MS4A6E,CD2AP,CD33 and EPHA1 are associated with late⁃onset Alzheimer's disease[J].Nat Genet,2011,43:436⁃441.
[19]Di Bona D,Candore G,Franceschi C,Licastro F,Colonna⁃Romano G,Cammà C,Lio D,Caruso C.Systematic review by meta⁃analyses on the possible role of TNF⁃α polymorphisms in association with Alzheimer's disease[J].Brain Res Rev,2009,61:60⁃68.
[20]Ma SL,Tang NL,Zhang YP,Ji LD,Tam CW,Lui VW,Chiu HF,Lam LC.Association ofprostaglandin⁃endoperoxide synthase 2(PTGS2)polymorphisms and Alzheimer's disease in Chinese[J].Neurobiol Aging,2008,29:856⁃860.
[21]Mun MJ,Kim JH,Choi JY,Jang WC.Genetic polymorphisms of interleukin genes and the risk of Alzheimer's disease:an update meta⁃analysis[J].Meta Gene,2016,8:1⁃10.
[22]Guerreiro RJ,Gustafson DR,Hardy J.The genetic architecture of Alzheimer's disease:beyond APP,PSENs and APOE[J].Neurobiol Aging,2012,33:437⁃456.
[23]Cruchaga C,Haller G,Chakraverty S,Mayo K,Vallania FL,Mitra RD,Faber K,Williamson J,Bird T,Diaz⁃Arrastia R,Foroud TM,Boeve BF,Graff⁃Radford NR,St Jean P,Lawson M,EhmMG,Mayeux R,Goate AM;NIA⁃LOAD/NCRAD Family Study Consortium.Rare variants in APP,PSEN1 and PSEN2 increase risk for AD in late⁃onset Alzheimer's disease families[J].PLoS One,2012,7:E31039.
[24]Wildsmith KR,Holley M,Savage JC,Skerrett R,Landreth GE.Evidencefor impairedamyloidβclearanceinAlzheimer's disease[J].Alzheimers Res Ther,2013,5:33.
[25]LambertJC,Heath S,Even G,Campion D,SleegersK,Hiltunen M,Combarros O,Zelenika D,Bullido MJ,Tavernier B,Letenneur L,Bettens K,Berr C,Pasquier F,Fiévet N,Barberger⁃Gateau P,Engelborghs S,De Deyn P,Mateo I,Franck A,HelisalmiS,PorcelliniE,Hanon O;European Alzheimer's Disease Initiative Investigators;de Pancorbo MM,Lendon C,Dufouil C,Jaillard C,Leveillard T,Alvarez V,Bosco P,Mancuso M,Panza F,Nacmias B,Bossù P,Piccardi P,Annoni G,Seripa D,Galimberti D,Hannequin D,Licastro F,Soininen H,Ritchie K,Blanché H,Dartigues JF,Tzourio C,Gut I,Van Broeckhoven C,Alpérovitch A,Lathrop M,Amouyel P.Genome⁃wide association study identifies variants at CLU and CR1 associated with Alzheimer's disease[J].Nat Genet,2009,41:1094⁃1099.
[26]Harold D,Abraham R,Hollingworth P,Sims R,Gerrish A,Hamshere ML,Pahwa JS,Moskvina V,Dowzell K,Williams A,Jones N,Thomas C,Stretton A,Morgan AR,Lovestone S,Powell J,Proitsi P,Lupton MK,Brayne C,Rubinsztein DC,Gill M,Lawlor B,Lynch A,Morgan K,Brown KS,Passmore PA,Craig D,McGuinness B,Todd S,Holmes C,Mann D,Smith AD,Love S,Kehoe PG,Hardy J,Mead S,Fox N,Rossor M,Collinge J,Maier W,Jessen F,Schürmann B,Heun R,van den Bussche H,Heuser I,Kornhuber J,Wiltfang J,Dichgans M,Frölich L,Hampel H,Hüll M,Rujescu D,Goate AM,Kauwe JS,Cruchaga C,Nowotny P,Morris JC,Mayo K,Sleegers K,Bettens K,Engelborghs S,De Deyn PP,Van Broeckhoven C,Livingston G,Bass NJ,Gurling H,McQuillin A,Gwilliam R,Deloukas P,Al⁃Chalabi A,Shaw CE,Tsolaki M,Singleton AB,Guerreiro R,Mühleisen TW,Nöthen MM,Moebus S,Jöckel KH,Klopp N,Wichmann HE,Carrasquillo MM,Pankratz VS,Younkin SG,Holmans PA,O'Donovan M,Owen MJ,Williams J.Genome⁃wide association study identifies variants at CLU and PICALM associated with Alzheimer'sdisease[J].Nat Genet,2009,41:1088⁃1093.
[27]VasquezJB,Fardo DW,EstusS.ABCA7 expression is associated with Alzheimer's disease polymorphism and disease status[J].Neurosci Lett,2013,556:58⁃62.
[28]Karch CM,Goate AM.Alzheimer's disease risk genes and mechanisms of disease pathogenesis[J].Biol Psychiatry,2015,77:43⁃51.
[29]Lambert JC,Ibrahim⁃Verbaas CA,Harold D,Naj AC,Sims R,Bellenguez C,DeStafano AL,Bis JC,Beecham GW,Grenier⁃Boley B,Russo G,Thorton⁃Wells TA,Jones N,Smith AV,Chouraki V,Thomas C,Ikram MA,Zelenika D,Vardarajan BN,Kamatani Y,Lin CF,Gerrish A,Schmidt H,Kunkle B,Dunstan ML,Ruiz A,Bihoreau MT,Choi SH,Reitz C,Pasquier F,Cruchaga C,Craig D,Amin N,Berr C,Lopez OL,De Jager PL,Deramecourt V,Johnston JA,Evans D,Lovestone S,Letenneur L,Morón FJ,Rubinsztein DC,Eiriksdottir G,Sleegers K,Goate AM,Fiévet N,Huentelman MW,Gill M,Brown K,Kamboh MI,Keller L,Barberger⁃Gateau P,McGuiness B,Larson EB,Green R,Myers AJ,Dufouil C,Todd S,Wallon D,Love S,Rogaeva E,Gallacher J,St George⁃Hyslop P,Clarimon J,Lleo A,Bayer A,Tsuang DW,Yu L,Tsolaki M,Bossù P,Spalletta G,Proitsi P,Collinge J,Sorbi S,Sanchez⁃Garcia F,Fox NC,Hardy J,Deniz Naranjo MC,Bosco P,Clarke R,Brayne C,Galimberti D,Mancuso M,Matthews F;European Alzheimer's Disease Initiative (EADI), Genetic and Environmental Risk in Alzheimer's Disease,Alzheimer's Disease Genetic Consortium,Cohorts for Heart and Aging Research in Genomic Epidemiology;Moebus S,Mecocci P,Del Zompo M,Maier W,Hampel H,Pilotto A,Bullido M,Panza F,Caffarra P,Nacmias B,Gilbert JR,Mayhaus M,Lannefelt L,Hakonarson H,Pichler S,Carrasquillo MM,Ingelsson M,Beekly D,Alvarez V,Zou F,Valladares O,Younkin SG,Coto E,Hamilton⁃Nelson KL,Gu W,Razquin C,Pastor P,Mateo I,Owen MJ,Faber KM,Jonsson PV,Combarros O,O'Donovan MC,Cantwell LB,Soininen H,Blacker D,Mead S,Mosley TH Jr,Bennett DA,Harris TB,Fratiglioni L,Holmes C,de Bruijn RF,Passmore P,Montine TJ,Bettens K,Rotter JI,Brice A,Morgan K,Foroud TM,Kukull WA,Hannequin D,Powell JF,Nalls MA,Ritchie K,Lunetta KL,Kauwe JS,Boerwinkle E,Riemenschneider M,Boada M,Hiltuenen M,Martin ER,Schmidt R,Rujescu D,Wang LS,Dartigues JF,Mayeux R,Tzourio C,Hofman A,Nöthen MM,Graff C,Psaty BM,Jones L,Haines JL,Holmans PA,Lathrop M,Pericak⁃Vance MA,Launer LJ,Farrer LA,van Duijn CM,Van Broeckhoven C,MoskvinaV,SeshadriS,Williams J,Schellenberg GD,Amouyel P.Meta⁃analysis of 74,046 individuals identifies 11 new susceptibility loci for Alzheimer's disease[J].Nat Genet,2013,45:1452⁃1458.
[30]Lee SH,Bachman AH,Yu D,Lim J,Ardekani BA.Predicting progression from mild cognitive impairmentto Alzheimer's disease using longitudinalcallosalatrophy[J].Alzheimers Dement,2016,2:68⁃74.
[31]Mosconi L.Brain glucose metabolism in the early and specific diagnosis of Alzheimer's disease:FDG⁃PET studies in MCI and AD[J].Eur J Nucl Med Mol Imaging,2005,32:486⁃510.
[32]Nir TM,Jahanshad N,Villalon⁃Reina JE,Toga AW,Jack CR,Weiner MW,Thompson PM;Alzheimer's Disease Neuroimaging Initiative(ADNI).Effectiveness of regional DTI measures in distinguishing Alzheimer's disease,MCI,and normal aging[J].Neuroimage Clin,2013,3:180⁃195.
[33]LiKC.Progressofneuroimaging research on Alzheimer's disease[J].Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2014,14:176⁃180[.李坤成.阿尔茨海默病神经影像学研究进展[J].中国现代神经疾病杂志,2014,14:176⁃180.]
[34]Jin M,Pelak VS,Cordes D.Aberrant default mode network in subjects with amnestic mild cognitive impairment using resting⁃state functional MRI[J].Magn Reson Imaging,2012,30:48⁃61.
[35]de Leon MJ,Ferris SH,George AE,Christman DR,Fowler JS,Gentes C,Reisberg B,Gee B,Emmerich M,Yonekura Y,Brodie J,Kricheff II,Wolf AP.Positron emission tomographic studiesofagingand Alzheimerdisease[J].AJNR Am J Neuroradiol,1983,4:568⁃571.
[36]Ishii K.Clinical application of positron emission tomography for diagnosis of dementia[J].Ann Nucl Med,2002,16:515⁃525.
[37]Smailagic N,Vacante M,Hyde C,Martin S,Ukoumunne O,Sachpekidis C.18F⁃FDG PET forthe early diagnosis of Alzheimer's disease dementia and other dementias in people with mild cognitive impairment(MCI)[J].Cochrane Database Syst Rev,2015,1:CD010632.
[38]Hatashita S,Yamasaki H.Diagnosed mild cognitive impairment due to Alzheimer'sdisease with PET biomarkersofbeta amyloid and neuronal dysfunction[J].PLoS One,2013,8:E66877.
[39]Landau SM,Mintun MA,Joshi AD,Koeppe RA,Petersen RC,Aisen PS,WeinerMW,JagustWJ;Alzheimer's Disease Neuroimaging Initiative.Amyloid deposition,hypometabolism,and longitudinal cognitive decline[J].Ann Neurol,2012,72:578⁃586.
[40]Trzepacz PT,Yu P,Sun J,Schuh K,Case M,Witte MM,HochstetlerH,HakeA;Alzheimer'sDiseaseNeuroimaging Initiative.Comparison of neuroimaging modalities for the prediction of conversion from mild cognitive impairment to Alzheimer's dementia[J].Neurobiol Aging,2014,35:143⁃151.
[41]Wang YH,Ji Y.Recent advances in Alzheimer's disease all over the world[J].Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2015,15:507⁃511[.王荫华,纪勇.世界阿尔茨海默病发展现状[J].中国现代神经疾病杂志,2015,15:507⁃511.]
[42]Jellinger KA,Janetzky B,Attems J,Kienzl E.Biomarkers for early diagnosis of Alzheimer disease:'ALZheimer ASsociated gene',a new blood biomarker[J]?J Cell Mol Med,2008,12:1094⁃1117.
[43]Olsson B,Lautner R,Andreasson U,Öhrfelt A,Portelius E,Bjerke M,Hölttä M,Rosén C,Olsson C,Strobel G,Wu E,Dakin K,Petzold M,Blennow K,Zetterberg H.CSF and blood biomarkers for the diagnosis of Alzheimer's disease: a systematic review and meta ⁃analysis[J].Lancet Neurol,2016,15:673⁃684.
[44]Borroni B,Colciaghi F,Caltagirone C,Rozzini L,Broglio L,Cattabeni F,Di Luca M,Padovani A.Platelet amyloid precursor protein abnormalities in mild cognitive impairmentpredict conversion to dementia of Alzheimer type:a 2⁃year follow⁃up study[J].Arch Neurol,2003,60:1740⁃1744.
[45]Swardfager W,Lanctôt K,Rothenburg L,Wong A,Cappell J,Herrmann N.A meta⁃analysis of cytokines in Alzheimer's disease[J].Biol Psychiatry,2010,68:930⁃941.
[46]Hellwig K,Kvartsberg H,Portelius E,Andreasson U,Oberstein TJ,Lewczuk P,Blennow K,Kornhuber J,Maler JM,Zetterberg H,Spitzer P.Neurogranin and YKL⁃40:independent markers of synaptic degeneration and neuroinflammation in Alzheimer's disease[J].Alzheimers Res Ther,2015,7:74.
[47]Lukiw WJ.Micro⁃RNA speciation in fetal,adult and Alzheimer's disease hippocampus[J].Neuroreport,2007,18:297⁃300.
[48]Lukiw WJ,Zhao Y,Cui JG.An NF⁃kappaB⁃sensitive micro RNA⁃146a⁃mediated inflammatory circuit in Alzheimer disease and in stressed human brain cells[J].J Biol Chem,2008,283:31315⁃31322.
[49]Sørensen SS,Nygaard AB,Christensen T.miRNA expression profiles in cerebrospinalfluid and blood ofpatients with Alzheimer's disease and other types of dementia:an exploratory study[J].Transl Neurodegener,2016,5:6.
[50]Yılmaz ŞG,Erdal ME, Özge AA,Sungur MA.Can peripheral microRNA expression data serve asepigenomic(upstream)biomarkers of Alzheimer's disease[J]?OMICS,2016,20:456⁃461.
[51]Kumar S,Reddy PH.Are circulating microRNAs peripheral biomarkers for Alzheimer's disease[J]?Biochim Biophys Acta,2016,1862:1617⁃1627.
[52]Fagan AM,Mintun MA,Shah AR,Aldea P,Roe CM,Mach RH,Marcus D,Morris JC,Holtzman DM.Cerebrospinal fluid tau and ptau(181)increase with cortical amyloid deposition in cognitively normal individuals:implications for future clinical trials of Alzheimer's disease[J].EMBO Mol Med,2009,1:371⁃380.
[53]PalmqvistS,Mattsson N,Hansson O;Alzheimer'sDisease Neuroimaging Initiative.Cerebrospinalfluid analysisdetects cerebral amyloid⁃β accumulation earlier than positron emission tomography[J].Brain,2016,139:1226⁃1236.
[54]LanariA,ParnettiL.Cerebrospinalfluid biomarkers and prediction of conversion in patients with mild cognitive impairment:4 ⁃year follow ⁃up in a routine clinical setting[J].ScientificWorldJournal,2009,9:961⁃966.
[55]Diniz BS,Pinto Júnior JA,Forlenza OV.Do CSF total tau,phosphorylated tau,and beta⁃amyloid 42 help to predict progression of mild cognitive impairment to Alzheimer's disease:a systematic review and meta⁃analysis of the literature[J]?World J Biol Psychiatry,2008,9:172⁃182.
[56]Neumann K,Farías G,Slachevsky A,Perez P,Maccioni RB.Human platelets tau: a potential peripheral marker for Alzheimer's disease[J].J Alzheimers Dis,2011,25:103⁃109.
[57]García ⁃Blanco A,Baquero M,Vento M,Gil E,Bataller L,Cháfer⁃Pericás C.Potential oxidative stress biomarkers of mild cognitive impairment due to Alzheimer disease[J].J Neurol Sci,2017,373:295⁃302.
[58]Jiang W,Zhang Y,Meng F,Lian B,Chen X,Yu X,Dai E,Wang S,Liu X,Li X.Identification of active transcription factor and miRNA regulatory pathways in Alzheimer's disease[J].Bioinformatics,2013,29:2596⁃2602.
[59]KikoT,NakagawaK,TsudukiT,FurukawaK,AraiH,Miyazawa T.MicroRNAs in plasma and cerebrospinal fluid as potential markers for Alzheimer's disease[J].J Alzheimers Dis,2014,39:253⁃259.
[60]Andreasson U, Blennow K, Zetterberg H. Update on ultrasensitive technologies to facilitate research on blood biomarkers for central nervous system disorders[J].Alzheimers Dement,2016,3:98⁃102.
[61]YangT,O'malleyTT,KanmertD,JerecicJ,ZieskeLR,Zetterberg H,Hyman BT,Walsh DM,Selkoe DJ.A highly sensitive novel immunoassay specifically detects low levels of soluble A β oligomers in human cerebrospinalfluid [J].Alzheimers Res Ther,2015,7:14.
[62]Shi ZH,Wang Y,Liu S,Liu SL,Zhou YY,Wang JH,Cai L,Gao S,Ji Y.11C⁃PIB PET and18F⁃FDG PET in patients with Alzheimer's disease and amnestic mild cognitive impairment[J].Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2014,14:222⁃231.[石志鸿,王颖,刘帅,刘淑玲,周玉颖,王金环,蔡莉,高硕,纪勇.11C⁃PIB PET和18F⁃FDG PET显像诊断阿尔茨海默病与遗忘型轻度认知损害的临床价值[J].中国现代神经疾病杂志,2014,14:222⁃231.]
