大脑中动脉闭塞模型大鼠高分辨力扩散张量纤维束示踪成像研究
2018-05-07曹宸张雪君韩彤
曹宸 张雪君 韩彤
脑卒中发病率、病残率和病死率均较高,约80%的脑卒中系血管堵塞引起的脑缺血所致[1⁃2],因此,建立操作简便、稳定可靠、重复性佳、接近人类的活体脑缺血动物模型是研究缺血性卒中病理生理学机制和预防与治疗措施的重要基本条件。大鼠是模拟人类缺血性卒中的首选对象,虽然大鼠脑组织体积小、白质纤维远不如人类发达,但相关技术的进步弥补了这一缺点[3]。随着高分辨力MRI的出现,使得MRI可以从结构和功能上准确、直观地观察缺血后脑组织结构变化。高场强(7.0T)MRI图像质量显著提高,除增加信噪比(SNR)外,还显著缩短扫描时间,尤其对于扩散张量成像(DTI)而言,采集方向的增加和分辨力的提高获得更强的扩散信号,图像时间分辨力和空间分辨力显著提高,将不同脑组织之间的对比和细节显示得更加清晰[4]。本研究对大脑中动脉闭塞(MCAO)模型大鼠进行高场强、高分辨力DTI和扩散张量纤维束示踪成像(DTT)扫描,以探讨缺血性卒中梗死灶中心和周围白质纤维束损伤情况。
材料与方法
一、实验材料
1.实验动物 健康清洁级雄性Sprague⁃Dawley(SD)大鼠30只,周龄8周,体重250~300 g,由首都医科大学实验动物部提供,于室温18~26℃、相对湿度40%~70%、12 h昼-12 h夜循环照明环境中饲养,自由摄食、饮水。
2.试剂与设备 PharmaScan 7.0T MRI扫描仪(美国Bruker公司)由首都医科大学医学实验与测试中心提供,孔径16 cm,最大梯度场强300 mT/m,配备38 mm大鼠专用表面线圈。Diffusion Toolkit 0.6软件和TrackVis 0.5.1软件由美国Athinoula A.Martinos生物医学影像中心开发(http://www.trackvis.org),DtiStudio 3.0.3软件由美国F.M.Kirby脑功能影像研究中心开发(https://www.mristudio.org)。质量分数为10%的水合氯醛由天津医科大学总医院药剂科提供。
二、实验方法
1.动物模型制备与分组 30只大鼠采用随机数字表法随机分为对照组和大脑中动脉闭塞模型组(MCAO组)。(1)对照组:10只大鼠,直接行MRI检查。(2)MCAO组:20只大鼠,采用线拴法制备左侧大脑中动脉闭塞模型,并于模型制备后0.50 h行扩散加权成像(DWI)和神经功能评分。DWI显示梗死侧明显异常信号和神经功能评分1~3分(0分,无神经功能缺损,活动正常;1分,对侧前爪不能完全伸展;2分,爬行时出现向对侧转圈;3分,行走时向偏瘫侧倾倒;4分,不能行走,意识障碍;5分,死亡)者为模型制备成功。
2.MRI检查 两组大鼠分别于模型制备后3 h、6 h、1 d、2 d、3 d、4 d和 7 d行 MRI检查。大鼠俯卧位,腹腔注射10%水合氯醛0.30 ml/100 g后以短木签固定头部并监测心率和呼吸,行冠状位扫描,扫描序列包括 T2WI、DWI和 DTI。(1)T2WI:重复时间(TR)3200 ms、回波时间(TE)15 ms,翻转角(FA)180°,扫描视野(FOV)22 mm ×16 mm,矩阵256×256,激励次数(NEX)为 1次,层厚 1 mm、层间距0.50 mm,共扫描 15层,扫描时间 102.64 s。(2)DWI序列:重复时间5500 ms、回波时间30 ms,翻转角90°,扫描视野22 mm×16 mm,矩阵128×128,激励次数1次,b值为200、400、600、800和1000 s/mm2,层厚1 mm、层间距0.50 mm,共扫描15层,扫描时间22 s。(3)DTI序列:重复时间为 4000 ms、回波时间24 ms,翻转角 90°,扫描视野 22 mm ×16 mm,矩阵128×96,激励次数1次,采集126个方向的扩散加权,b值为1000 mm/s2,层厚1 mm、层间距0.50 mm,共扫描15层,扫描时间500 s。
3.图像处理 采用Diffusion Toolkit 0.6软件和DtiStudio 3.0.3软件获得大鼠头部部分各向异性(FA)图、平均扩散率(MD)图、轴向扩散系数(λ║)图和径向扩散系数(λ┴)图,参照大鼠解剖图谱,于梗死侧皮质、皮质下和胼胝体分别选取大小约为2、2和1 mm2的兴趣区(ROI),计算相应FA值、MD值、λ║值和λ┴值。采用TrackVis 0.5.1软件进行DTT扫描,获得三维神经纤维图,于内囊区选取直径2.50 mm的小球作为兴趣区,计算纤维数目(NT)值并观察其变化。
三、统计分析方法
采用SPSS 18.0统计软件进行数据处理与分析。正态性检验采用Shapiro⁃Wilk检验,两组大鼠不同时间点梗死侧皮质、皮质下和胼胝体FA值、MD值、λ║值、λ┴值和NT值的比较采用重复测量设计的方差分析,两两比较行LSD⁃t检验。以P≤0.05为差异具有统计学意义。
结 果
本研究随着时间的延长,对照组大鼠死亡5只,最终纳入5只;MCAO组大鼠死亡10只,最终纳入10只。两组大鼠不同时间点梗死侧皮质、皮质下和胼胝体FA值(均P=0.000)、MD值(均P=0.000)、λ║值(均P=0.000)和λ┴值(均P=0.000)差异均有统计学意义(表1~6),其中,随着时间的延长,MCAO组梗死侧皮质FA值于超急性期(≤6 h)缓慢升高(P=0.000)、急性期(6小时至3天)明显下降(均P=0.000)、亚急性期(3天至8周)缓慢下降(均P=0.000)并趋于稳定,MD值、λ║值和λ┴值均于超急性期无明显变化(均P>0.05)、急性期明显升高(均P=0.000)、亚急性期缓慢升高(均P=0.000)并趋于稳定;梗死侧皮质下FA值于超急性期缓慢升高(P=0.000)、急性期明显下降(均P=0.000)、亚急性期有所升高但仍低于超急性期(均P=0.000)并趋于稳定,MD值和λ║值均于超急性期无明显变化(均P>0.05)、急性期明显升高(均P=0.000)、亚急性期缓慢升高(均P=0.000)并趋于稳定,λ┴值于超急性期即明显升高(均P=0.000)、急性期和亚急性期缓慢升高(均P=0.000)并趋于稳定;梗死侧胼胝体FA值于超急性期缓慢升高(P=0.000)、急性期明显下降(均P=0.000)、亚急性期有所升高但仍低于超急性期(均P=0.000)并趋于稳定,MD值、λ║值和λ┴值均于超急性期无明显变化(均P>0.05)、急性期明显升高(均P=0.000)、亚急性期有所下降但仍高于超急性期(均P=0.000)并趋于稳定。对照组与MCAO组大鼠梗死侧皮质、皮质下和胼胝体FA值(P=0.003,0.000,0.000),皮质下MD值(P=0.013),皮质下和胼胝体λ║值(P=0.012,0.001)和λ┴值(P=0.001,0.036)差异有统计学意义,而皮质MD值、λ║值和λ┴值以及胼胝体MD值差异无统计学意义(均P>0.05,表1~6)。
两组大鼠不同时间点梗死侧NT值差异有统计学意义(P=0.000;表7,8),其中,随着时间的延长,MCAO组梗死侧NT值于超急性期缓慢下降(P=0.032)、急性期明显下降(均P=0.000)、亚急性期有所升高但仍低于超急性期(均P=0.000)并趋于稳定。MCAO组大鼠各时间点梗死侧NT值低于对照组且差异有统计学意义(P=0.000;表7,8)。
采用DTT分别对两组大鼠梗死侧和健侧进行白质纤维束重建(图1),结果显示,对照组和MCAO组健侧白质纤维束走行自然,形态完整;MCAO组梗死侧白质纤维束走行迂曲,部分离断,边缘纤维仍保持相对正常,尤其模型制备1 d后,DTT即可见梗死侧受损纤维趋于围绕病灶边缘(图2)。
讨 论
通过对DTI参数的综合分析,可以看出缺血后脑组织的微观变化[5⁃6]。FA值是定量评价各向异性的最常用参数,代表水分子各向异性成分占整个扩散张量的比例[7];MD值描述单个水分子的综合微观运动,细胞毒性水肿可以导致该值降低[8⁃9];λ║值和λ┴值分别代表体素中平行和垂直于纤维方向的扩散系数,可以提供更详细的扩散方向信息。
表1 两组大鼠不同时间点梗死侧皮质FA值、MD值、λ║值和λ┴值的比较Table 1. Comparison of FA,MD,λ║ and λ┴ values in cortex of infarct side at different time points between 2 groups

表1 两组大鼠不同时间点梗死侧皮质FA值、MD值、λ║值和λ┴值的比较Table 1. Comparison of FA,MD,λ║ and λ┴ values in cortex of infarct side at different time points between 2 groups
MCAO,middle cerebral artery occlusion,大脑中动脉闭塞;FA,fractional anisotropy,部分各向异性;MD,mean diffusion coefficient,平均扩散率;λ║,axial diffusivity,轴向扩散系数;λ┴,radial diffusivity,径向扩散系数
?

表2 两组大鼠不同时间点梗死侧皮质FA值、MD值、λ║值和λ┴值的重复测量设计的方差分析表Table 2. ANOVA of repeated measurement design of FA,MD,λ║ and λ┴ values in cortex of infarct side at different time points between 2 groups
正常人群白质FA值高于灰质,白质内为平行纤维,较灰质结构更加紧密,故白质λ║值高于λ┴值,表明水分子平行轴突方向扩散较垂直轴突方向更加自由,而灰质λ┴值与λ║值差值较白质小,这是由于灰质水分子布朗运动限制较少,因此,λ║值和λ┴值反映出白质与灰质的结构差异,而MD值无法区分二者[10]。
在本研究中,脑缺血分为超急性期(≤6 h)、急性期(6小时至3天)和亚急性期(3天至8周),超急性期MCAO组大鼠梗死侧皮质(灰质)、皮质下(白质)和胼胝体FA值缓慢升高,这是由于脑缺血致细胞毒性水肿,纤维髓鞘肿胀,纤维束间隙减小,但灰质和白质结构小梁尚未破坏。既往的大脑中动脉闭塞大鼠模型研究显示,脑缺血超急性期FA值呈现明显不同改变,包括明显升高、略升高、维持不变或降低[11⁃12],多种因素可以导致上述差异,包括缺血原因、病变部位、严重程度和图像质量等。急性期MCAO组大鼠梗死侧皮质、皮质下和胼胝体FA值明显下降,皮质MD值、λ┴值和λ║值升高,皮质下λ║值和λ┴值明显升高,尤以λ┴值显著。这是由于梗死灶逐渐形成血管源性水肿,血管内皮细胞损伤,血⁃脑屏障破坏,血管内大分子物质和水分子外渗至细胞外间隙,随着这一过程的进行性加重,灰质和白质结构小梁均已破坏,导致FA值明显下降。亚急性期大鼠梗死侧皮质、皮质下和胼胝体FA值仍缓慢下降或有所升高但仍低于超急性期并趋于稳定,皮质下λ┴值有所下降但仍高于超急性期并趋于稳定,表明神经纤维重塑已经发生,这可能是由于增加的轴突和髓鞘导致的,也可能是由于神经胶质细胞增生、瘢痕组织等形成的扩散屏障导致的。
表3 两组大鼠不同时间点梗死侧皮质下FA值、MD值、λ║值和λ┴值的比较Table 3. Comparison of FA,MD,λ║ and λ┴ values in subcortex of infarct side at different time points between 2 groups

表3 两组大鼠不同时间点梗死侧皮质下FA值、MD值、λ║值和λ┴值的比较Table 3. Comparison of FA,MD,λ║ and λ┴ values in subcortex of infarct side at different time points between 2 groups
MCAO,middle cerebral artery occlusion,大脑中动脉闭塞;FA,fractional anisotropy,部分各向异性;MD,mean diffusion coefficient,平均扩散率;λ║,axial diffusivity,轴向扩散系数;λ┴,radial diffusivity,径向扩散系数
?

表4 两组大鼠不同时间点梗死侧皮质下FA值、MD值、λ┴值和λ║值的重复测量设计的方差分析表Table 4. ANOVA of repeated measurement design of FA,MD,λ║ and λ┴ values in subcortex of infarct side at different time points between 2 groups
DTI技术可以利用水分子扩散的各向异性进行DTT成像,从三维立体角度显示白质纤维束走行方向及其完整性。本研究DTT扫描显示,MCAO组大鼠梗死侧兴趣区纤维束分布较对侧明显稀疏,大部分纤维束卷曲、离断;尤其模型制备1 d后,梗死侧兴趣区纤维束NT值即明显下降,并随着时间的延长,NT值持续降低,表明脑缺血导致的髓鞘结构破坏、细胞微观结构丧失仍在继续;至亚急性期,NT值有所升高,表明此时梗死侧神经纤维重塑已经发生,这与DTI参数的综合分析结果相符。本研究结果还显示,模型制备1 d后MCAO组大鼠梗死侧受损纤维趋于围绕病灶边缘,有助于抑制病灶向周围侵袭,并促进病灶恢复,对梗死灶的神经纤维重塑具有重要作用。
表5 两组大鼠不同时间点梗死侧胼胝体FA值、MD值、λ║值和λ┴值的比较Table 5. Comparison of FA,MD,λ║ and λ┴ values in the corpus callosum of infarct side at different time points between 2 groups

表5 两组大鼠不同时间点梗死侧胼胝体FA值、MD值、λ║值和λ┴值的比较Table 5. Comparison of FA,MD,λ║ and λ┴ values in the corpus callosum of infarct side at different time points between 2 groups
MCAO,middle cerebral artery occlusion,大脑中动脉闭塞;FA,fractional anisotropy,部分各向异性;MD,mean diffusion coefficient,平均扩散率;λ║,axial diffusivity,轴向扩散系数;λ┴,radial diffusivity,径向扩散系数
?

表6 两组大鼠不同时间点梗死侧胼胝体FA值、MD值、λ║值和λ┴值的重复测量设计的方差分析表Table 6. ANOVA of repeated measurement design of FA,MD,λ║ and λ┴ values in corpous callosum of infarct side at different time points between 2 groups
静脉溶栓是目前治疗急性缺血性卒中的主要方法,但其治疗时间窗较窄,多数患者仅能接受药物治疗和相关康复治疗,治疗方法相对有限[13]。对于缺血性卒中治疗方法的研究,动物实验意义重大。动物实验显示,脑缺血后进行数周神经康复治疗,有助于神经纤维重塑,促进神经功能恢复;DTI显示,治疗组脑缺血边缘FA值升高,DTT显示,梗死灶周围神经纤维重塑;予神经干细胞治疗后,移植的神经干细胞迁移至梗死灶边缘地区[14⁃15]。亦有动物实验提出“神经血管单元”的概念[16],认为这是一种功能和结构上相互依赖的多细胞复合体,包括神经元、血管内皮细胞、星形胶质细胞和基底细胞,作为一个复杂网络维持稳定的神经元微环境[17⁃18]。因此认为,药物治疗不应仅关注神经元功能的维持,还应保护血管完整性及其他神经血管单元成分,并通过DTI和动脉自旋标记(ASL)观察药物作用[19]。
表7 两组大鼠不同时间点梗死侧NT值的比较Table 7. Comparison of NT value of infarct side at different time points between 2 groups
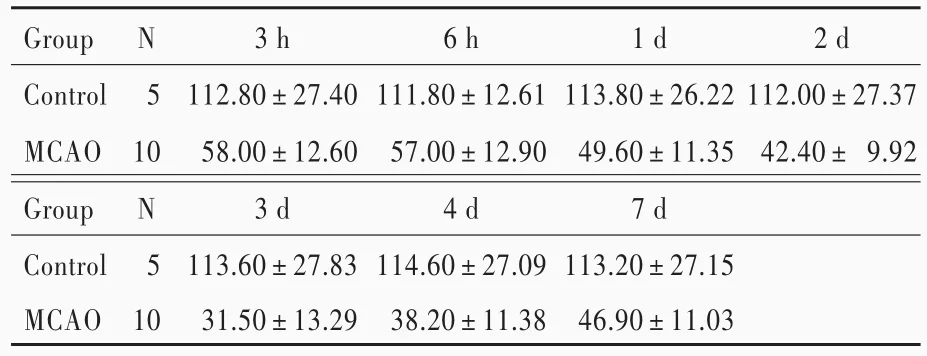
表7 两组大鼠不同时间点梗死侧NT值的比较Table 7. Comparison of NT value of infarct side at different time points between 2 groups
MCAO,middle cerebral artery occlusion,大脑中动脉闭塞
?
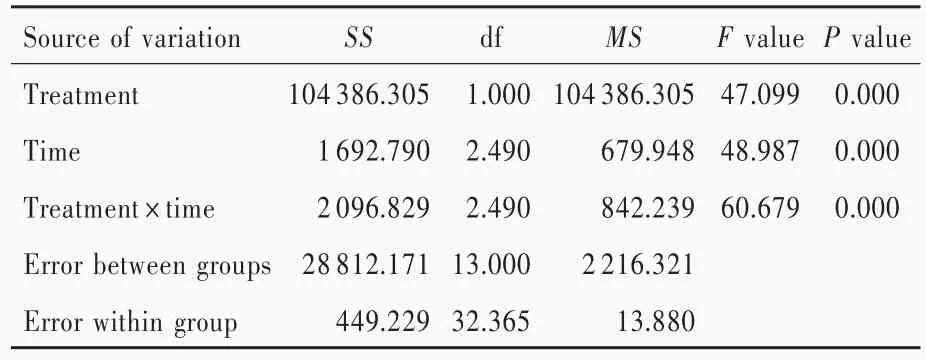
表8 两组大鼠不同时间点梗死侧NT值的重复测量设计的方差分析表Table 8. ANOVA of repeated measurement design of NT value of infarct side at different time points in 2 groups

图1 头部DTT扫描所见 1a 对照组大鼠白质纤维束走行自然,形态完整 1b MCAO组大鼠健侧白质纤维束走行自然,形态完整;梗死侧白质纤维束走行迂曲,部分离断 图2 头部DTT扫描显示,MCAO组大鼠模型制备1 d后梗死侧受损纤维趋于围绕病灶边缘Figure 1 Brain DTT findings The white matter fiber tracts in control group were normal and intact(Panel 1a).In MCAO group,the white matter fiber tracts in the affected side were twisted and disconnected,but the contralateral white matter fiber tracts were normal and intact(Panel 1b).Figure 2 Brain DTT showed the damaged fibers tended to be around the edge of lesion 1 d after MCAO model establishment.
神经纤维重塑的解剖学基础目前尚不清楚,推测有多种因素发挥重要作用。第一,为促进神经功能恢复,重塑区可能发生轴突出芽,形成新的神经元之间连接。第二,神经胶质细胞增生可能发挥重要作用,神经胶质细胞增生提高轴突的定向性。神经元与神经胶质细胞之间的沟通对轴突传导、突触传递和信号转导具有重要作用,神经胶质细胞调控神经元周围环境,包括离子流量、神经递质、细胞间黏附分子(ICAM)、传递因子和神经生长因子(NGF)等,通过释放神经递质及其他信号转导分子,神经胶质细胞可以影响神经兴奋性和突触传递,并协调神经网络活性。第三,受损的白质纤维束围绕病灶形成天然屏障,可以保护周围尚未受损的脑组织,并使新生轴突进入损伤区,促进其在梗死灶边缘重新建立新的连接[20]。
本研究采用高场强(7.0T)DTI和DTT技术对大脑中动脉闭塞模型大鼠白质纤维束进行精细成像,克服小视野DTI成像分辨力不足的缺点,但尚待补充更大样本量、更长时间点的影像学数据,并进行病理学检查。
[1]Faralli A,Bigoni M,Mauro A,Rossi F,Carulli D.Noninvasive strategies to promote functional recovery after stroke[J].Neural Plast,2013:ID854597.
[2]Wang YT,Zeng LL,Lü HY,Yuan FL,Xie BH,Cai BB,Tang YH,Guan YJ,Yang GY.Ten⁃year advance in the study on causes and pathologic mechanism of ischemic stroke[J].Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2010,10:2⁃27[.王永亭,曾丽莉,吕海燕,袁法磊,谢博华,蔡蓓蓓,汤耀辉,管永靖,杨国源.缺血性卒中病因学与发病机制研究的十年进展[J].中国现代神经疾病杂志,2010,10:2⁃27.]
[3]Krafft PR,Bailey EL,Lekic T,Rolland WB,Altay O,Tang J,Wardlaw JM,Zhang JH,Sudlow CL.Etiology of stroke and choice of models[J].Int J Stroke,2012,7:398⁃406.
[4]Moser E,Stahlberg F,Ladd ME,Trattnig S.7⁃T MR:from research to clinical applications[J]?NMR Biomed,2012,25:695⁃716.
[5]Guo HY,Sun F,Zhang ZJ,Zhang ZQ,Qi RF,Ma SY,Lu GM.Study of diffusion tensor imaging in subcortical ischemic vascular cognitive impairment[J].Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2014,14:309⁃315[.郭会映,孙芳,张宗军,张志强,戚荣丰,马思懿,卢光明.皮质下缺血性血管性认知损害扩散张量成像研究[J].中国现代神经疾病杂志,2014,14:309⁃315.]
[6]Zhou Y,Gao PY.Research progress of diffusion tensor imaging in peripheral neuropathy[J].Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2014,14:125⁃128[.周洋,高培毅.扩散张量成像在周围神经病变的研究进展[J].中国现代神经疾病杂志,2014,14:125⁃128.]
[7]Tuor UI,Morgunov M,Sule M,Qiao M,Clark D,Rushforth D,Foniok T,Kirton A.Cellular correlates of longitudinal diffusion tensor imaging of axonal degeneration following hypoxic⁃ischemic cerebral infarction in neonatal rats[J].Neuroimage Clin,2014,6:32⁃42.
[8]Hui ES,Du F,Huang S,Shen Q,Duong TQ.Spatiotemporal dynamics of diffusional kurtosis,mean diffusivity and perfusion changes in experimental stroke[J].Brain Res,2012,1451:100⁃109.
[9]Helpern JA,Adisetiyo V,Falangola MF,Hu C,Di Martino A,Williams K,Castellanos FX,Jensen JH.Preliminary evidence of altered gray and white matter microstructural development in the frontal lobe of adolescents with attention⁃deficit hyperactivity disorder:a diffusional kurtosis imaging study[J].Magn Reson Imaging,2011,33:17⁃23.
[10]Sen PN,Basser PJ.A model for diffusion in white matter in the brain[J].Biophys J,2005,89:2927⁃2938.
[11]Bhagat YA,Hussain MS,Stobbe RW,Butcher KS,Emery DJ,Shuaib A,Siddiqui MM,Maheshwari P,Al⁃Hussain F,Beaulieu C.Elevations of diffusion anisotropy are associated with hyper⁃acute stroke:a serial imaging study[J].Magn Reson Imaging,2008,26:683⁃693.
[12]Van der Linden A,Van Camp N,Ramos⁃Cabrer P,Hoehn M.Current status of functional MRI on small animals:application to physiology,pathophysiology,and cognition[J].NMR Biomed,2007,20:522⁃545.
[13]Nathaniel TI,Williams⁃Hernandez A,Hunter AL,Liddy C,Peffley DM,Umesiri FE.Tissue hypoxia during ischemic stroke:adaptive clues from hypoxia⁃tolerant animal models[J].Brain Res Bull,2015,114:1⁃12.
[14]Shimamura M,Sato N,Morishita R.Experimental and clinical application of plasmid DNA in the field of central nervous diseases[J].Curr Gene Ther,2011,11:491⁃500.
[15]Liu HS,Shen H,Harvey BK,Castillo P,Lu H,Yang Y,Wang Y.Post⁃treatment with amphetamine enhances reinnervation of the ipsilateral side cortex in stroke rats[J].Neuroimage,2011,56:280⁃289.
[16]Zhang J,Zou H,Zhang Q,Wang L,Lei J,Wang Y,Ouyang J,Zhang Y,Zhao H.Effects of Xiaoshuan enteric⁃coated capsule on neurovascular functions assessed by quantitative multiparametric MRI in a rat model of permanent cerebral ischemia[J].BMC Complement Altern Med,2016,16:198.
[17]Zhou Z,Wei X,Xiang J,Gao J,Wang L,You J,Cai Y,Cai D.Protection of erythropoietin against ischemic neurovascular unit injuries through the effects of connexin43[J].Biochem Biophys Res Commun,2015,458:656⁃662.
[18]Pan J,Lei X,Wang J,Huang S,Wang Y,Zhang Y,Chen W,Li D,Zheng J,Cui H,Liu Q.Effects of Kaixinjieyu,a Chinese herbal medicine preparation,on neurovascular unit dysfunction in rats with vascular depression[J].BMC Complement Altern Med,2015,15:291.
[19]Li P,Zhou YY.Methyl CpG⁃binding protein 2 participating in the regulation of differentiation plasticity of nerve regeneration in the basal ganglia after ischemic stroke[J].Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2013,13:955⁃960.[李 攀, 周 玉颖.甲基化CpG结合蛋白2参与缺血性卒中后基底节神经再生的分化调控[J].中国现代神经疾病杂志,2013,13:955⁃960.]
[20]Dijkhuizen RM,van der Marel K,Otte WM,Hoff EI,van der Zijden JP,van der Toorn A,van Meer MP.Functional MRI and diffusion tensor imaging of brain reorganization after experimental stroke[J].Stroke Res,2012,3:36⁃43.
