油茶籽多糖Ⅰ的分离纯化、单糖组分及降脂作用
2018-05-04张宽朝王海林
张宽朝, 文 汉, 陶 俊, 王海林
(安徽农业大学 生命科学学院,安徽 合肥 230036)
油茶(Camellia oleiferaAbel.)是山茶属植物,常绿灌木或小乔木,起源于中国,分布在广西、湖南、江西、安徽等中国南方的18个省 (自治区、直辖市),在东南亚的北部也有少量存在。据山海经记载,中国利用油茶种子的历史已超过2 000年[1]。
从油茶籽中提取的油茶油,是一种高品质的食用油,被称为“东方橄榄油”[2],与棕榈油、橄榄油、椰子油并称世界四大木本油料[3]。油茶油因具有不饱和脂肪酸及多酚含量高等特点,所以是非常健康的[4-5]。油茶油中油酸、亚油酸、不饱和脂肪酸含量均比菜籽油、花生油、大豆油、红花籽油、猪油含量高[6]。
目前,油茶的种子主要用于制油。最近的研究表明,油茶籽中含有大量生物活性多糖以及蛋白质、脂肪、单宁酸、咖啡因和皂甙等活性成分[7]。因此,应进一步挖掘油茶籽的综合利用价值。
如今,伴随肉、脂肪和乳制品消耗的增加,心脑血管疾病正严重危害人类健康,而脂质代谢与心脑血管疾病密切相关,脂质代谢紊乱所致的动脉粥样硬化是引发心脑血管疾病的重要因素[8]。已知的降脂药物(他汀类、贝特类、烟酸和胆汁酸螯合剂等)调节脂质的代谢机理不同,还可能伴有严重的不良反应[9]。
研究与开发天然来源的降脂药物具有很大的市场需求。多糖是与人类生命功能密切相关的四种基本物质之一。多糖具有多目标、毒性低、临床应用前景广等特点。许多研究表明,多糖具有增强机体免疫功能、抗肿瘤、抗氧化、抗衰老、保护消化系统、抗菌、抗病毒、降血糖和脂肪、抗辐射、抗凝血等多种生物学效应。因此,对油茶籽多糖I(CPSⅠ)的分离、纯化、单糖成分分析及其对高脂血症小鼠的降血脂功能进行了研究,为油茶籽的综合开发利用提供参考,为进一步研究油茶籽多糖结构与其活性功能的关系提供一定依据。
1 材料与方法
1.1 材料、试剂和仪器
1.1.1 材料 油茶籽:由安徽黄山徽山食用油业有限公司提供,室温贮存;四周龄雄性小白鼠(体重20±2 g):购自安徽中医学院动物中心。
1.1.2 试剂 DE-52:Pharmacia公司产品;果糖、葡萄糖、半乳糖、木糖、甘露糖及阿拉伯糖:美国sigma-aldrich公司;低密度脂蛋白胆固醇(LDL-C)试剂盒、总胆固醇(T-CHO)试剂盒:长春汇力生物技术有限公司;生理盐水:安徽丰原药业股份有限公司;硫酸软骨素:蚌埠宏业生化制药厂;卵黄乳:上海信然生物科技有限公司;蒽酮、氯化钠、三氯乙酸、丙酮、浓硫酸、乙酸乙酯、异戊醇、氯仿、甲醇、乙醇、氢氧化钠、盐酸等:均为国产分析纯。
1.1.3 仪器 高效毛细管电泳仪:美国BECKMAN公司;紫外分光光度计:上海瑞利分析仪器公司;傅立叶变换红外光谱分析仪:美国热电公司;MC99-3自动液相色谱分离层析仪:上海沪西分析仪器厂有限公司;LXJ-IIB大容量低速离心机:上海安亭科学仪器厂;冷冻干燥机:北京德天佑科技发展有限公司;722S型分光光度计:上海精密科学仪器有限公司;数控超声波清洗器:昆仑市超声仪器有限公司;FA1 104分析天平:上海精科天平;旋转蒸发仪:上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 多糖含量的测定 蒽酮比色法,以葡萄糖体积为横坐标,吸光度值为纵坐标,回归方程为:y=1.581 8x+0.010 4,R2=0.993 4(式中,y 表示 OD620nm,x为葡萄糖体积mL)。
1.2.2 油茶籽多糖的粗提、Sevage法除蛋白质 取冷榨油茶籽饼粉末按1∶3料液比加入蒸馏水,50℃恒温水浴浸泡120 min,超声波恒温水浴浸提30 min,4层纱布过滤,残渣重复上述操作一次。滤液4 800 r/min离心10 min,取上清液,加入4倍体积95%乙醇,4 800 r/min离心10 min,收集沉淀。Sevage法除蛋白质,得油茶籽多糖粗品。
1.2.3 DEAE-52层析 商品DE-52常规处理,装柱,取一定量油茶籽多糖粗品溶液上样,3 mol/L NaCl溶液和蒸馏水各500 mL梯度洗脱,洗至无糖检出为止。收集波峰管数的洗脱液,检测多糖含量,供Sephadex G-100柱层析使用。
1.2.4 Sephadex G-100柱层析 常规方法处理Sephadex G-100,装柱,取一定量DE-52层析纯化多糖溶液,上样。蒸馏水洗脱,控制其流速为1.5 mL/min,收集洗脱液,洗至无糖检出为止。根据波峰形成的顺序,依次收集得油茶籽粗纯化多糖I、油茶籽粗纯化多糖Ⅱ、油茶籽粗纯化多糖Ⅲ。
1.2.5 红外光谱分析 以傅立叶变换红外光谱仪对油茶籽粗纯化多糖I进行分析。
1.2.6 亲和层析 Sephadex G-100柱层析后油茶籽粗纯化多糖I溶液上铜离子-琼脂糖凝胶亲和层析柱,0.2 mol/L、pH 6.0磷酸盐缓冲液洗脱,得精制油茶籽多糖Ⅰ(CPSI)。
1.2.7 透析、浓缩、冷冻干燥 CPSI经蒸馏水透析,50℃水浴浓缩。冷冻干燥,收集所得即为CPSI精品。
1.2.8 毛细管电泳测定油茶籽多糖Ⅰ的单糖组成
1)电泳条件。 石英毛细管柱(58.5 cm×75 μm,有效长度48.5 cm);运行缓冲液:100 mmol/L硼砂溶液(pH=10.50);电压:15 kV;压力进样:0.5 Pa×20 s;柱温:25℃;检测波长:245 nm。样品及缓冲液于4℃储存,使用前0.45 μm微孔滤膜滤过,备用。
2)多糖的水解。精确称取CPSI 20.0 mg,加入2.0 mL、2 mol/L的H2SO4溶液,于10 mL具塞试管内100℃水解8 h后,得水解样品溶液。以4 mol/L NaOH溶液中和至pH 7.0,以水稀释至5.0 mL,离心,上清液为多糖水解样品,备用。
3)衍生物的制备
标准单糖混合液的配制:分别精密称取0.0 018 g甘露糖、0.0 036 g半乳糖、0.0 036 g鼠李糖、0.0 030 g木糖,加水溶解并定容至10 mL。
标准单糖混合液的衍生:精密吸取50 μL单糖混合液,加入 50 μL、0.3 mol/L NaOH 和 50 μL 0.5 mol/L PMP甲醇溶液,涡旋混合30 s,具塞试管内70℃水浴反应30 min,冷却至室温,加入50 μL、0.3 mol/L HC1中和,以100 μL去离子水稀释混匀后,加入氯仿1 mL涡漩混匀30 s,静置5 min,重复萃取上层水相2次,0.45 μm微孔滤膜过滤,进样。
多糖水解样品的衍生:将水解后的CPSI按标准单糖衍生化的方法处理,进样。
1.2.9 油茶籽多糖Ⅰ降血脂研究
1)试剂的配制。75%蛋黄乳注射液、2 mg/mL硫酸软骨素注射液、低剂量CPSI注射液 (0.5 mg/mL CPSI注射液)、中剂量CPSI注射液(1 mg/mL CPSI注射液)、高剂量CPSI注射液(2 mg/mL CPSI注射液)。
2)高脂模型的建立。将小鼠分成两组,其中空白对照组小鼠每天注射0.5 mL的生理盐水,其它小鼠每天注射0.5 mL的75%蛋黄乳,第三天禁食12 h后剪尾采血测小鼠TC含量,取其中造模成功的小鼠。
3)分组与指标测定。取造模成功的小鼠随机分组,分别为高剂量组、中剂量组、低剂量组、高脂组、阳性对照组。其中,高剂量组、中剂量组、低剂量组每天注射0.5 mL蛋黄乳和相应浓度的CPSⅠ注射液;阳性对照组每天注射0.5 mL蛋黄乳和0.2 mL硫酸软骨素;高脂组每天注射0.5 mL蛋黄乳和0.2 mL生理盐水;空白组每天注射0.7 mL生理盐水;多糖对照组每天注射0.5 mL生理盐水和0.2 mL均剂CPSⅠ注射液。
连续维持7 d,禁食12 h后剪尾采血,测定TCHO,HDL-C,LDL-C 和 HMG-CoA。
注射CPSⅠ后第5天起收集小鼠粪便,70℃烘干至恒质量。以料液比1∶30加入冷丙酮,20℃超声波提取60 min,离心,上清液即为粗粪固醇。
1.3 数据的处理与分析
实验数据用v7.55版DPS数据处理系统统计分析,以EXCEL 2003作图。
2 结果与讨论
2.1 DE-52分离粗多糖
目前在多糖纯化中阴离子交换层析法是普遍采用的一种方法。经DE-52柱分离后,自动部分收集器收集各组分,蒽酮比色法测定多糖。DE-52离子交换层析图谱见图1。DE-52为中等碱性阴离子交换剂,可用以分离中性多糖与酸性多糖,图1中出峰较为集中且仅有1个峰,表明冷榨油茶籽饼中主要为带负电荷的酸性粗多糖,且多糖各组分间等电点差异较小。因此,下一步对DE-52分离后的样品采用Sephadex G-100进行分离,以便根据相对分子质量大小差异进一步纯化油茶多糖各组分。

图1 DE-52分离粗多糖Fig.1 Elution of crude polysaccharide by DE-52 column
2.2 Sephadex G-100纯化油茶多糖
DE-52分离后的样品经Sephadex G-100柱分离,自动部分收集器收集各组分,蒽酮比色法测定多糖。Sephadex G-100层析图谱见图2。根据油茶籽粗多糖中各组分相对分子质量的差异,可得3个多糖峰,依次命名为油茶籽粗纯化多糖I(CCPS I)、油茶籽粗纯化多糖Ⅱ(CCPSⅡ)、油茶籽粗纯化多糖Ⅲ(CCPS Ⅲ)。

图2 Sephadex G-100纯化油茶多糖Fig.2 Purification diagram of CPS on Sephadex G-100 column
油茶籽粗多糖三个Sephadex G-100纯化组分中,CCPS I含量较多、相对分子质量较大,而且经过预实验发现其较CCPSⅡ、CCPSⅢ降血脂效果显著。因此,后续重点研究CCPS I。
2.3 油茶籽粗多糖I的红外光谱分析
从红外光谱图3-4可以看出,CCPSⅠ样品在1 000~1 200cm-1有多糖类吸收峰,在844±8 cm-1有吸收峰,说明CCPSⅠ是α-的端基差向异构体,C-H是平伏的。与磷酸盐标准图对比发现,两者在940-970 cm-1均存在非常强的PO43+对称伸缩,且吸收峰峰位对比发现,除多糖类吸收峰位外,两者峰位有较高一致性,因此认为,CCPSⅠ与磷酸盐具有较高的曲线匹配度,而实验操作中未引入磷酸盐,同时,CCPSⅠ可以和蒽酮发生显色反应,故推测CPSⅠ可能为结合磷酸基团的复合多糖。

图3 油茶籽粗纯化多糖I(CCPS I)的红外光谱图Fig.3 CCPS I IR map

图4 磷酸盐标准图Fig.4 Phosphate standard map
因此,根据磷酸基团能与金属离子螯合的特点,采用特异性较高的铜离子-琼脂糖凝胶亲和层析进一步纯化CCPSⅠ,实验获得单一洗脱峰,波峰管溶液可与蒽酮-硫酸发生特异性显色反应,进一步验证CPSⅠ可能为结合磷酸基团的复合多糖。同时,通过亲和层析纯化,获得了经精制纯化的油茶籽多糖Ⅰ(CPSⅠ)。
2.4 CPSⅠ的单糖组成
在图5中,a为油茶籽CPSⅠ水解后的毛细管电泳图谱,b是标准单糖混合液的毛细管电泳图谱。由图可知,油茶籽CPSⅠ经酸水解成为两种单糖,其图谱中两个峰分别与混标中的木糖、半乳糖的出峰时间相对应,可以得出油茶籽CPSⅠ由木糖和半乳糖两种单糖组成。

图5 4种标准单糖混合液及CPSⅠ水解后的电泳图谱Fig.5 Electrophoretogram of four standard mixture simple sugars and CPSⅠ
根据图5中各单糖的峰面积,计算可知油茶籽CPSⅠ的水解液中半乳糖和木糖的摩尔比为4.6∶5.57。
2.5 CPSⅠ对高血脂小鼠T-CHO、HDL-C、LDLC的影响
总胆固醇(T-CHO)是血液中所有脂蛋白所含胆固醇之总和。总胆固醇增高是导致动脉粥样硬化的一个非常重要的危险因素。表1数据表明,各种浓度多糖降脂程度依次是高剂量、中剂量、低剂量油茶籽多糖,其中中浓度和高浓度比硫酸软骨素降脂效果好。且多糖对照组较空白组小,更好地说明了CPSⅠ具有较好的降脂效果。
高密度脂蛋白胆固醇(HDL-C),能够驱动胆固醇逆转运,通过逆转运作用把血液和组织中多余的胆固醇携带经肝脏分解逆向排除体外。表2数据表明,各种浓度CPSⅠ注射液不能提高血液中HDL-C的浓度,不具有生物统计学意义。
表1 CPSⅠ对高血脂小鼠T-CHO、HDL-C、LDL-C的影响(n=6,±s)Table 1 Effect of CPSⅠon serum T-CHO,HDL-C,LDL-C in hyperlipidemia mice(n=6,±s)
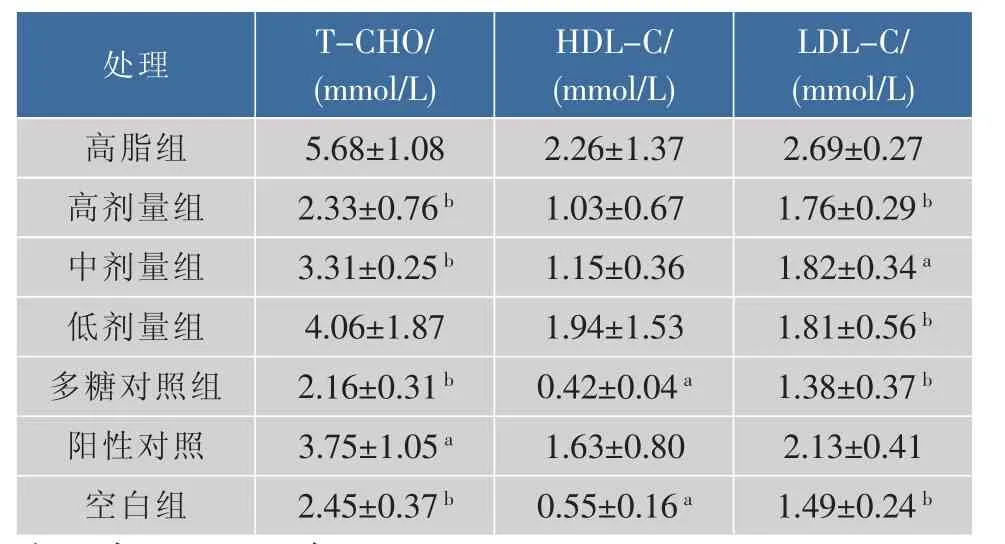
表1 CPSⅠ对高血脂小鼠T-CHO、HDL-C、LDL-C的影响(n=6,±s)Table 1 Effect of CPSⅠon serum T-CHO,HDL-C,LDL-C in hyperlipidemia mice(n=6,±s)
注:a 为 p<0.05,b 为 p<0.01。
处理T-C H O/(m m o l/L)H D L-C/(m m o l/L)L D L-C/(m m o l/L)高脂组5.6 8±1.0 8 2.2 6±1.3 7 1.0 3±0.6 7 2.3 3±0.7 6 b 高剂量组中剂量组3.3 1±0.2 5 b 1.7 6±0.2 9 b 1.8 2±0.3 4 a 4.0 6±1.8 7 1.1 5±0.3 6低剂量组1.9 4±1.5 3 1.8 1±0.5 6 b多糖对照组0.4 2±0.0 4 a 2.1 6±0.3 1 b 1.3 8±0.3 7 b阳性对照3.7 5±1.0 5 a 1.6 3±0.8 0 2.1 3±0.4 1 2.4 5±0.3 7 b 空白组0.5 5±0.1 6 a 2.6 9±0.2 7 1.4 9±0.2 4 b
低密度脂蛋白(LDL-C)是人体重要的脂蛋白,可运送胆固醇到全身供细胞利用。但如果血中LDL的浓度过高,则容易在血管壁造成堆积,与纤维蛋白原、血小板、巨噬细胞等发生作用,形成血管粥状硬化,阻塞血管。LDL-C即低密度脂蛋白胆固醇,在整个LDL的分子结构中所占的比例相对稳定,因此,可以通过LDL-C来判断LDL的整体水平。LDL-C过高,被视为血管阻塞的危险因子。研究结果表明,小白鼠在注射外源性胆固醇后,LDL-C浓度显著升高。其中高剂量组、中剂量组、低剂量组均能很好的降低LDL-C水平。
2.6 CPSⅠ对高血脂小鼠HMG-CoA的影响
HMG-CoA还原酶是动物与人体中肝细胞合成胆固醇过程中的限速酶,催化生成甲羟戊酸,抑制HMG-CoA还原酶能阻碍胆固醇合成。表2数据表明,与空白组相比,高脂组HMG-CoA还原酶活性下降,这可能是因为外源性胆固醇的增加,反馈抑制胆固醇的合成,从而降低HMG-CoA还原酶活性。同时注射蛋黄乳和CPSⅠ可以极显著提高HMGCoA还原酶活性。在多糖对照组时,HMG-CoA还原酶活性稍微下降,但不显著。
2.7 CPSⅠ对高血脂小鼠粪固醇的影响
粪固醇是消化道中未被吸收的胆固醇在结肠被细菌利用,将C-5与C-6间的双键还原生成的产物之一,随粪排出。表3数据表明,与空白组比较,高剂量CPSⅠ注射液能极显著提高小鼠排出粪固醇的能力,中剂量CPSⅠ和低剂量的CPSⅠ仅促进胆固醇排出的能力略有提升,可能是由于CPSⅠ剂量不足的原因。
表2 CPSⅠ对高血脂小鼠HMG-CoA的影响(n=6,±s)Table 2 Effect of CPSⅠon serum HMG-CoA reductase activity in hyperlipidemia mice(n=6,±s)

表2 CPSⅠ对高血脂小鼠HMG-CoA的影响(n=6,±s)Table 2 Effect of CPSⅠon serum HMG-CoA reductase activity in hyperlipidemia mice(n=6,±s)
注:a为 p<0.05,b 为 p<0.01。
处理H M G-C o A 还原酶活性/(μ m o l/(m i n·m g))高脂组4 4.9 3±2 1.6 2 1 3.3 1±3.8 3 b高剂量组中剂量组多糖对照组2 7.7 4±3.8 5 1 1.9 3±5.5 0 b空白组1 7.8 4±7.1 0 b
表3 CPSⅠ对高血脂小鼠粪固醇的影响(n=6,±s)Table 3 Effect of CPSⅠon coprosterol in hyperlipidemia mice(n=6,±s)
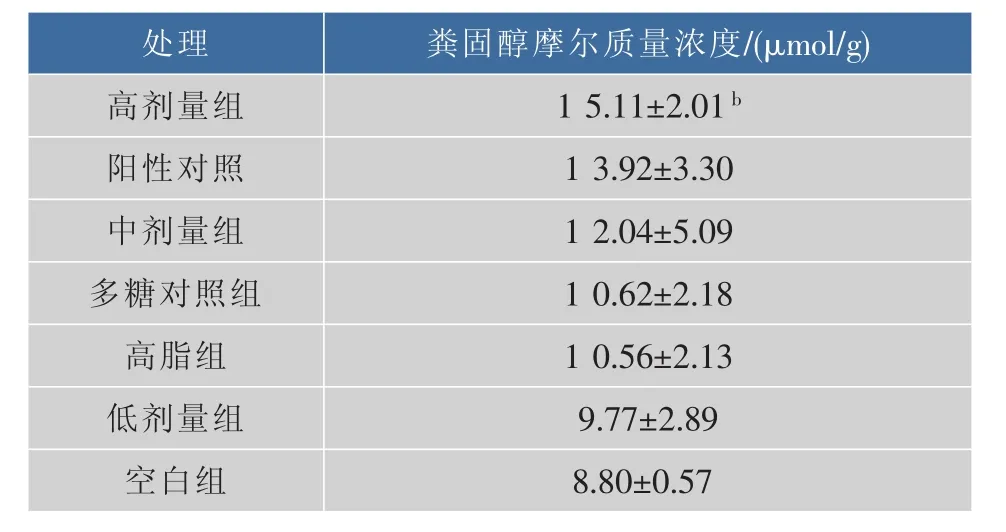
表3 CPSⅠ对高血脂小鼠粪固醇的影响(n=6,±s)Table 3 Effect of CPSⅠon coprosterol in hyperlipidemia mice(n=6,±s)
注:a 为 p<0.05,b 为 p<0.01。
处理粪固醇摩尔质量浓度/(μ m o l/g)高剂量组阳性对照1 5.1 1±2.0 1 b 1 3.9 2±3.3 0中剂量组多糖对照组1 2.0 4±5.0 9 1 0.6 2±2.1 8高脂组低剂量组1 0.5 6±2.1 3 9.7 7±2.8 9空白组8.8 0±0.5 7
与高血脂组相比,CPSI处理组小鼠血清TCHO和LDL-C显著下降,粪固醇摩尔质量浓度升高,但HDL-C和HMG-CoA还原酶活性没有变化。同时,实验对硫酸软骨素与CPSI的降血脂作用进行了比较研究。临床医学证明,硫酸软骨素可以清除体内血液中的脂质和脂蛋白,清除心脏周围血管的胆固醇,防治动脉粥样硬化,并增加脂质和脂肪酸在细胞内的转换率。比较实验发现,CPSI降低小鼠血清T-CHO、LDL-C的能力优于或接近硫酸软骨素降低小鼠血清T-CHO、LDL-C的能力,CPSⅠ提高小鼠排出粪固醇的能力也优于或接近硫酸软骨素的作用能力。因此,CPSI对预防小鼠高血脂有一定疗效,每日补充注射CPSI可导致高血脂小鼠血清总胆固醇和LDL胆固醇浓度显著的降低,其可能在降低心血管疾病风险方面发挥一定的作用。
一般认为,降低血清胆固醇的机制可能是脂肪和/或胆汁酸吸收障碍,从血液到组织的脂类运输的减少,胆固醇生物合成的内源性抑制和胆固醇分解代谢的增强[10]。
虽然CPSI降脂作用的机制仍不完全明确,但在初步的实验中发现CPSI可能导致粪固醇排泄的增加。因此,喂饲高胆固醇饮食小鼠的降脂机制可能在于通过干扰肠道内胆固醇的吸收,增加粪固醇的排泄,抑制外源胆固醇的吸收从而促进体内胆固醇的直接消耗。据报道,包括藻多糖在内的膳食纤维降低血脂水平主要就是通过在空肠内干扰胆固醇的吸收,在回肠内重吸收胆汁酸,从而增强粪便中胆固醇和胆汁酸的的排泄[11-12]。
3 结语
作者从冷榨油茶籽饼中提取、纯化得到了水溶性多糖I(CPSI)。分析发现,CPSI可能是一种具有多种磷酸基团的复合多糖。毛细管电泳分析结果表明,CPSI由木糖、半乳糖组成,油茶籽CPSⅠ的水解液中半乳糖和木糖的摩尔比为4.6:5.57。
研究表明,油茶籽CPSI具有降低高脂血症的治疗作用,有一定的应用前途。CPSI的配合使用可能是减轻高血脂症的一种安全有效的方法。CPSI可以开发作为一种保健食品,广泛用于高胆固醇血症患者的辅助治疗,但对CPSI作用的代谢机制和生物活性的评估仍需要进一步的研究。
参考文献:
[1]JOHN M R.Trends in new crops and new uses[M].Alexandria VA:ASHS Press,2002:222-224.
[2]WANG Xiangnan,CHEN Yongzhong,WU Liqi,et al.Oil content and fatty acid composition ofCamellia oleiferaseed[J].Journal of Central South University of Forestry&Technology:Natural Science Edition,2008,28(3):11-17.(in Chinese)
[3]ZHANG D Q,TAN X F,PENG W X,et al.Improved application ofCamellia oleiferaon biomass energy by enlarging its production[J].Acta Scientiarum Naturalium Universitatis Sunyatseni,2007,46(z1):109-110.
[4]YU Y S,REN S X,TAN K Y.Study on climatic regionalization and layer and belt distribution of oil tea camellia quality in china[J].Journal of Asian Natural Products Research,1999(14):123-127.
[5]XING Chaohong,LI Jinwei,WANG xingguo,et al.Determination of fatty acid composition and vitamin E content ofCamellia oleiferaoil by chromatographic technique[J].Journal of Food Science and Biotechnology,2011,30(6):838-842.(in Chinese)
[6]MA J L,YE H,RUI Y K,et al.Fatty acid composition ofCamellia oleiferaoil[J].Journal für Verbraucherschutz und Lebensmittelsicherheit,2011,6(1):9-12.
[7]LI Tingting,ZHANG Hui,WU Caie,et al.Extraction optimization and antioxidant activity of glycoprotein fromCamellia oleiferaseed[J].Journal of Agricultural Machinery,2012,43(4):148-155.(in Chinese)
[8]WANG Yafang,WANG Qiukuan,HE Yunhai,et al.Effects of a mixture of seaweed fucoidan combined with hawthorn extracts on hypercholesterolemia[J].Journal of Dalian Ocean University,2015,30(3):309-313.(in Chinese)
[9]VISHNU K,SUSHMA S,ASHOK K K,et al.Hypolipidemic activity ofAnthocephalus indicus(kadam) in hyperlipidemic rats[J].Medicinal Chemistry Research,17(2-7):152-158.
[10]LEOPOLD F,NOACK R.Aktuelle Aspekte der Ballaststoffforschung[M].Hamburg:Behr’s-Verlag,1993:147-155.
[11]HIDEOMI A,MAKOTO K,DANIEL A C,et al.Effect of a seaweed mixture on serum lipid level and platelet aggregation in rats[J].Fisheries Science,2005,71(5):1160-1166.
[12]KODAMA T,NAKAI H,KIRIYAMA S,et al.Hypocholesterolemic mechanisms of non-nutritive polysaccharides (konjac mannan,pectin and carboxymethyl cellulose) in foods[J].Eiyo Shokuryo,1972,25:603-608.
