液相色谱-串联质谱法测定肉品中氯噻啉药物残留
2018-05-04周大卫
周大卫
(北京市食品及酿酒产品质量监督检验一站,北京 100075)
氯噻啉是一种新烟碱类杀虫剂,是继有机磷、有机氯、氨基甲酸酯和拟除虫菊酯类杀虫剂之后的新型农药,其分子结构式如图1所示。氯噻啉属于广谱杀虫剂,对鞘翅目、双翅目和鳞翅目害虫均有很好的防治效果,尤其对叶蝉、稻飞虱、蓟马和水稻螟虫具有比较高的毒力,且因其价格低廉,使得越来越多的种植人员使用氯噻啉替代原有农药来防治虫害[1-4]。然而,由于我国部分种植人员在农药施放环节操作不科学,往往造成农作物中的农药残留超标。畜禽位于食物链的下游,摄食玉米、豆粕、糠、麦麸等农作物的产品或副产品,超量残留的农药会积累在家畜体内,最终危害人体健康[5-7]。
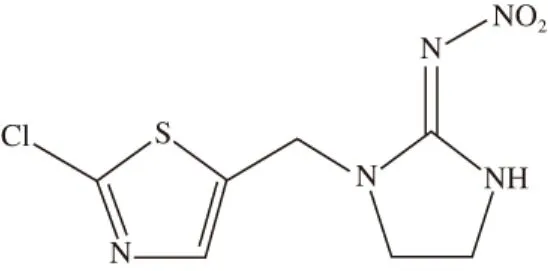
图1 氯噻啉分子结构式Fig. 1 Molecular formula of imidaclothiz
氯噻啉的毒理学数据为雌性小鼠口服半致死量LD50=90 mg/kg,雄性小鼠口服半致死量LD50=126 mg/kg,属中等毒性,对豚鼠皮肤变态反应(过敏)的实验结果为弱致敏性,大鼠喂饲原药最大无作用剂量为1.5 mg/kg,若以100 倍安全系数计,则人体每日允许摄入量为0.015 mg/kg[8]。
GB 2763—2016《食品安全国家标准 食品中农药残留最大限量》[9]中规定,氯噻啉的最大允许残留量在稻谷中为0.1 mg/kg,在小麦中为0.2 mg/kg。由于氯噻啉是一种新型农药,所以我国还没有相应的检测标准。目前,关于氯噻啉检测方法的研究主要包括液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法[10-12]、LC法[13-15]、气相色谱(gas chromatography,GC)-MS法[16]、胶体金免疫层析法[17]和毛细管电泳法[18]。在已有的报道中,研究对象只有水果、蔬菜、茶叶、大米等植物源性样品,未见到有关生鲜肉中氯噻啉残留检测方法的报道,而植物源性样品的前处理方法并不适用于蛋白质和脂肪含量较高的生鲜肉样品。
动物源性样品中农药残留检测的前处理方法一般有固相萃取法和QuEChERS(quick,easy,cheap,effective,rugged,safty)法。与QuEChERS法相比,固相萃取法的处理步骤较为繁琐,需要多次浓缩,耗时长、易损失、回收率低[19-21],故本研究采用QuEChERS法进行样品提取,采用LC-MS/MS法定量检测肉品中的氯噻啉残留。
1 材料与方法
1.1 材料与试剂
氯噻啉标准品(纯度≥96%) 德国Dr.Ehernstorfer公司;乙腈、甲酸(均为色谱纯) 美国Thermo Fisher公司;氯化钠、无水硫酸钠及无水硫酸镁(均为分析纯)北京化工厂;N-丙基乙二胺(primery secondary amine,PSA)吸附剂(40~63 μm)、C18吸附剂(40~63 μm) 上海安谱科学仪器有限公司;超纯水(电阻率18.2 MΩ·cm)。
猪肉、牛肉、羊肉、鸡肉、猪肝、猪肾、羊肝、羊肾样品各10 kg,均采购于北京市内超市。
1.2 仪器与设备
LC-20ADXR液相色谱仪 日本Shimadzu公司;API3200三重四极杆LC-MS/MS仪 美国AB Sciex公司;BP110S分析天平(感量0.1 mg) 瑞士Sartorius公司;MS1602TS分析天平(感量0.01 g) 瑞士Mettler Toledo公司;TGL-16M高速冷冻离心机 湘仪离心机仪器有限公司;T18高速均质机、MS3漩涡振荡仪德国IKA公司。
1.3 方法
1.3.1 标准溶液的配制
标准储备液的配制:准确称取氯噻啉标准品10.0 mg于100 mL容量瓶中,用乙腈定容,配制成质量浓度为100 μg/mL的标准储备液,4 ℃冷藏保存,有效期为6 个月。
1.3.2 样品制备
将样品用均质机匀浆后,准确称取2.00 g(精确到0.01 g)于50 mL离心管中,加入10 mL乙腈、适量甲酸和无机盐提取剂。拧紧离心管盖后漩涡振荡提取1 min,在10 ℃、5 000 r/min条件下离心5 min。取5 mL上层有机相,转移至装有50 mg PSA吸附剂和150 mg C18吸附剂的15 mL离心管中;拧紧离心管盖后漩涡振荡1 min,在10 ℃、5 000 r/min条件下离心5 min。吸取2 mL上清液,加入2 mL水,振摇,经0.22 μm有机微孔滤膜过滤后供LC-MS/MS测定。
其中,分别选择甲酸添加量为0.00、0.02、0.04、0.06、0.08、0.10、0.12、0.14 mL,根据样品中氯噻啉的回收率和相对标准偏差(relative standard deviation,RSD),确定甲酸的最佳添加量。
无机盐提取剂的选择:向样品中加入氯噻啉标准物质,使其添加量为20.0 μg/kg,再分别加入乙腈及不同比例的无机盐,并加入甲酸调整pH值为2.70,进行提取、净化后定容,上机测定后计算回收率。根据样品中氯噻啉的回收率和RSD,确定无机盐提取剂的最佳组合。
1.3.3 LC条件
Waters BEH-C18色谱柱(2.1 mm×50 mm,1.7 μm);流动相为乙腈(A)和0.1%甲酸水溶液(B);梯度洗脱程序为:0~1.0 min,流动相A 5%;1.0~4.0 min,流动相A 5%~95%;4.0~5.0 min,流动相A 95%;5.0~5.1 min,流动相A 95%~5%;5.1~8.0 min,流动相A 5%;柱温35 ℃;流速0.30 mL/min;进样量10 μL。
1.3.4 MS条件
采用电喷雾离子源正离子模式(electron spray ionization in the positive mode,ESI+),多反应监测(multiple reaction monitoring,MRM)模式,离子源温度550 ℃,电喷雾电压5 500 V,雾化气压力0.050 MPa,辅助加热气压力0.050 MPa,气帘气压力0.015 MPa,雾化气、辅助加热气、气帘气、碰撞气均为氮气。
1.3.5 方法准确度和精密度测定
称取猪肉、牛肉、羊肉、鸡肉、猪肝、猪肾、羊肝及羊肾样品,每种样品5 份,每份2.00 g。向每种样品的5 份试样中分别加入40、100、200、400、1 000 μL质量浓度为10 ng/mL的氯噻啉标准溶液,即其在样品中的添加量为0.2、0.5、1.0、2.0、5.0 μg/kg。采用优化后的方法进行处理,用LC-MS/MS仪测定。每个样品均进行8 次平行实验。
2 结果与分析
2.1 样品前处理条件优化
2.1.1 无机盐提取剂的选择
氯噻啉有N-硝基胍结构,具有热不稳定性。传统的QuEChERS方法,提取时为使目标化合物在水相中饱和后能更充分地分布于有机相中,会加入无水硫酸镁[22-26],而无水硫酸镁与样品中的水分接触后会大量放热,导致氯噻啉在提取时遇热分解产生损失。
参照AOAC 2007.01《利用乙腈提取和硫酸镁分离测定食品中农药残留的分析方法:气相色谱-质谱法和液相色谱-串联质谱法》[27]中的净化方法和其他学者检测动物源性食品中兽药残留的前处理方法[28]及检测植物源性食品中农药残留时的提取净化方法[29-30],对本研究的前处理条件进行优化。研究加入不同比例的无机盐提取剂对目标化合物提取效果的影响,最终确定一种最优前处理方案。
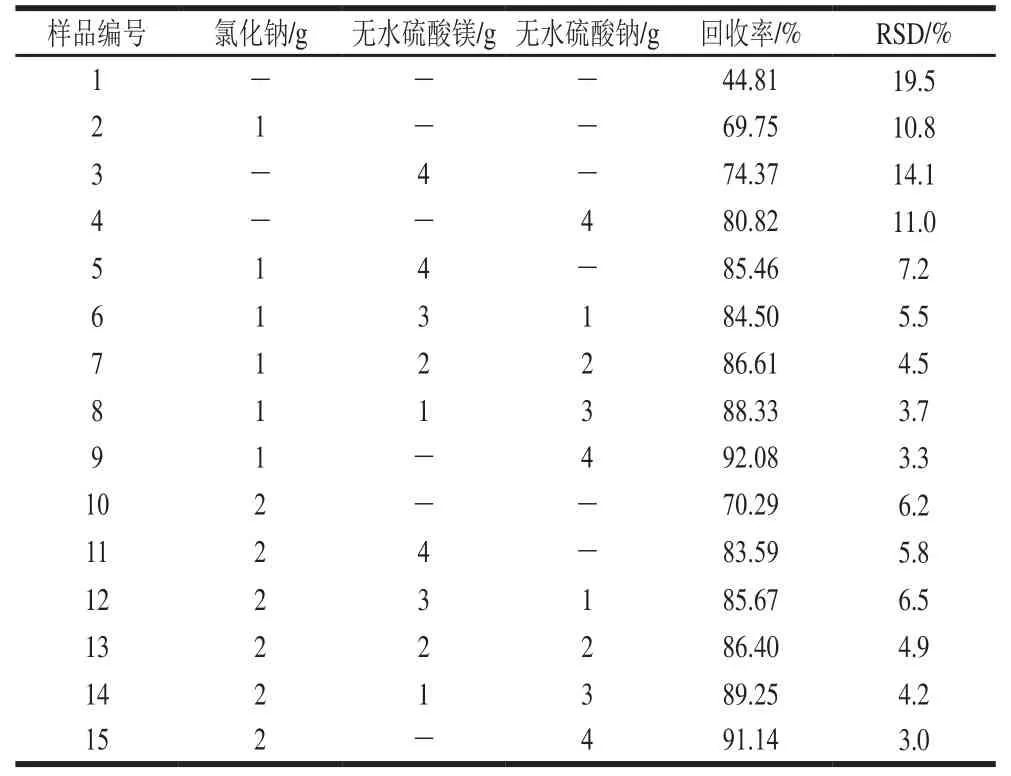
表1 不同比例无机盐提取剂对目标化合物提取回收率的影响(n=8)Table 1 Effects of inorganic salt extractants on the extraction of target compound (n= 8)
由表1可知:对于第1组样品,不加入无机盐时,则氯噻啉大部分溶于样品中所带的水分中,没有完全被乙腈提取出来,回收率只有44.81%;对于第2组样品,提取时只加入氯化钠,则氯噻啉在提取时依然不能充分被分配至有机相,其回收率只有69.75%;对于第3组和第4组样品,只加入无水硫酸镁或无水硫酸钠时,氯噻啉的回收率相较于第2组样品分别提高了4.62%和11.07%,但依然偏低;对于第5组样品,同时加入氯化钠和无水硫酸镁时,氯噻啉的回收率相较于第2组样品提高了15.71%,但由于无水硫酸镁的放热作用,导致一部分氯噻啉产生了损失;对于第6~9组样品,降低了无水硫酸镁的添加量,同时提高了无水硫酸钠的添加量,此过程中氯噻啉的回收率逐渐提高至92.08%;对于第10~15组样品,实验结果表明,在加入无水硫酸镁或无水硫酸钠后,单纯增加氯化钠的含量已经不能再提高氯噻啉的回收率。结合上述实验结果,并出于对节约试剂的考虑,本研究最终确定无机盐提取剂为1.00 g氯化钠和4.00 g无水硫酸钠。
2.1.2 提取pH值的选择
氯噻啉在酸性条件下稳定,而在碱性条件下易分解,因此在提取时控制pH值是保证回收率良好的关键。
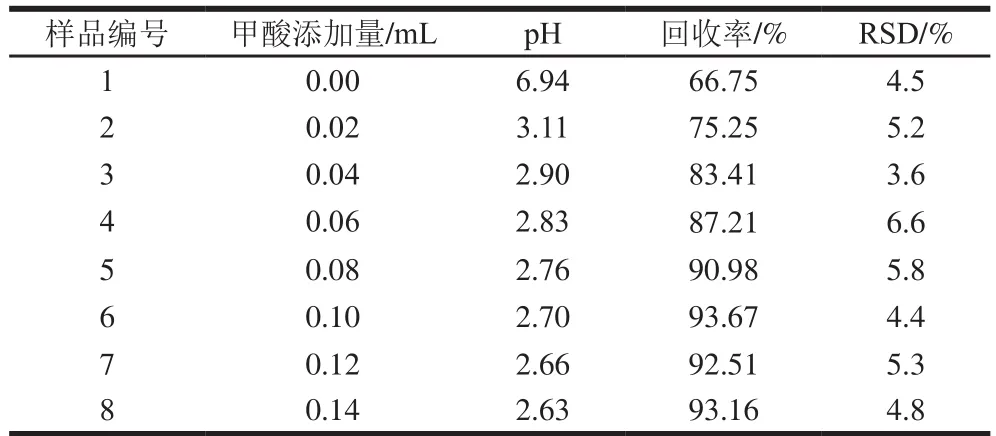
表2 不同甲酸添加量对目标化合物提取回收率的影响(n=8)Table 2 Effect of formic acid on the extraction of target compound (n= 8)
由表2可知:对于第1组样品,由于氯噻啉分子上的—NO2结构是强吸电子基团,使得与之相邻的C=N基团上的C原子具有强烈的吸附电荷趋势,当提取溶剂中未加入甲酸时,该C原子易受到溶液中—OH的进攻,从而发生亲核取代反应,导致氯噻啉分子分解,因此氯噻啉的回收率只有66.75%;对于第2~6组样品,随着甲酸添加量的增加,pH值逐渐下降,提取过程中氯噻啉的分解率逐渐降低,回收率也逐渐提升,当甲酸添加量为0.10 mL时(溶液pH值为2.70),氯噻啉的回收率为93.67%;对于第7~8组样品,继续增加甲酸的添加量,氯噻啉的回收率不再提高。故本研究选择在提取溶剂中加入0.10 mL甲酸(溶液pH值为2.70)。
2.1.3 MS条件的优化
首先采用1 μg/mL氯噻啉标准溶液为样品,以流动注射方式,在ESI+模式下进行全扫描,确定母离子;然后打开碰撞室能量,使用二级MS扫描,确定子离子;进一步优化去簇电压、碰撞电压等参数。氯噻啉的特征离子质量色谱图如图2所示,氯噻啉的去簇电压、碰撞电压及其他MS参数如表3所示。
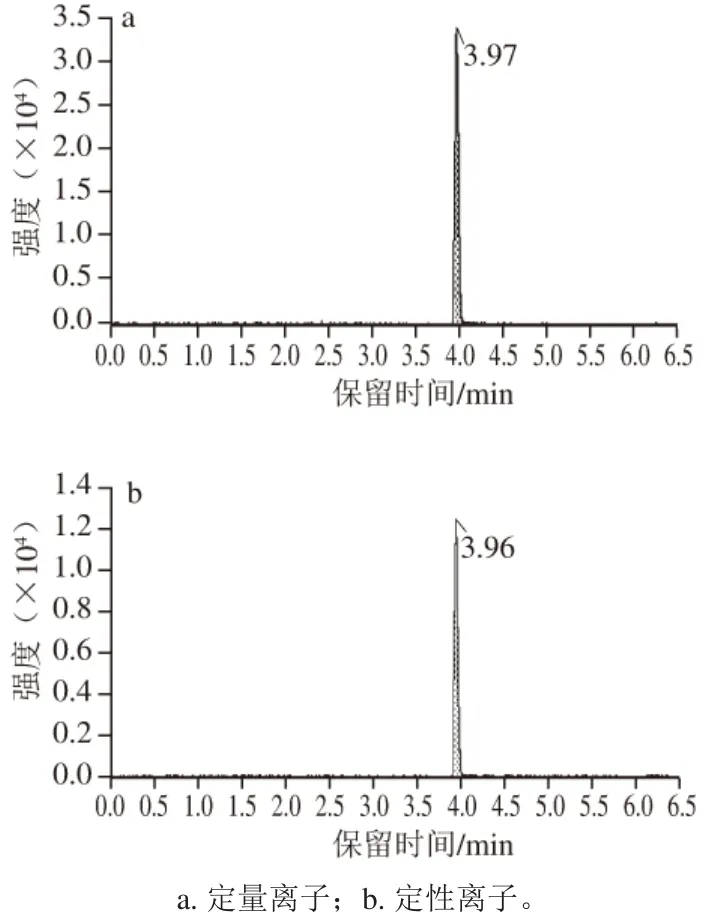
图2 氯噻啉的特征离子质谱图Fig. 2 MRM chromatograms of characteristic fragment ions for imidaclothiz

表3 氯噻啉的MS参数Table 3 Mass spectrometric parameters of imidaclothiz
2.2 方法准确度和精密度
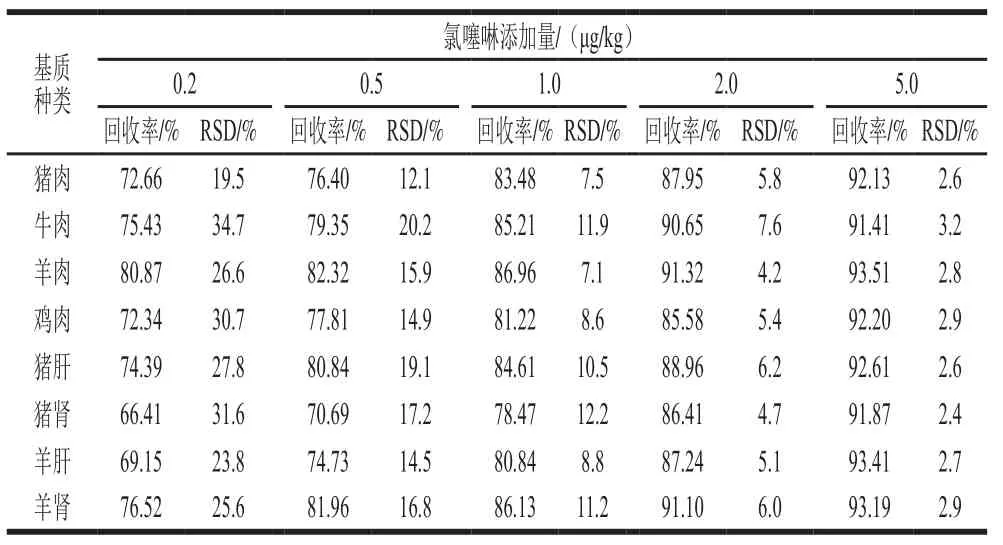
表4 不同基质中氯噻啉的回收率及精密度测定结果(n=8)Table 4 Recoveries and precision of imidaclothiz in different matrices (n= 8)
依据GB/T 27404—2008《实验室质量控制规范 食品理化检测》[31]附录F中检测方法确认的技术要求,回收率在90%~110%时的最低添加浓度为方法检出限。由表4可知,不同基质中氯噻啉的方法检出限均为5.0 μg/kg,对应的RSD在2.4%~3.2%之间。
2.3 基质效应对检测结果的影响
基质效应是指在样品测试过程中,由于待测物以外物质的存在直接或间接影响待测物响应的现象[32]。生鲜肉样品即使经过净化处理也会含有大量糖类、胺类、肽类等有机化合物,在LC-MS/MS技术中,这些非挥发性基质组分在通过ESI源时,会将带电液滴吸附在一起,阻止其分裂成更小的雾滴,进而阻碍氯噻啉的离子化过程,降低氯噻啉在质量分析器上的响应值。
外标法制作校正曲线的过程是用乙腈稀释氯噻啉标准品后,直接用LC-MS/MS仪测定,由于测定液中没有抑制离子化的基质,因此响应值会比同等浓度的带有基质的样品测定液更高一些。
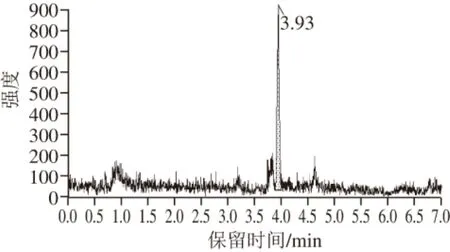
图3 猪肉基质中氯噻啉(10 ng/mL)的质谱图Fig. 3 Mass chromatogram for imidaclothiz (10 ng/mL) in pork matrix
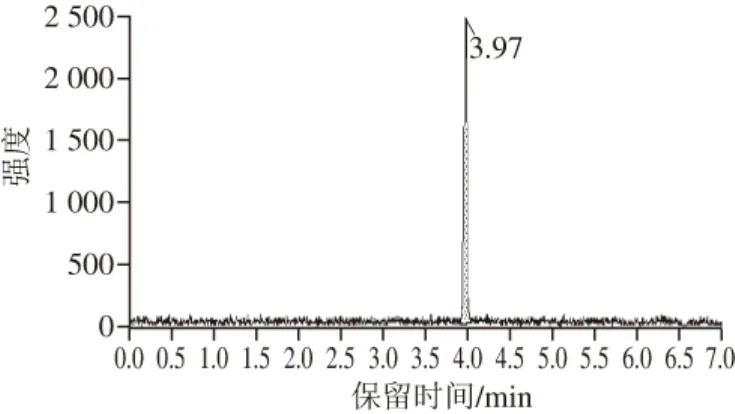
图4 用乙腈稀释的氯噻啉(10 ng/mL)的质谱图Fig. 4 Mass chromatogram for imidaclothiz (10 ng/mL) diluted in acetonitrile
由图3~4可知,采用外标法检测生鲜肉样品中的氯噻啉不能准确地得到氯噻啉在样品中的真实含量。
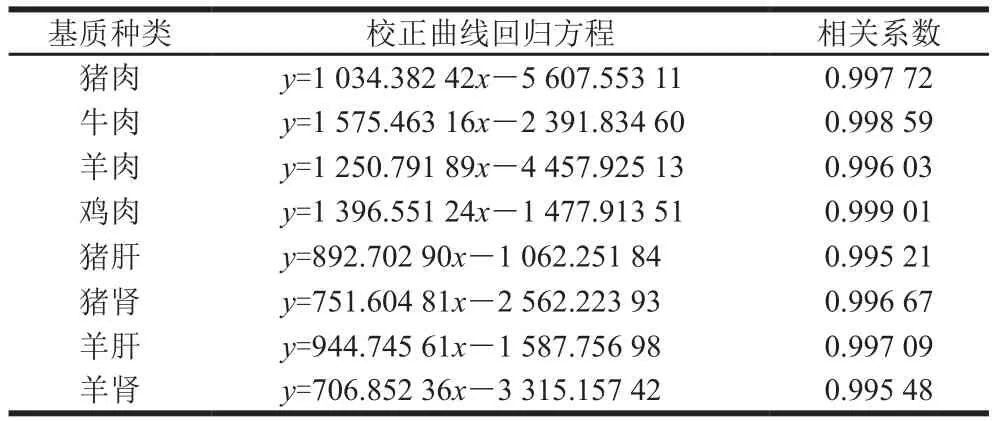
表5 不同基质校正曲线的回归方程Table 5 Calibration curve equations for different matrices
不同基质中含有的抑制离子化的组分不同,其抑制率不同,在LC-MS/MS仪上的响应就会不同,不同基质的基质添加校正曲线的斜率与截距就会不同。本研究采用基质添加曲线测定肉品中的氯噻啉含量。由表5可知,检测不同基质中的氯噻啉要选取相对应的阴性基质来绘制基质添加曲线,避免基质效应带来的定量差异。不同基质的校正曲线在10~400 ng/mL范围内的相关系数均大于0.995,因此该方法校正曲线的线性关系良好。
3 结 论
本研究建立了氯噻啉的LC-MS/MS检测方法,方法检出限为5.0 μg/kg,在不同肉品基质中的回收率为91.41%~93.51%,RSD在2.4%~3.2%之间。本方法操作简便、分析速度快、灵敏度高、重现性好,可以用于肉品中氯噻啉残留的检测,为肉品中氯噻啉的检测提供了有力工具,对保证我国肉品的安全卫生具有十分重要的意义。
参考文献:
[1] 贺敏, 贾春虹, 朱晓丹, 等. 40%氯噻啉水分散粒剂在稻田环境中的残留动态[J]. 农药, 2010, 49(1): 50-52. DOI:10.3969/j.issn.1006-0413.2010.01.017.
[2] 何震宇, 张夕林. 氯噻啉防治四代褐飞虱的田间效果的评价[J]. 安徽农学通报, 2006, 12(2): 75-76. DOI:10.3969/j.issn.1007-7731.2006.02.048.
[3] 张夕林, 周玉, 王陈, 等. 10%氯噻啉可湿性粉剂防治4代褐飞虱的田间效果的评价[J]. 农药科学与管理, 2006, 27(2): 19-20.DOI:10.3969/j.issn.1002-5480.2006.02.007.
[4] 刘飞, 尹鑫, 陈洪波, 等. 五种药剂防治茶小绿叶蝉田间试验[J]. 湖北植保, 2015, 10(5): 27-28. DOI:10.3969/j.issn.1005-6114.2015.05.013.
[5] 候鹏程, 俞平高, 莫成伟. 上海松江区种养结合家庭农场存在的问题及对策[J]. 浙江农业科学, 2012, 12(12): 1723-1725. DOI:10.3969/j.issn.0528-9017.2012.12.039.
[6] 杨路, 胡小品. 我国出口农产品农药残留超标的原因及策略选择[J]. 对外经贸实务, 2016, 25(10): 50-53. DOI:10.3969/j.issn.1003-5559.2016.10.012.
[7] 马玉霞, 虞敏达, 唐含英, 等. 冀中典型农业区农作物中有机氯农药的生物富集特征与健康风险评价[J]. 环境污染与防治, 2017, 39(2):147-154.
[8] 戴宝江. 新颖杀虫剂-氯噻啉[J]. 世界农药, 2005, 27(6): 46-47.
[9] 中华人民共和国卫生和计划生育委员会. 食品安全国家标准 食品中农药最大残留限量: GB/T 2763—2016[S]. 北京: 中国标准出版社,2016.
[10] 陆小磊, 叶美君, 周卫龙. 超高效液相色谱-串联质谱法测定茶叶中氯噻啉的残留量[J]. 农药, 2014, 53(11): 825-828.
[11] 刘松南, 赵新颖, 董晓倩, 等. QuEChERS净化-液相色谱-串联质谱法测定茶叶中氯噻啉[J]. 色谱, 2015, 33(11): 1205-1209.
[12] 陈言凯. 超高效液相色谱串联质谱法测定茶叶中6 种农药残留[J]. 安徽化工, 2016, 42(2): 89-91. DOI:10.3969/j.issn.1008-553X.2016.02.028.
[13] 高智席, 吴艳红, 敖克厚, 等. 水果中甲霜灵和氯噻啉的固相萃取-反相高效液相色谱测定法[J]. 环境与健康杂志, 2012, 36(3): 258-259.
[14] 侯如燕, 卞红正, 赵秀霞, 等. 固相萃取-液相色谱测定复杂基质蔬菜中9 种烟碱类残留[J]. 分析测试学报, 2011, 36(1): 58-63.DOI:10.3969/j.issn.1004-4957.2011.01.012.
[15] 杨东冬, 丛路静, 田明明, 等. 分子印迹固相萃取-液相色谱联用法测定3 种新烟碱类农药的残留[J]. 分析化学, 2014, 42(6): 872-877.
[16] 许秀莹, 施海燕, 王鸣华. 气相色谱-质谱联用测定大米中6 种烟碱类农药残留[J]. 质谱学报, 2012, 50(2): 99-103.
[17] 施海燕, 盛恩泽, 马明, 等. 氯噻啉胶体金增强免疫层析分析方法的建立[J]. 分析化学, 2017, 30(3): 403-408. DOI:10.11895/j.issn.0253-3820.160730.
[18] ZHANG Shuaihua, YANG Xiuming, YIN Xiaofang, et al. Dispersive liquid-liquid microextraction combined with sweeping micellar electrokinetic chromatography for the determination of some neonicotinoid insecticides in cucumber samples[J]. Food Chemistry,2012, 133(2): 544-550.
[19] 马琳, 陈建波, 赵莉, 等. 固相萃取-超高效液相色谱-串联质谱法同时测定果蔬中6 种酰胺类农药残留量[J]. 色谱, 2015, 33(10):1019-1025.
[20] 罗丹, 张玲玲, 闫正, 等. 固相萃取-高效液相色谱法测定蔬菜中8 种磺胺类抗生素[J]. 化学分析计量, 2017, 26(5): 50-54.
[21] 孙秀梅, 郝青, 金衍健, 等. 固相萃取-气相色谱质谱法同时测定稻田水产品中11 种农药残留[J]. 山东化工, 2017, 46(21): 83-84.DOI:10.3969/j.issn.1008-021X.2017.21.033.
[22] 田丽梅, 孙志勇, 向明, 等. 固相萃取-气相色谱法检测金银花中9 种拟除虫菊酯农药残留[J]. 食品科学, 2015, 36(20): 239-241.
[23] 李杨, 戴莹, 马帅, 等. QuEChERS-液相色谱-串联质谱联用法测定草莓中毒死蜱及其代谢物[J]. 食品安全质量检测学报, 2017, 8(9):3531-3535.
[24] 王昕璐, 贾琪, 许彦阳, 等. QuEChERS-超高效液相色谱-串联质谱法同时测定草莓中甲基硫菌灵、多菌灵和乙嘧酚残留[J]. 农药学学报, 2017, 19(5): 603-608.
[25] 粟有志, 李芳, 齐鑫, 等. QuEChERS-高效液相色谱/串联质谱法同时测定蜂蜜中9 种新烟碱类杀虫剂残留[J]. 分析科学学报, 2015,31(2): 203-207.
[26] 吴岩, 姜冰, 徐义刚, 等. QuEChERS-液相色谱-串联质谱法同时测定果蔬中16 种农药残留[J]. 色谱, 2015, 33(3): 228-234.
[27] Association of Analytical Communities. Pesticide residues in foods by acetonitrile extraction and partitioning with magnesium sulfate:gas chromatography/mass spectrometry and liquid chromatography/tandem mass spectrometry: AOAC 2007.01[S]. Philadelphia: AOAC International, 2007.
[28] 张科明, 梁飞燕, 邓鸣, 等. QuEChERS结合液相色谱-串联质谱法快速测定猪肉中多类兽药残留[J]. 色谱, 2016, 34(9): 860-867.
[29] 徐国锋, 聂继云, 李海飞, 等. QuEChERS/气相色谱法测定水果中31 种有机磷农药残留[J]. 分析测试学报, 2016, 35(8): 1021-1025.DOI:10.3969/j.issn.1004-4957.2016.08.016.
[30] 李海飞, 聂继云, 徐国锋, 等. QuEChERS样品前处理方法联合在线GPC/GC-MS测定水果中15 种三唑类农药残留量方法评估[J]. 分析测试学报, 2015, 34(12): 1331-1338. DOI:10.3969/j.issn.1004-4957.2015.12.001.
[31] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 实验室质量控制规范 食品理化检测: GB/T 27404—2008[S].北京: 中国标准出版社, 2008.
[32] TAYLOR P J. Matrix effects: the achilles heel of quantitative high performance liquid chromatography electrospray tandem mass spectrometry[J]. Clinical Biochemistry, 2005, 38(4): 328-334.
