生物活性玻璃治疗牙本质过敏症的长效性体外研究
2018-05-03史舒雅许玉婷陈亚明
史舒雅 武 琼 许玉婷 陈亚明
牙本质过敏症的定义是牙齿在受到外界刺激,如温度、化学物质以及机械作用等引起的酸、软、痛症状。它不是一种独立的疾病,而是各种牙体疾病所共有的症状[1,2]。它与釉质缺失和(或)根面暴露所致的牙本质小管暴露密切相关[1,2]。多种因素可致牙本质小管暴露,如牙合面磨损、磨耗、食物酸蚀、副功能运动、牙龈萎缩、老龄化、慢性牙周疾病、牙列不齐、牙周手术、不正确的刷牙方法、冠桥修复牙体预备以及牙折[1,3]。
流体动力学理论认为牙本质过敏症是由于暴露的牙本质小管内异常的液体流动造成的[4]。因此,封闭牙本质小管能阻断管内液体流动,从而缓解症状[5]。多种材料、方法能达到良好的短期脱敏效果[6]。然而日常牙合面磨损、唾液或者酸性饮食能重新打开封闭的牙本质小管,使得治疗效果维持时间较短[7,8]。一些体外实验已经证实食物酸性会增加牙齿敏感的可能[9]。因此,理想的脱敏剂不仅需降低牙本质的渗透性,同时要经受酸性饮食及唾液浸泡的考验[10]。
生物活性玻璃具备封闭牙本质小管和再矿化牙本质的能力。它最初用于刺激新骨形成,随后被用作骨科植入物涂层以促进植入物与骨的结合[11,12],后又用于充填牙周骨缺损[13,14]。最近,含有生物活性玻璃的脱敏剂被证实能有效缓解牙本质过敏症状[15]。此外,关于生物活性玻璃的细胞毒性研究表明这是一种高度生物相容性的材料[16~18]。尽管各种脱敏剂能在短期内减缓牙齿敏感的症状,但是关于其长期性的研究较少。
本体外实验研究的目的是比较含有生物玻璃的脱敏剂与另外两种脱敏剂治疗牙本质过敏症的长期效果,为临床治疗牙本质过敏症提供理论参考。
资料和方法
一、样本的制备
收集新鲜拔除的无龋、无裂纹、无修复体的人类第三磨牙50颗,彻底清洁后贮存于4℃的含有0.5%麝香草酚的去离子水中。平行于夹持板平面包埋固定,用低速切割机(Isomet Low Speed Saw,Buehler Ltd,美国)将牙体于釉牙骨质界上1.0mm处,垂直牙体长轴切成1.0mm厚的牙本质盘,用点标记近冠面和近髓面,在持续水流冲洗下,牙本质盘用600目的碳化硅砂纸打磨30秒。将样本浸入0.5M 乙二胺四乙酸(Ethylenediaminetetraacetic acid disodium salt,EDTA)溶液(pH=7.4)中2分钟去除玷污层,随后用大量蒸馏水冲洗3分钟。
二、实验步骤
1.将样本按随机数字表分为5组(N=10)。组1、2、3、4分别用生物活性玻璃、冷酸灵、高露洁抗敏和蒸馏水每天上午9点和下午5点处理2分钟;组5为对照组,不做任何处理。采用的是两组软毛电动牙刷(Colgate 360°,Colgate-Palmolive Co.),15日后更换。表1为三种脱敏剂的生产厂家和有效成分。每天脱敏处理样本后于上午10点浸泡在咖啡(pH=5.4)中5分钟,下午6点浸泡在可乐(pH=2.5)中5分钟。每次脱敏处理和酸性饮料浸泡后,将样本放于蒸馏水中超声震荡清洗。处理间隔期将样本贮存于常温(36±1.0℃)人工唾液中。使用的人工唾 液 配 方 为 1.5mM/L CaCl2,50mM/L KCl,0.9 mM/L KH2PO4and 20mM/L Tris(pH=7.4)。

表1 三种脱敏剂的生产厂家及主要成分
2.电化学阻抗检测:在样本处理2天后以及之后每隔7天进行一次样本的电化学阻抗值测定。采用的是电化学工作站(IM6,ZAHNER-Elektrik GmbH&Co.KG,Kronach,德国)。将牙本质盘置于含有一对橡胶“O环”(直径6㎜)的U型分裂腔装置中,该装置与Pashley等人提出的液压传导装置相似[19]。玻碳电极(CHI104,CHI Instruments,Inc.,Austin,TX,USA)作为工作电极,铂电极(CHI120,CHI Instruments,Inc.,美国)作为对电极分别放入两个半腔中。样本的合面朝向工作电极。Ag/AgCl电极(CHI111,CHI Instruments,Inc.,美国)用作参比电极。两个半腔中充满了0.1M KCl作为电解液。样本在进行电化学阻抗值测定前需浸泡在电解液2日排除残留的空气,每次测定均需更换电解液。采用振幅为10mV的正弦电压信号,频率设为0.1Hz到60kHz之间,获得奈奎斯特阻抗谱。影响阻抗值(kΩ)的因素包括电解液、样本以及电极的电阻值。因此,样本的阻抗值 R(d)等于总的阻抗值 R(t)减去电解液的阻抗值R(e)。同时,当Z值(交流阻抗矢量)最低时,它接近 R(t)。R(e)值是通过单独测定0.1M KCl电解液的阻抗值获得,其通常能稳定维持2~3小时。
3.原子力显微镜(atomic force microscopy,AFM)观察:将5组样本处理一个月后进行原子力显微镜观察。实验组(组1、2、3)各选取2个样本。将样本逐个包埋于丙烯酸树脂中,然后依次用1.00μm,0.30μm和0.05μm的氧化铝抛光粉抛光,超声震荡清洗后干燥备用。原子力显微镜(CSPM 5000,Ben Yuan Ltd,中国)采用敲击模式(tapping mode),探针可周期性地接触样本表面获得较少伪影的高清图像[20,21]。本实验使用AC160TS-C2型号的AFM探针(Olympus公司,日本),其共振频率 ~300kHz,弹簧力常数~42N/m。图像扫描速率为~1.5Hz,分辨率为512×512像素,其中最大垂直和横向分辨率分别为0.1nm和0.2nm。采用AFM仪器制造商提供的数据分析软件定量分析牙本质小管的直径变化。
4.扫描电子显微镜(Scanning electron microscopy,SEM)观察:样本处理一个月后,大量蒸馏水冲洗、干燥器干燥,然后喷金以增加导电性。扫描电镜(JSM6000,JEOL,日本)选取 20kV加速电压。
三、统计学方法
电化学阻抗值采用SPSS17.0进行统计分析,各个时间段所测得的每组样本的EIS值以及原子力显微镜观察到的牙本质小管直径用均数±标准差(±s)表示。Levene’s法测试方差齐性后,采用双因素方差分析和Post hoc LSD确定各组值是否有统计学差异,检验水准α=0.05。
结 果
一、电化学阻抗实验结果
样本EDTA脱矿、脱敏剂和酸性溶液处理2天,9天,16天,23天,30天的牙本质盘阻抗值见表2和图1。

表2 EDTA脱矿、脱敏剂和酸性溶液处理2天、9天、16天、23天、30天后的牙本质盘阻抗值(kΩ)*
双因素方差分析结果显示时间(F=7.42;P<0.05)和分组(F=12.07;P<0.05)都有统计学差异。Post hoc LSD结果提示,使用生物活性玻璃处理与其他组相比能显著降低牙本质的渗透性,差异有统计学意义(P<0.05),但高露洁组除外(P=0.324)。所有时段生物活性玻璃组产生的EIS值均最高。组4蒸馏水处理所获得的EIS值较组5(对照组)低,但差异没有统计学差异(P=0.25)。组2使用冷酸灵处理所获得的EIS值较组5略高,差异没有统计学意义(P=0.29)。
二、原子力显微镜结果
图2显示的是组1、2、3样本经过脱敏处理1个月后的AFM图像。组1图像可以看到样本表面有颗粒状的管间沉积物,牙本质小管径缩小最明显。组1(生物活性玻璃)、组2(冷酸灵)、组3(高露洁抗敏)测得的牙本质小管径分别为817±156μm,1231±277μm和 944±230μm。其中,组2与组1(P<0.01)和组3(P<0.05)均有统计学差异,后两者之间差异无统计学意义(P>0.05)。
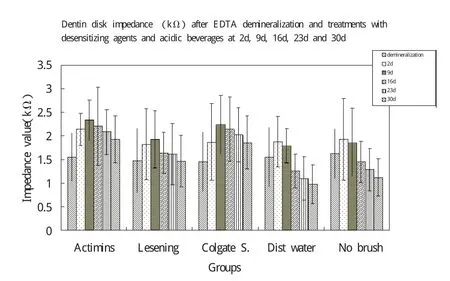
图1 样本EDTA脱矿、脱敏剂和酸性溶液处理2天,9天,16天,23天,30天的牙本质盘阻抗值

图2 组1、2、3样本经过脱敏处理1个月后的AFM图像
三、扫描电子显微镜结果
图3显示的是组1、2、3样本经过脱敏处理1个月后选取的SEM图像。使用生物活性玻璃处理后(图3-A,3-B)呈现出类似于玷污层的较均匀的颗粒状牙本质表面,极少数牙本质小管仍开放但管径已显著缩小,呈现出最佳的小管封闭效果。 使用冷酸灵(图3-C,3-D)和高露洁抗敏(图3-E,3-F)处理后的表面牙本质小管凸度降低、管径缩小,可见小颗粒沉积在牙本质表面、部分封闭牙本质小管,高露洁组封闭效果更明显。蒸馏水组(图3-G,3-H)和对照组(图3-I,3-J)呈现出扩大的牙本质小管径,其中蒸馏水组样本表面可见少量牙本质碎屑,部分进入管内。

图3 组1、2、3样本经过脱敏处理1个月后选取的SEM图像
讨 论
治疗牙本质过敏症的方法可分为物理和化学两类[22]。化学方法包括氯化锶、氟化钠、福尔马林溶液[23]、草酸铁[24]、氢氧化钙、氢氧化锡、草酸钙、磷酸铁[25]以及硝酸钾[26];物理方法包括释放氟的树脂[27]和激光[28~30]。这些材料脱敏效果理想,但维持时间相对较短。日常刷牙、咀嚼以及口内唾液和酸性饮食的接触,会使这些材料逐渐磨损或溶解,最终失去封闭效果[6]。因此,评价治疗牙本质过敏症的材料时,必须将其长期脱敏效果考虑在内。根据解释牙本质过敏症疼痛的液体动力学理论[4,31],生物活性玻璃的小管封闭能力成为近年来研究关注的热点。
电化学阻抗法是一种灵敏且非破坏性的方法,可用于评价牙本质小管的封闭情况。它已经被用于评价酸引起的牙本质渗透性改变[19,32]、树脂-牙本质粘结的有效性[33]、树脂复合物修复体的微渗漏[34]以及根管治疗后临时性修复体的封闭[35]。采用电化学阻抗法测量牙本质盘渗透性需先浸泡样本使电解液渗入从而导电。所获得的电化学阻抗波常与样本微结构的改变有关,牙本质样本的电化学阻抗值取决于样本两侧半腔内的电势差,以及贯穿牙本质小管的电流[19]。牙本质小管的封闭会降低液压传导性、增加电阻抗值,即小管开放多阻抗值低、小管开放少阻抗值高[19]。
电化学阻抗结果表明含有生物活性玻璃的脱敏剂处理后样本的渗透性最低。处理第2天,所有样本的EIS值均有上升趋势,其中生物活性玻璃组上升最显著,提示生物活性玻璃与冷酸灵和高露洁相比能迅速起效,见表2。作为一种生物相容性材料,生物活性玻璃能在体内形成磷灰石晶体封闭开放的牙本质小管,抑制温度或触觉刺激的传导从而缓解或消除牙本质过敏症。磷灰石的形成是通过一系列相互依赖的序列反应而得到:生物活性玻璃逐渐溶解后表面形成Si-OH基团[11]、随后聚合生成Si-O-Si基团、无定形沉积物吸附于玻璃表面后晶化为碳酸羟基磷灰石层(hydroxy carbonate apatite,HCA)、组织液中的生物成分(胶原纤维等)吸附在HCA层上、巨噬细胞及成骨细胞的附着及活动、基质的生成及结晶化,最终形成磷灰石[36]。
冷酸灵的有效成分为氯化锶和硝酸钾,两者都被广泛应用于牙膏治疗牙本质过敏症。由于钾离子能够降低敏感牙齿的神经兴奋性,另体外实验证实锶盐能增加脱矿牙本质的矿物密度[37]、也能与氟化物协同起效[38]。然而,本实验中冷酸灵处理后牙本质渗透性的改变与空白对照组无统计学差异(P=0.29)。研究证实含有8%精氨酸和1450ppm氟化物的高露洁脱敏牙膏能显著缓解牙本质过敏症[39]。这种Pro-Argin配方的牙膏能有效地封闭牙本质小管,含有精氨酸的牙本质沉积物能有效低抵抗酸蚀[40]。在本体外实验中,生物活性玻璃组和高露洁组所造成的牙本质渗透性改变无统计学差异(P=0.32)。
本实验证实,蒸馏水组和空白对照组在经过EDTA脱矿和人工唾液浸泡后,都能在短期(2天)内使牙本质的渗透性降低,随后升高,见表2。曾有研究证实使用蒸馏水刷牙能在牙本质小管内保留部分玷污层残余物[15],本实验中,纯可乐浸泡样本后使用去离子水刷牙也能在牙本质小管内保留部分玷污层残余物。而空白对照组没有观察到显著的形态学改变[9]。人工唾液能溶解牙本质小管内的颗粒物,增加牙本质的渗透性[10];而再矿化时,人工唾液中矿物盐成分可能在牙本质表面沉积晶体,降低牙本质的渗透性[7]。牙本质渗透性的改变除与脱敏处理有关,也能反应脱矿和再矿化的循环过程。
原子力显微镜不止能提供样本表面的形态改变,同时能提供精确的定量信息,诸如尺寸、粗糙度和周期[41]。与扫描电镜相比,原子力显微镜具备伪影更少,无需物理或化学固定、样本表面无需涂层来获得更好的对比度和导电性等优点。但是,和扫描电子显微镜相比,原子力显微镜的缺点在于成像范围太小,速度慢,受探头的影响太大[20,21]。因此,本实验中既采用了原子力显微镜观察小管的封闭情况,又采用了扫描电子显微镜获得成像范围更大的图像来观察样本的表面形态。观察生物样本时,采用轻敲模式有助于避免探针摩擦造成的表面损伤[42]。由于本实验中使用的精细抛光粉末直径(1.00μm,0.30μm和0.05μm)小于人年青第三恒磨牙的平均牙本质小管直径(1.21±0.08μm)[43],必须将样本放入蒸馏水中超声振荡30分钟后再进行原子力显微镜观察。处理1个月后,组1、2、3牙本质小管平均直径分别为 817±156μm,1231±277μm,944±230μm。组2的小管径显著大于组 1(P<0.05)或组 3(P<0.05),差异有统计学意义。与人年青第三恒磨牙的平均牙本质小管径相比,组1和组3的管径明显缩小。
三种脱敏剂都能不同程度地长期降低牙本质小管渗透性。日常刷牙所沉积在牙本质小管内的材料能在1个月内有效低抵抗酸性溶液和人工唾液的浸泡。生物活性玻璃能够迅速降低牙本质的渗透性,降低程度比高露洁高,但不具有明显的统计学差异(P=0.32),两者与冷酸灵相比都有统计学差异(P<0.05)。因此,无效假设仅对高露洁成立。
体外实验的局限性在于活髓牙与牙本质模型存在一定差异,活髓牙中牙本质小管内充满牙本质小管液并存在液体静压力(14.1cm H2O),因此推测对活髓牙牙髓压力的存在也可能影响脱敏剂封闭牙本质小管的长期有效性。因此,还需进一步临床实验来证实本体外实验研究结果。
1 Addy M.Dentine hypersensitivity:definition,prevalence,distribution and aetiology.In:Addy M,Embery G,Edgar W,Orchardson R,eds.Tooth wear and sensitivity.London:Martin-Dunitz.2000.239-248.
2 Addy M,Dowell P.Dentine hypersensitivity-review.Clinical and in vitro evaluation of treatment agents.J Clin Periodontol,1983,10(4):351-363.
3 Pashley DH.Mechanisms of dentine sensitivity.Dent Clin N Am,1990,34(2):449-473.
4 Brännström M,Linden LA,Johnson G.Movement of dentinal and pulpal fluid caused by clinical procedures.J Dent Res,1968,47(5):679-682.
5 Pashley DH.Dentine permeability,dentine sensitivity and treatment through tubule occlusion.J Endod,1986,12(10):465-474.
6 Lee BS,Chang CW,Chen WP,et al.In vitro study of dentin hypersensitivity treated by Nd:YAP laser and bioglass.Dent Mater,2005,21(6):511-519.
7 Suge T,KawasakiA,Ishikawa K,etal.Ammonium hexafluorosilicate elicits calcium phosphate precipitation and shows continuous dentine tubule occlusion.Dent Mater,2008,24(2):192-198.
8 Sauro S,Watson TF,Thompson I.Dentine desensitization induced by prophylactic and air-polishing procedures:An in vitro dentine permeability and confocal microscopy study.J Dent,2010,38(5):411-422.
9 Prati C,Montebugnoli L,Suppa P,et al.Permeability and morphology of dentine after erosion induced by acidic drinks.J Periodontol,2003,74(4):428-436.
10 Gandolfi MG,Silvia F,Pashley DH,et al.Calcium silicate coating derived from Portland cement as treatment for hypersensitive dentine.J Dent,2008,36(8):565-578.
11 Hench LL,Paschall HA.Direct chemical bond of bioactive glass-ceramic materials to bone and muscle.J Biomed Mater Res,1973,7(3):25-42.
12 Hench LL.The story of bioglass.J Mater Sci:Mater Med,2006,17(11):967-978.
13 Wilson J,Low SB.Bioactive ceramics for periodontal treatment:comparative studies in the patus monkey.J Appl Biomater,1992,3(2):123-129.
14 Lovlace TB,Melloning JT,Meffert RM,et al.Clinical evaluation of bioactive glass in the treatment of periodontal osseous defects in humans.J Periodontol,1999,26(7):421-428.
15 Wang Z, Sa Y, Sauro S, et al.Effect of desensitising toothpastes on dentinal tubule occlusion:A dentine permeability measurement and SEM in vitro study.J Dent,2010,38(5):400-410.
16 Kuo TC,Lee BS,Kang SH,et al.Cytotoxicity of DP-bioglass paste used for treatment of dentin hypersensitivity.J Endod,2007,33(4):451-454.
17 Bakry AS,Tamura Y,Otsuki M,et al.Cytotoxicity of 45S5 bioglass paste used for dentine hypersensitivity treatment.J Dent,2011,39(9):599-603.
18 Wilson J, Pigotl GH, Schoen FJ, et al.Toxicology and biocompatibility of bioglasses.J Biomed Mater Res,1981,15(6):805-817.
19 Pradelle-Plasse N,Wenger F,Colon P.Effect of conditioners on dentine permeability using an impedance method.J Dent,2002,30(5):251-257.
20 Eliades G,Vougiouklakis G,Palaghias G.Effect of dentine primers on the morphology,molecular composition and collagen conformation of acid-demineralized dentine in situ.Dent Mater,1999,15(5):310-317.
21 Silikas N, Watts DC, England KER, et al.Surface fine structure of treated dentine investigated with tapping mode atomic force microscopy (TMAFM).J Dent, 1999,27(2):137-144.
22 Scherman A,Jacobsen PL.Managing dentine hypersensitivity:what treatment to recommend to patients.J Am Dent Assoc,1992,123(4):57-61.
23 Kishore A,Mehrotra KK,Saimbi CS.Effectiveness of desensitizing agents.J Endod,2002,28(4):34-35.
24 Gillam DG,Khan N,Mordan NJ,et al.Scanning electron microscopy(SEM)investigation of selected desensitizing agents in the dentine disc model.Endod&Dent Traumatol,1999,15(5):198-204.
25 Jain P,Vargas MA,Denehy GE,et al.Dentine desensitizing agents:SEM and X-ray microanalysis assessment.Am J Dent,1997,10(4):21-26.
26 Nagata T,Ishida H,Shinohara H,et al.Clinical evaluation of a potassium nitrate dentifrice for the treatment of dentinal hypersensitivity.J Clin Periodontol,1994,21(3):217-221.
27 Tavares M,Depaola PF,Soparkar P.Using a fluoride-releasing resin to reduce cervical sensitivity.J Am Dent Assoc,1994,125(10):1337-1342.
28 Lan WH,Liu HC.Sealing of human dentinal tubules by Nd:YAG laser.J Dent Res,1995,13(5):329-333.
29 Zhang C,Matsumoto K,Kimura Y,et al.Effect of CO2laser in treatment of cervical dentinal hypersensitivity.J Endod,1998,24(9):595-597.
30 Schwarz F,Arweiler N,Georg T,et al.Desensitizing effects of an Er:YAG laser on hypersensitive dentine.A controlled,prospective clinical study.J Clin Periodontol, 2002, 29(3):211-215.
31 Brännström M, Garberoglio R.The dentinal tubules and the odontoblast processes:a scanning electron microscopic study.Acta Odontolog Scand,1972,30(3):291-311.
32 Xu Z,Neoh KG,Kishen A.Monitoring acid-demineralization of human dentine by electrochemical impedance spectroscopy(EIS).J Dent,2008,36(12):1005-1012.
33 Sword J,Pashley DH,Foulger S,et al.Use of electrochemical impedance spectroscopy to evaluate resin-dentine bonds.J Biomed Mater Res Part B Appl Biomater, 2008, 84(2):468-477.
34 Pradelle-Plasse N,Wenger F,Picard B,et al.Evaluation of microleakage of composite resin restorations by an electrochemical technique:the impedance methodology.Dent Mater,2004,20(5):425-434.
35 Jacquot BM,Panighi MM,Steinmetz P,et al.Evaluation of temporary restorations’microleakage by means of electrochemical impedance measurements.J Endod,1996,22(11):586-589.
36 Curtis AR,West NX,Su B.Synthesis of nanobioglass and formation of apatite rods to occlude exposed dentine tubules and eliminate hypersensitivity.Acta Biomater, 2010, 6(9):3740-3746.
37 Gedalia I,Brayer L,Kalter N,et al.The effect of fluoride and strontium application on dentine:in vivo and in vitro studies.J Periodontol,1978,49(2):269-272.
38 Thuy TT,Nakagaki H,Kato K,et al.Effect of strontium in combination with fluoride on enamel remineralization in vitro.Arch Oral Biol,2008,53(11):1017-1022.
39 Que K,Fu Y,Lin L,et al.Dentine hypersensitivity reduction of a new toothpaste containing 8.0%arginine and 1450 ppm fluoride:An 8-week clinical study on Chinese adults.Am J Dent,2010,23(3):28A-35A.
40 Lavender SA,Petrou I,Heu R,et al.Mode of action studies on a new desensitizing dentifrice containing 8.0%arginine,a high cleaning calcium carbonate system and 1450 ppm fluoride.Am J Dent,2010,23(3):14A-19A.
41 Sanches RP,Otani C,Damião AJ,et al.AFM characterization of bovine enamel and dentine after acid-etching.Micron,2009,40(4):502-506.
42 Kubinek R,Zapletalová Z,Vújtek M,et al.Sealing of open dentinal tubules by laser irradiation:AFM and SEM observations of dentine surfaces.J Mol Recog,2007,20(6):476-482.
43 Xu C,Wang Y.Chemical composition and structure of peritubular and intertubular human dentine revisited.Arch Oral Biol,2012,57(4):383-391.
