凡纳滨对虾ATG6基因克隆及其在WSSV感染中的表达
2018-05-03褚吉兴孟凡娟张广成耿绪云王丽燕
褚吉兴,孟凡娟,张广成,耿绪云,王丽燕*
(1.天津师范大学生命科学学院,天津市动植物抗性重点实验室,天津 300387;2.天津市水产研究所,天津 300221)
凡纳滨对虾(Litopenaeusvannamei)作为我国重要的对虾养殖品种,具有极高的经济价值和食用价值。但是,近年来对虾病害的发生使对虾养殖业遭受了重大经济损失,尤以病毒性疾病发生最为严重[1]。其中,白斑综合征病毒(white spot syndrome virus,WSSV)自 1992 年暴发以来就成为我国及东南亚地区对虾养殖业主要病毒性病原之一,目前尚无有效防治策略。
越来越多的研究表明,自噬在病毒侵染增殖中发挥了重要作用[2-7]。自噬作为一种溶酶体降解途径,是实现细胞内物质与能量平衡的一种重要的细胞学过程。在酵母中,已经有超过36种自噬相关基因(autophagy related gene,ATG)被鉴定,而这些基因中的大部分都在哺乳动物中存在相应的同源基因[8-9]。自噬相关基因参与到调控自噬机制的整个过程当中,包括自噬泡的形成、自噬体膜的延伸、自噬小体与溶酶体融合以及自噬溶酶体的降解等[9-12]。研究发现,自噬可成功地抑制胞内病毒的复制及增殖,如Sindbis病毒和烟草花叶病毒感染宿主时[13];有的病毒通过抑制自噬促进自身增殖,如I型单纯疱疹病毒和I型人类免疫缺陷病毒[14-16];另有一些昆虫类病毒如黄病毒已进化出相关机制调控Akt-mTOR通路,从而可以逃逸宿主自噬免疫防御达到增殖的目的[17-19]。西米利奇森林病毒的增殖则会被宿主自噬水平的增强所抑制[20-21]。可见,不同的病毒与宿主自噬的相互作用关系亦不一样。
目前针对细胞自噬展开的研究越来越多,但是对虾自噬研究仍鲜见报道。笔者首次对凡纳滨对虾自噬相关基因LvATG6进行了克隆,并对其组织表达特征和在WSSV感染后的表达情况进行了分析,以期为对虾自噬与病毒作用关系的研究奠定基础,为对虾免疫和病毒防治策略的研究开辟新的思路。
1 材料与方法
1.1材料
1.1.1试验动物。试验所用的凡纳滨对虾购自天津恒兴富民水产养殖合作社,体重(10.2±1.0) g,体长(10.0±1.6)cm。试验前将其置于循环水族缸内暂养,养殖温度为25 ℃,每天喂食1次,使其适应新环境,选取健康有活力的对虾用于试验。用于刺激对虾的WSSV病毒悬液参照文献[22]制备。
1.1.2试剂。TRIzolTMReagent购自Invitrogen公司;M-MLV反转录试剂盒购自Promega公司;质粒提取试剂盒及琼脂糖凝胶回收试剂盒购自上海生工生物公司;pMD18-T载体连接试剂盒购自大连宝生物公司;DNA Marker、DH5α感受态细胞购自北京天根生物公司;其他药品均为国产分析纯;引物序列由华大基因公司合成,引物序列见表1。
1.1.3仪器。PCR仪(Applied Biosystems)、GelDocTMXR成像系统(Bio-Rad)、Nano Drop 2000分光光度计(Thermo)、电泳仪(Bio-Rad)、台式冷冻离心机(Eppendorf)。
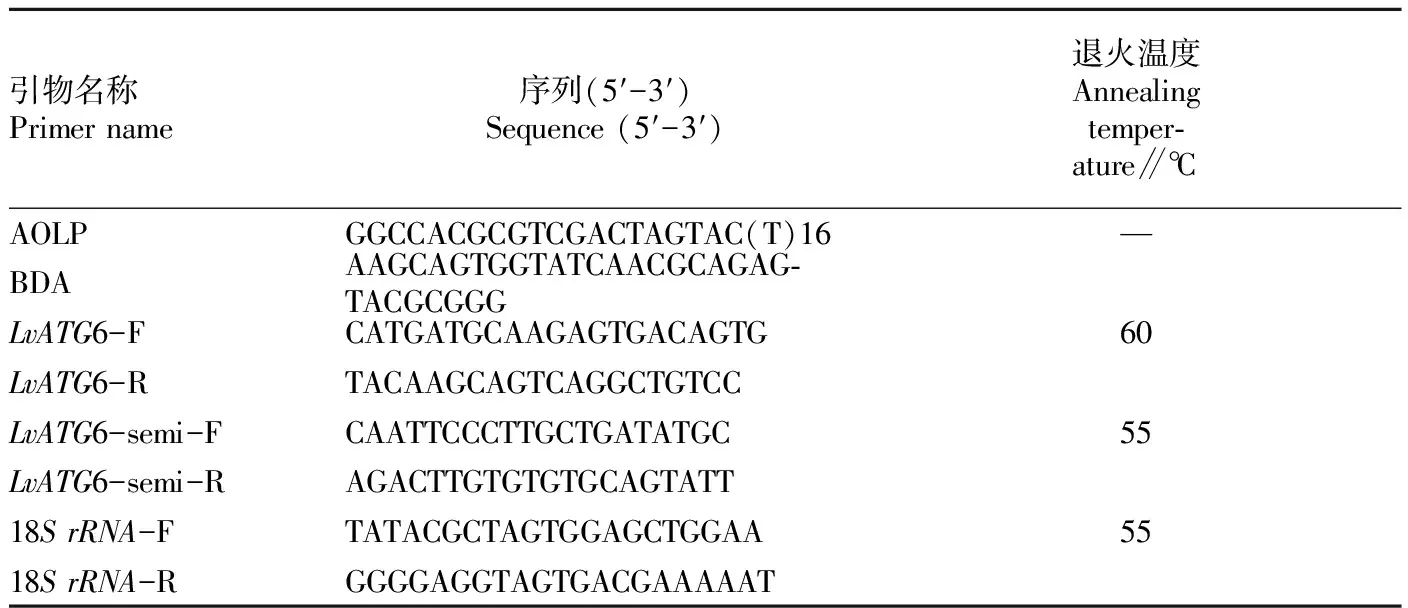
表1 试验所用引物序列信息
1.2方法
1.2.1凡纳滨对虾组织样品制备。选取7尾健康有活力的凡纳滨对虾,分别取鳃、肝胰脏、心脏、血细胞、前肠、中肠、后肠、表皮、神经、肌肉,冻存于液氮中备用。
另取30尾健康有活力的凡纳滨对虾,注射10 μL病毒悬液[22]。将感染病毒后的对虾置于水温为25 ℃的循环水族缸内养殖,分别在注射病毒后的6、12、24、36、48 h,各取5尾对虾的鳃和肝胰脏组织分别冻存于液氮中备用。
1.2.2凡纳滨对虾总RNA提取及cDNA合成。按照提取总RNA的TRIzol试剂盒说明书分别提取正常凡纳滨对虾及感染WSSV不同时间各组织总RNA,利用Nano Drop 2000分光光度计以及琼脂糖凝胶电泳对RNA进行纯度和定量分析。样品检测合格后,取1 μg RNA作为反转录反应模板,按照反转录试剂盒说明书,以引物AOLP、BDA为接头引物合成cDNA后用于基因全长克隆,使用随机引物并以感染病毒后对虾组织总RNA为模板合成cDNA用于半定量PCR检测。
1.2.3LvATG6基因克隆。根据转录组序列设计凡纳滨对虾自噬相关基因ATG6全长特异性引物LvATG6-F、LvATG6-R,以“1.2.2”中合成的cDNA为模板进行PCR反应。25 μL的反应体系中包含无酶水8.5 μL、LvATG6-F引物1 μL、LvATG6-R引物1 μL、2×TaqPCR Master Mix 12.5 μL、鳃cDNA 2 μL。反应条件为94 ℃预变性4 min;94 ℃变性50 s,60 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min,4 ℃冷却。产物在1.0%的琼脂糖凝胶上进行检测,切胶回收后与pMD18-T载体进行16 ℃连接,转化DH5α后挑取单菌落送至苏州金唯智生物公司进行测序。
1.2.4LvATG6基因序列的生物信息学分析。使用在线网址(http://web.expasy.org/compute_pi)预测等电点和分子量;应用NCBI的CDD数据库(http://www.ncbi.nlm.gov/Structure/cdd/wrpsb.cgi)分析基因编码氨基酸的结构域特征。应用在线翻译软件(http://web.expasy.org/translate/)对测序结果进行氨基酸翻译;应用Clustal W与MEGA 5.0.1对不同物种的ATG6蛋白比对和分析,构建系统进化树。
1.2.5LvATG6组织表达分析。 半定量PCR检测目的基因差异表达所用组织为正常凡纳滨对虾鳃、肝胰脏、心脏、血细胞、前肠、中肠、后肠、表皮、神经、肌肉,以18SrRNA-F、18SrRNA-R为引物进行PCR,25 μL的反应体系中包含无酶水8.5 μL、18SrRNA-F引物1 μL、18SrRNA-R引物1 μL、2×TaqPCR Master Mix 12.5 μL、各组织cDNA 2 μL。反应条件为94 ℃预变性4 min;94 ℃变性50 s,55 ℃退火30 s,72 ℃延伸1 min,26个循环;72 ℃总延伸10 min,4 ℃冷却。产物在1.0%琼脂糖凝胶上进行检测,调整各组织模板加入量,使18SrRNA引物扩增出来的条带亮度一致,记录各组织模板的加入量。按照相同条件,换用LvATG6-semi-F、LvATG6-semi-R引物进行PCR反应,扩增产物于1.0%琼脂糖凝胶上进行检测。
1.2.6WSSV侵染后LvATG6的组织表达分析。以WSSV感染不同时间的鳃和肝胰脏组织cDNA为模板进行半定量PCR,25 μL的反应体系中包含无酶水8.5 μL、LvATG6-semi-F引物1 μL、LvATG6-semi-R引物1 μL、2×TaqPCR Master Mix 12.5 μL、各组织cDNA根据调整量添加。PCR反应同“1.2.5”中条件。产物在1.0%琼脂糖凝胶上进行检测。18SrRNA作为内参。
2 结果与分析
2.1LvATG6基因克隆及序列分析该研究利用PCR技术克隆获得了LvATG6 cDNA全长(图1),共1 275 bp,编码424个氨基酸,蛋白分子量为51.5 kD,等电点为5.47,含有1个自噬相关结构域——APG6结构域。多序列比对结果显示(图2),LvATG6编码的蛋白与节肢动物门其他物种自噬相关蛋白具有很高的序列相似性,其中与臭虫、白蚁ATG6基因编码的自噬相关蛋白序列相似性高达59%。利用MEGA5.0.1软件的邻接法(Neighbor-Joining,NJ)构建系统进化树,结果显示(图3),LvATG6蛋白独自一支,但与臭虫的亲缘关系较近。
2.2LvATG6的组织表达特征运用半定量PCR技术检测LvATG6基因在凡纳滨对虾10种组织中的表达情况,结果显示(图4),LvATG6在检测的凡纳滨对虾10种组织中均有表达,在前肠、中肠、后肠中的表达量最高。
2.3WSSV侵染后LvATG6的组织表达特征利用半定量PCR技术,分别检测LvATG6感染WSSV后6、12、24、36、48 h在鳃和肝胰脏组织中的表达变化,结果显示(图5),在病毒感染6和12 h时,鳃组织中的LvATG6表达量最高,而在24、36和48 h时表达量较低;在病毒感染6 h时,LvATG6在肝胰脏组织中表达量很低,而在12~48 h时出现显著的基因表达上调。
3 讨论
自噬过程普遍存在于真核生物中,不仅可维持细胞内自身物质平衡,在病原感染方面发挥的作用也越来越被重视[23-24],其发生的过程严格受到自噬相关基因调控。
该研究成功获得了凡纳滨对虾自噬相关基因LvATG6的cDNA全长,该基因编码的蛋白含有1个自噬相关结构域——APG6结构域,该结构负责协调自噬体的形成。生物信息学分析发现,LvATG6基因与节肢动物门其他物种该基因具有较高的同源性,其中与臭虫、白蚁ATG6基因编码的自噬相关蛋白序列相似性高达59%,说明LvATG6基因与已被报道的其他物种的ATG6基因在氨基酸组成和潜在功能上无较大差异,是一种在各物种中比较保守的自噬相关蛋白。

注:黑色方框为起始密码子,*表示终止密码子;红色框内为APG6结构域Note:The initiation codon(ATG) was boxed in black,the stop codon was marked with an asterisk,the APG6 domain was boxed in red图1 凡纳滨对虾LvATG6 cDNA全长及编码的氨基酸序列Fig.1 Full-length of L.vannamei ATG6 cDNA and deduced amino acid sequence

注:臭虫(XP_014247219.1);传粉榕小蜂(XP_011496307.1);麦芽蜂(XP_015589297.1);芦蜂(XP_017879818.1);芜菁叶蜂(XP_012258889.1);白蚁(PNF22772.1)Nnote:Cimex lectularius(XP_014247219.1);Ceratosolen solmsi marchali(XP_011496307.1);Cephus cinctus(XP_015589297.1);Ceratina calcarata(XP_017879818.1);Athalia rosae(XP_012258889.1);Cryptotermes secundus(PNF22772.1)图2 凡纳滨对虾LvATG6与其他物种ATG6的氨基酸序列比对分析Fig.2 Analysis of amino acid sequence alignment based on LvATG6 gene of L.vannamei and other species ATG6
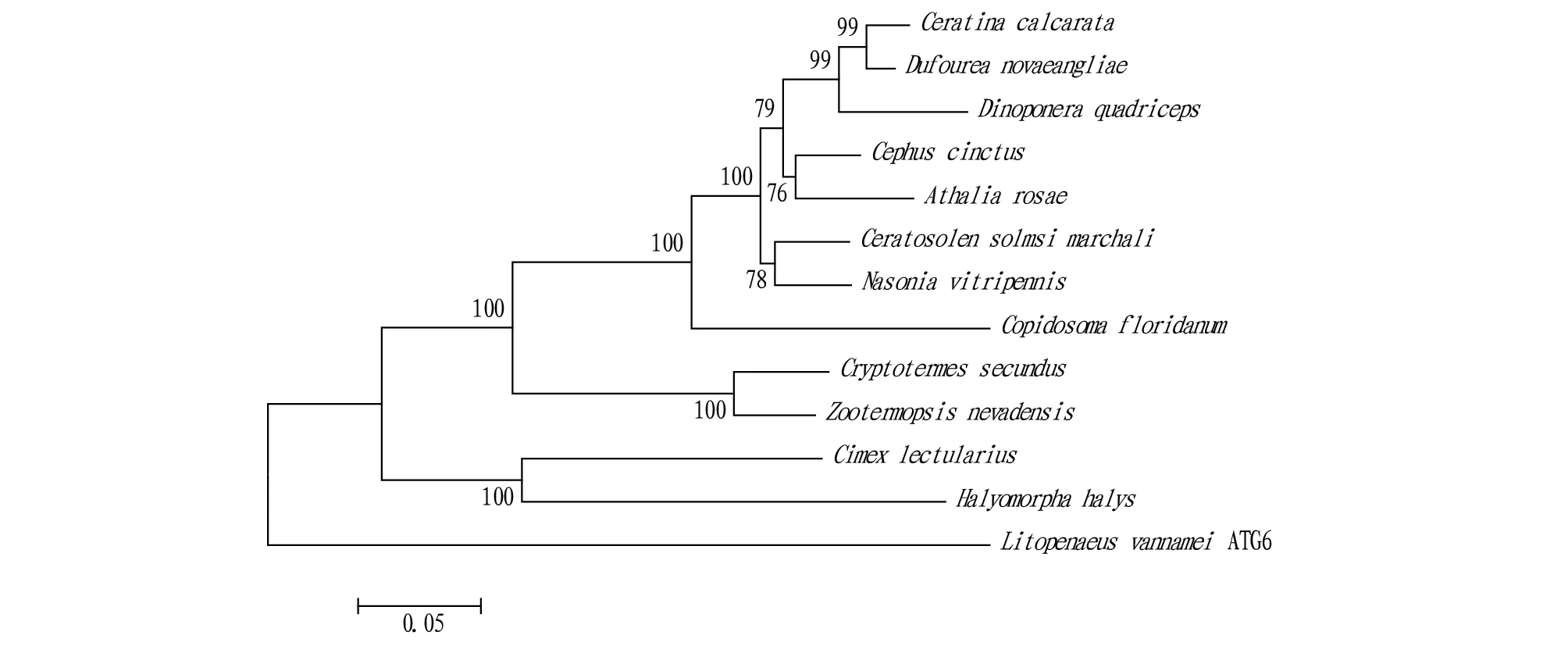
注:麦芽蜂(XP_015589297.1);芜菁叶蜂(XP_012258889.1);芦蜂(XP_017879818.1);蜂类(XP_015439892.1);传粉榕小蜂(XP_011496307.1);丽蝇蛹集金小蜂(XP_001601439.1);白蚁(PNF22772.1);臭虫(XP_014247219.1);茶翅蝽(XP_014273603.1);子弹蚁(XP_014479707.1);内华达古白蚁(XP_021921721.1);多胚跳小蜂(XP_014219117.1)Note:C.cinctus(XP_015589297.1);A.rosae(XP_012258889.1);C.calcarata(XP_017879818.1);Dufourea novaeangliae(XP_015439892.1);C.solmsi marchali(XP_011496307.1);Nasonia vitripennis(XP_001601439.1);C.secundus(PNF22772.1);Cimex lectularius(XP_014247219.1);Halyomorpha halys(XP_014273603.1);Dinoponera quadriceps(XP_014479707.1);Zootermopsis nevadensis(XP_021921721.1);Copidosoma floridanum(XP_014219117.1)图3 LvATG6与其他物种ATG6之间的进化树分析Fig.3 The phylogenetic tree of LvATG6 with ATG6s from other species

注:1.心;2.肝胰脏;3.鳃;4.血细胞;5.前肠;6.中肠;7.后肠;8.表皮;9.神经;10.肌肉Note:1.heart;2.Hepatopancreas;3.gills;4.blood cells;5.foregut;6.midgut;7.hindgut;8.skin;9.nerves;10.muscles图4 LvATG6在凡纳滨对虾不同组织中的分布Fig.4 Expression of LvATG6 of L.vannamei in different tissues
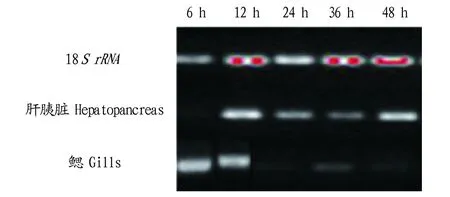
图5 WSSV感染不同时间LvATG6在凡纳滨对虾鳃和肝胰脏组织中的表达变化Fig.5 Expression of LvATG6 in the hepatopancreas and gills of L.vannamei after WSSV infection
LvATG6组织表达研究显示,LvATG6在检测的10种对虾组织中均有表达,表明自噬是一种在对虾机体细胞中广泛存在的现象,不具有组织特异性,但其表达量在不同组织中有差异,在鳃和肠道组织中的表达量均较高。鳃和肠道组织是对虾重要的免疫器官,也是WSSV入侵的靶器官[25]。自噬相关基因LvATG6的高表达暗示自噬在鳃和肠道免疫中可能也发挥了重要作用。
为进一步揭示自噬相关蛋白LvATG6及自噬在WSSV感染中的作用,笔者检测了WSSV感染后,凡纳滨对虾LvATG6基因在对虾鳃和肝胰脏组织中的表达变化,发现LvATG6在病毒感染不同时间表达差异显著,在WSSV的靶组织鳃中LvATG6表达量呈现先上升后下降的趋势,分析推测病毒侵染早期调控或影响了自噬相关基因LvATG6及细胞自噬,宿主细胞为避免病毒对自身的利用和增殖,感染后期相对地下调LvATG6表达,对抗病毒的侵染增殖[26]。
目前,自噬在病毒侵染增殖中的作用主要有3个方面[14,27-32]:①自噬抑制病毒增殖。Shelly等[27]使用对果蝇无致病性的VSV分别感染Atg-1和Atg-5沉默的果蝇后,试验组的果蝇大量死亡而且病毒滴度显著高于对照组,表明在果蝇体内自噬对水泡性口炎病毒的感染起重要的拮抗作用。②病毒劫持自噬。人疱疹病毒可以通过抑制自噬的上游激活信号通路、影响自噬相关蛋白的功能、干扰自噬的调节机制以及抑制自噬相关的免疫应答等方式来破坏自噬、阻滞自噬的清除作用[28]。单纯疱疹病毒I型的神经毒性蛋白可以结合Beclin 1而阻止自噬过程的发生[14],除以Beclin 1为靶点外,HSV-1的ICP34.5蛋白还能通过招募 PP1α 使 PKR下游蛋白eIF2α去磷酸化抑制自噬体的形成。③自噬促进病毒增殖。鼠肝炎病毒和SARS病毒感染之后可以在自噬泡上发现病毒蛋白;马动脉炎病毒的复制和转录的复合体在自噬泡上被发现;轮状病毒感染后,病毒复制相关蛋白NSP4可以从未成熟的双层膜小泡中移行至内质网中,并且与NSP5及LC3Ⅱ有共定位现象[29]。黄病毒科的登革热病毒可以诱导自噬的发生,而且促进自噬有助于病毒的复制[30];柯萨奇病毒敲除Atg7基因后,病毒的复制水平显著下降以及成熟病毒粒子的释放受到抑制[31];在新城疫病毒感染神经胶质瘤细胞的试验中发现使用RNAi干扰分别沉默Atg5和Beclin1后,病毒滴度都有显著下降的现象[32];口蹄疫病毒在感染时也发现非结构蛋白 2B、2C 和3A 与 LC3 共定位而结构蛋白 VP1 与 Atg-5 共定位的现象,并且刺激自噬有能够增强病毒的水平[33]。可见自噬功能的发挥是具有病毒种类特异性的。因此,了解自噬与病毒感染之间的关系对控制病害的传播意义重大。
总之,笔者通过克隆获得了LvATG6 cDNA全长,对其组织表达特征进行了分析,并对LvATG6在WSSV感染中的作用进行了研究,研究结果表明对虾自噬在WSSV侵染增殖中发挥了一定作用。但是,对虾自噬发生究竟是促进病毒增殖,还是抑制病毒增殖,有待于深入研究。
[1] THITAMADEE S,PRACHUMWAT A,SRISALA J,et al.Review of current disease threats for cultivated penaeid shrimp in Asia[J].Aquaculture,2016,452:69-87.
[2]SHINTANI T,KLIONSKY D J.Autophagy in health and disease:A double-edged sword[J].Science,2004,306(5698):990-995.
[3] LEVINE B,KROEMER G.Autophagy in the pathogenesis of disease[J].Cell,2008,132(1):27-42.
[4] DERETIC V.Autophagy in infection[J].Current opinion in cell biology,2010,22(2):252-262.
[5] 耿盼盼.轮状病毒编码小RNA分子1755激活细胞自噬及调控自身复制的机制[D].北京:北京协和医学院,2017.
[6] 康恺,林鸷,高海慧,等.猪瘟病毒促进细胞自噬并利于病毒增殖[J].畜牧兽医学报,2014,45(9):1481-1487.
[7] 赵俊.细胞自噬在巨细胞病毒感染复制中的作用研究[D].长沙:中南大学,2014.
[8] REGGIORI F.Membrane origin for autophagy[J].Current topics in developmental biology,2006,74:1-30.
[9] KLIONSKY D J.Autophagy:From phenomenology to molecular understanding in less than a decade[J].Nature reviews molecular cell biology,2007,8(11):931-937.
[10] KLIONSKY D J,EMR S D.Autophagy as a regulated pathway of cellular degradation[J].Science,2000,290(5497):1717-1721.
[11] LIN L T,DAWSON P W,RICHARDSON C D.Viral interactions with macroautophagy:A double-edged sword[J].Virology,2010,402(1):1-10.
[12] TANIDA I.Autophagosome formation and molecular mechanism of autophagy[J].Antioxid redox signal,2011,14(11):2201-2214.
[13] LIANG X H,KLEEMAN L K,JIANG H H,et al.Protection against fatal Sindbis virus encephalitis by beclin,a novel Bcl-2-interacting protein[J].Journal of virology,1998,72(11):8586-8596.
[14] ORVEDAHL A,ALEXANDER D,TALLCZY Z,et al.HSV-1 ICP34.5 confers neurovirulence by targeting the Beclin 1 autophagy protein[J].Cell host microbe,2007,1(1):23-35.
[15] ALIREZAEI M,KIOSSES W B,FLYNN C T,et al.Disruption of neuronal autophagy by infected microglia results in neurodegeneration[J].PLoS One,2008,3(8):2906.
[16] KYEI G B,DINKINS C,DAVIS A S,et al.Autophagy pathway intersects with HIV-1 biosynthesis and regulates viral yields in macrophages[J].Journal of cell biology,2009,186(2):255-268.
[18] LIANG Q M,LUO Z F,ZENG J X,et al.Zika virus NS4A and NS4B proteins deregulate Akt-mTOR signaling in human fetal neuralstem cells to inhibit neurogenesis and induce autophagy[J].Cell stem cell,2016,19(5):663-671.
[19] MCLEAN J E,WUDZINSKA A,DATAN E,et al.Flavivirus NS4A-induced autophagy protects cells against death and enhances virus replication[J].Journal of biological chemistry,2011,286(25):22147-22159.
[20] JOUBERT P E,WERNEKE S W,DE LA CALLE C,et al.Chikungunya virus-induced autophagy delay scaspase-dependent cell death[J].Journal of experimental medicine,2012,209(5):1029-1047.
[21] LIANG X H,KLEEMAN L K,JIANG H H,et al.Protection against fatal Sindbis virus encephalitis by beclin,a novel Bcl-2-interacting protein[J].Journal of virology,1998,72(11):8586-8596
[22] SARATHI M,SIMON M C,AHMED V P I,et al.Silencing VP28 gene of white spot syndrome virus of shrimp by bacterially expressed dsRNA[J].Marine biotechnology,2008,10(2):198-206.
[23] YANG Z F,KLIONSKY D J.An overview of the molecular mechanism of autophagy[J].Current Topics in microbiol immunol,2009,335:1-32.
[24] HE C C,KLIONSKY D J.Regulation mechanisms and signaling pathways of autophagy[J].Annual review of genetics,2009,43(1):67-93.
[25] NG G,HUANG J.The significance of autophagy in cancer[J].Molecular carcinogenesis,2005,43(4):183-187.
[26] 刘伟,李方方,孙航军,等.TMV侵染烟草诱导寄主产生细胞自噬[J].植物病理学报,2016,46(6):759-766.
[27] SHELLY S,LUKINOVA N,BAMBINA S,et al.Autophagy is an essential component ofDrosophilaimmunity against vesicular stomatitis virus[J].Immunity,2009,30(4):588-598.
[28] 黄媛,刘兴楼,方峰.细胞自噬和人类疱疹病毒相互作用的研究进展[J].中国细胞生物学学报,2014,36(8):1207-1212.
[29] SIR D,OU J H.Autophagy in viral replication and patho-genesis[J].Molecules and cells,2010,29(1):1-7.
[30] HEATON N S,RANDALL G.Dengue virus and autophagy[J].Viruses,2011,3(8):1332-1341.
[31] MEYERS G,STOLL D,GUNN M.Insertion of a sequence encoding light chain 3 of microtubule-associated proteins 1A and 1B in a pestivirus genome:Connection with virus cytopathogenicity and induction of lethal disease in cattle[J].Journal of virology,1998,72(5):4139-4148.
[32] LI J H,LIU Y H,WANG Z K,et al.Subversion of cellular autophagy machinery by hepatitis B virus for viral envelopment[J].Journal of virology,2011,85(13):6319-6333.
[33] SHRIVASTAVA S,RAYCHOUDHURI A,STEELE R,et al.Knockdown of autophagy enhances the innate immune response in hepatitis C virus-infected hepatocytes[J].Hepatology,2011,53(2):406-414.
