3种药剂对猕猴桃花粉溃疡病菌灭菌及果实产量的影响
2018-05-02高贵田雷玉山杜莹琳
曹 凡 高贵田,2 -,2 雷玉山 - 杜莹琳 - 朱 丹
徐雅芬1XU Ya-fen1 张晓萍1ZHANG Xiao-ping1 李朝政1LI Chao-zheng1 张 鑫1ZHANG Xin1
猕猴桃(Actinidiachinensis)是“水果之王”“维C之冠”[1-2]。全球共有30多个国家栽培种植,其中中国猕猴桃栽培面积及产量最大,分别占全世界的53%和38%[3]。中国猕猴桃的主要产区分布在陕西、四川、安徽等地。绝大多数猕猴桃品种为功能性雌雄异株类型,人工授粉对猕猴桃果实大小及商品性、果肉颜色、产量等具有决定作用[4-6]。近年来,猕猴桃产区爆发毁灭性的细菌性溃疡病,其病原菌为丁香假单胞杆菌猕猴桃致病变种(Pseudomonassyringaepv.actinidiae,Psa)[6-8]。该病原菌致病性强、危害重、发病速度快、寄主范围广[9],一旦感染发病无有效药物防治,只有挖树毁园,严重威胁猕猴桃产业的发展。在猕猴桃花粉传播Psa的研究方面,Gallelli等[10]通过分子检测水平发现意大利的猕猴桃花粉中存在Psa;Stefani等[11]也从花粉中检测到Psa,并且认为花粉是导致猕猴桃溃疡病传播的重要原因;Vanneste等[12]通过检测认为新西兰目前大面积流行的PSA-V(强致病力菌株)病原菌是由于进口带菌花粉引起;Pattemore等[13]研究发现蜜蜂在Psa的传播过程中也起了较重要的作用。新西兰学者Everett等[14]通过热处理方式杀灭花粉中的Psa,该方法在菌悬液浓度为107CFU/mL,55 ℃ 处理3.1 min,对Psa的杀灭率可达90%,但花粉生活力下降可达50%,对花粉生活力影响较大。目前中国在杀灭花粉中Psa方面还未有报道。
目前,对Psa的田间防治多采用化学试剂对树干、枝条、土壤等部位进行预防,噻霉酮、可杀得等农药对Psa的杀灭也取得较好的效果[15-17]。二氧化氯(ClO2)被世界卫生组织和世界粮食组织列为A1级安全高效的消毒剂,杀菌速度快、副产物少、效率高,非常适合作果蔬表面的杀菌消毒剂[18-21]。ClO2具有较强的稳定性和氧化能力,对病毒、真菌、芽孢等具有杀灭作用[22-24],对猕猴桃表面微生物灰霉[25]、青霉[26]、链格孢[27]等多种微生物具有较强的杀菌作用。
本研究选用ClO2、噻霉酮、可杀得三千3种药剂来杀灭猕猴桃花粉中的Psa,并研究3种药剂对猕猴桃花粉生活力及猕猴桃果实产量、商品性的影响。建立既能杀死花粉中Psa又能保持花粉活力的消毒方法,为防止猕猴桃花粉传播Psa提供理论依据。
1 材料与方法
1.1 试验材料与仪器
丁香假单胞杆菌猕猴桃致病变种(Pseudomonassyringaepv.actinidiae,Psa):西北农林科技大学植保学院黄丽丽教授惠赠;
猕猴桃花粉:陕西佰瑞猕猴桃研究院有限公司;
ClO2缓释剂:有效缓释剂8%,天津市张大科技发展有限公司;
噻霉酮:陕西西大华特科技实业有限公司;
可杀得三千:上海杜邦农化有限公司;
蛋白胨:分析纯,北京澳博星生物技术有限责任公司;
硫代硫酸钠、NaOH、2,3,5-三苯基四唑氯化物(TTC):分析纯,天津市天力化学试剂有限公司;
立式压力蒸汽灭菌锅:LDZX-30KBS型,上海申安医疗器械厂;
恒温振荡器:THZ-C型,太仓市实验器械设备厂;
生物显微镜:麦克奥迪BA200型,杭州量子检测仪器有限公司。
1.2 Psa的培养
将Psa甘油菌接种在固体培养基上,于恒温培养箱24 ℃ 培养3 d,挑取单菌落接种在已灭菌的液体培养基中,于恒温振荡器中过夜培养12 h,菌悬液浓度为104CFU/mL。
1.3 3种药剂对猕猴桃花粉中Psa杀灭效果研究
将培养好的菌悬液均匀喷湿在猕猴桃花粉上,自然晾干。准确称取被Psa污染的花粉0.1 g于100 mL King’s B 液体培养基中(2.00 g蛋白胨、0.15 g MgSO4·7H2O、0.15 g K2HPO4、1 mL甘油),24 ℃、200 r/min过夜培养8~12 h,使菌悬液浓度为104CFU/mL。配置ClO2溶液浓度梯度为1.25,12.50,25.00 mg/L;噻霉酮溶液浓度梯度为125.0,312.5,625.0 μL/L;可杀得三千溶液浓度为12.50,31.25,62.50 mg/L。分别吸取菌悬液1 mL对应加入4 mL不同浓度的ClO2、噻霉酮、可杀得三千溶液于10 mL离心管,充分混匀,使ClO2溶液最终浓度分别达到1,10,20 mg/L;噻霉酮溶液最终浓度分别达到100,250,500 μL/L;可杀得三千溶液最终浓度分别达到10,25,50 mg/L。作用时间梯度为15,30,45,60 min 后,加入0.5 mL中和剂(5 g硫代硫酸钠晶体与20 mL 吐温80加热溶于1 000 mL磷酸缓冲液中),中和10 min,用无菌水代替ClO2溶液进行空白对照。吸取最终样液100 μL进行涂布,于24 ℃培养箱培养3 d,菌落计数法按式(1)计算:
(1)
式中:
c——杀灭率,%;
m1——对照组菌落数;
m2——试验组菌落数。
1.4 3种药剂对花粉生活力影响
准确称取0.1 g花粉,分别加入1 mL的ClO2溶液浓度为1,10,20 mg/L;噻霉酮溶液浓度为100,250,500 μL/L;可杀得三千溶液浓度为1,5,10 mg/L于10 mL离心管中,充分混匀,分别作用15,30,45 min后,加入0.5 mL中和剂,中和10 min,用无菌水代替ClO2溶液进行空白对照。以氯化三苯基四氯唑(TTC)染色法进行花粉活力的检测[28],取1滴最终样液于载玻片上,加1滴TTC染色剂染色后制成切片,在35 ℃烘箱中放置15 min,于光学显微镜下观察,显示红色即为有生活力的花粉。每个处理观察3个载玻片,每个载玻片观察3个视野,按式(2)计算:
(2)
式中:
c——花粉生活力,%;
m1——有生活力花粉数;
m2——总花粉数。
1.5 花粉消毒
花粉消毒处理液体授粉花粉溶液根据文献[29]修改如下:对照组0.5 g 花粉、0.1 g 硼砂、0.3 g 蔗糖、50 μL 柔水通、0.5 g 硫代硫酸钠、2.0 mL 吐温80、100 mL磷酸缓冲液。处理组根据对Psa的杀灭率及花粉生活力的试验结果,将ClO2、噻霉酮、可杀得三千分别加入花粉溶液(0.5 g 花粉、0.1 g 硼砂、0.3 g 蔗糖、50 μL 柔水通、100 mL磷酸缓冲液)中,使终浓度分别为10,500,10 mg/L,处理45,30,15 min后加入中和剂(0.5 g 硫代硫酸钠、2.0 mL吐温80)。花粉溶液需现配现用,超过2 h花粉逐渐失去活力,影响授粉效果。
1.6 授粉
以陕西省周至县九峰乡5年生猕猴桃种植园为试验田,选取健康、无病害、树势相近的“海沃德”猕猴桃果树16棵,4棵树为一试验组,根据对Psa的杀灭率及花粉生活力的试验结果,分别设置为ClO2处理组:ClO2溶液浓度10 mg/L,处理时间45 min;噻霉酮处理组:噻霉酮溶液浓度500 μL/L,处理时间30 min;可杀得三千处理组:可杀得三千溶液10 mg/L,处理时间15 min;对照组:不做任何处理。授粉前,将所有雌花在大蕾期进行套袋,防止蜜蜂授粉,盛花期解开套袋并进行授粉,授粉后立即再套袋,防止蜜蜂进行二次授粉。待猕猴桃花瓣自然脱落,解开套袋。进行人工授粉时,以清晨授粉为宜,以确保能够有充分的授粉率。
1.7 果实座果率、产量、种子数的统计
授粉结束1个月后,调查各树座果率。10月中旬采摘果实,调查猕猴桃产量、单果重、果实种子数。以每4棵树为一个试验组,根据每棵树的总产量和果实个数计算每棵树果实单果重。每棵树分别选取大、中、小3个大小不同的猕猴桃,于室温下放至变软,取1/4,去皮、芯,置于纱布中揉搓,将果渣倒入水中摇匀静置5 min,弃渣取出种子。按式(3)计算座果率。
(3)
式中:
c——座果率,%;
m1——座果数;
m2——授粉花朵数。
2 结果与分析
2.1 3种药剂对花粉中Psa的杀灭率
由表1可知,随着处理浓度的升高和时间的延长对Psa杀灭作用逐渐增大。当ClO2的浓度为10 mg/L,处理45 min 时,对Psa的杀灭率达到99%以上,ClO2的浓度为20 mg/L,处理45 min时,对Psa的杀灭率达到100%;噻霉酮的浓度为500 μL/L,处理30 min,对Psa的杀灭率达到99%以上,当处理时间为45 min时,杀灭率可达100%;可杀得三千的处理浓度为10 mg/L,时间为15 min时,杀灭率为99%以上,当处理时间为45 min时,杀灭率可高达100%。
2.2 3种药剂对花粉生活力的影响
花粉生活力是判断花粉是否具有授精能力的指标,环境温度、湿度对花粉生活力都有较大的影响[30]。由表2可知,用噻霉酮和可杀得三千处理花粉后,花粉的生活力随着药剂浓度的增大和作用时间的延长而降低;使用ClO2溶液处理花粉后,同一浓度,处理前30 min,花粉生活力逐渐下降,但处理后期,花粉生活力呈上升趋势。ClO2属于弱酸类化合物,与孢粉素不溶,花粉的外壁完整,对花粉生活力影响较小。可杀得三千是无机铜制剂,有效成分是氢氧化铜,属于碱制剂,能溶解孢粉素,破坏花粉外壁,降低花粉生活力。
通过3种药剂对Psa的杀灭作用和花粉生活力的研究,选择杀灭作用高且对花粉生活力影响小的药剂浓度和作用时间。因此本研究选择ClO2溶液浓度10 mg/L,时间45 min,噻霉酮溶液浓度500 μL/L,时间30 min;可杀得三千溶液浓度10 mg/L,时间15 min。
2.3 3种药剂处理对猕猴桃产量、种子数的影响
2.3.1 3种药剂处理对猕猴桃座果率的影响 猕猴桃花粉的生活力直接影响果实的座果率,花粉生活力越大,座果率越高。授粉前,对照组、ClO2溶液、噻霉酮和可杀得三千处理组花朵数分别为63.47,71.45,78.47,81.85个,授粉1个月后统计座果数分别为53.00,52.50,52.75,57.75个,座果率分别为83.5%,73.48%,67.22%,70.56%,较对照组分别下降12.0%,15.5%,19.5%,各处理组均与对照组有极显著性差异(P<0.01),但ClO2处理组对座果率影响较小,见图1。因此,在生产中,应尽量选择对座果率影响较小的试剂处理花粉。
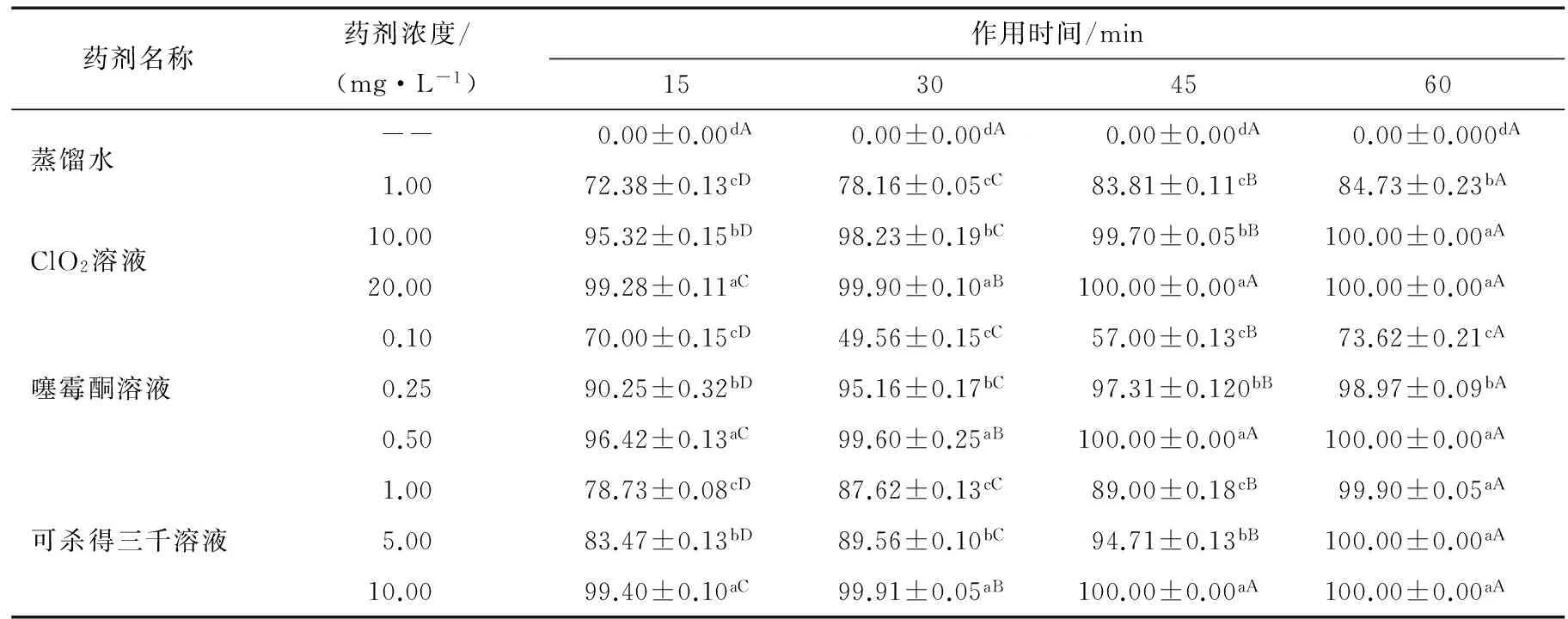
表1 3种药剂作用浓度和时间对花粉中Psa杀灭效果的影响†Table 1 Efficacy of three kinds of medicament in killing Psa of pollen for different periods of concentration and time (n=3)
† 试验温度是25 ℃;不同小写字母表示纵向P≤5%差异显著性,不同大写字母表示横向P≤5%差异显著性。
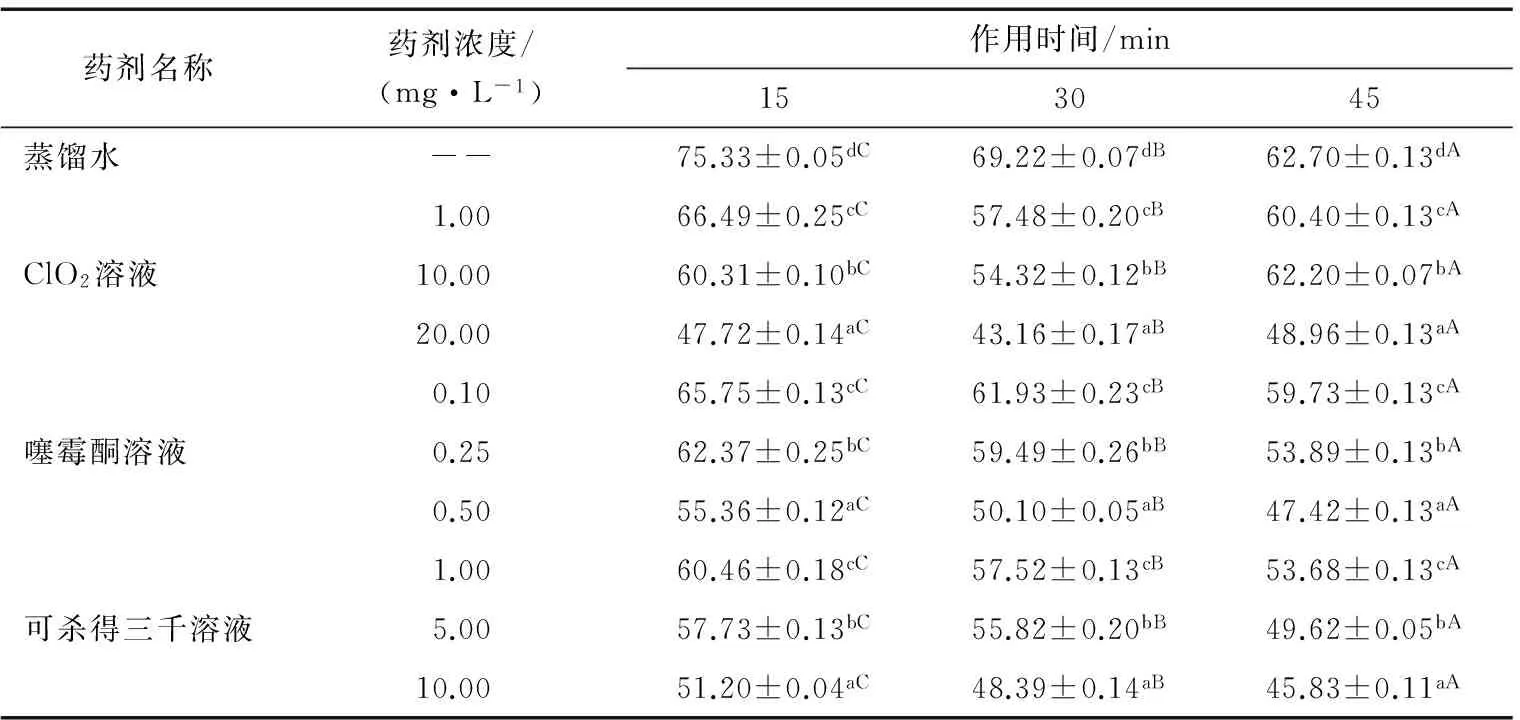
表2 3种药剂作用浓度和时间对花粉生活力的影响†Table 2 Efficacy of three kinds of medicament in killing Psa for different periods of concentration and time (n=3)
† 不同小写字母表示纵向P≤5%差异显著性,不同大写字母表示横向P≤5%差异显著性。
2.3.2 3种药剂处理对猕猴桃总产量的影响 由图2可知,对照组、ClO2溶液、噻霉酮和可杀得三千处理组猕猴桃果实的总产量分别为4 455.0,4 205.0,4 078.5,3 955.0 g,3种药剂处理花粉后总产量都有下降,以可杀得三千处理组下降最多,较对照组下降11.2%,差异显著(P<0.05);ClO2处理组和噻霉酮处理组较对照组分别下降5.6%和8.4%,均无显著性差异,以ClO2处理组较好。
2.3.3 3种药剂处理对猕猴桃单果重的影响 由图3可知,对照组、ClO2溶液、噻霉酮和可杀得三千处理组猕猴桃果实的单果重分别为84.06,79.02,75.65,68.48 g,3种药剂处理花粉后果实的单果重都有降低,以可杀得三千处理组下降最多,较对照组下降18.5%,差异显著(P<0.05);ClO2处理组和噻霉酮处理分别下降6%和10%,均无显著性差异,说明ClO2处理组和噻霉酮处理组对猕猴桃单果重的影响不大,以ClO2处理组较好。

图1 3种药剂处理对猕猴桃座果率的影响Figure 1 Effects of three kinds of medicament on setting rate of kiwifruit (n=3)
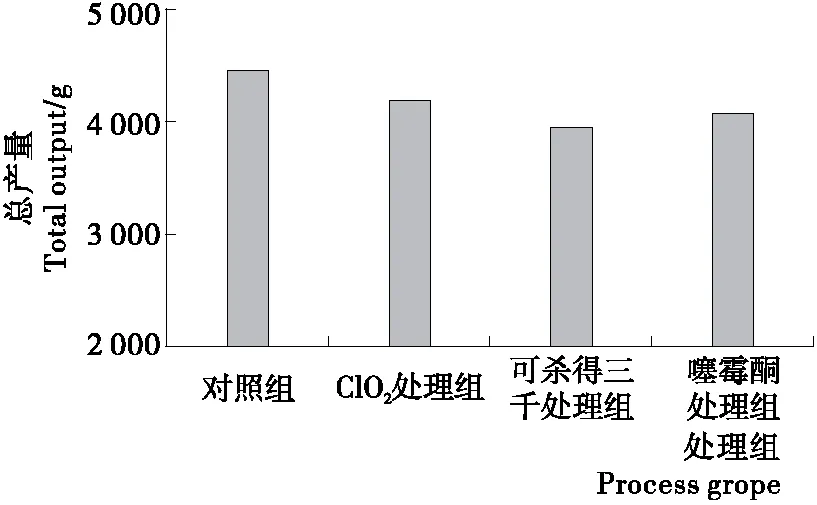
图2 3种药剂处理对猕猴桃总产量的影响Figure 2 Effects of three kinds of medicament on output of kiwifruit (n=3)
2.3.4 3种药剂处理对猕猴桃种子数的影响 授粉效果影响果实种子数量,从而影响果实大小。一般种子越多,果实越大,风味越好[31-32]。由图4可知,对照组、ClO2溶液、噻霉酮和可杀得三千处理组猕猴桃果实种子数分别为791.75,781.50,479.00,480.25个,其中可杀得三千处理组和噻霉酮处理组的果实种子数较对照组下降可达35%以上,差异极显著(P<0.01);ClO2处理组的种子数仅下降1.2%,无显著性差异,表明ClO2处理组对种子数影响较小。结果与郭晓成[33]发现的猕猴桃果实中种子数量与果实大小呈正相关结果一致,同时也说明在液体授粉前将ClO2加入花粉溶液进行花粉中Psa消毒在猕猴桃栽培生产中有比较广阔的应用前景。

图3 3种药剂处理对猕猴桃单果重的影响Figure 3 Effects of three kinds of medicament on weight of single kiwifruit (n=3)
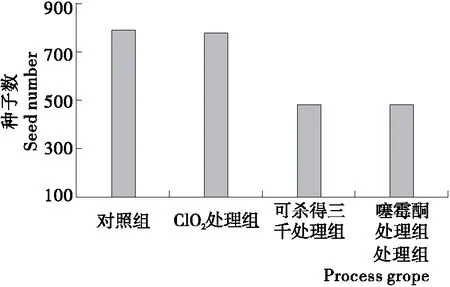
图4 3种药剂处理对猕猴桃种子数的影响Figure 4 Effects of three kinds of medicament on on seed number of kiwifruit (n=3)
3 结论
被Psa污染的花粉以10 mg/L ClO2溶液处理45 min对花粉中Psa的杀菌率为99.7%,而花粉生活力仅下降0.5%、座果率下降12%、总产量下降5.6%、单果重下降6%、种子数下降1.2%,表明10 mg/L ClO2溶液处理45 min对花粉中Psa杀菌率高,花粉生活力影响小,在生产上能有效防止猕猴桃花粉传播Psa,具有较大的推广价值。前人的研究方法对花粉的生活力影响较大,本研究方法对花粉的生活力影响较小,但在授粉时需要将花粉配制成液体,加大了授粉难度,生产上一般选用干粉授粉,因此后续的试验可深入研究干粉授粉,降低授粉难度。
[1] 黄诚, 周长春, 李伟. 猕猴桃的营养保健功能与开发利用研究[J]. 食品科技, 2007(4): 51-55.
[2] 许牡丹, 曹晴, 毛跟年, 等. 猕猴桃营养咀嚼片制备工艺优化与质量评价[J]. 食品与机械, 2016, 32(8): 188-191.
[3] 雷玉山, 王西锐, 姚春潮, 等. 猕猴桃无公害生产技术[M]. 杨凌: 西北农林科技大学出版社, 2010: 3-5.
[4] 齐秀娟, 徐善坤, 钟云鹏, 等. 不同来源猕猴桃雄株花粉特性遗传差异及聚类分析[J]. 果树学报, 2016, 33(10): 1 194-1 205.
[5] SEAL A G, DUNN J K, SILVA H N D, et al. Choice of pollen parent affects red flesh colour in seedlings of diploidActinidiachinensis(kiwifruit)[J]. New Zealand Journal of Crop and Horticultural Science, 2013, 41(4): 207-218.
[6] DENNEY J O. Xenia includes metaxenia[J]. HortScience, 1992, 27: 722-728.
[7] TAKIKAWA Y, SERIZAWAE S, ICHIKAWA T, et al.Pseu-domonassyringaepv.nov. The causal bacterium of canker of kiwifruit in Japan[J]. Annals of the Phytopathologicial Society of Japan, 1989, 55(4): 437-444.
[8] MAZZAGLIA A, STUDHOLME D J, TARATUFOLO M C, et al.Pseudomonassyringaepv.actinidiae(PSA) isolates from recent bacterial canker of kiwifruit outbreaks belong to the same genetic lineage[J]. Plos One, 2012, 7(5): e36 518.
[9] 黄其玲, 高小宁, 赵志博, 等. GFPuv土壤、根系中的定殖[J]. 中国农业科学, 2013, 46(2): 282-291.
[10] GALLELLI A, LAERORA A, LORETI S. Gene sequence analysisfor the molecular detection ofPseudomonassyringaepv.actinidiae:developing diagnostic protocols[J]. Journal of Plant Pathology, 2011, 93(2): 425-435.
[11] STEFANI E, GIOVANARD D. Dissemination ofPseudomonassyringaepv.actinidiaethrough pollen and its epiphytic life on leaves-and fruits[J]. Phytopathologia Mediterranea, 2011, 50: 501-505.
[12] VANNESTE J L, GIOVANARD D, YU J C. Detection ofPseudomonassyringaepv.actinidiaein pollen samples[J]. New Zealand Plant Protection, 2011, 64: 246-251.
[13] PATTEMORE D E, GOODMIN R M, MCBRYDIORNISH D A, et al. Evidence of the role of honey bees (Apis mellifera) as vectors of the bacterial plant pathogenPseudomonassyringae[J]. Australasian Plant Pathol, 2014, 43(5): 571-575.
[14] EVERETT K R, COHEN D, PUSHPARAJAH I P S, et al. Heat treatments to killPseudomonassyringaepv.actinidiaeon contaminated pollen[J]. New Zealand Plant Protection, 2012, 65: 8-18.
[15] 谭永中, 赵琳, 周贤文, 等. 噻霉酮对猕猴桃溃疡病的防治效果及施药方法[J]. 中国南方果树, 2016, 45(2): 140-141.
[16] 秦虎强, 赵志博, 高小宁, 等. 四种杀菌剂防治猕猴桃溃疡病的效果及田间应用技术[J]. 植物保护学报, 2016, 43(2): 321-328.
[17] 焦红红. 猕猴桃细菌性溃疡病防治药物的筛选[D]. 杨凌: 西北农林科技大学, 2014: 29-31.
[18] LEE S Y, GRAY P M, DOUGHERTY R H, et al. The use of chlorine dioxide to control Alicyclobacillus acidoterrestris spores in aqueous suspension and on apples[J]. International Journal of Food Microbiology. 2004, 92: 121-127.
[19] LEE S Y, DANCER G I, CHANGA S S, et al. Efficacy of chlorine dioxide gas against Alicyclobacillus acidoterrestris spores on apple surfaces[J]. International Journal of Food Microbiology, 2006, 108: 364-368.
[20] HODGES D W, FORNEY C F, WISMER W. Processing line effects on storage attributes of fresh-cut spinach leaves[J]. Hortscience: A Publication of the American Society for Horticultural Science, 2000, 35(7): 1 308-1 311.
[21] TSAI L S, HUXSOLL C C, ROBERTSON G. Prevention of potato spoilage during storage by chlorine dioxide[J]. Journal of Food Science, 2001, 66(3): 472-477.
[22] 李学敏, 张福娥, 田若涛, 等. 一种二氧化氯消毒剂消毒相关性能研究[J]. 中国消毒学杂志, 2017, 34(8): 739-741.
[23] 田红炎, 饶景萍. 二氧化氯处理对机械损伤猕猴桃果实的防腐保鲜效果[J]. 食品科学, 2012, 33(18): 298-302.
[24] 许艳顺, 朱建秋, 葛黎红, 等. 二氧化氯减菌化处理对发酵鱼糜品质的影响[J]. 食品与机械, 2013, 29(4): 47-49.
[25] 耿鹏飞. 猕猴桃灰霉病防治与保鲜技术研究[D]. 西安: 陕西师范大学, 2015: 12-15.
[26] 薛敏. 气体ClO2对猕猴桃青霉的抑制作用及对猕猴桃保鲜效果的研究[D]. 西安: 陕西师范大学, 2015: 13-16.
[27] 赵金梅. 中华猕猴桃褐斑病病原鉴定及ClO2杀灭效果的研究[D]. 西安: 陕西师范大学, 2014: 36-37.
[28] 杨红, 余和明, 李小艳, 等. 猕猴桃花粉生活力测定方法及花药处理方法研究[J]. 北方园艺, 2015(8): 36-39.
[29] 潘德林, 张计育, 程竞卉, 等. 不同授粉方式对猕猴桃着果率的影响[J]. 中国南方果树, 2017, 46(1): 120-122.
[30] 陈永安, 陈鑫, 刘艳飞. 采粉期及贮藏条件对猕猴桃花粉生活力的影响[J]. 西北农林科技大学学报: 自然科学版, 2012, 40(8): 157-160.
[31] 陈学选, 蒋桂华, 谢鸣, 等. 猕猴桃种子对果实大小及品质的影响[J]. 浙江农业科学, 1990(5): 243-245.
[32] 陈建业, 李占红, 宁玉霞. 猕猴桃花粉悬浊液省力化制备及其生物效应[J]. 果树学报, 2014, 31(6): 1 105-1 109.
[33] 郭晓成. 猕猴桃溶液授粉技术[J]. 山西果树, 2007(1): 16-17.
