缺磷对茶树磷吸收及miR399a表达量的影响
2018-05-02陈志辉林郑和游小妹钟秋生单睿阳陈常颂
陈志辉,林郑和,游小妹,钟秋生,单睿阳,陈常颂
(福建省农业科学院茶叶研究所/国家茶树改良中心福建分中心,福建 福安 355015)
磷素缺乏是我国及世界农业生产中影响作物产量的一个限制因子。据统计,当今全世界的耕地中约有43%缺磷[1],而我国约有2/3的耕地严重缺磷[2]。磷元素的缺乏可导致植物幼芽和根部生长缓慢、叶小、分枝减少、植株矮小、花果少等症状[2]。在缺磷条件下,植物会形成一种应对机制,以提高磷的利用率[3],某些microRNA(miRNA)基因(miR399、miR827等)在这其中起重要作用[4-6]。miRNA是一类内源性的非编码单链小分子RNA[7],其前体具有发夹结构[8-9],长度约为20~23 nt[10]。miRNA 作为基因表达中的一类负调控子,主要在转录后水平上通过与靶mRNA结合,介导靶mRNA 切割降解或抑制翻译来调节植物基因的表达[8,11-12]。许多植物的miRNA 成熟序列呈现高度保守并出现独特的表达时序性、组织及发育特异性或逆境特异性。在植物新陈代谢、组织生长、器官发育及分化、细胞程序性凋亡中起重要作用[13-14]。miRNA 还参与植物生物及非生物逆境胁迫过程,不同的miRNA 对不同逆境胁迫发生响应,并证实某些miRNA在植物感受逆境胁迫并产生适应性的过程中发挥重要作用[15]。
植物对磷的吸收利用过程极其复杂[16-18],目前植物中大量关于低磷胁迫诱导基因的研究(包括miRNA基因的表达和调控)在一定程度上揭示了植物低磷响应机制[19-20]。有研究表明,低磷胁迫下拟南芥基因组中有6个miR399受诱导表达,分别是miR399a-f[21],在拟南芥中超表达miR399成员造成磷吸收过量而出现中毒表型,现已证明miR399家族是一类与植物耐低磷胁迫密切相关的小RNA家族[22-23]。水稻、大麦等植物中有关miR399参与调控磷元素的吸收利用的相关报道较多[5,24-25]。虽然在多种植物中都报道了低磷胁迫诱导miR399的表达及其调控路径[3,18],但在茶树中有关磷吸收与miR399表达和调控机制的相关报道仍未见到,到目前为止还无法确定茶树基因组中miR399家族有多少个成员,在查阅的文献中发现仅有一篇报道茶树中存在miR399a和miR399b[26]。通过对比,发现茶树中miR399a和miR399b都为21个碱基,只有3′端最后一个碱基差别,而miR399a与其他物种中miR399成员的同源性更高。鉴于此,本研究以茶树幼苗为试验材料,通过不同磷浓度胁迫处理,检测茶树对磷素的吸收利用情况以及miR399a在缺磷条件下的响应状况。
1 材料与方法
1.1 试验材料的培养与取样
试验于2017年在福建省农科院院部大楼进行。选生长一致的10月龄的扦插‘瑞香’茶苗为试验材料,盆栽于6 L的装满沙的花盆,每盆栽3株,于自然温、光条件下培养。营养液参考文献[27-28],完全营养液包含1 mmol·L-1(NH4)2SO4,1 mmol·L-1NH4H2PO4,2 mmol·L-1KNO3,0.6 mmol·L-1MgSO4·7H2O,0.5 mmol·L-1CaCl2,30 μmol·L-1EDTA·Na2Fe,46 μmol·L-1H3BO3,9 μmol·L-1MnSO4·H2O,9 μmol·L-1ZnSO4·7H2O,2 μmol·L-1CuSO4·5H2O,2.6 μmol·L-1Na2MoO4,0.035 mmol·L-1A12(SO4)3·18H2O。移栽后8周进行缺磷处理,每处理重复6次,每盆施含3000 μmol·L-1、1000 μmol ·L-1、100 μmol·L-1、10 μmol·L-1浓度磷的营养液约500 mL,每周3次,处理15周后采集根、叶进行分析。
1.2 磷含量检测
采用钼锑抗比色法测定,参照《植物生理学测试技术》[29]。
1.3 Stem-loop RT-PCR检测miRNA的表达量
采用stem-loop RT-PCR的方法检测miRNAs的表达量[30]。按照Trizol(Invitrogen,Carlsbad,CA,USA)试剂盒的说明书提取茶树不同组织的总RNA,取样部位为新叶和根,新叶为倒数第二叶的完全叶,根为有活力的白色根,3次重复。提取总RNA后,检测RNA浓度和质量,检测试剂盒为Agilent 2100 RNA 6000 Nano kit。总RNA反转录用TransScript First-Strand cDNA Synthesis SuperMix kit(TRANS,AT301),反转录引物为基因上的特定引物stem-loop RT prime(MIR399a-St-RT)或者作为对照的内源基因引物U6-R。反应体系为:50 ng total RNA,0.5 μM stem-loop RT primer或U6-R primer,2×TS Reaction Mix 2.5 μL,TransScript RT/RI Enzyme Mix 0.25 μL,加RNase-free water到5 μL。把这5 μL反应混合物放在ABI 9700 thermocycler (Applied Biosystems,http://www.appliedbiosystems.com/)PCR仪上:16℃ 15 min,42℃ 50 min,70℃ 15 min,降到4℃,反应完毕。以上所有反转录试验都3次重复。Real-time PCR是在ABI PRISM 7500 PCR仪上进行(Applied Biosystems)。25 μL PCR体系包含5 μL RT product,forward primer和reverse primer各0.4 μM,0.5 μL Rox Reference Dye II 和1×SYBRPremixEXTaq(Takara),加ddH2O到25 μL。反应程序为:95℃ 10 s,然后是95℃ 5 s和60℃ 34 s 共40个循环。溶解曲线分析按照以下程序:95℃ 15 s、60℃ 20 s和95℃ 15 s。所有反应数据都保存在 ABI PRISM 7500 sequence detection system上,并按说明书分析或导出分析。以上所有引物序列见表2。
2 结果与分析
2.1 磷胁迫处理对茶树不同组织磷含量的影响
在4种磷浓度(3000、1000、100、10 μmol·L-1)下胁迫处理15周后,检测茶树根、新叶(从上往下数第二叶)、老叶(从上往下数第8叶)的磷含量,见图1。

图1 不同磷浓度胁迫下,茶树根、新叶、老叶中的磷含量Fig.1 phosphorus contents in roots, young shoots and old leaves of tea plants under phosphorus stresses
分析图1发现,不同磷浓度处理下,根、新叶、老叶中磷含量都随着处理浓度的下降而降低,其中老叶中磷含量变化最显著。
在磷肥过量的条件下(3000 μmol·L-1),老叶中磷含量最高,其次是根,然后是新叶,根和新叶磷含量接近,而老叶磷含量是根和新叶的两倍多,说明茶树在磷肥过量的环境中生长时,把吸收的过量磷元素存储在老叶中。
在正常的施肥条件下(1000 μmol·L-1),根中磷含量最高,依次是新叶和老叶,而根和新叶含量相当,其中老叶磷含量比在过量磷肥条件下显著下降,约为新叶的一半。从老叶的磷含量比新叶低,说明在正常的磷肥条件下,老叶中的磷元素会转移到其它更需要磷营养的新生组织中,重复利用磷元素,提高利用效率,保障植物的生长发育。
在缺磷条件下(100 μmol·L-1、10 μmol·L-1),新叶磷含量最高,根和老叶的磷含量都急剧下降,但根的磷含量仍显著高于老叶。在4种磷浓度处理中,新叶是3个部位中磷浓度变化最小的器官,说明茶树在生长过程中出现缺磷状况时,首先保证新生组织等重要部位磷元素的供应,最大限度的减少非重要器官的磷含量,以维持基本生存需求。
2.2 磷胁迫茶树总RNA提取与质量检测
提取正常(1000 μmol L-1)和低磷(10 μmol L-1)2种处理茶树的新叶与根的总RNA,并检测RNA浓度和质量,从RNA电泳图(图2、图3)可以直观地看出每个RNA样品的质量。而RIN值(RIN=RNA integrity number,即RNA分子完整数,从0~10,直接反应了RNA质量的好坏,此数值越大表明RNA质量越好越完整)也表明提取的总RNA质量较好,绝大部分在8左右,仅有一个为6.6,都能满足反转录需求。从每个样品的浓度和体积,得出样品的RNA总量(表1),分析表1发现叶片提取的RNA总量比根高出较多,其中8号和11号的根部RNA总量仅有1.79 μg和2.77 μg,基本满足反转录要求。从RNA总量可以判断叶片基因表达比根丰富。

图2 电泳检测磷胁迫处理茶树提取的总RNAFig.2 Electrophoresis of total RNA extracted from tea plants under phosphorus stresses注:1~3号样为低磷胁迫(10μmol L-1)的茶树叶片(3个生物学重复,以下相同),4~6为正常磷浓度处理(1000 μmol L-1)的茶树叶片,7~9为低磷胁迫的根,10~12为正常磷浓度处理的根。下同。
2.3 磷胁迫对茶树miR399a表达的影响
试验采用Stem-loop RT-PCR的方法检测miR399a的表达量[30]。反转录引物的径环序列为 5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGAC-3′,3′端加上与miR399a成熟序列5′-UGCCAAAGGAGAGUUGCCCUG-3′的3′端互补的6个碱基5′-CAGGGC-3′,形成反转录引物MIR399a-St-RT:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCAGGGC-3′。荧光定量PCR的正向引物取miR399a成熟序列的5′端15个碱基,然后在5′端上加上4个碱基5′-CGGC-3′,获得正向引物MIR399a -F:5′-CGGCTGCCAAAGGAGAGTT-3′。反向引物为反转录引物径环序列上的一段碱基,MIRNA-R:5′-GTGCAGGGTCCGAGGT-3′。荧光定量PCR的内参引物为U6-F和U6-R。以上引物序列见表2。
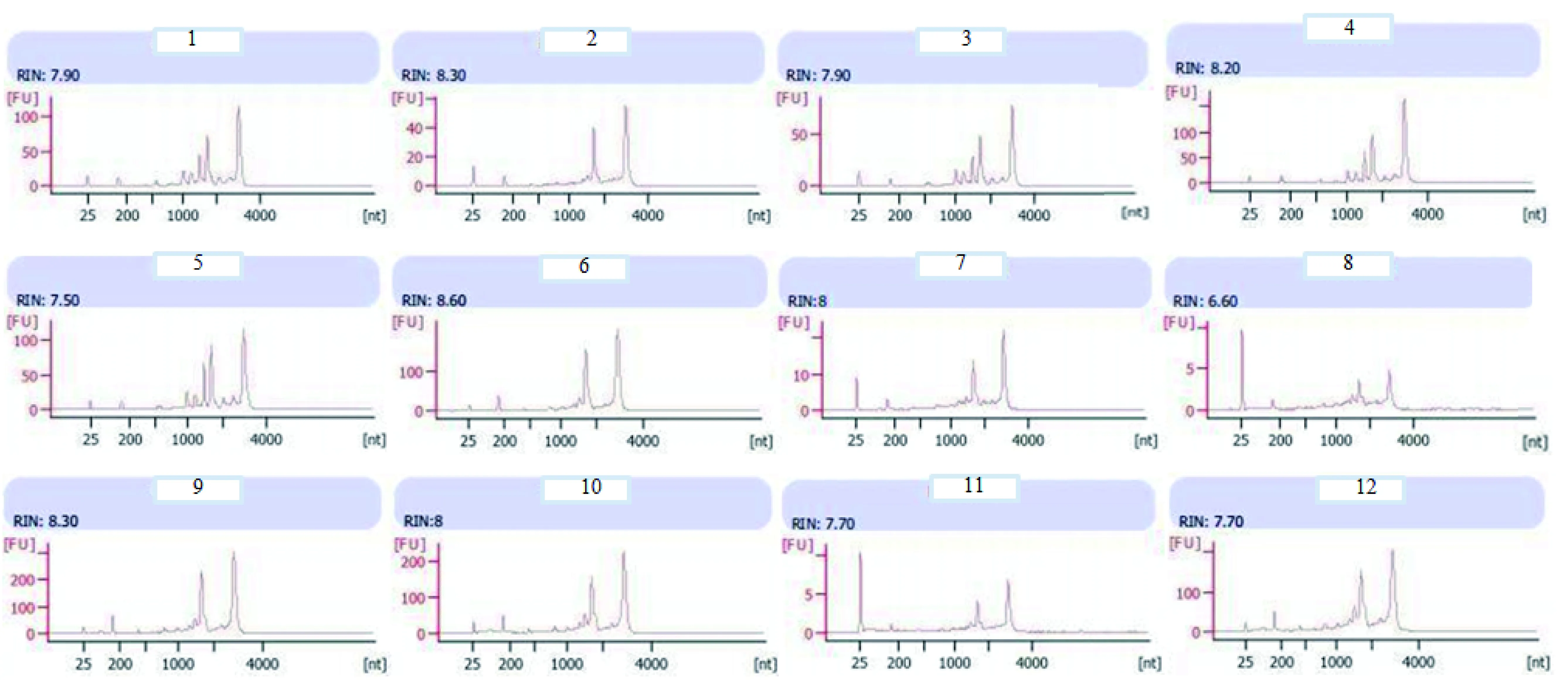
图3 磷胁迫处理茶树总RNA电泳检测Fig.3 Electrophoretic detection of total RNA from tea plants under phosphorus stresses
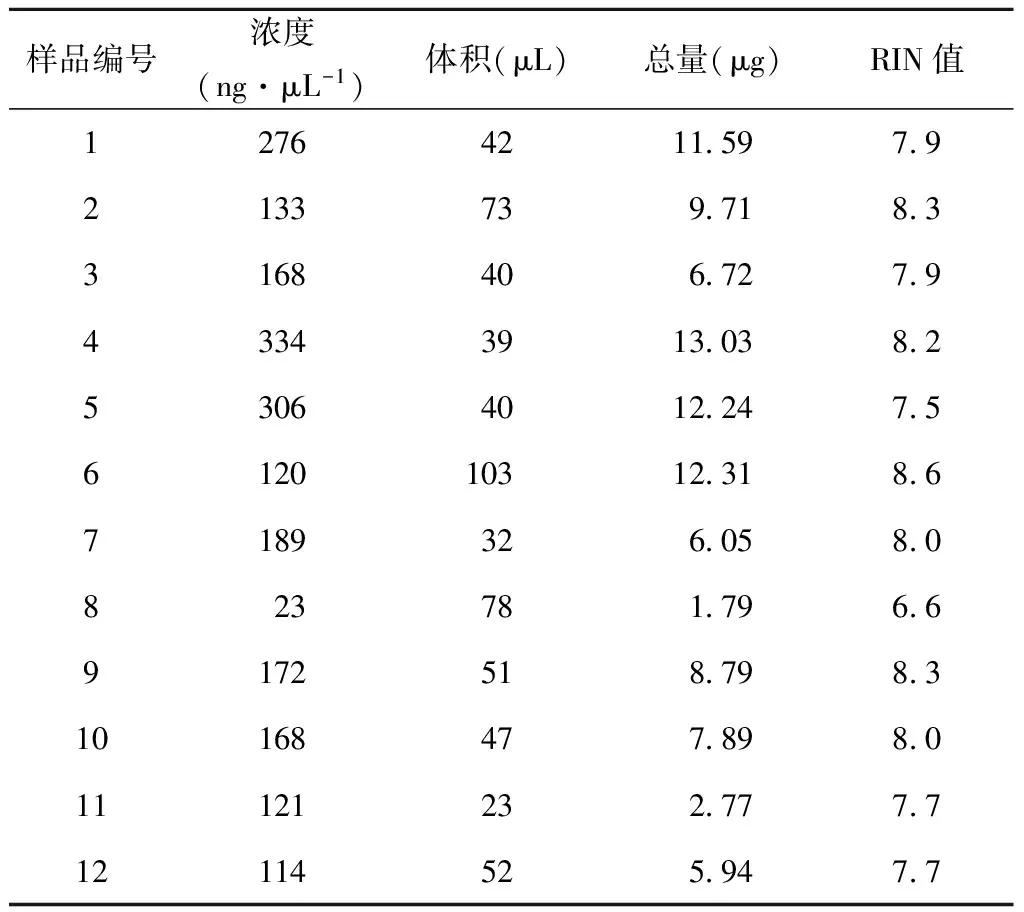
表1 磷胁迫处理茶树提取RNA的浓度、总量及RIN值
通过荧光定量PCR方法,检测正常和低磷胁迫下叶片和根中miR399a的表达量,了解磷胁迫对茶树miR399a表达量的影响,见图4。
分析图4发现,茶树在低磷胁迫下,miR399a的表达量在叶片和根中都显著提高,其中低磷胁迫的叶片比正常磷供应的叶片表达量提高约2.77倍,而低磷胁迫的根比正常磷处理的根表达量提高约3.82倍。说明茶树在低磷环境中,能够诱导miR399a提高表达量。已知在拟南芥和水稻等植物中,miR399表达量提高有助于植物吸收利用土壤中的磷,而过量表达miR399甚至引起植物磷吸收过量而造成磷中毒现象,以上结果说明miR399在茶树磷吸收中的功能与其它植物相似。已有研究发现miR399是通过抑制靶基因来实现它的调控功能,茶树中是否存在其它植物同源的靶基因,还需要后续实验进一步验证。下一步将开展miRNA与mRNA表达谱测序,分析低磷胁迫中茶树miR399的调控路径。
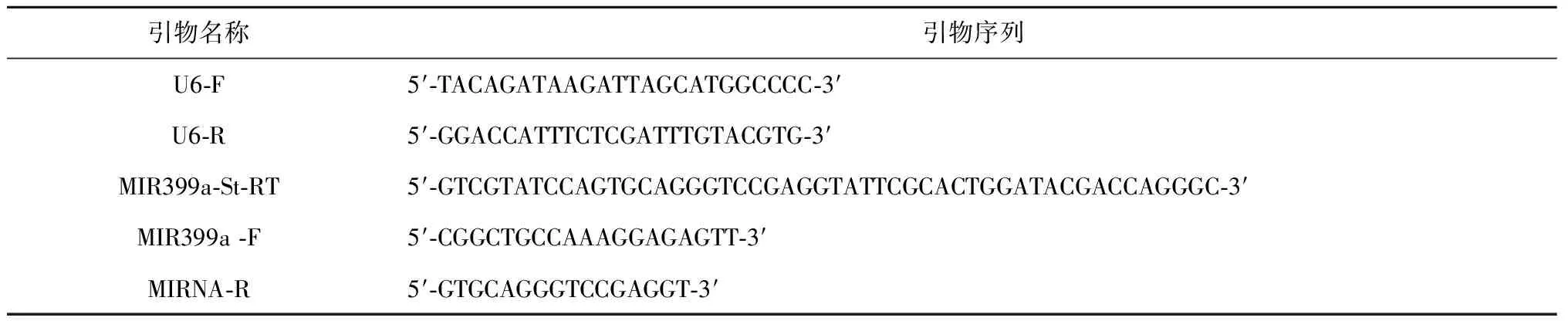
表2 引物序列

图4 正常和低磷胁迫下miR399a在叶和根中的相对表达量Fig.4 Relative expressions of miR399a in leaves and roots under normal and low phosphorus supplies
3 讨论
已有文献中有关植物体内磷元素从衰老器官转运到新生器官,实现磷元素高效利用的研究报道较多,但是茶树中却鲜有报道。本研究发现在不同磷浓度胁迫处理下,茶树不同器官对磷元素的吸收利用各不相同,其中在缺磷或者正常磷浓度条件下,茶树中老叶部位的磷元素都会重新转运到新生组织等重要部位,实现磷元素的再次利用,但在过量磷浓度条件下,茶树会把过量的磷元素储存于老叶中,避免新生组织出现磷中毒,维持体内磷元素的平衡。此研究结果有助于充实茶树对磷元素吸收利用的试验数据。
本研究发现茶树在缺磷条件下,引起miR399a表达量的提高,这与其它植物的研究结果相一致[5-6]。大量研究都发现植物在低磷条件下,miR399受环境中磷酸盐水平强烈诱导,表达量提高,其靶基因PHO2(UBC24)的mRNA丰度下降,而恢复供磷时miR399又急剧下降,恢复正常表达水平[31-32]。miR399与靶基因PHO2(UBC24)的mRNA水平在正常和低磷胁迫时均存在着一个倒置的关系,低磷胁迫下,miR399通过与PHO2(UBC24)-mRNA的3′-UTR结合,从而实现对其mRNA的降解或抑制其翻译,PHO2(UBC24)蛋白表达量的下调能够促进植物根部的生长、提高磷高亲和力转运子的表达(如AtPT1)[33],从而提高对磷的吸收利用以应对磷素缺乏[23]。高磷环境下,miR399 的表达却受到抑制,根部 PHO2(UBC24)基因的表达量增加,抑制过量无机磷进入植物体内,使其免于磷中毒。有研究表明,PHO2(UBC24)的突变体(pho2)具有在茎和叶中积累磷的功能[17]。总之,miR399在保持植株体内磷的平衡和稳定方面具有重要的作用[5,34-37]。有研究发现除miR399外,还存在其他的miRNAs基因参与磷胁迫响应。拟南芥在缺磷条件下还诱导miR778、miR827表达,抑制miR398的表达[38],其中miR827的靶基因是E3连接酶NLA(Atlg0260),NLA参与植物花青素合成,缺磷条件下miR827会抑制NLA表达。另外大豆在缺磷胁迫下miR159、miR894、miR1507、miR1509等基因表达量上调,而miR165/166、miR398、miR1450、miR1511等表达量下调[39]。
虽然其它植物中有关miR399通过抑制靶基因表达,从而调节植物对磷元素吸收利用的报道较多,但在茶树中没有发现相关报道。miR399在茶树中是否存在同源的靶基因PHO2(UBC24),以及靶基因PHO2(UBC24)如何调控下游的磷转运子基因PT1的表达,都需要进一步的深入研究。后续研究将检测不同磷浓度胁迫下mRNA和miRNA的表达谱,获得与磷吸收转运的相关基因,重点研究miRNAs与靶基因及下游基因的表达调控模式,从而了解茶树在磷胁迫后不同基因的应急反应,获得miRNAs在磷胁迫反应中的调控路径,为探明茶树磷吸收转运机理提供依据。
[1]Raghothanma K G. Phosphate acquisition [J]. Annu Rev Plant Physiol Plant Mol Biol,1999,50(1):665-693.
[2]林郑和,陈荣冰,郭少平.植物对缺磷的生理适应机制研究进展[J].作物杂志,2010,138(5):5-8.
[3]Lopez-Arredondo D L, Leyva-Gonzalez M A, Gonzalez-Morales S I,etal. Phosphate nutrition: improving low-phosphate tolerance in crops [J]. Annual review of plant biology,2014,65(1):95-123.
[4]Sunkar R, Zhu J K. Novel and stress-regulated microRNAs and other small RNAs from Arabidopsis [J]. Plant Cell,2004,16(8):2001-2019.
[5]Hackenberg M, Shi B J, Gustafson P,etal. Characterization of phosphorus-regulated miR399 and miR827 and their isomirs in barley under phosphorus-sufficient and phosphorus-deficient conditions [J]. BMC plant biology, 2013,13(1):214.
[6]Xu F, Liu Q, Chen L,etal. Genome-wide identification of soybean microRNAs and their targets reveals their organ-specificity and responses to phosphate starvation [J]. BMC Genomics,2013,14(1):66.
[7]Carrington J C, Ambros V. Role of microRNAs in plant and animal development [J]. Science, (New York, N.Y, 2003,301(5631):336-338.
[8]Bartel D E. MicroRNAs: genomics, biogenesis, mechanism, and function [J]. Cell,2004,116(2):28l-297.
[9]Ambros V, Bartel B, Bartel D P,etal. Auniform system for microRNA annotation [J]. RNA,2003,9(3):277-279.
[10]Zhang B H, Stellwag E J, Pan X P. Large-scale genome analysis reveals unique features of microRNAs [J]. Gene,2009,443(1-2):100-109.
[11]Schwab R, Palatnik J F, Riester M,etal. Specific effects of microRNAs on the plant transcriptome [J]. Developmental cell,2005,8(4):517-527.
[12]Vaucheret H. Post-transcriptional small RNA pathwaysin plants: mechanisms and regulations [J]. Genes Dev,2006,20(7):759-771.
[13]Jover-Gil S, Candela H, Ponce M R. Plant microRNAs and development [J]. The International journal of developmental biology,2005,49(5-6):733-744.
[14]Willmann M R, Poethig R S. Conservation and evolution of miRNA regulatory programs in plant development [J]. Current opinion in plant biology,2007,10(5):503-511.
[15]Liu H H, Tian X, Li Y J,etal. Microarray-based analysis of stress-regulated microRNAs in Arabidopsis thaliana [J]. RNA, 2008,14(5):836-843.
[16]Lin W Y, Lin S I, Chiou T J. Molecular regulators of phosphate homeostasis in plants [J]. Journal of experimental botany,2009,60(5):1427-1438.
[17]Bari R, Datt Pant B, Stitt M,etal. PHO2, microRNA399, and PHR1 define a phosphate-signaling pathway in plants [J]. Plant physiology,2006,141(3):988-999.
[18]Chiou T J, Lin S I. Signaling network in sensing phosphate availability in plants [J]. Annual review of plant biology,2011,62(1):185-206.
[19]Liu J, Vance C P. Crucial roles of sucrose and microRNA399 in systemic signaling of P deficiency: a tale of two team players? [J]. Plant signaling & behavior,2010,5(12):1556-1560.
[20]Lin S I, Chiou T J. Long-distance movement and differential targeting of microRNA399s [J]. Plant signaling & behavior,2008,3(9):730-732.
[21]Sunkar R, Zhu J K. Novel and stress-regulated microRNAs and other smal1 RNAs from Arabidopsis[J]. Plant Cell,2004,l6(8):2001-2019.
[22]Sunkar R, Chinnusamy V, Zhu J K. Small RNAs as big players in plant abiotic stress responses and nutrient deprivation [J]. Trendsin Plant Science,2007,12(7):301-309.
[23]Lin S I, Chiang S F, Lin W Y,etal. Regulatory network of microRNA399 and PHO2 by systemic signaling [J]. Plant physiology,2008,147(2):732-746.
[24]Wang C, Ying S, Huang H,etal. Involvement of OsSPX1 in phosphate homeostasis in rice [J]. The Plant journal: for cell and molecular biology,2009,57(5):895-904.
[25]Wang Z, Hu H, Huang H,etal. Regulation of OsSPX1 and OsSPX3 on expression of OsSPX domain genes and Pi-starvation signaling in rice [J]. J Integr Plant Biol,2009,51(7):663-674.
[26]Zhang Y, Zhu X, Chen X,etal. Identification and characterization of cold-responsive microRNAs in tea plant (Camellia sinensis) and their targets using high-throughput sequencing and degradome analysis [J]. BMC Plant Biology,2014,14(1):271.
[27]Ghanati F, Morita A, Yokota H. Effects of aluminum on the growth of tea plant and activation of antioxidant system [J]. Plant & Soil,2005,276(1-2):133-141.
[28]Salehi S Y, Hajiboland R. A high internal phosphorus use efficiency in tea (CamelliasinensisL.) plants [J]. Asian Journal of Plant Sciences,2008,7(1):30-36.
[29]白玉璋,汤学军.植物生理学测试技术[M].北京:中国科学技术出版社,1993:26.
[30]Chen C, Ridzon D A, Broomer A J,etal. Real-time quantification of microRNAs by stem-loop RT-PCR [J]. Nucleic Acids Res,2005,33(20):e179.
[31]Buhtz A, Springer F, Chappell L,etal. Identification and characterization of small RNAs from the phloem of Brassica napus [J]. Plant J,2008,53(5):739-749.
[32]Pant B D, Buhtz A, Kehr J,etal. MicroRNA399 is a long-distance signal for the regulation of plant phosphate homeostasis [J]. Plant Journal for Cell & Molecular Biology,2008,53(5):731-738.
[33]Chiou T J, Aung K, Lin S I,etal. Regulation of phosphate homeostasis by microRNA in Arabidopsis [J]. Plant Cell,2006,18(2):4l2-421.
[34]Park B S, Seo J S, Chua N H. NITROGEN LIMITATION ADAPTATION recruits PHOSPHATE2 to target the phosphate transporter PT2 for degradation during the regulation of Arabidopsis phosphate homeostasis [J]. The Plant cell,2014,26(1):454-464.
[35]Lin W Y, Huang T K, Chiou T J. Nitrogen limitation adaptation, a target of microRNA827, mediates degradation of plasma membrane-localized phosphate transporters to maintain phosphate homeostasis in Arabidopsis [J]. The Plant cell,2013,25(10):4061-4074.
[36]Aung K, Lin S I, Wu C C,etal. pho2, a phosphate overaccumulator, is caused by a nonsense mutation in a microRNA399 target gene [J]. Plant physiology,2006,141(3):1000-1011.
[37]Baek D, Kim MC, Chun HJ,etal. Regulation of miR399f transcription by AtMYB2 affects phosphate starvation responses in Arabidopsis [J]. Plant physiology,2013,161(1):362-373.
[38]Phillips J R, Dalmay T, Bartels D. The role of small RNAs in abiotic stress [J]. FEBS letters,2007,581(19):3592-3597.
[39]Zeng H Q, Zhu Y Y, Huang S Q,etal. Analysis of phosphorus-deficient responsive miRNAs and cis-elements from soybean (Glycine max L.) [J]. Journal of plant physiology,2010,167(15):1289-1297.
