不同拉伸力加载培养对人血管内皮细胞增殖情况的影响和意义*
2018-05-02杜广刚
李 巍,陈 博 ,杜广刚, 岑 瑛
1. 四川省医学科学院·四川省人民医院 烧伤科(成都 610072);2. 四川大学华西医院 整形烧伤科(成都 610041)
目前,负压创面治疗技术(NPWT)已被应用于各种急慢性创面治疗及皮片移植术前后的处理,其能改善创面微循环及促进移植皮片的成活,并加速创面愈合[1],但作用机制仍不完全明确[2]。负压治疗中拉伸力的大小尚无定论。本实验通过观察静态培养及不同拉伸力加载下体外培养的人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)增殖情况,检测其相关生长因子及基因,探讨外加不同拉伸力对人血管内皮细胞增殖的影响及与创面愈合的关系。
1 材料与方法
1.1 实验材料
人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)。
1.2 主要试剂和仪器
DMEM培养基:Hyclone(SH30243.01B);胎牛血清:Hyclone(SH30070.03);CCK-8试剂盒:Sigma(96992);qPCR Kit(SYBR Premix Ex Taq):Takara(RR820A);Flk-1抗体:Proteintech(26415-1-AP);Tie-2抗体:Proteintech(19157-1-AP);外加载力学系统:UniFlex Culture Plate-Collagen Type I:Flexcellint(UF-4001C-Each);细胞培养箱:Thermo Scientific(8000);倒置拍照显微镜:Leica(DMI3000B);7900 / Viia7型实时荧光定量PCR仪:ABI。
1.3 实验方法
1.3.1 实验分组 实验分为6组,HUVEC接种于Uniflex单向应力培养板贴壁后,A组正常培养24 h;B、C、D、E、F组加载FX-5000T应力系统培养24 h,B组伸展度为5%,30 转/min;C组伸展度为10%,30 转/min;D组伸展度为15%,30 转/min;E组伸展度为20%,30 转/min;F组伸展度为30%,30 转/min(细胞上机前饥饿12 h,重新上机时再加入10% FBS,刺激24 h后,取出进行后续检测)。
1.3.2 CCK-8检测细胞活性 制备细胞悬液,并对不同组进行不同处理培养。继续培养1 h(每隔0.5 h观察1次,1 h为最佳时间点),用酶标仪测定在450 nm处的吸光度。
1.3.3 qRT-PCR检测血管内皮细胞中VEGF、Flk-1、Tie-2的表达 用Trizol-离心柱法提取组织总RNA,取RNA溶液检测,观察A260/A280 、A260/A230比值及连续波长吸收峰,并计算RNA溶液浓度,判断RNA提取质量:需2.0 表1 各基因引物序列 荧光定量PCR扩增条件的设置:扩增曲线:95 ℃ / 2 min/转;94 ℃/20 s,60 ℃/20 s,72 ℃/30 s,40 转。熔解曲线:95 ℃, 15 s;60 ℃, 30 s;95 ℃, 15 s。结果数据采用2-△△Ct法进行分析。 1.3.4 WB检测血管内皮细胞Flk-1、Tie-2蛋白表达 根据样本细胞量提取总蛋白,并根据标准曲线计算样品的蛋白浓度。随后通过蛋白变性后电泳使染料至分离胶适当位置,行电转移及放入化学发光成像系统免疫印迹显色。 各组细胞CCK-8检测结果比较差异有统计学意义(P<0.05)。与A组比较,其余各组细胞活性下降,且拉伸力越高细胞活性越低,说明过大拉伸力可能会抑制HUVEC活性而影响细胞的增殖(图1)。 图1 不同拉伸力对血管内皮细胞活性的影响 注:与A组比较,**P<0.01;与B组比较,#P<0.05,##P<0.01 与A组比较,其余各组细胞内Flk-1、Tie-2的蛋白表达呈下调趋势,且呈现一定的剂量依赖性,即应力越高,Flk-1、Tie-2的蛋白表达越低,表明应力能够抑制HUVEC内Flk-1、Tie-2的蛋白表达,且应力越大,抑制作用越强(图2~3)。 图2 各组细胞Flk-1、Tie-2的WB结果 图3 不同应力对血管内皮细胞中Flk-1、Tie-2蛋白表达影响 注:A:不同应力对血管内皮细胞中Flk-1蛋白表达影响;B:不同应力对血管内皮细胞中Tie-2蛋白表达影响。与A组比较,*P<0.05,**P<0.01; 与B组比较,##P<0.01; 与C组比较,^^P<0.01; 与E组比较,&&P<0.01; 与F组比较,++P<0.01 与A组比较,其余各组细胞内VEGF、Flk-1、Tie-2基因的表达呈不同程度下调趋势,且拉伸力越大,VEGF、Flk-1、Tie-2的表达越低,表明过大拉伸力可能会抑制HUVEC细胞内VEGF、Flk-1、Tie-2的表达,进而影响HUVEC细胞的正常功能(图4)。 注:A:相对的VEGFmRNA水平比较;B:相对的Flk-1 mRNA水平比较;C:相对的Tie-2 mRNA水平比较。与A组比较,*P<0.05,**P<0.01; 与B组比较,##P<0.01; 与C组比较,^P<0.05,^^P<0.01; 与E组比较,&&P<0.01; 与F组比较,++P<0.01 血管由3个主要层组成:内膜,中膜和外膜。血管内皮细胞是覆盖在血管内膜表面的连续单层细胞,是连接血流和血管壁的重要结构,在血管生成中起主要作用,它们参与微血管形成、发芽、迁移及管腔结构的形成和功能重建。它既是感应细胞又是效应细胞,不仅能感受血液中的各种炎症信号、激素水平、剪切应力、压力等信息,而且能通过分泌多种血管活性物质对这些信息作出反应和影响。由于心脏泵送运动的脉动性质,如剪切力和拉伸应力的血流动力学力量连续作用在血管上,对血管内皮细胞的形态、结构、功能等产生了较大的影响,最终影响新血管的生成。以前的研究集中在剪切应力对血管内皮细胞的病理学影响,然而拉伸的作用尚未深入研究[3]。 不同强度的机械拉伸由细胞表面上的机械感受器检测到,其能够将外部机械刺激转化为细胞中的生化信号,激活下游信号通路。该激活可根据细胞是否暴露于生理或病理性拉伸强度而变化。与正常生理功能相关的实质性拉伸在维持血管内环境稳定中至关重要,因其参与调节细胞结构、血管发生、血管紧张素的增殖和控制[4]。例如,在HUVECs和RCMECs中,发现生理上的拉伸已上调了关键的酪氨酸激酶受体如Flk-1,Tie-2和Tie-1[5]。这些受体对生长因子敏感,并起到诱导新血管形成的作用。然而,在高血压期间,升高的压力使细胞暴露于过度的机械负荷已被证明是有害的,因其通过形成活性氧物质,炎症和/或凋亡而导致病理学后果,扰乱了正常生理过程,并引起可能导致心血管异常的不适当的细胞反应。 因此,本研究通过模拟生命体内细胞组织生长生物力环境,建立了体外机械力加载装置细胞培养模型,通过调节拉伸强度以模拟生理和病理拉伸幅度,从而了解不同拉伸力下血管内皮细胞的生理生化变化。低幅度拉伸5%~10%为生理拉伸,而15%~20%以上的高幅度拉伸被认为是病理性伸展,并被认为是模拟高血压发生模型[6]。拉伸强度的差异可能激活决定细胞功能,生物学和表型特征不同的下游信号通路。而鉴定涉及这些过程的蛋白质可能有助于阐明涉及与病理性机械拉伸相关的血管疾病的新机制,且可为抵抗机制的负面影响治疗策略提供新见解。 有研究[7]表明,生理状态下的机械拉伸力可促进血管内皮细胞增殖,而病理拉伸激活不同的机制,导致细胞表型的显著变化,加快其凋亡,这可能导致内皮功能障碍,从而成为导致血管疾病发生的原因。但不同应力大小加载体外培养血管内皮细胞生长的实验国内外未有报道,而本实验中>5%拉伸度的拉伸力均对细胞生长起抑制作用,其可能的原因是,血管系统中的血管内皮细胞暴露于复杂力学环境中,并与各种细胞类型,以及各种以旁分泌或自分泌方式循环的血管生成因子,机械力和其他血管活性物质相互作用。由于细胞环境的复杂性,研究血管内皮细胞机械拉伸的具体结果特别复杂[7]。本研究为简化的单一细胞培养方法,只能提供一些可相信的基因、蛋白质信号表型变化以及病理结果,可能有助于阐明一部分涉及与病理性机械拉伸相关的血管疾病的机制,即过大的机械拉伸力可能会抑制内皮细胞的生长,这对之前临床上提到的负压治疗中压力强度的应用范围提出了新的质疑。在临床上使用负压治疗技术,太大的治疗压力强度可能不利于创面血管化的过程。内皮细胞的活动涉及其形态和结构变化、蛋白质合成、细胞增殖、离子通道的活化、细胞机械性质的改变、血管紧张度、血管生成、细胞迁移和基因表达等多个方面[8],设计完全模拟血管环境的实验是不可能的。共培养系统的应用可模拟更准确的复合血管系统,例如血管内皮细胞与SMC密切接触的系统,虽然这些方法仍然有限,但它们可以在机械应力条件下阐明ECs和SMCs之间的相互作用[9]。 而真正的血管内皮细胞相关的机械转导研究还包括感测机械拉伸的受体,信号转导通路以及可能导致细胞外基质重塑,血管生成、细胞增殖、血管张力稳态、活性氧形成、炎症和细胞凋亡等诸多方面。该实验结果指导负压引流治疗的引力尚显证据不足,所以还需设计高度模拟血管内皮细胞环境的反应器,为研究基础细胞活动和验证临床负压解决方案提供一个更有信心的平台[10]。本研究结果还需在动物实验或人体实验中得到更多验证,如使用全基因组表达检测,观测不同应力下基因表达差异等。 [1]柴家科, 申传安. 重视负压伤口治疗技术在烧伤外科中的应用[J]. 中华烧伤杂志, 2015, 31(2):81-83. [2]赵朋. 负压创面治疗分子机制的系统综述[J]. 中华烧伤杂志, 2015, 31(2):97. [3]Chiu J J, Usami S, Chien S. Vascular endothelial responses to altered shear stress: Pathologic implications for atherosclerosis[J]. Ann Med 2009, 41(1): 19-28. [4]Joung I S, Iwamoto M N, Shiu Y T,etal. Cyclic strain modulates tubulogenesis of endothelial cells in a 3D tissue culture model[J]. Microvasc Res, 2006, 71(1): 1-11. [5]Zheng W, Christensen L P, Tomanek R J. Differential effects of cyclic and static stretch on coronary microvascular endothelial cell receptors and vasculogenic/angiogenic responses[J]. Am J Physiol Heart Circ Physiol, 2008, 295(2): H794-H800. [6]Anwar M A, Shalhoub J, Lim C S,etal. The effect of pressure-induced mechanical stretch on vascular wall differential gene expression[J]. J Vasc Res, 2012, 49(6): 463-478. [7]Jufri N F, Mohamedali A, Avolio A,etal. Mechanical stretch: physiological and pathological implications for human vascular endothelial cells[J]. Vasc Cell, 2015, 7:8. [8]Haghighipour N, Tafazzoli-Shadpour M, Shokrgozar M A,etal. Effects of cyclic stretch waveform on endothelial cell morphology using fractal analysis[J]. Artif Organs, 2010, 34(6): 481-490. [9] Wang J H, Goldschmidt-Clermont P, Wille J,etal. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching[J]. J Biomech, 2001, 34(12): 1563-1572. [10] Bachmann B J, Bernardi L, Loosli C,etal. A Novel Bioreactor System for the Assessment of Endothelialization on Deformable Surfaces[J]. Sci Rep, 2016, 6: 38861.
1.4 统计学方法
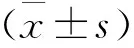
2 结果
2.1 各组细胞CCK-8检测结果

2.2 细胞Flk-1、Tie-2的WB检测结果


2.3 细胞VEGF、Flk-1、Tie-2的qRT-PCR检测结果


3 讨论
