颌面部间隙感染并存糖尿病患者的临床特征分析*
2018-05-02杨忠昕
周 昊,杨忠昕,夏 鑫,费 伟,△
1.四川省人民医院 颌面外科 (成都 610072);2.西南医科大学(泸州 646000)
颌面部间隙感染(maxillofacial space infection,MSI)为口腔颌面外科常见疾病,随着医疗条件提高,此类疾病发病率已经大幅下降,但在临床上也并不少见。MSI常累及颌面部单个间隙或多个间隙,严重者可以引起呼吸道梗阻、纵膈感染、脑脓肿、海绵窦血栓性静脉炎、脓毒血症、败血症等并发症[1]。糖尿病是一组代谢性疾病,由多种病因引起,以慢性高血糖状态为特征,是由于胰岛素分泌缺陷所导致。糖尿病长期以来都被看作是引发宿主免疫力降低的原因之一,机体在高血糖状态下,可加速细菌的生长繁殖,同时引起神经血管病变,使周围组织血氧供应不足,降低局部组织抗感染能力,利于厌氧菌生长,损伤宿主免疫系统,增加感染性疾病的发生率和病死率[2-3]。本研究通过对MSI并存糖尿病患者与MSI未并存糖尿病患者的临床特征进行比较分析,为MSI合并糖尿病患者的临床治疗提供指导,现报道如下。
1 资料与方法
1.1 临床资料
收集2015年1月至2017年5月四川省人民医院颌面外科收治的83例MSI患者病例资料,根据有无患糖尿病,将有明确的糖尿病史和入院后经内分泌科医生诊断为糖尿病的患者分为糖尿病组,将既往无糖尿病史和入院后不能明确诊断为糖尿病的患者分为非糖尿病组。其中,糖尿病组37例,非糖尿病组46例。
1.2 资料收集
研究内容包括患者性别、年龄、感染来源、受累间隙数目、实验室指标、并发症发生率、住院天数和治疗方案,并绘制系统表格,对这些数据进行比较分析。
1.3 统计学方法
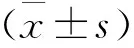
2 结果
2.1 一般情况
本研究共83例患者,其中,男40例,占48.2%,女43例,占51.8%。年龄<60岁者42例(50.6%),年龄≥60岁者41例(49.4%);汉族人共65例(78.3%),藏族人13例(15.7%),其他(包括回族、维吾尔族等)5例(6.0%);居住于城镇33例(39.8%),居住于农村50例(60.2%);糖尿病患者37例(44.6%),无糖尿病患者46例(55.4%);糖尿病组和非糖尿病组年龄比较,差异有统计学意义(P=0.006)。糖尿病组和非糖尿病组平均住院天数分别为(8.40±4.05)d和(11.70±8.48)d,差异有统计学意义(P=0.008)(表1) 。
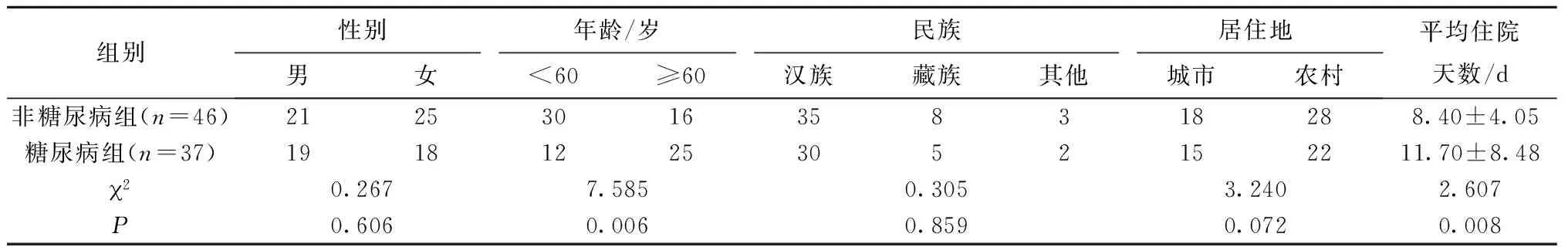
表1 一般资料分析
2.2 感染情况
大多数患者感染来源于牙源性,非牙源性感染中常见的病因是腺源性感染,两组感染来源比较,差异无统计学意义(P=0.890)。颌面部间隙感染累及的间隙通常有咬肌间隙、下颌下间隙、颊间隙、翼下颌间隙、咽旁间隙、颏下间隙、眶下间隙、颞下间隙和颞间隙,两组感染部位比较,差异有统计学意义(P=0.001)(表2)。

表2 感染情况(n)
2.3 实验室检查
入院时糖尿病组与非糖尿病组白细胞计数(WBC)、中性粒细胞计数(NEU)比较,差异无统计学意义(P>0.05)(表3)。

表3 实验室检查
2.4 细菌培养结果
脓液培养结果中,糖尿病组培养出肺炎克雷伯球菌有11例(29.7%),链球菌属4例(10.8%),葡萄球菌属3例(8.1%),厌氧菌3例(8.1%),肠杆菌2例(5.4%);非糖尿病组培养出肺炎克雷伯球菌有4例(8.7%),链球菌属13例(28.3%),葡萄球菌属6例(13.0%),厌氧菌2例(4.3%),念珠菌1例(2.2%);一共有5例患者出现了2种细菌合并感染,其中,糖尿病组4例(10.8%)非糖尿病组1例(2.2%)(表4)。
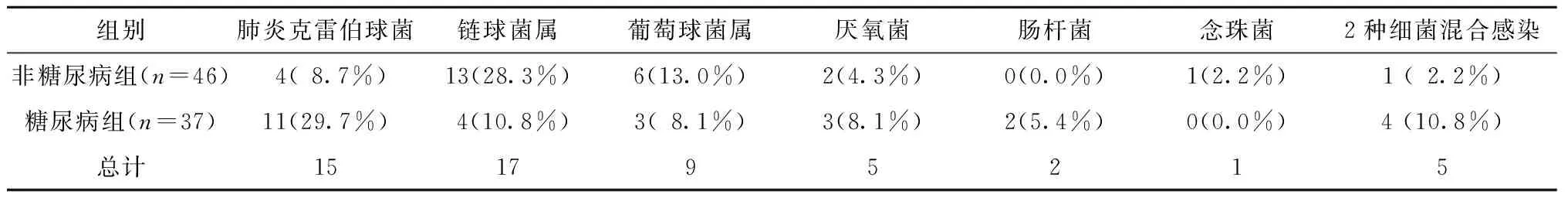
表4 细菌培养结果[n(%)]
2.5 并发症
83例患者中,有22例患者出现了并发症,其中,糖尿病组14例(37.8%),非糖尿病组8例(17.4%),差异有统计学意义(P=0.013) (表5)。
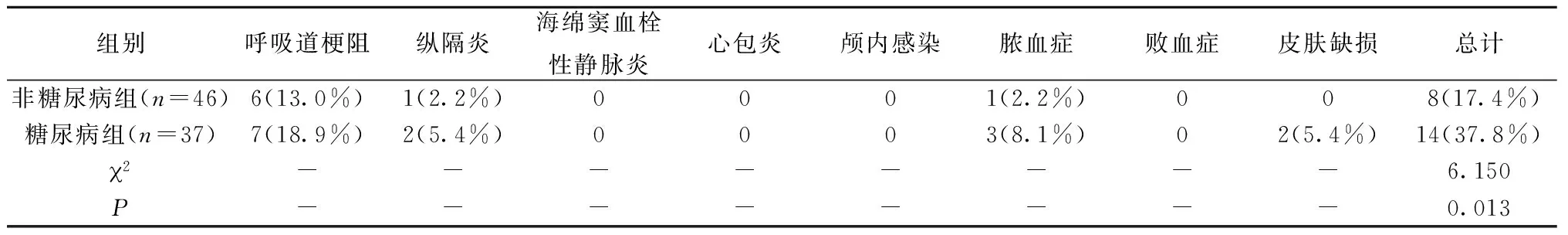
表5 相关并发症[n(%)]
2.6 抗生素治疗方案
入院后所有患者均使用抗生素治疗,确诊糖尿病的患者均请内分泌科会诊用药控制血糖水平。35例患者在后续治疗中使用了更高级的抗生素(喹诺酮类,氨基糖苷类),糖尿病组25例(67.6%),非糖尿病组10例(21.7%),两组间比较,差异有统计学意义(P<0.001)。有48名患者采用了两联用药,糖尿病组30(81.1%)例,非糖尿病组18(39.1%)例,两组间比较,差异有统计学意义(P<0.001)(表6)。
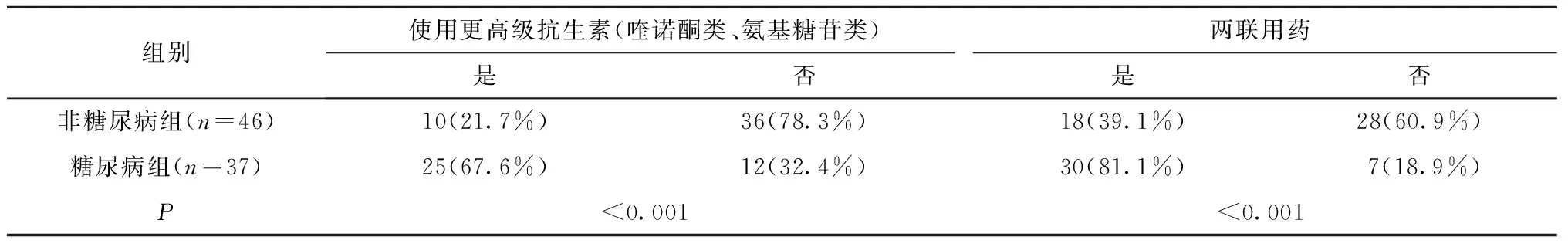
表6 抗生素治疗方案[n(%)]
3 讨论
颌面部间隙感染为口腔颌面部感染的常见类型,其发病急、症状重,如不及时处理,往往造成严重的并发症,甚至危及生命[1,4]。糖尿病是常见的基础代谢性疾病之一,随着社会的进步,生活水平的提高,饮食习惯多样化,健康管理以及口腔保健知识缺乏,糖尿病患者越来越多[5-6]。糖尿病患者血糖控制不佳,导致自身免疫力的降低,而感染又是一种应激反应,使糖皮质激素、胰高血糖素及生长激素升高,糖皮质激素分泌增多又可促进糖异生,而且增加胰岛素的抵抗,糖尿病与感染相互影响,加重患者病情[7-8]。因此,当颌面部间隙感染患者合并糖尿病时,了解其临床症状特点,有针对性治疗显得更加重要。
本研究对37例糖尿病与46例非糖尿病MSI患者的临床特征进行了分析,研究发现,糖尿病组患者的年龄更大,差异有统计学意义(P<0.05);两组患者的感染来源均主要来自于牙源性感染,其结果与Cheng等[9]的研究一致。在糖尿病患者中,感染累及2个间隙以上的患者有17例(45.9%),非糖尿病组感染累及2个间隙以上的患者有8例(17.4%),糖尿病组患者的感染程度高于非糖尿病组患者,这与糖尿病人免疫力低下,感染更容易扩散有关[10]。
在实验室检查中发现,糖尿病组检出最常见的细菌为肺炎克雷伯菌(29.7%),其次为链球菌(10.8%),非糖尿病组最常见的为链球菌(28.3%),其次为葡萄球菌(13.0%),这与其他学者研究结果[11-13]一致,但是糖尿病组患者合并两种细菌感染的比例更高。在后续治疗中,糖尿病组有67.6%的患者使用了更高级的抗生素(喹诺酮类,氨基糖苷类),非糖尿病组为21.7%;糖尿病组有81.1%的患者采取了两联用药,非糖尿病组为39.1%。在治疗颌面部间隙感染合并糖尿病的患者时,不但要严格控制血糖水平,更要合理选用抗生素。在未获得准确的细菌培养结果前,以上研究发现能帮助临床医生选择合适的抗生素以缓解患者症状[11-13]。
入院时WBC、NEU实验室指标相比,差异无统计学意义(P>0.05),均高于正常值。糖尿病组患者更容易出现危及生命的并发症,甚至死亡。其中,最常见的为呼吸道梗阻,糖尿病组7例,非糖尿病组6例,颌面部感染所引发的肿胀常常压迫呼吸道,尤其糖尿病患者,病程进展快,在患者出现呼吸道症状时,应及时行脓肿切开引流术,必要时行气管切开术,保证患者呼吸道通畅[14]。
MSI合并糖尿病患者与MSI未合并糖尿病患者相比,患者年龄更大,受累间隙数目更多,并发症发生率更高,住院天数更长。这些临床特征的不同,往往提示患者病情的危重程度,治疗的难易程度,在MSI合并糖尿病患者的临床治疗过程中,应当严格控制血糖,及时切开引流,及时选择合适的抗生素治疗。
[1]张志愿. 口腔颌面外科学[M].第7版.北京:人民卫生出版社,2015:186.
[2]Jang J W, Kim C H, Kim M Y. Analysis of glycosylated hemoglobin (HbA1c) level on maxillofacial fascial space infection in diabetic patients[J].J Korean Assoc Oral Maxillofac Surg, 2015, 41(5): 251.
[3]Kamat R D, Dhupar V, Akkara F,etal. A comparative analysis of odontogenic maxillofacial infections in diabetic and nondiabetic patients: an institutional study[J].J Korean Assoc Oral Maxillofac Surg, 2015, 41(4): 176.
[4]王冕, 丁婕, 董晶, 等. 糖尿病对颌面部间隙感染患者治疗的影响[J]. 医学信息, 2016, 29(12): 86-87.
[5]张莉, 陈涌, 张亮. 口腔颌面部间隙感染糖尿病与非糖尿病的临床诊治对比[J]. 昆明医科大学学报, 2016, 37(12): 94-98.
[6]阴绪超, 耿春芳. 62例糖尿病合并颌面部间隙感染的临床分析[J]. 中国医药指南, 2015, 13(30): 103-104.
[7]Shah P, Vella A, Basu A,etal. Lack of suppression of glucagon contributes to postprandial hyperglycemia in subjects with type 2 diabetes mellitus[J]. J Clin Endocrinol Metab, 2000, 85(11): 4053-4059.
[8]Lunetta M, Di Mauro M, Le Moli R,etal. Effects of octreotide on glycaemic control, glucose disposal, hepatic glucose production and counterregulatory hormones secretion in type 1 and type 2 insulin treated diabetic patients[J]. Diabetes Res Clin Pract, 1997, 38(2): 81-89.
[9]Cheng N C, Tai H C, Chang S C,etal. Necrotizing fasciitis in patients with diabetes mellitus: clinical characteristics and risk factors for mortality[J]. BMC Infect Dis, 2015, 15: 417.
[10] 张伟杰, 郑凌艳, 杨驰, 等. 影响糖尿病患者口腔颌面部多间隙感染治疗结果的因素分析[J]. 中国口腔颌面外科杂志, 2012, 10(3): 217-222.
[11] Huang T T, Tseng F Y, Yeh T H,etal. Factors affecting the bacteriology of deep neck infection: a retrospective study of 128 patients[J]. Acta Otolaryngol, 2006, 126(4): 396-401.
[12] Al-Qamachi L H, Aga H, McMahon J,etal. Microbiology of odontogenic infections in deep neck spaces: a retrospective study[J]. Br J Oral Maxillofac Surg, 2010, 48(1): 37-39.
[13] Hasegawa J, Hidaka H, Tateda M,etal. An analysis of clinical risk factors of deep neck infection[J]. Auris Nasus Larynx, 2011, 38(1): 101-107.
[14] Chang C M, Lu F H, Guo H R,etal. Klebsiella pneumoniae fascial space infections of the head and neck in Taiwan: emphasis on diabetic patients and repetitive infections[J]. J Infect, 2005, 50(1): 34-40.
