白头翁复方灌肠对溃疡性结肠炎模型大鼠MUC2、IL-6及IL-10的影响*
2018-05-02张瑞芳陈朝晖刘海荣刘漪沦刘卫华
张瑞芳,陈朝晖,李 灿,刘海荣,刘漪沦,刘卫华△
1.成都医学院(成都 610500);2.成都医学院第一附属医院 中西医结合科(成都 610500); 3.成都医学院第一附属医院 科研实验中心(成都 610500)
溃疡性结肠炎(UC)是一种病因特殊的慢性非特异性炎症性肠病,临床症状主要包括腹痛、腹泻、黏液血便、里急后重等[1],其病理特征主要表现为结肠黏膜及黏膜下层炎性细胞浸润、伴多发裂隙状溃疡形成。UC病变主要累及乙状结肠与直肠段,呈连续弥漫性分布,病程迁延不愈,病情轻重不同,严重影响患者生活质量。
黏蛋白MUC2是构成肠道黏液层的主要成分,是从人小肠黏膜的cDNA表达文库中克隆得到的一种黏蛋白核心肽基因编码,其在肠腔上皮表面形成一层黏液层,发挥润滑和拮抗致病菌的黏附及侵袭作用[2-3]。IL-6是一种由活化的巨噬细胞、淋巴细胞及上皮细胞等多种细胞产生的一种促炎性细胞因子,通过激活NF-κB使细胞间的黏附分子表达,从而促进炎症性肠病患者体内的中性粒细胞和上皮细胞相互作用,加重炎症过程。IL-10是由单核细胞、巨噬细胞及T淋巴细胞等多种细胞合成并分泌的一种抗炎与免疫抑制性细胞因子,可抑制多种炎性介质释放及促炎细胞因子分泌,发挥免疫调节作用,稳定肠道黏膜内环境,调节细胞因子的平衡[4]。
中医学并无UC的相应病名,但据其腹泻、解黏液脓血便等表现,将其划入中医学的“肠澼、痢疾、便血”等范畴。UC病因及机制尤为复杂,大部分人认为与环境、免疫、遗传、感染、肠道黏膜屏障等多种因素有关[5]。多年来,白头翁汤仍为中医临床治疗UC的常用方法,结合临床经验在其药方基础上加减发展成白头翁复方,为成都医学院第一附属医院常用的灌肠方剂,临床效果佳。本研究观察白头翁复方对UC模型大鼠结肠黏膜炎症反应的抑制作用,检测MUC2、IL-6、IL-10的表达,探讨该方治疗UC的可能机制。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠40只,8~9周,体质量(250±20)g,购自四川成都达硕实验动物有限公司,分笼饲养,自由摄食饮水。
1.2 实验药物及主要试剂仪器
中药白头翁复方,组方:白头翁30 g,黄连30 g,黄柏30 g,秦皮30 g,木香15 g,葛根15 g,茯苓20 g,槐花20 g,地榆20 g,白芨20 g,厚朴20 g(成都医学院第一附属医院中药房);柳氮磺吡啶肠溶片(SASP)(上海信谊天平药业有限公司,规格0.25 g×60 片,批号09161012);三硝基苯磺酸(TNBS)(美国Sigma公司);无水乙醇(分析纯)、兔抗大鼠MUC2单克隆抗体(美国Abcam公司);S-P法免疫组化试剂盒(北京中杉金桥生物技术有限公司,批号K166616F);RNA提取试剂盒(北京索莱宝生物科技有限公司);逆转录试剂盒(Bio-Rad公司,批号0000007526);大鼠β-actin引物(BBI Life Sciences公司,产品编号B661202-0001);Universal SYBR Green Supermix(Bio-Rad公司);ELISA检测试剂盒(贝赛维斯生物科技有限公司);TUNEL细胞凋亡检测试剂盒(上海碧云天生物技术有限公司,产品编号C1088);酶标仪(美国BioTek公司);荧光定量PCR仪、低温高速离心机(美国Thermo公司);小型电子称(沈阳龙腾电子有限公司);正置荧光显微镜、切片机、包埋机(德国Leica公司)。
1.3 分组
实验动物恒温(20 ℃左右)正常适应性饲养1周后,禁食不禁水24 h,采用数字表法随机等分为4组,即正常对照组(CON组)、TNBS造模组(TNBS组)、中药白头翁复方治疗组(ZY组)、SASP治疗组(SASP组),每组各10只。
1.4 模型制备
采用TNBS灌肠制备UC大鼠模型,参考文献[6]及前期预实验,均提示此造模方法有效。将TNBS 100 mg/kg与50%的乙醇等量混合,造模前30 min轻轻按摩大鼠肛周,刺激其排出多余大便后称体质量,腹腔注射10%水合氯醛3.5 mL/kg,麻醉成功后用注射器连接硅胶管,吸取混合液1 mL,硅胶管表面涂抹石蜡油,然后将硅胶管缓缓插入大鼠肛门至4 cm处,缓缓将药液推入,倒提起大鼠尾部,捏紧其肛门,适当改变大鼠体位,保证造模药液与结肠内腔充分接触,持续2 min后平放,注意保暖。待麻醉清醒后归笼,自由饮食。观察7 d后,见大鼠出现不同程度腹泻、解黏液血便。随机选取造模大鼠5只,剖腹摘取直肠和结肠,生理盐水冲洗表面及肠腔后,肉眼观察结肠充血及水肿情况,HE染色确定造模成功。
1.5 药液制备
取中药白头翁复方成药1剂,共250 g生药,加水1 500 mL,浸泡30 min,大火熬沸腾,改用小火煎煮30 min,浓缩得到含生药浓度为0.25 g/mL的药液备用;取SASP 1 g,研碎,溶入20 mL生理盐水中,配置成浓度为50 mg/mL的药液备用,4 ℃保存。
1.6 给药方法
造模成功后,ZY组大鼠每日给予白头翁复方水煎剂2 000 mg/kg灌肠,约2 mL;SASP组每日予SASP 400 mg/kg灌肠,约2 mL;CON组、TNBS组每日给予生理盐水2 mL灌肠,1 次/d,连续15 d。
1.7 标本采集
末次给药后,禁食不禁水12 h,眼球取血后处死各组大鼠,血液标本予低温高速离心机离心,离心速度3 000 r/min,离心半径10 cm,离心15 min,吸取上层血清,-80 ℃冻存备用,剖开大鼠腹腔,取肛门上4~8 cm的结肠组织,对结肠进行大体肉眼观察,记录评分,预冷的生理盐水冲洗肠腔,一部分用10%中性甲醛固定,一部分用无酶冻存管冻存于-80 ℃保存备用。
1.8 检测指标
1)一般状态:每天观察大鼠的一般状态(毛色、饮食、精神、活动情况、大便情况),称体质量并记录。进行疾病活动指数(DAI)评分[7](表1),DAI=体质量下降评分+大便性状评分+便血评分。2)结肠黏膜损伤指数(CMDI)评分:CMDI评分参照Luketal标准[8]进行(表2)。3)结肠组织病理学评分:甲醛固定后的组织,流水冲洗过夜,行常规组织脱水、固定、透明、石蜡包埋、切片、HE染色,光镜下观察结肠黏膜病理变化,并采用Dieleman[9]标准行结肠组织病理学评分(表3)。4)结肠组织细胞凋亡情况:采用TUNEL检测大鼠结肠组织细胞凋亡变化,操作流程按照试剂盒说明书进行。根据凋亡细胞分布情况在400倍光镜下,每组切片拍摄5个阳性视野,每个视野计数500个细胞,以计算平均凋亡细胞数所占百分比作为凋亡指数。5)炎症细胞因子检测:采用ELISA法测定大鼠血清IL-6、IL-10水平,操作流程按照试剂盒说明书完成。采用RT-PCR法检测各组大鼠结肠组织IL-6、IL-10基因表达量,以β-actin为内参,IL-6、IL-10引物由四川生工科技有限公司设计并合成(表4)。6)免疫组化检测结肠黏膜组织MUC2的表达:按免疫组化试剂盒说明书操作。MUC2表达于大鼠结肠黏膜表面的上皮细胞、隐窝上皮细胞等,MUC2阳性表达细胞以细胞质着色为主,呈棕黄色、粗颗粒状分布,细胞核不着色。

表1 DAI评分标准
注:正常大便:成形的大便;松散大便:不粘肛周的糊状大便;腹泻:粘肛周的稀水样便

表2 CMDI评分标准

表3 结肠组织病理学评分标准
1.9 统计学方法
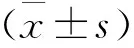
2 结果
2.1 一般状态观察及DAI评分
CON组大鼠毛色光泽,精神良好,运动活跃,饮食量大,均无腹泻及血便。TNBS组大鼠体质量明显下降,食量少,毛色无光泽,精神萎靡、少动、喜蜷缩,弓背扎堆,出现不同程度的大便松散或腹泻,部分有肉眼血便。给药后,以上症状ZY组和SASP组较TNBS组均有不同程度改善,体质量逐渐增加,毛色恢复光泽,精神逐渐好转,反应灵敏,活动量增加,大便逐渐成形,各组间比较差异有统计学意义(F=66.470,P<0.001),与CON组比较,其他组DAI评分较高,且TNBS组高于ZY组和SASP组(P<0.01)(图1)。
2.2 各组大鼠结肠黏膜损伤情况
TNBS组大鼠结肠组织与周围脏器黏连严重,肠管变粗,肠壁增厚,充血水肿明显,有溃疡形成,部分糜烂面有黑黄色附着物;ZY组及SASP组仍有轻度水肿,但未见糜烂面;各组间比较差异有统计学意义(F=30.160,P<0.001),与CON组比较,其他组CMDI评分较高,且TNBS组高于ZY组和SAPA组(P<0.05或P<0.01),说明中药及SASP治疗后均可以减轻UC模型大鼠结肠黏膜损伤程度(图2)。
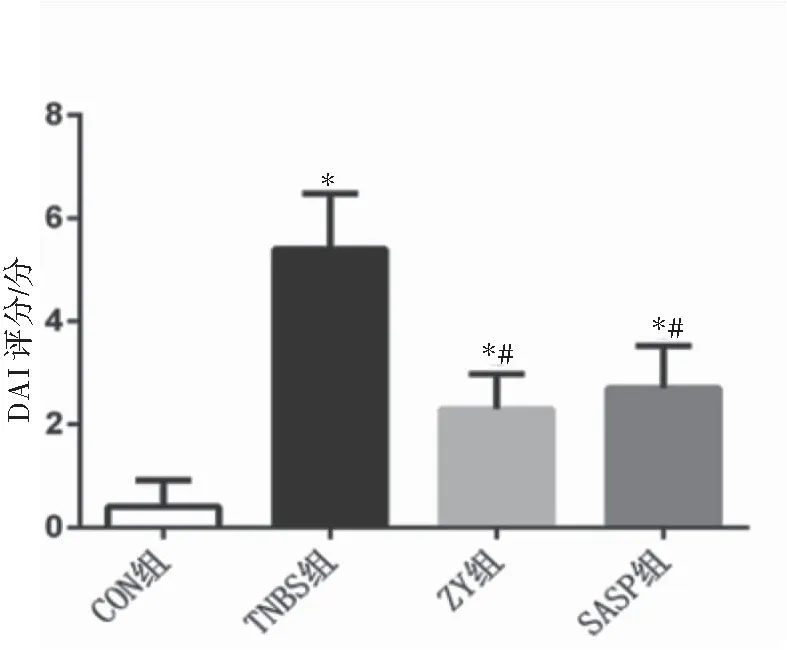
图1 大鼠DAI评分结果注:与CON组比较,*P<0.01;与TNBS组比较,#P<0.01

图2 各组大鼠结肠黏膜损伤情况注:A:大鼠结肠黏膜肉眼大体观察;B:大鼠CMDI评分情况;与CON组比较,*P<0.01;与TNBS组比较,#P<0.01,&P<0.05
2.3 大鼠结肠黏膜病理组织学变化及细胞凋亡情况
HE染色:CON组大鼠结肠组织病理形态表现正常,腺体结构完整,排列整齐,无炎性细胞浸润,黏膜下层无水肿;TNBS组大鼠结肠组织结构破坏严重,腺体形态不规则,可见明显裂隙状溃疡形成,炎性细胞浸润明显,黏膜下层水肿;ZY组腺体结构稍规整,黏膜下层轻微水肿,部分区域可见糜烂,无明显溃疡形成,但也见少量炎细胞浸润;各组间比较差异有统计学意义(F=34.680,P<0.001),与TNBS组相比,ZY组炎症程度明显减轻,SASP组炎性细胞浸润程度、腺体修复程度也有不同程度改善;与CON组比较,其他组结肠黏膜组织病理学评分较高,且TNBS组高于ZY组和SASP组(P<0.01)。TUNEL染色:与CON组比较,其他组细胞凋亡明显,且TNBS组多于ZY组和SASP组(F=271.500,P<0.01)(图3)。
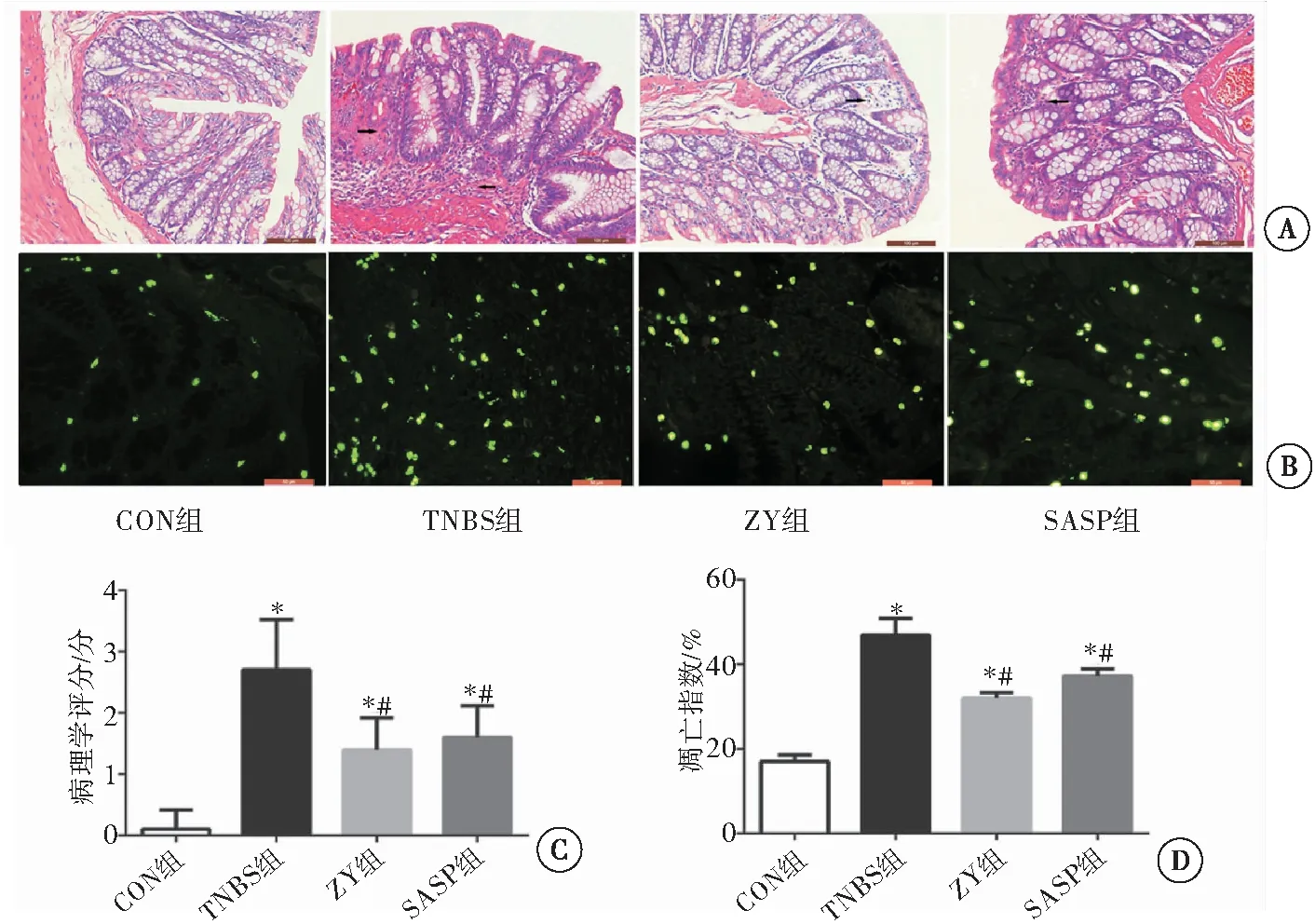
图3 各组大鼠结肠黏膜病理组织学变化及细胞凋亡情况
注:A:HE染色(×200);B: TUNEL染色(×400);C:大鼠结肠黏膜病理学评分;D:大鼠结肠组织细胞凋亡情况;与CON组比较,*P<0.01;与TNBS组比较,#P<0.01
2.4 炎症细胞因子IL-6、IL-10测定
与CON组比较,其他组IL-6 mRNA表达升高(F=33.720,P<0.001),IL-10 mRNA表达下降(F=30.820,P<0.001),且TNBS组变化更明显(P<0.05)。与CON组比较,其他组血清IL-6水平升高(F=88.860,P<0.001),血清IL-10水平下降(F=54.970,P<0.001),且TNBS组变化更明显(P<0.05或P<0.01)(图4)。

图4 各组大鼠炎症细胞因子IL-6、IL-10测定
注:A:IL-6 mRNA相对表达量;B: IL-10 mRNA相对表达量;C:血清IL-6 表达水平;D:血清IL-10表达水平;与CON组比较,*P<0.01;与TNBS组比较,#P<0.01,&P<0.05
2.5 免疫组化检测MUC2表达
与CON组相比,TNBS组MUC2在黏膜表面上皮、隐窝上皮及上皮增生处的表达减少,细胞质着色呈浅棕黄色,颗粒细小;与TNBS组相比,ZY组和SASP组结肠黏膜MUC2表达增多,细胞质着色呈棕黄色,颗粒稍粗。与SASP组比较,ZY组的MUC2表达量稍增多,细胞质着色加深,粗颗粒增多(图5)。

3 讨论
研究[10]发现,UC的发病是多因素、多环节相互作用的结果,其发病与机体免疫调节异常及黏膜屏障失衡关系密切,机体免疫应答过程中细胞因子起到免疫细胞间相互联系的纽带作用,同时促炎症细胞因子(TNF-α、IL-6等)与免疫调节细胞因子(IL-10、TGF-β等)的比例失衡也是引起异常免疫应答的重要方面。近些年,研究[11]证明,如果阻断或抑制过激的免疫反应,或抑制参与的某些细胞因子、炎性介质,均可缓解病情;同时,肠道黏膜系统的免疫反应过程中,抗炎症细胞因子通过平衡促炎症细胞因子的作用而限制炎症发展,二者平衡被打破,可以引起结肠免疫功能紊乱,促使结肠黏膜损伤,引起炎症,产生一系列临床症状,故增强抗炎细胞因子的活性亦能缓解UC病情。另外,临床应用细胞因子拮抗剂治疗UC有一定效果,亦可以证明UC的发病与某些细胞因子有较密切关系,故在实验或者临床中,通过检测某些细胞因子的水平及基因表达对于评判UC的病情程度及治疗效果有一定意义。
中医多认为本病为标实本虚之证,因感受六淫、饮食失宜、七情内伤等多种病因引起脾胃不足,中焦运化失司,湿热内壅,阻滞气机,瘀热互结,搏结肠道糟粕,血腐肉败,肠络被损,故症见下痢赤白脓血,其本虚在脾胃,标实在大肠,故归入“肠澼、痢疾”范畴。中医强调整体观,注重标本兼治,治疗UC重在调整人体免疫力,全身及局部免疫力的改变均与其发病密切相关。
白头翁基础方即白头翁、黄连、黄柏、秦皮,是临床治疗湿热痢疾的常用方剂,其不良反应少、可长期应用,对其治疗UC给予了肯定疗效。通过临床治疗UC的经验总结,我院在白头翁汤的基础上,增加木香、葛根、茯苓、槐花、地榆、白芨、厚朴七味中药,即成白头翁复方。其组方以白头翁为君药,具有清热解毒、凉血止痢的作用。有研究[12-13]发现,白头翁不但抗炎抗病毒,还能调节人体免疫力,此外,白头翁还可通过调节炎性因子的平衡及其介导的免疫反应达到治疗UC的功效。黄连性苦寒,清热燥湿、泻火解毒,且黄连所含成分小檗碱有较好的止泻疗效,故黄连为临床止痢的要药,黄柏功用清下焦湿热,荡涤肠道[14],二者除具有抗菌、抗病毒之效,还有促进溃疡愈合、调节免疫的功效[15]。秦皮清燥湿、敛肠止痢。茯苓健脾利湿,并能增强机体免疫[16]。地榆止血。槐花性凉,善清大肠之火,行凉血止血之功。厚朴下气除痞,理气通腑。木香行气止痛。白芨有收敛、凉血止血、消肿生肌之效,可促进溃疡愈合。葛根有生津、退热、升阳止泻之功[17],其主要成分为葛根素,有研究[18-19]表明,其能提高机体免疫力,具有较好的抗氧化活性。以上多药合用,相辅相成,共同发挥清热祛湿、凉血止泻、化腐生肌的功效。
在炎症性肠道疾病中,肠黏膜屏障功能受损,通透性增加,肠腔内有毒物质进入肠黏膜与促炎症细胞因子的增加密切相关[20-21]。Mitsuyama等[22]研究发现,血清IL-6的水平在UC中升高,它与其他炎症细胞因子一起介导了UC的炎症反应。魏思忱等[23]研究发现,活动期UC患者血清IL-10水平降低,其中,病变范围广、病情严重者明显降低,血清IL-10的表达下调使抑炎作用减弱,表明IL-10可减轻UC的炎症过程,从而维持肠道正常黏膜免疫平衡。有研究[24]指出,敲除MUC2基因的小鼠可引起自发性结肠炎。由此可见,MUC2具有直接保护肠黏膜的作用[25]。当MUC2水平发生改变,肠道屏障将会受到影响,通透性增大,导致肠腔内的内毒素、抗原等促炎物质进入肠黏膜固有层,进一步引起细胞损伤,结肠黏膜破坏,最终导致结肠炎发生。炎症细胞及发生部位均与炎症反应、细胞因子密切相关,说明UC存在上皮细胞、巨噬细胞、单核细胞的异常激活及炎性细胞因子的表达失衡,此过程可能与MUC2表达量减少,从而使其对结肠黏膜的保护作用降低有关联。
本研究证实,白头翁复方可明显降低UC模型大鼠结肠组织中IL-6的表达,上调MUC2、IL-10的表达,其能保护肠黏膜,促进损伤黏膜的修复,在治疗UC中发挥免疫调节及抗炎、抗氧化作用。另外,应用免疫组化发现,MUC2在水肿区和炎症反应明显区的表面上皮、隐窝上皮表达明显减低。本研究发现,中药白头翁复方灌肠通过对IL-6、IL-10的调节,上调MUC2的表达,增加肠道抗炎能力,对首当其冲的结肠黏膜免疫屏障起作用,减少细菌对黏膜的黏附,防止肠黏膜受到二次打击,增加肠道黏膜免疫屏障的保护功能。此外,本方对UC模型大鼠肠道炎症改善作用较为明显,从大体肉眼及病理组织方面观察推断,白头翁复方可明显减轻UC模型大鼠肠道炎症细胞的浸润,减轻黏膜腺体的损伤,同时可以减少血清及组织IL-6的释放,上调IL-10的水平,达到抗炎作用。因此,白头翁复方对UC的治疗作用机制可能是通过调节细胞因子的水平使肠道免疫紊乱得以恢复,促进炎症消退。
本实验从抑制炎症反应方面研究白头翁复方对UC的治疗作用机制,制备UC的动物模型,通过行为学、形态学观察及对全身和局部炎症指标的观察,发现白头翁复方可能通过降低促炎症细胞因子IL-6表达、促进抑炎症细胞因子IL-10表达、上调MUC2表达,从而增强肠道黏膜免疫屏障和抗炎能力,对UC起到治疗作用。
[1]刘超.丹参注射液联合双歧三联活菌佐治溃疡性结肠炎36例[J].中国药业, 2013, 22(18): 97.
[2]Shet T, Valsangar S, Dhende S.Secretory carcinoma of breast: pattern of MUC 2/MUC 4/MUC 6 expression[J].Breast J, 2013, 19(2): 222-224.
[3]Itoh Y, Kamata-Sakurai M, Denda-Nagai K,etal.Identification and expression of human epiglycanin/MUC21: a novel transmembrane mucin[J].Glycobiology, 2008, 18(1): 74-83.
[4]Mitsuyama K, Tomiyasu N, Takaki K,etal.Interleukin-10 in the pathophysiology of inflammatory bowel disease: increased serum concentrations during the recovery phase[J].Mediators Inflamm , 2006, 2006: 1-7.
[5]陈璐, 周中银.溃疡性结肠炎发病机制的研究进展[J].疑难病杂志, 2016, 15(6): 650-654.
[6]高丽萍, 李荣振, 徐晓冉.参苓白术散治疗溃疡性结肠炎的实验研究[J].社区医学杂志, 2017, 15(5): 14-17.
[7]侯丽娟, 唐方, 王晓红, 等.溃疡性结肠炎模型的建立及影响因素[J].世界华人消化杂志, 2011, 19(31): 3242-3245.
[8]文怀宇, 郑爽, 郎轶咏, 等.灌肠散对大鼠溃疡性结肠炎的治疗作用研究[J].中南药学, 2017, 15(4): 443-446.
[9]Dieleman L A, Palmen M J, Akol H,etal.Chronic experimental colitis induced by dextran sulphate sodium(DSS) is characterized by Th1 and Th2 cytokines[J].Clin Exp Immunol, 1998, 114(3): 385-391.
[10] Fonseca-Camarillo G, Yamamoto-Furusho J K.Immunoregulatory Pathways Involved in Inflammatory Bowel Disease[J].Inflamm Bowel Dis, 2015, 21(9): 2188-2193.
[11] 周国华, 冷明芳, 周红宇, 等.保留灌肠与小剂量SASP联合治疗溃疡性结肠炎的临床研究[J].医学临床研究, 2008, 25(9): 1663-1665.
[12] 吴强, 刘明晖, 孙然, 等.白头翁提取液对溃疡性结肠炎模型大鼠血清TNF-α、IL-10的影响[J].长春中医药大学学报, 2015, 31(5): 919-921.
[13] 袁恩.白头翁汤加味治疗溃疡性结肠炎的疗效及作用机制[J].现代中西医结合杂志, 2014, 23(9): 955-957.
[14] 周治明.复方黄柏液加锡类散保留灌肠治疗慢性溃疡性直肠炎的临床疗效[J].江苏医药, 2016, 42(3): 338-339.
[15] 王彤, 王骁, 范焕芳, 等.白头翁汤对溃疡性结肠炎模型小鼠结肠黏膜及血清TNF-α、IL-6影响[J].辽宁中医药大学学报, 2017, 19(2): 32-35.
[16] 纪云飞, 王瑞君, 李晓波.复方四君子汤的化学成分和药理作用研究进展[J].中草药, 2016, 47(5): 837-843.
[17] 邓烨, 孙新.葛根素的药理作用及不良反应[J].临床医药文献杂志(电子版), 2017, 4(5): 955.
[18] 李博萍, 刘秀丽, 邱倩.葛根素对老年大鼠抗氧化作用的研究[J].实用临床医药杂志, 2017(7): 1-4.
[19] 汪群红, 章灵芝, 徐文伟, 等.葛根素的药理作用与不良反应分析[J].中华中医药学刊, 2015, 33(5): 1185-1187.
[20] Chiu Y H, Lu Y C, Ou C C,etal.Lactobacillus plantarum MYL26 induces endotoxin tolerance phenotype in Caco-2 cells[J].BMC Microbiology, 2013, 13(1): 190.
[21] Dou W, Zhang J, Li H,etal.Plant flavonol isorhamnetin attenuates chemically induced inflammatory bowel disease via a PXR-dependent pathway[J].J Nutr Biochem, 2014, 25(9): 923-933.
[22] Mitsuyama K, Toyonaga A, Sasaki E,etal.Soluble interleukin-6 receptors in inflammatory bowel disease: relation to circulating interleukin-6[J].Gut, 1995, 36(1): 45-49.
[23] 魏思忱, 郑国启, 田树英, 等.IL-10在溃疡性结肠炎患者血清中的表达及意义[J].河北医药, 2010, 32(5): 559-560.
[24] Mizoguchi A, Mizoguchi E.Inflammatory bowel disease, past, present and future: lessons from animal models[J].J Gastroenterol, 2008, 43(1): 1-17.
[25] Lee S , Choi D W, Jang K T,etal.High expression of intestinal-type mucin(MUC2) in intraductal papillary mucinous neoplasms coexisting with extrapancreatic gastrointestinal cancers[J].Pancreas, 2006, 32(2): 186-189.
