紫外线对水溶液中西酞普兰降解的影响因素
2018-05-02李娜,吕娟
李 娜,吕 娟
(上海理工大学环境与建筑学院,上海 200093)
抗抑郁药物是一类较常见的精神类处方药物,主要应用于抑郁症、焦虑症以及精神病等的治疗。其经人体摄入后,排出体外,随污水进入水环境。研究表明,国内城市污水处理厂及医疗废水中均能检测到抗抑郁药物,其在污水处理厂的浓度在ng/L~μg/L[1-2]。西酞普兰(表1)是目前使用较为普遍的抗抑郁药物,具有较低的辛醇水分布系数(log Kow为1.39)和较低的亨利系数,不易挥发也不易被生物富集和颗粒吸附[3-5],且在水环境中的水解、自然光解作用几乎可以忽略[6]。因此,西酞普兰稳定存在于水体中,在地表水、污水处理厂进水中广泛检出[4,7],检出浓度已高达2 000~8 000 ng/L[7]。目前的研究表明,西酞普兰具有干扰人类内分泌系统等毒理效应,并可诱发环境菌群产生抗药性而破坏生态平衡,对生态系统及人类健康产生不可估量的危害[8-11]。此外,还可能会对鱼类、软体动物和原生动物等产生巨大的影响,导致胚胎的异常发育、延缓生理发展等[12]。同时,随着环境中西酞普兰的不断增多,其生态风险性也在不断增大。国内外的调查研究表明,西酞普兰难以被传统的污水处理工艺有效去除[13-14]。因此,研究西酞普兰的降解具有重要的意义。
装置高级氧化技术是一类以产生具有强氧化能力的羟基自由基(·OH)为主要特征的深度氧化技术[15]。·OH可以无选择性地氧化水中的有机物,尤其适用于有毒、有害、难降解有机物的去除[16-18]。UV作为一种成熟的高级氧化技术,在国内外已有大量的应用实例[19]。本研究采用UV工艺降解水体中的西酞普兰,考察了初始浓度、pH、H2O2投加量、水质等因素对西酞普兰降解效能的影响,以期为处理污水中的西酞普兰提供理论基础。

表1 西酞普兰的分子结构式及相关的物理化学性质Tab.1 Molecular Structure and Related Physicochemical Characteristics of Citalopram
1 材料与方法
1.1 试验
试验所用UV反应器为Sterilight Silver(S287RL)。反应器为不锈钢材质,不透光,其尺寸为38.1 cm×6.4 cm,其有效容积为1 200 mL,反应器内嵌UV灯,UV灯的波长为254 nm。
1.2 试验方法
1.2.1 试剂及仪器
试剂:试验中所需的西酞普兰(纯度大于98%)购于Chemservice,美国。
其他试剂:乙腈、甲醇(色谱纯)购于Thermo fisher公司;腐植酸、富里酸、叠氮化钠、磷酸、氢氧化钠以及抗坏血酸等为分析纯,均购于国药集团化学试剂有限公司。
仪器:高效液相色谱质谱联用仪(Thermo Scientific)(USA),色谱柱为Hypersil GOLD(100×2.1mm,1.9 μm)。
1.2.2 试验内容
本试验为间歇试验,即将配制的西酞普兰溶液(500 mL)从进水口注入,立刻扭紧旋塞,之后将UV反应器连上电源。UV反应的时间为60 min,每隔5 min从取水口取样,取样体积为2 mL,并立即用0.01 mol/L的抗坏血酸终止水样反应,经0.45 μm的滤膜过滤后,进行分析测定。
1.3 分析方法
采用高效液相色谱质谱联用仪(LC/MS/MS)检测西酞普兰的浓度,仪器检测限为10 μg/L。色谱条件:流动相为乙腈∶超纯水(V/V=60∶40);流速为0.1 mL/min;进样体积为10 μL;柱温为30 ℃。质谱条件:电喷雾电离源电压为3.8 kV;加热毛细血管温度为320 ℃;鞘气(氮气)压力为241.5 kPa;辅助气(氮气)压力为34.5 kPa;碰撞气(氩气)压力为0.16 kPa;碰撞诱导解离电压(CID)为25 eV;正离子检测方式;扫描方式为选择反应监测(SRM),用于定量分析的离子反应分别为m/z 325→m/z 109。
采用TOC/TN测定仪(德国耶拿3100)测定总有机碳(TOC),检测下限为0.5 mg/L。
2 结果与讨论
2.1 初始浓度对UV降解西酞普兰的影响
西酞普兰在环境中的浓度在ng/L,为了方便仪器的检测以及后续降解产物和机理的研究,将西酞普兰的浓度定为μg/L~mg/L,即分别配制100 μg/L、1 mg/L、5 mg/L、10 mg/L的西酞普兰溶液进行UV降解试验,反应液的pH值调至7.0(±0.05),反应时间为60 min。西酞普兰的去除率随反应时间的变化如图1所示。将试验结果采用拟一级动力学进行拟合,结果如表2所示。

图1 起始浓度对UV降解西酞普兰的影响Fig.1 Effect of Initial Concentration on Citalopram Degradation by UV

表2 不同初始浓度下,UV降解西酞普兰的动力学方程及参数Tab.2 Kinetic Equations and Parameters of Citalopram Degradation by UV under Different Initial Citalopram Concentrations
由图1和表2可知,西酞普兰的降解速率与其初始浓度成反比,即药物的初始浓度越高,降解的速率就越低。初始浓度为100 μg/L的西酞普兰,反应40 min几乎被完全去除,其表观一级速率常数为0.061 2 min-1,而1、5、10 mg/L的西酞普兰溶液在反应60 min后被完全去除,其速率常数分别为0.059 7、0.059 4、0.047 8 min-1。其原因为,在反应体中,随着药物初始浓度的提高,单位体积内的西酞普兰分子数量增加,在UV辐射剂量不变的前提下,单位西酞普兰分子获得的能量减少,从而造成了西酞普兰降解速率的减少。
2.2 溶液初始pH对UV降解西酞普兰的影响
在西酞普兰的初始浓度为5 mg/L时,采用H3PO4和NaOH调节溶液的pH值分别为6、7、8、9、10,进行UV降解试验,考察溶液初始pH对降解效果的影响。反应过程中西酞普兰浓度随时间的变化如图2所示。采用拟一级动力学模型对试验结果进行模拟,其相关参数如表3所示。
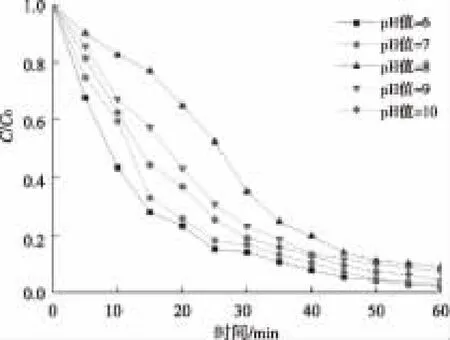
图2 溶液初始pH对UV降解西酞普兰的影响Fig.2 Effect of Initial pH Value on Citalopram Degradation by UV
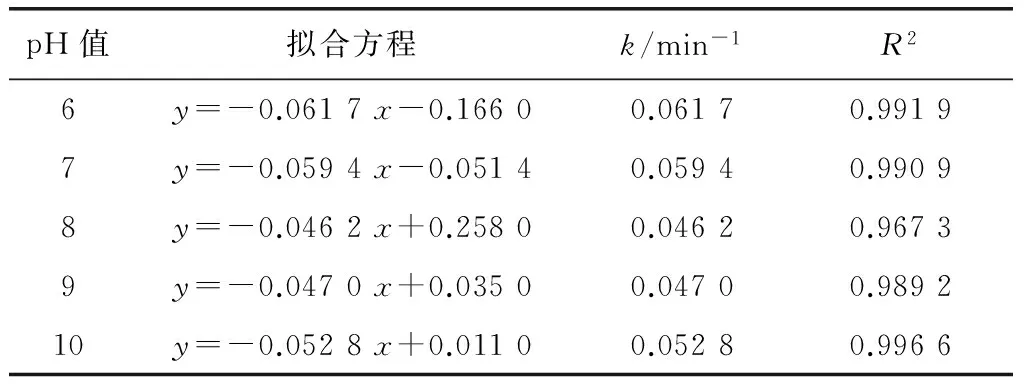
表3 不同pH下,UV降解西酞普兰的动力学方程及参数Tab.3 Kinetic Equations and Parameters of Citalopram Degradation by UV under Different pH Value
由图2和表3可知,溶液pH对UV降解西酞普兰的速率具有一定的影响。西酞普兰在pH值为6时,降解最快,其次为中性条件下,碱性条件下降解较慢,但当pH值进一步提高为10时,西酞普兰的降解速率并未继续降低。
由于西酞普兰的pKa为9.59,可以推测溶液pH值大于9.59时,水溶液中以分子形态存在的西酞普兰较多;当溶液的pH值小于9.59时,西酞普兰发生质子化反应,且质子化程度随着pH的降低而提高。而质子化的西酞普兰具有较高的光活性,从而导致反应在中性、酸性条件下,具有较高的反应速率。在本试验中也观察到酸性及中性条件下的反应速率大于碱性条件的反应速率。但在碱性条件下,pH值为10的反应速率大于pH值为8和9的反应速率,其中的原因有待进一步研究。
此外,研究表明,有机物在UV反应中存在自敏化反应,即在反应过程中会产生活性氧物种(ROS),从而加快有机物降解的速率(具体见2.5.2)。而ROS在酸性条件下的氧化性大于中性和碱性条件下的,因此,在pH值为6时反应的速率最快。
2.3 外加H2O2对UV降解西酞普兰的影响
在西酞普兰初始浓度为5 mg/L、溶液的pH值为7(±0.05)时,加入一定量的H2O2(0.02、0.05、0.1 mmol/L和0.5 mmol/L),考察H2O2对UV降解西酞普兰的影响。为了研究西酞普兰能否被单独的H2O2降解,在西酞普兰溶液中加入1 mol/L的H2O2,在避光条件下进行反应。反应过程中西酞普兰的浓度变化如图3 所示,采用拟一级动力学拟合的结果如表1所示。
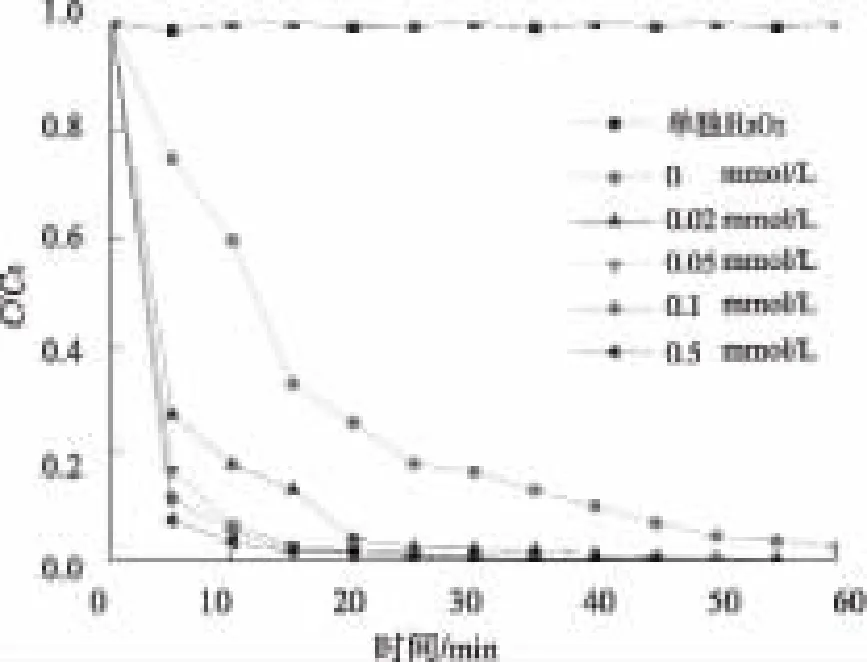
图3 不同剂量H2O2对UV降解西酞普兰的影响Fig.3 Effect of Different H2O2 Dosage on Citalopram Degradation by UV
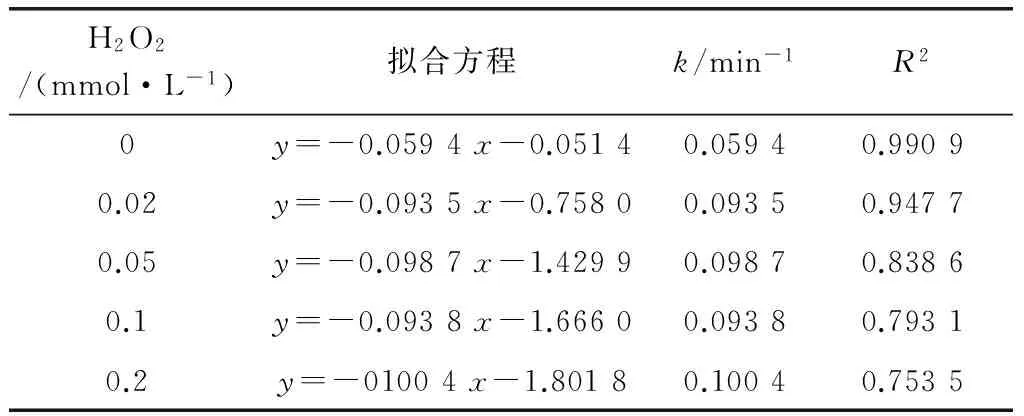
表4 不同剂量H2O2条件下,UV降解西酞普兰的动力学方程及参数Tab.4 Kinetic Equations and Parameters of Citalopram Degradation by UV under Different H2O2 Dosage
由图3可知,单独的H2O2几乎不能降解西酞普兰,而加入一定浓度的H2O2并用UV处理时,能显著提高西酞普兰的降解速率。投加0.02 mmol/L H2O2,反应55 min,西酞普兰的去除率即可达到99.6%;当投加量提高至0.05 mmol/L和0.1 mmol/L H2O2时,西酞普兰的降解速率可进一步提高(表4)。
原因在于,在UV/H2O2体系中,H2O2会在UV的照射下,产生具有强氧化性的·OH,从而促进西酞普兰的快速降解。由此可知,在UV/H2O2体系中,·OH对西酞普兰的降解起到了主要作用。
2.4 水质对西酞普兰降解的影响
2.4.1实际水体中,UV对西酞普兰的降解效能
为考察实际水体中UV降解西酞普兰的情况,以实际水体为背景,研究西酞普兰的UV降解很有必要。试验分别采用超纯水、地表水(上海理工大学花园)以及污水处理厂二级出水(上海曲阳污水处理厂二沉池出水)(水质如表5所示)为原水,外加5 mg/L的西酞普兰进行UV降解试验。试验结果如图4和表6所示。

表5 地表水和二级出水的水质Tab.5 Water Quality of Surface Water and Secondary Effluent

图4 不同水质条件对UV降解西酞普兰的影响Fig.4 Effect of Water Quality on Citalopram Degradation by UV

表6 不同水质条件下,UV降解西酞普兰的动力学方程及参数Tab.6 Kinetic Equation and Parameters of Citalopram Degradation by UV under Different Water Quality Conditions

2.4.2 NOM对UV降解西酞普兰的影响
NOM是实际水体中的常见溶解性有机物,其在环境中的浓度为0.3~30 mg/L,会对物质的氧化降解产生影响。本研究考察了环境中常见的NOM,腐植酸(humic acid,HA)和富里酸(fulvic acid,FA)对UV降解西酞普兰的影响。加入的HA浓度分别为0 、10、30、100 mg/L,加入的FA浓度分别为0 、10、30、50 mg/L。试验结果分别如图5、图6所示,相应的动力学分析如表7、表8所示。
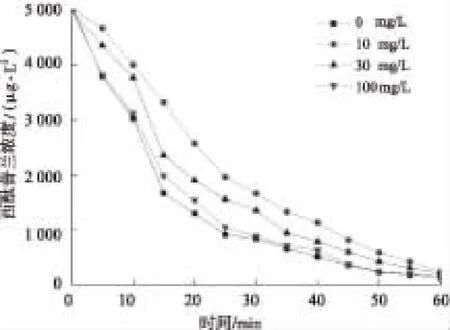
图5 HA对UV降解西酞普兰的影响Fig.5 Effect of HA on Citalopram Degradation by UV
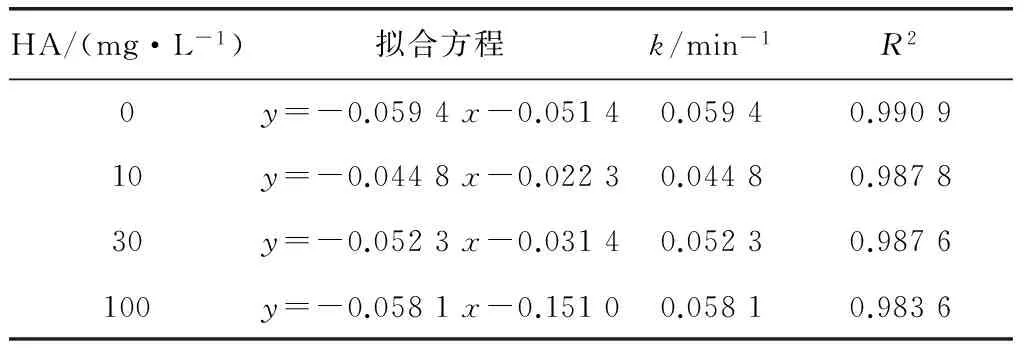
表7 不同HA浓度下, UV降解西酞普兰的动力学方程及参数Tab.7 Kinetic Equations and Parameters of Citalopram Degradation by UV under Different HA Concentrations

表8 不同FA浓度下,UV降解西酞普兰的动力学方程及参数Tab.8 Kinetic Equations and Parameters of Citalopram Degradation by UV under Different FA Concentrations
由表7可知,外加HA对西酞普兰的降解起抑制作用,且其抑制作用随着HA浓度的增大而减弱。由表8可知,外加FA同样会对西酞普兰的降解起抑制作用,但其抑制作用随着FA浓度的增大而增强。
研究表明,NOM对化合物的降解起双重作用。一方面,NOM可以在光照下产生ROS,使一些有机污染物发生光氧化降解[22-23];另一方面,NOM可以在光照条件下激发产生三线态物种,直接敏化降解胺类物质[24]。此外,NOM通过与有机物竞争光的吸收作用,或者与污染物分子发生键合反应等,抑制有机物的降解行为[25]。
在试验中,HA和FA对西酞普兰的降解起到了双重作用:光屏蔽和光敏化。与光敏化作用相比,光屏蔽作用(包括竞争光吸收作用或者键合作用)更为显著。因此,HA和FA对西酞普兰的降解均起抑制作用。另一方面,HA和FA的浓度越大,溶液色度越大,且两者捕获·OH的能力大于西酞普兰,因此FA浓度越大,抑制作用越强,而HA浓度越大,抑制作用越弱,其原因有待进一步研究。
2.5 UV降解西酞普兰机理的初步探讨
2.5.1 反应过程中TOC的变化
当西酞普兰初始浓度为5 mg/L、溶液pH值为7时,考察西酞普兰降解过程中TOC的变化,研究UV降解过程中西酞普兰的矿化程度,试验结果如图7所示。
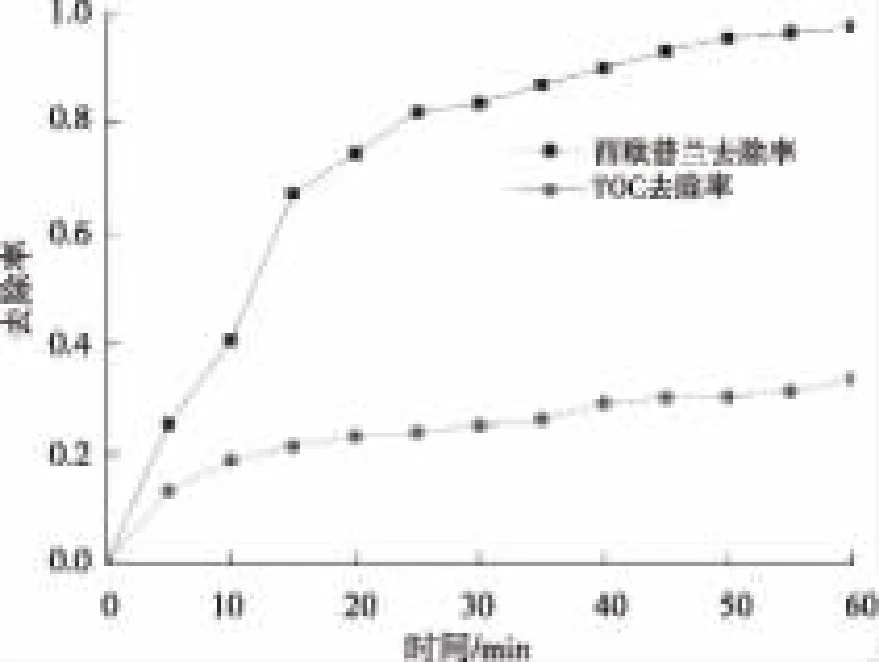
图7 西酞普兰以及TOC的去除率随时间的变化Fig.7 Variation with Time of TOC and Citalopram Removal Rates during Citalopram Degradation by UV
由图7可知,在反应60 min后,西酞普兰的去除率可达97.38%,而TOC的去除率仅为33.58%,即反应后西酞普兰基本被去除,但其矿化度较小。表明UV处理难以将西酞普兰彻底矿化。
2.5.2 淬灭剂对西酞普兰降解的影响
研究表明,水体中的有机污染物能通过吸收光子转移电子和能量,进而产生ROS(活性态氧,包括·OH和1O2等)促进有机污染物的氧化降解,即自敏化降解[26-27]。本研究为考察西酞普兰的降解过程中,是否有自敏化反应参与降解,进行了淬灭试验。试验在西酞普兰初始浓度为5 mg/L、溶液pH值为7、室温条件下进行。分别投加异丙醇(IPA)淬灭反应体系中的·OH,投加叠氮化钠(NaN3)淬灭·OH和1O2。由于IPA和NaN3对西酞普兰光解的抑制作用不同,IPA抑制反应中的·OH,NaN3抑制反应中的·OH和1O2,且NaN3对于·OH的抑制作用更强,因此采用较低浓度的NaN3(0、10、50、100 mg/L)和较高浓度的IPA(0、10、50、100 mmol/L)进行试验。西酞普兰的降解速率随时间的变化如图8和图9所示,拟一级动力学模拟结果如表9和表10所示。

图8 不同剂量IPA对UV降解西酞普兰的影响Fig.8 Effects of Different IPA Dosage on Citalopram Degradation by UV

表9 不同剂量IPA条件下,UV降解西酞普兰的动力学方程及参数Tab.9 Kinetic Equation and Parameters of Citalopram Degradation by UV under Different IPA Dosage
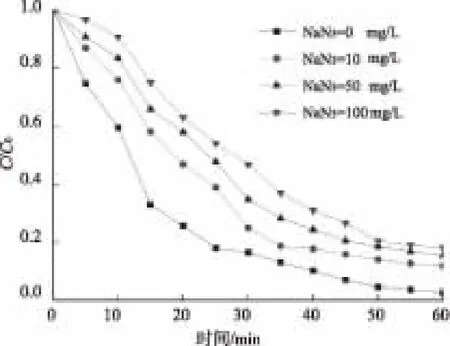
图9 不同剂量NaN3对UV降解西酞普兰的影响Fig.9 Effects of NaN3 Dosage on Citalopram Degradation by UV

表10 不同剂量NaN3条件下,UV降解西酞普兰的动力学方程及参数Tab.10 Kinetic Equation and Parameters of Citalopram Degradation by UV under Different NaN3 Dosage
由表9和表10可知,由于IPA淬灭·OH,明显降低了西酞普兰的降解效率,且IPA投加量越多,对西酞普兰降解的抑制作用越明显。而投加NaN3时,可同时淬灭反应过程中的·OH和1O2,其降解速率常数明显低于投加IPA时(表9、表10)。由此,加入IPA和NaN3可通过淬灭·OH和1O2在不同程度上抑制UV的降解,因此可知,在UV降解西酞普兰的过程中确实存在自敏化反应。
3 结论
(1)UV降解西酞普兰的过程符合拟一级动力学模型,西酞普兰的初始浓度越低,其降解速率越快;西酞普兰的降解速率在弱酸(pH值为6)条件下最大。
(2)外加H2O2可促进西酞普兰的降解,加入的H2O2浓度越大,西酞普兰的降解速率越快。
(3)西酞普兰在超纯水中降解的最快,其次为地表水,其在二级出水中降解的最慢。HA和FA均对西酞普兰的降解有抑制作用。
(4)UV降解西酞普兰的过程中存在自敏化作用。
[1]KASPRZYK H B,DINSDALE R M,GUWY A J.The occurrence of pharmaceuticals,personal care products,endocrine disruptors and illicit drugs in surface water in South Wales,UK [J].Water Research,2008,42(13):3498-3518.
[2]BATT A L,KOSTICH M S,LAZORCHAK J M.Analysis of ecologically relevant pharmaceuticals in wastewater and surface water using selective solid-phase extraction and UPLC/MS/MS [J].Analytical Chemistry,2008,80(13):5021-5030.
[3]SIVA J G,LINO C M,MEISEL L M,et al.Selective serotonin re-uptake inhibitors (SSRIs) in the aquatic environment:An ecopharmacovigilance approach [J].Science of the Total Environment,2012,41(20):185-195.
[4]WRITER J H,FERRE I,BARBER L B,et al.Widespread occurrence of neuro-active pharmaceuticals and metabolites in 24 minnesota rivers and wastewaters [J].Science of the Total Environment,2013,42(11):519-527.
[5]KASPRZYK-HORDERN B,BAKER D R.Enantiomeric profiling of chiral drugs in wastewater and receiving waters [J].Environmental Science & Technology,2012,46(3):1681-1691.
[6]STYRISHAVE B,HALLING-SØRENSEN B,INGERSLEV F.Environmental risk assessment of three selective serotonin reuptake inhibitors in the aquatic environment:A case study including a cocktail scenario [J].Environmental Toxicology and Chemistry,2010,30(1):254-261.
[7]HALLING-SØENSEN B,NORS Nielsen S,LANZKY P F,et al.Occurrence,fate and effects of pharmaceutical substances in the environment—A review [J].Chemosphere,1998,36(2):357-393.
[8]WOLS B A,HOFMAN-CARIS C H M,HARMSEN D J H,et al.Degradation of 40 selected pharmaceuticals by UV/H2O2[J].Water Resource,2013,47(15):5876-5888.
[9]FENT K,WESTON A A,Caminada D.Ecotoxicology of human pharmaceuticals [J].Aquatic Toxicology,2006,76(2):122-159.
[10]JONES O A H,VOULVOULIS N,Lester J N.Comprehensive analytical chemistry,ecotoxicity of pharmaceuticals [M].The Netherland:Elsevier Publishing Company,2007:387-417.
[11]SILVA L J G,PEREURA A M P T,MEISE L M,et al.A one-year follow-up analysis of antidepressants in Portuguese wastewaters:Occurrence and fate,seasonal influence,and risk assessment [J].Science of the Total Environment,2014,43(16):279-287.
[12]SANTOKE H,SONG W,COOPE W J,et al.Advanced oxidation treatment and photochemical fate of selected antidepressant pharmaceuticals in solutions of Suwannee River humic acid [J].Journal of Hazardous Materials,2012,217-218(6):382-390.
[13] LESTER Y,MAMANE H,ZUCKER I,et al.Treating wastewater from a pharmaceutical formulation facility by biological process and ozone [J].Water Research,2013,47(13):4349-4356.
[14] AJEUNESSE A,SMYTH SA,BARCLAY K,et al.Distribution of antidepressant residues in wastewater and biosolids following different treatment processes by municipal wastewater treatment plants in Canada[J].Water Research,2012,46(17):5600-5612.
[15]LUNDSTEDT S,BANDOWE B A M,WILCKE W,et al.First intercomparison study on the analysis of oxygenated polycyclic aromatic hydrocarbons and nitrogen heterocyclic polycyclic aromatic compounds ( N-PACs ) in contaminated soil [J].Trends in Analytical Chemistry,2014,57(5):83-92.
[16]CHANG J,CHEN Z L,WANG Z,et al.Ozonation degradation of micro-cystin-LR in aqueous solution:Intermediates,byproducts and pathways [J].Water Research,2014,63(1):52-61.
[17]ZONG W S,SUN F,SUN X J.Oxidation by-products formation of microcystin-LR exposed to UV/H2O2:Toward the generative mechanism and biological toxicity [J].Water Research,2013,47(9):3211-3219.
[18]HE X X,PELAEZ M,WESTRICK J A,et al.Efficient removal of microcystin-LR by UV-C/H2O2in synthetic and natural water samples [J].Water Research,2012,46(5):1501-1510.
[19]RUBIO-CLEMENTE A,TORRES-Palma R A,PEUELA G A.Removal of polycyclic aromatic hydrocarbons in aqueous environment by chemical treatments:A review [J].Science of the Total Environment,2014,43(8):201-225.
[20]BAI Q,YANG L H,LI R J,et al.Accelerating quinoline biodegradation and oxidation with endogenous electron donors [J].Environmental Science & Technology,2015,49(19):11536-11542.
[21]李海翔,林华,陆兰晶.硝基苯类化合物高级氧化与生物还原处理技术研究[M].北京:中国环境科学出版社,2014.
[22]GONCALVES C,DIMOU A,SAKKAS V,et al.Photolytic degradation of quinalphos in natural waters and on soil matrices under simulated solar irradiation [J].Chemosphere,2006,64(8):1375-1382.
[23]FISHER J,REESE J G,PELLECHIA,et al.Role of Fe(Ш),phosphate,dissolved organic matter,and nitrate during the photodegradation of domoic acid in the marine environment[J].Environmental Science & Technology,2006,40(7):2200-2205.
[24]CHEN Y,HU C,HU X,et al.Indirect photodegradation of amine drugs in aqueous solution under simulated sunlight [J].Environmental Science & Technology,2009,43(8):2760-2765.
[25]JING J Y,LI W Y,BOYD A,et al.Photocatalytic degradation of quinoline in aqueous TiO2suspension[J].Journal of Hazardous Materials,2012,237-238(17):247-255.
[26]COGAN S,HAS Y.Self-sensitized photo-oxidation of para-indenylidene-dihydropyridine derivatives[J].Journal of Photochemistry and Photobiology A:Chemistry,2008,193(1):25-32.
[27]SHARMA V K.Oxidative transformations of environmental pharmaceuticals by Cl2,ClO2,O3,and Fe(VI):Kinetics assessment[J].Chemosphere,2008,73(9):1379-1386.
