狐尾藻净化生猪养殖场沼液的研究
2018-05-02吴晓梅叶美锋吴飞龙林代炎
吴晓梅,叶美锋,吴飞龙,黄 薇,林代炎*
(1.福建省农业科学院农业工程技术研究所,福州 350003;2.福建省农业科学院农业质量标准与检测技术研究所,福州350003)
近年来,随着我国畜牧业持续稳定发展,畜禽养殖规模化集约化水平显著提高,保障了社会需求和养殖户的收入,同时也产生了大量养殖粪污。利用沼气工程可将粪污收集进行厌氧发酵处理,降低畜禽废弃物对环境的影响,但其发酵产物(沼液)具有高浓度CODCr、氮磷等污染物质,处理难度、花费成本较大,导致其不能得到有效处理与利用,甚至有养殖户将其直接排入天然水体,导致地表水、地下水被污染[1]。据资料统计,2014年我国畜禽养殖业的CODCr、总氮(TN)和总磷(TP)排放量分别占农业源总排放量的95.17%、63.37%和76.85%。另也有研究预测,到2020年我国畜禽业污染排放将比2007年增加37%[2],沼液处理处置问题亟待解决。沼液的处理工艺主要包括A/O、SBR、氧化塘、耕地利用等,A/O、SBR工业化处理投资大、技术要求高;氧化塘、耕地利用等方法虽然耗能小、方便管理,但存在占地面积大、受自然环境影响严重、处理效果不稳定等缺点[3],不易被推广。而水生植物因具有较高生产率及对水体有较好净化能力,易收割、可资源化等优点,目前被广泛应用于环境领域处理污水[4]。不同类型水生植物对营养物质吸收积累能力不同,研究表明沉水植物>漂浮植物>挺水植物[5]。沉水植物在光合作用活性期间大量消耗水中的溶解性无机碳,增加溶解氧(DO)浓度,升高pH值,利于氨的挥发和磷的化学沉淀,可对氮磷做短期储存,利于水中有机物的矿化[6-7]。
狐尾藻是一种常见的沉水植物,是水生植被恢复中被优先考虑的先锋物种之一。狐尾藻耐污染能力较强,根系泌氧作用强,对水体中的氮磷等富营养化元素吸收能力好,且其营养价值较高,收割后还可作为优质青饲料再利用,实现水体资源循环与净化作用[8]。当前狐尾藻在富营养化水体的治理方面得到了广泛应用[9-11],但在生猪养殖场沼液上的应用研究相对较少。利用狐尾藻处理沼液,一方面通过自生生长吸收沼液中氮磷等营养物质;另一方面因其根系泌氧作用,提高水体溶氧量,促进水体有机物的降解,保护养殖场生态环境,同步实现资源再利用与污染治理。因此本文以生猪养殖场沼液为水培基质,在半动态进水条件下,探究不同水力停留时间狐尾藻对沼液的净化能力差异,为下一步沼液工程化利用提供理论依据。
1 材料与方法
1.1 试验材料
供试狐尾藻为穗花狐尾藻(Myriophyllum spicatum):多年生沉水性双子叶植物,多裂叶型,具有较低的CO2补偿点和对pH较高的耐受能力,对水体氮磷去除效果明显。狐尾藻取自福清市某人工鱼塘,其理化性质见表1。
供试沼液:来源于福建省福清市某规模化生猪养殖场,其主要污染物浓度见表2。
1.2 试验方法
选取叶子带有光泽、长势良好的狐尾藻,截取顶枝(10~12 cm,外形基本一致),清洗干净放入试验培养箱。培养箱选用直径36 cm、高40 cm的塑料圆桶。试验前将狐尾藻置于5%浓度沼液培养水箱培养,待长芽时开始每日进出水处理,期间观察植株生长状况。试验设置处理组、空白组和对照组,每个处理各设3次重复。

表1 狐尾藻成分分析Table 1 Component analysis of Myriophyllum spicatum
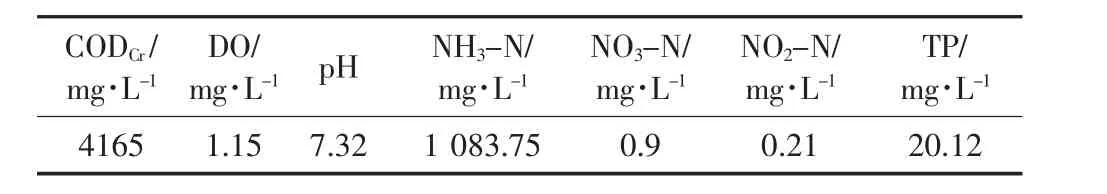
表2 供试沼液的特性Table 2 Characteristics of testing biogas slurry
处理组(Z0、Z1、Z2)用 5%沼液水培,每个培养箱加受试液40 L。Z0:水力停留时间60 d,每日进出水量0.5 L;Z1:水力停留时间40 d,每日进出水量1 L;Z2:水力停留时间20 d,每日进出水量2 L;
空白组(CK)用5%沼液水培。空白组主要是作为在不同水力停留时间下沼液对狐尾藻的生理特性影响的参考,因而不设水力停留时间,其他条件同处理组。
对照组(K0、K1、K2)不放狐尾藻,其他处理同处理组。
上述每日进出水皆为沼液原液。每隔3 d用蒸馏水补充由蒸腾损失的水分(计算方法:第1 d进出水后,在桶对应水位标识,隔3 d后在第4 d同一时间进出水后,根据水位离上一次标识位置距离,补给水量直到水位达到标识水平面。试验正处于春季,气温适宜,试验过程蒸腾损失的水分较小,在计算污染物去除量时忽略不计),每7 d测定一次水样,并观察记录其生长状况,在水力停留时间结束后收获整株植物,用去离子水清洗、晾干。将植物在105℃下杀青30 min,在70℃下烘干至恒重,测量干重,并粉碎过筛,供分析测定用。
1.3 测试指标
狐尾藻生物量用鲜重表示,采用称重法测定。
受试液检测水体相关参数,包括CODCr、pH、溶解氧、温度、氨氮、总磷、硝态氮(NO-3-N)及亚硝态氮(NO-2-N)。CODCr采用重铬酸盐法(HJ 828—2017)测定;溶解氧用便携式溶氧仪测定;pH值及水温分别用雷诺pH计、温度计现场测定;氨氮用纳氏试剂光度法测定;总磷利用钼酸铵分光光度法测定(GB 11893—1989);硝态氮用紫外分光光度法测量;亚硝态氮用重氮偶合分光光度法测定。
1.4 数据处理
污染物去除率公式:
ηi=(C进水-Ci出水)/C进水×100%
式中:ηi为第i日污染去除率,%;C进水为进水污染物浓度,mg·L-1;Ci出水为第 i日出水后污染物浓度,mg·L-1。
所有指标均取3次平均值,并求出标准差,采用Origin 7.5和SPSS 22.0软件进行数据分析,显著性差异分析采用One-way ANOVA分析方法。
2 结果与分析
2.1 不同处理对狐尾藻生物量的影响

图1不同处理对狐尾藻生物量的影响Figure 1 Effects of different treatments on the biomass of Myriophyllum spicatum
图1 为不同处理对狐尾藻生物量的影响,前两周各处理的狐尾藻增长速率都大于CK,第三周Z1和Z2处理狐尾藻增长速率开始变缓并小于CK处理,第四周开始这3组狐尾藻长势不良,开始出现死亡腐烂,Z1、Z2两组增长速率呈现负值。随着水力停留时间的增加,Z0处理生物量增长速率呈现先增后减的趋势,其生物量在第六周即42 d时,达到最大1475 g,增长了24.6倍,是CK处理的4.9倍;其次是Z1,其最大生物量出现在第三周,为415.0 g,增长了6.9倍,是CK处理的1.6倍;Z2出现的最大生物量为233.3 g,仅增长了3.9倍,是CK处理的0.9倍,出现在第三周;第四周开始Z1和Z2处理生物量出现不同程度的降低,增长率出现负值。Z0的最大生物量最高,是CK处理最大生物量的4.44倍、Z1处理最大生物量的3.55倍、Z2处理最大生物量的6.32倍。
图2是试验期间水体温度的变化。试验期间最高温度平均值是27.46℃,最低温度平均值为19.64℃,该温度波动均在狐尾藻合适的生长温度范围内。因而本文中狐尾藻生长的主要影响因素还是沼液水质和污染物浓度。2017年5月7日的水体温度最低为1℃,主要原因是当日最低温度为-1℃,背景温度较低,夜间水温读数较低。

图2试验期间水体温度Figure 2 Water temperature during the test
2.2 不同处理植株氮磷钾变化
图3 为不同处理狐尾藻植株体内氮磷钾变化。不同的水力停留时间对狐尾藻氮磷钾含量影响不同,随着水力停留时间的增加,狐尾藻体内氮磷钾含量均呈现先增后减的变化趋势,但全氮和全磷含量的变化幅度较小。
从图3a中可以看出,试验结束后各处理狐尾藻体内全氮含量关系为Z1>Z2>Z0>CK,处理组狐尾藻体内全氮含量明显高于CK,其中Z1处理全氮含量最高为7.69%,是CK处理的2.00倍,CK处理全氮含量最低为3.85%。图3b为各处理狐尾藻体内全磷含量,全磷含量关系为Z1>Z2>Z0>CK,各处理植株全磷含量都高于CK,但各处理之间全磷含量没有显著差异。由此表明,20 d以上的水力停留时间对植株全磷含量的增加影响不大。Z1处理狐尾藻全磷含量最高为0.97%,是CK的1.90倍,CK处理狐尾藻全磷含量最低为0.51%。图3c为各处理狐尾藻体内全钾含量变化,各处理关系为Z1>Z0>Z2>CK,处理组狐尾藻体内全钾含量都高于CK。Z1全钾含量最高为1.97%,是CK的1.88倍。Z2处理全钾含量最低为1.42%,是CK的1.35倍。Z1处理即每日进出水为1 L·d-1时,狐尾藻氮磷钾含量可达最大,分别为7.69%、0.97%及1.97%。

图3 不同水力停留时间狐尾藻体内氮磷钾变化Figure 3 The NPK changes of Myriophyllum spicatum in different hydraulic retention time(HRT)
2.3 不同处理水体CODCr的变化
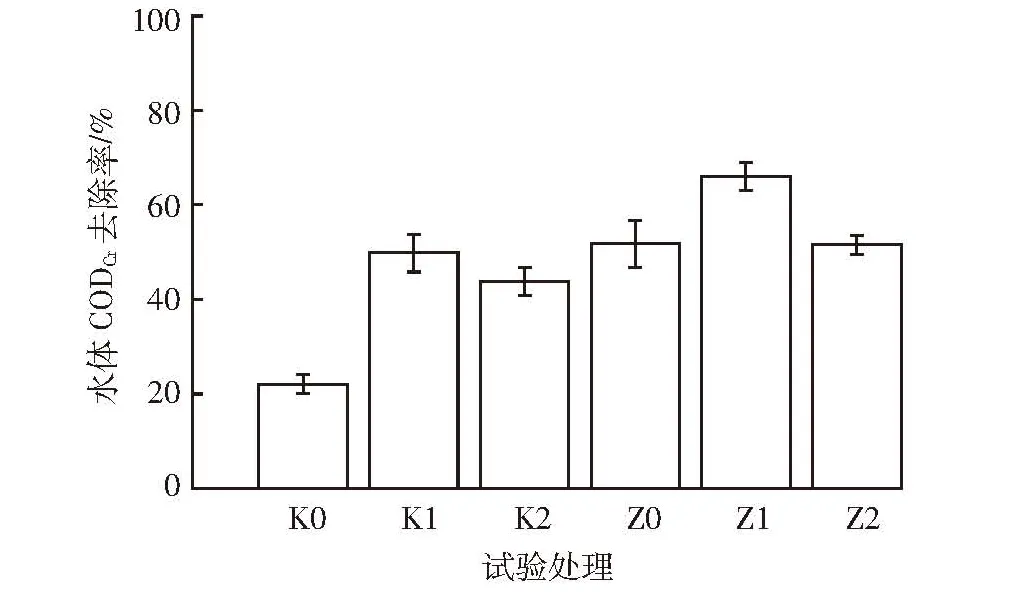
图4不同水力停留时间处理水体CODCr的去除率Figure 4 CODCrremoval rate of water in different HRT
图4 为不同处理水体CODCr的去除率。栽培狐尾藻的处理组对CODCr的去除能力都高于对照组,由此可见狐尾藻有利于水体CODCr的去除。各处理对CODCr去除率的关系为 Z1>Z0>Z2>K1>K2>K0,Z1 处理对水体CODCr的去除率最高,为65.99%,K0去除率最低,为22.06%。对照组中K1处理对水体CODCr的去除率在同组中最高,为49.84%,这表明水力停留时间为 40 d(沼液进出水量为 1 L·d-1)时,狐尾藻对水体CODCr的去除效果最好。
2.4 不同处理水体氨氮的变化
图5为不同处理水体氨氮的变化。各处理对水体氨氮去除率关系为 Z1>Z0>K1>K0>Z2>K2,其中进出沼液水量为1 L·d-1时,狐尾藻对水体氨氮的去除效果最好,去除率可达59.54%。同一处理组中,Z2处理(水力停留时间为20 d)对水体氨氮去除率为39.72%,去除效果不及其他处理。另结合图1狐尾藻的生物量,可以得出本试验狐尾藻氨氮耐受值:当水体氨氮浓度超过220.00 mg·L-1时,狐尾藻的生长受到抑制,增速明显变缓;当水体氨氮浓度超过368.17 mg·L-1时,狐尾藻出现生长量锐减;当水体氨氮浓度超过450.00 mg·L-1时,狐尾藻呈现大面积氨中毒症状,大量死亡。
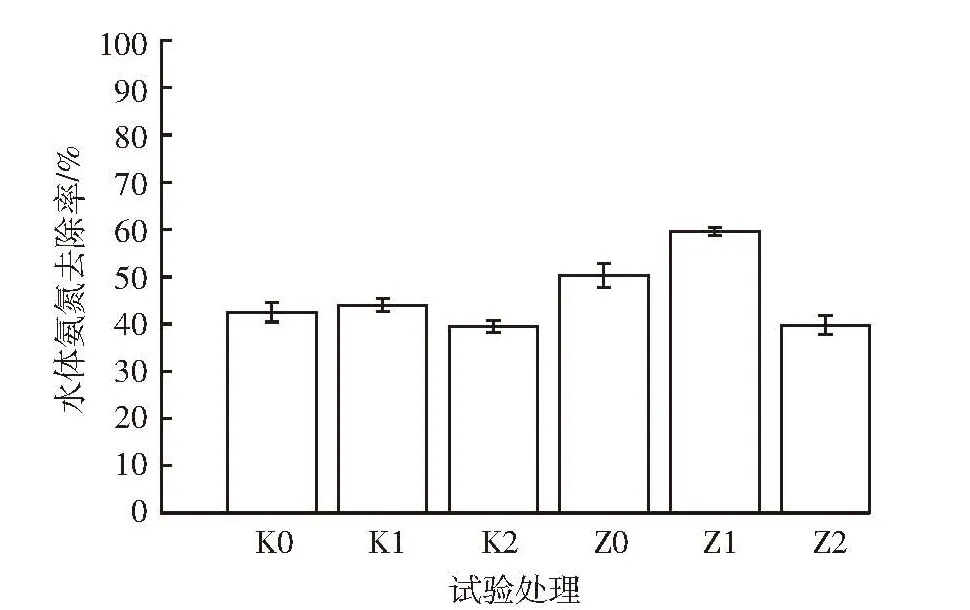
图5不同水力停留时间处理水体氨氮的去除率Figure 5 NH3-N removal rate of water in different HRT
2.5 不同处理水体硝态氮和亚硝态氮的变化
图6 为不同处理水体硝态氮和亚硝态氮的变化。对照组和处理组硝态氮和亚硝态氮含量较初始水样都有不同程度的增加。其中硝态氮增长率最大为Z1处理,可达393%,增长最少的是K2处理,仅为32.9%;亚硝态氮增长率最大的是K0处理,为350%,最小的为Z2处理,为53.24%。
2.6 不同处理水体总磷的变化
图7为不同处理水体总磷的去除率。从图中可以看出Z1处理对总磷的去除率最高,为90.06%,其次为Z0处理(78.98%),去除率最小的是Z2处理(43.29%),Z2处理对总磷的去除率低于对照组。对于对照组,水体总磷去除率最大的是K1处理,为65.81%,所以当水力停留时间为40 d(沼液进出量为1 L·d-1)时,狐尾藻或生物处理对水体总磷有较高的去除率。
2.7 不同处理水体性质的变化
从图8可以看出,各处理的pH值变化趋势相近,且波动幅度不大,总体为小幅增加。变化最大的是K0处理,pH值从8.32升到8.76;Z0处理的变化幅度最小,从7.32降到7.27。各处理水体溶解氧随着时间变化整体呈现下降趋势,其中处理组水体溶氧量整体低于对照组。试验结束时,对照组K0水体出水溶解氧含量最大,为15.18 mg·L-1,处理组Z1溶氧值最小,为 1.16 mg·L-1。
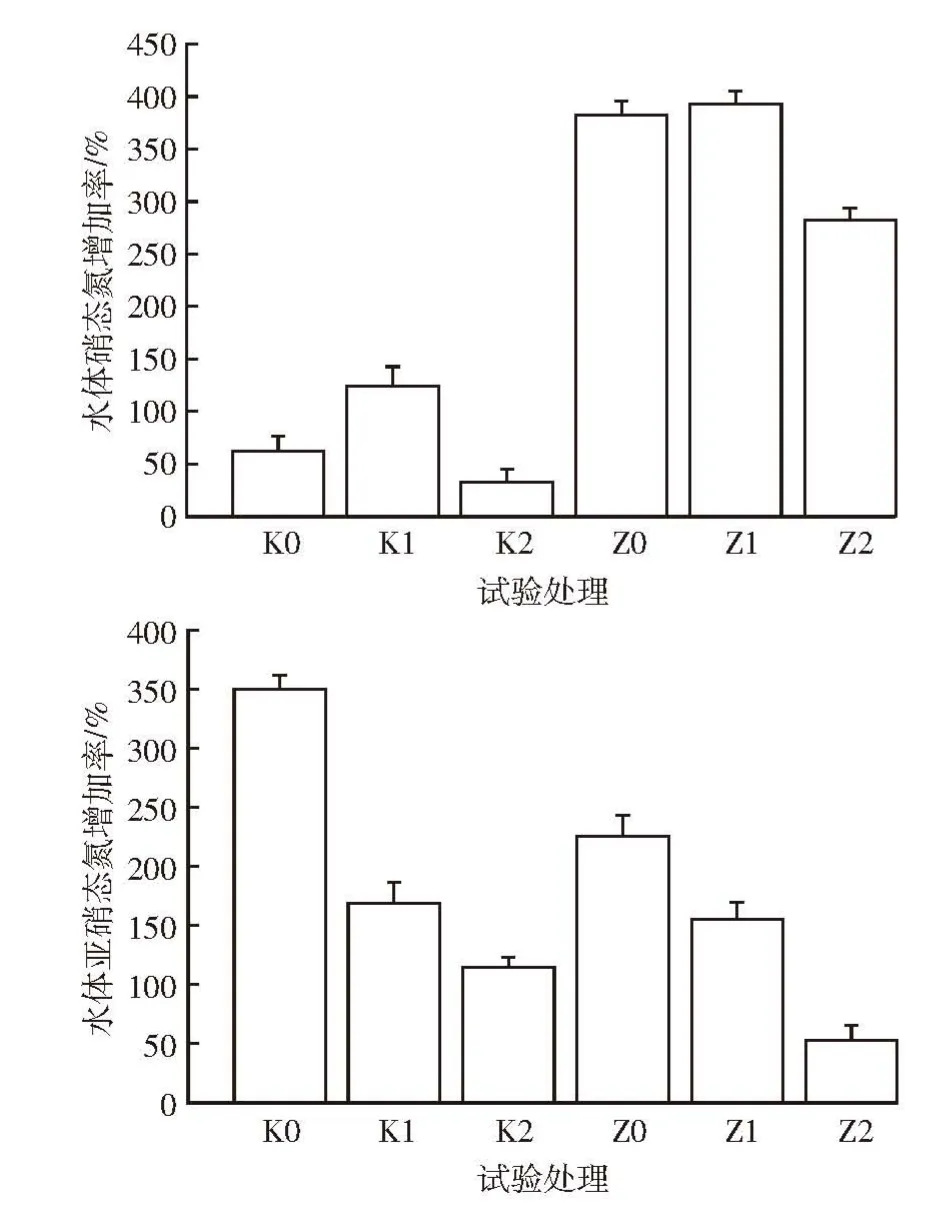
图6 不同水力停留时间处理水体硝态氮和亚硝态氮的变化Figure 6 NO-3-N and NO-2-N changes of water in different HRT
3 讨论
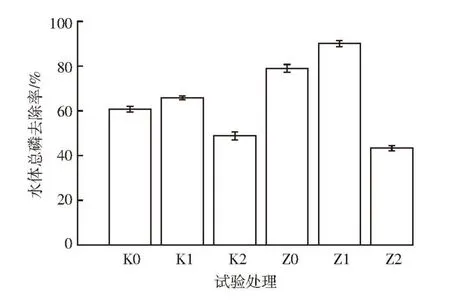
图7 不同水力停留时间处理水体总磷的去除率Figure 7 The cumulative removal rate of TP of water in different HRT
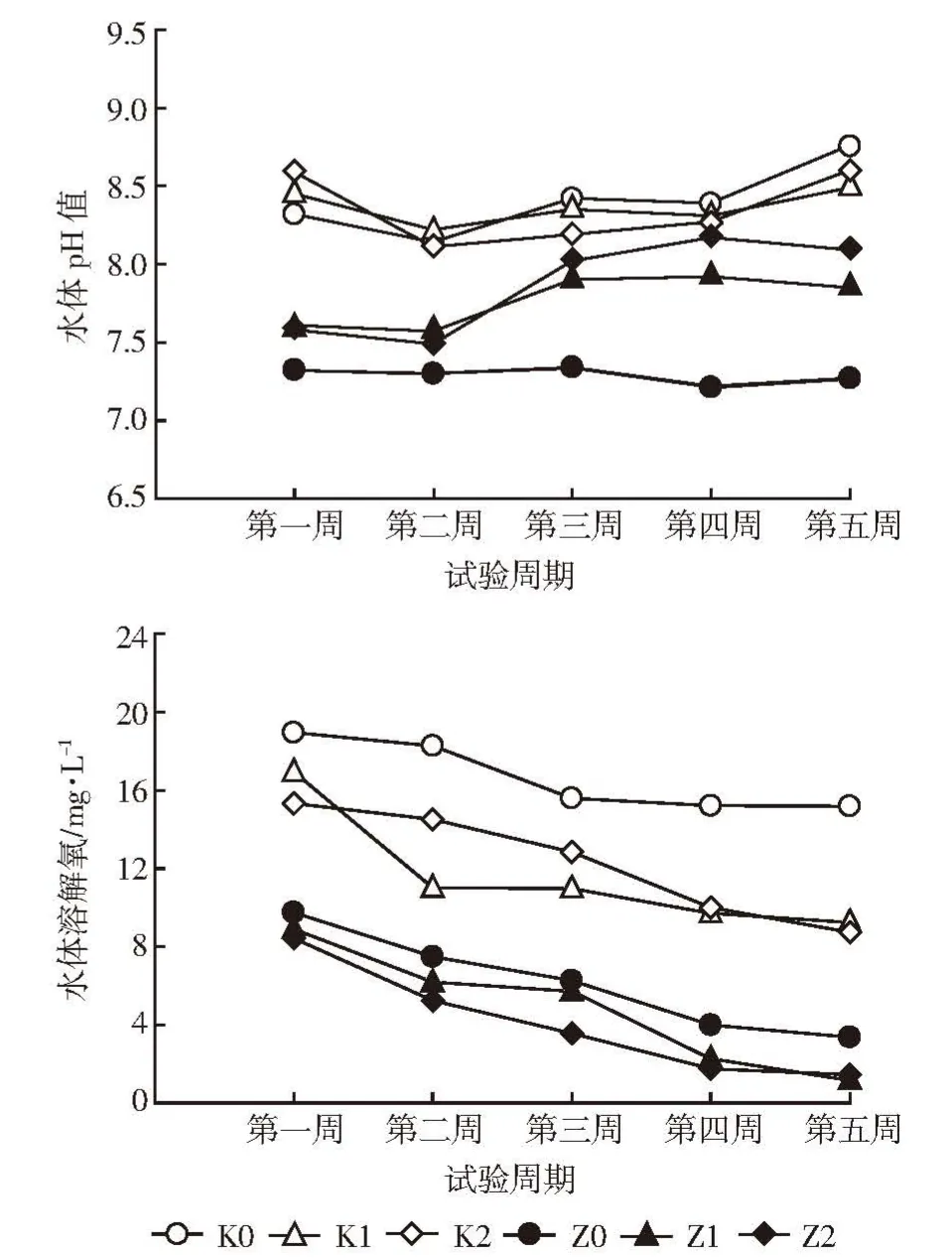
图8 不同水力停留时间处理水体pH值和溶解氧的变化Figure 8 The changes of pH value and DO of water in different HRT
本文在相同栽培方式下比较不同进出水量对狐尾藻生长量的影响,试验结束后,各处理生物量关系为Z0>Z1>CK>Z2,随着沼液浓度的提高,各处理生物量、生物量增长率都出现不同程度的减少。主要是因为进出水量不同,水体沼液浓度高低不一。Z2处理每日进出水2 L,第三周结束受试液为沼液原液;Z1处理每日进出水1 L,第三周结束受试液浓度为原沼液的一半,水体沼液浓度为50%,水体污染物浓度逐渐超过了狐尾藻的承载能力;而Z0处理在整个试验周期生物量均表现为增加,前期狐尾藻对沼液中营养物质的需要量大于进水沼液中营养物质浓度,随着每日进水量累积,狐尾藻对沼液的需要量逐渐趋近饱和,沼液对狐尾藻的生长起到了一定的抑制作用,所以增长率呈现先增后降。试验表明狐尾藻在5%~45%沼液中可以存活,当提高狐尾藻的生物量时,则需要通过添加一定量的沼液原液提供营养物质补给狐尾藻的生长消耗,沼液浓度维持在20%~30%为宜,当沼液浓度超过50%,则会抑制狐尾藻生长。
利用沼液水培狐尾藻,可以提高狐尾藻养分氮磷钾含量,全磷和全钾含量的增加幅度小于全氮含量,主要是狐尾藻对全氮的吸收能力大于对全钾的吸收能力。氮磷在植物生命活动中发挥首要作用,水体环境总氮、总磷的变化影响沉水植物的生长和生物合成。本试验处理组狐尾藻植株体内氮磷钾含量都有不同程度的增加,这与王瑶等[12]结论一致。狐尾藻既可通过根吸收底质中的氮磷营养,也可通过茎叶利用水中的营养物质,氮磷被吸收后用以合成植物自身的结构组成物质,当其被收割运移出水生生态系统时,大量的营养物质也随之从水体中输出,从而达到净化水体的目的。随着水体氮磷浓度的升高,植株体内氮磷钾含量呈先增后减趋势,在每日进出水量为1 L·d-1时,植株体内氮磷钾含量最大,同时水体总氮、总磷的去除量也最高,这表明狐尾藻在氮磷丰富的水体中有较高的吸收效果,但浓度过高也会阻碍植株光合作用、损伤植物根系,这与范国兰等[11]及葛芳杰等[13]研究结论一致。可能是因为植物叶片中可溶性糖的积累影响某个代谢途径的转录,进而影响了植物体内的信号转换[14]。
氨氮浓度是影响狐尾藻生长最重要的因素之一。低溶度氨氮含量有利于植物的生长和光合作用,而过高的浓度容易使狐尾藻中毒,出现叶黄、烂根等现象[15-17]。本试验发现当水体氨氮浓度超过220.00 mg·L-1时,狐尾藻的生长受到抑制,增速明显变缓。当水体氨氮浓度超过450.00 mg·L-1时,狐尾藻呈现大面积氨中毒症状,大量死亡,这个结论在刘少博等[18]的试验中得到验证。其原因可能来自两方面:一是氨氮浓度增加引起狐尾藻氮同化作用加强,与光合作用一并竞争同化力ATP和NADPH(还原型辅酶Ⅱ),并且降低了呼吸作用提供碳架的能力,致使CO2同化速率降低、净光合速率降低、暗呼吸速率升高,由此增加狐尾藻代谢负荷[19-20];二是氨氮浓度升高,引起狐尾藻根系中过氧化物酶(POD)和过氧化氢酶(CAT)活性升高,叶片和根系膜脂过氧化程度增加,且这种毒害作用随着其浓度增高,生理反应增强[21]。
根据各处理试验结束时水体中CODCr、总磷、氨氮、硝态氮和亚硝态氮变化可知,狐尾藻对沼液具有良好的净化效果,特别是当每日进出水为1 L时,狐尾藻对水体的净化效果最好。狐尾藻根际有氧区和缺氧区共同存在,为根区亚硝化、硝化等好氧菌群与氨化、反硝化等兼氧或厌氧菌群提供了各自所需的小环境[22]。狐尾藻叶片的光合作用释放氧气,增加水中溶解氧,促进有机污染物和某些还原性无机物的氧化分解,从而达到净化水质的目的[23]。另狐尾藻发达的根系组织可以分泌有机碳和氧气来调节水体氮生物转化过程,水体中氮生物转化过程包括硝化、反硝化反应过程。水体溶解氧充足条件下,随着水体铵态氮浓度不断减少,硝态氮含量会增加,这与Reddy等[24]试验结论类似。Bames等[25]研究表明,硝化过程氧化1 mg氨氮需要消耗4.3 mg的氧气,而狐尾藻根系具有泌氧作用,改善水体充氧环境同时也为氨氮转化提供条件,促进有机物降解及消化过程的进行。由此可见,水体氨氮去向主要是植物吸收、基质吸附、挥发、硝化、反硝化等作用;而水体总磷去向主要是植物吸收、生物处理等。
狐尾藻对沼液较强的净化效果与狐尾藻根系泌氧效率密不可分,吴建强等[26]及周洋洋等[27]研究表明,狐尾藻根系具有泌氧作用,可以改变水体溶氧环境,影响水体微生物环境,进而影响水体污染物的降解效果。狐尾藻根系泌氧作用可使根系周围形成一个好氧区域,以根系为中心向外辐射,溶氧量减少。同时在收获狐尾藻时发现其根系周围存在大量微生物,微生物的活动及水体中的铵盐、磷酸盐、硝酸盐、COD等物质在降解过程中都需要大量氧气,因此在狐尾藻供氧量与污染物处理需氧量之间存在动态关系[28]。文中水体溶氧值降低,可能是水体污染物降解需氧量大于狐尾藻供氧量所致。试验中水体pH普遍有小幅度增加,主要可能是狐尾藻利用光合作用吸收CO2转化为O2,导致水体中的pH有所增加,这与赵联芳等[29]研究结论类似。Z0处理水体pH值变化最小,可能是因为Z0生物量最大,使污染物降解产生的部分CO2溶于水体。
4 结论
(1)20%~30%沼液浓度有利于狐尾藻生长,处理组相比空白组生物量可以提高1.6~4.9倍;各组狐尾藻植株体内氮磷钾含量相比空白组分别提高了1.5~2.0、1.57~1.90、1.35~1.88 倍。
(2)不同的进水量条件下,狐尾藻生长情况及其对沼液净化能力存在明显差异,综合生物量、对沼液的净化能力及试验周期等方面考虑,当水力停留时间为40 d时,狐尾藻对沼液的处理效果最好,沼液中CODCr、氨氮及总磷去除率分别可达65.99%、59.54%及90.06%。
(3)沼液中氨氮浓度小于 220.00 mg·L-1时,可以促进狐尾藻生长,当水体氨氮浓度超过450.00 mg·L-1时,狐尾藻呈现大面积氨中毒症状,大量死亡。
(4)在处理氨氮、CODCr、总磷等高浓度生猪沼液废水的生态湿地系统中,狐尾藻可作为一种良好的候选水生植物。
参考文献:
[1]吴天马.江苏省规模化畜禽养殖业污染调查报告[J].环境导报,2001(4):20-22.WU Tian-ma.Investigation report on large-scale livestock breeding pollution of Jiangsu province[J].Environment Herald,2001(4):20-22.
[2]谷晓明,邢可霞,易礼军,等.农村养殖户畜禽粪污综合利用的公共私营合作制(PPP)模式分析[J].生态与农村环境学报,2017,33(1):62-69.GU Xiao-ming,XING Ke-xia,YI Li-jun,et al.Introduction of publicprivate-partnership(PPP)into comprehensive utillization of livestock waste from rural livestok keepers[J].Journal of Ecology and Rural Environment,2017,33(1):62-69.
[3]邓良伟.猪场废水处理新工艺研究[D].杭州:浙江大学,2007:1-14.DENG Liang-wei.Study on new treatment process of piggery wastewater[J].Hangzhou:Zhejiang University,2007:1-14.
[4]种云霄,胡洪营,钱 易.大型水生植物在水污染治理中的应用研究进展[J].环境污染治理技术与设备,2003,4(2):36-40.ZHONG Yun-xiao,HU Hong-ying,QIAN Yi.Advances in utilization of macrophytes in water pollution control[J].Techniques and Equipment for Environmental Pollution Control,2003,4(2):36-40.
[5]张洪刚,洪剑明.人工湿地中植物的作用[J].湿地科学,2006,4(2):146-154.ZHANG Hong-gang,HONG Jian-ming.Functions of plants of constructed wetlands[J].Wetland Science,2006,4(2):146-154.
[6]刘 燕.氮对沉水植物狐尾藻的生理特征及与沉积物氮行为的影响[D].北京:首都师范大学,2009.LIU Yan.The effect of physiological response and nitrogen acts for sediment in the Myriophyllum spicatum L.on nitrogen nutrition[D].Beijing:Capital Normal University,2009.
[7]李红美,王永阳,李 玉,等.水体氮浓度对狐尾藻和金鱼藻片段萌发及生长的影响[J].植物营养与肥料学报,2014,20(1):213-220.LI Hong-mei,WANG Yong-yang,LI Yu,et al.Effects of nitrogen concentration in water on the germination and growth of Myriophyllum spicatum and Ceratophyllum demersum fragments[J].Plant Nutrition and Fertilizer Science,2014,20(1):213-220.
[8]李 伟,程 玉.洪湖主要沉水植物群落的定量分析Ⅲ.金鱼藻+菹草+穗花狐尾藻群落[J].水生生物学报,2000,24(1):30-35.LI Wei,CHENG Yu.Quantitative analysis on the main submerged communities in Honghu Lake.Ⅲ.Ceratophyllum demersum+Potamogeton crispus+Myriophyllum spicatum community[J].Acta Hydrobiologica Sinica,2000,24(1):30-35.
[9]方焰星,何池全,梁 霞,等.水生植物对污染水体氮磷的净化效果研究[J].水生态学杂志,2010,3(6):36-40.FANG Yan-xing,HE Chi-quan,LIANG Xia,et al.The purifying effect of polluted water by the aquatic plants[J].Journal of Hydroecology,2010,3(6):36-40.
[10]钟爱文,曹 特,张 萌,等.光照和黑暗条件下苦草和穗花狐尾藻对铵态氮的吸收[J].湖泊科学,2013,25(2):289-294.ZHONG Ai-wen,CAO Te,ZHANG Meng,et al.Uptake of ammonium by Vallisneria natans and Myriophyllum spicatum under light and dark regimes[J].Journal of Lake Sciences,2013,25(2):289-294.
[11]范国兰,李 伟.穗花狐尾藻在不同程度富营养化水体中的营养积累特点及营养分配对策[J].武汉植物学研究,2005,23(3):267-271.FAN Guo-lan,LI Wei.Response of nutrient accumulation characteristics and nutrient strategy of Myriophyllum spicatum L.under different eutrophicationconditions[J].JournalofWuhanBotanicalResearch,2005,23(3):267-271.
[12]王 瑶,顾宇飞,纪东成,等.富营养条件下不同形态氮对轮叶黑藻(Hydrilla verticillata)的生理影响[J].环境科学研究,2006,19(1):71-74.WANG Yao,GU Yu-fei,JI Dong-cheng,et al.Effects of different form of nitrogen on Hydrilla verticillata under eutrophic nutrient condition[J].Reseach of Environmental Sciences,2006,19(1):71-74.
[13]葛芳杰,刘碧云,鲁志营,等.不同氮、磷浓度对穗花狐尾藻生长及酚类物质含量的影响[J].环境科学学报,2012,32(2):472-479.GE Fang-jie,LIU Bi-yun,LU Zhi-ying,et al.Effects of different nitrogen and phosphorus levels on the growth and total phenolic contents of Myriophyllum spicatum[J].Acta Scientiae Circumstantiae,2012,32(2):472-479.
[14]Hermans C,Hammond J P,White P J,et al.How do plants respond to nutrient shortage by biomass allocation[J].Trends in Plant Science,2006,11(12):610-617.
[15]Correia C M,Pereira J M M,Coutinho J F,et al.Ultraviolet-B radiation and nitrogen affect the photosynthesis of maize:A mediterranean field study[J].European Journal of Agronomy,2005,23(3):267-271.
[16]Field C,Mooney H A.The photosynthesis-nitrogen relationship in wild plants[M]//Givnish T.On the economy of plant form and function.London:Cambridge University Press,1986:25-55.
[17]Nakaji T,Fukami M,Dokiya Y.Effects of high nitrogen load on growth,photosynthesis and nutrient status of Cryptomeria japonica and Pinus desiflora seedlings[J].Trees,2001,15:453-461.
[18]刘少博,冉 彬,曾冠军,等.高铵条件下绿狐尾藻的生理与氮磷吸收特征[J].环境科学,2017,38(9):3731-3737.LIU Shao-bo,RAN Bin,ZENG Guan-jun,et al.Physiological characteristics and nitrogen and phosphorus uptake of Myriophylum aquaticum under high ammonium conditions[J].Environment Science,2017,38(9):3731-3737.
[19]刘 燕,王圣瑞,金相灿,等.水体营养水平对3种沉水植物生长及抗氧化酶活性的影响[J].生态环境学报,2009,18(1):57-63.LIU Yan,WANG Sheng-rui,JIN Xiang-can,et al.Effects of different nutritional condition on the growth and antioxidant enzyme activity of three submerged macrophytes[J].Ecology and Environmental Sciences,2009,18(1):57-63.
[20]金相灿,楚建周,王圣瑞.水体氮浓度、形态对黑藻和狐尾藻光合特征的影响[J].应用与环境生物学报,2007,13(2):200-204.JIN Xiang-can,CHU Jian-zhou,WANG Sheng-rui.Effects of nitorgen concentration and form in water on photosynthetic characteristics of Hydrilla verticillata and Myriophyllum verticillatum[J].Chinese Journal of Applied and Environmental Biology,2007,13(2):200-204.
[21]焦立新,王圣瑞,金相灿.穗花狐尾藻对铵态氮的生理响应[J].应用生态学报,2009,20(9):2283-2288.JIAO Li-xin,WANG Sheng-rui,JIN Xiang-can.Physiological responses of Myriophylum spicatum to ammonium nitrogen[J].Chinese Journal of Applied Ecology,2009,20(9):2283-2288.
[22]黄 正,范 玮,李 谷,等.固定化硝化细菌去除养殖废水中氨氮的研究[J].华中科技大学学报,2002,31(1):18-20.HUANG Zheng,FAN Wei,LI Gu,et al.Removing ammonia nitrogen from fishery wastewater by immobilized nitrifying bacteria[J].Journal of Huazhong University of Science and Technology,2002,31(1):18-20.
[23]苏胜齐,姚维志.沉水植物与环境关系评述[J].农业环境保护,2002,21(6):570-573.SU Sheng-qi,YAO Wei-zhi.A brief review on mutual relationship between submergerd macrophytes and environment[J].Agro-Enviromental Protection,2002,21(6):570-573.
[24]Reddy K R,Dangelo E M,Debusk T A.Oxygen transport through aquatic macrophytes:The role in wastewater treatment[J].Environment Quality,1989,19(2):261-267.
[25]Barnes D,Bliss P J.Biological control of nitrogen in wastewater treatment[M].London:E&FN Spoon Ltd,1983:29-47.
[26]吴建强,阮晓红,王 雪.人工湿地中水生植物的作用和选择[J].水资源保护,2005,21(1):1-6.WU Jian-qiang,RUAN Xiao-hong,WANG Xue.Selection and function of aquatic plants in constructed wetlands[J].Water Resources Protection,2005,21(1):1-6.
[27]周洋洋,刘红乾,董如梦,等.五种水培观赏植物对城市污水净化效果的研究[J].山东林业科技,2014,44(6):21-24.ZHOU Yang-yang,LIU Hong-qian,DONG Ru-meng,et al.The research of purification effect about five hydroponic ornamental plants in polluted water[J].Journal of Shandong Forestry Science and Technology,2014,44(6):21-24.
[28]吴晓磊.人工湿地废水处理机理[J].环境科学,1994,16(3):83-86.WU Xiao-lei.Mechanism of wastewater treatment in constructed wetlands[J].Environmental Science,1994,16(3):83-86.
[29]赵联芳,朱 伟,莫妙兴.沉水植物对水体pH值的影响及脱氮作用[J].水资源保护,2008,24(6):64-67.ZHAO Lian-fang,ZHU Wei,MO Miao-xing.Effects of submerged macrophytes on pH values and nitrogen removal[J].Water Resources Protection,2008,24(6):64-67.
