塑化剂DEHP暴露对小鼠巨噬细胞的免疫毒性作用
2018-05-02韩佳萦苏伊玲
韩佳萦,苏伊玲,熊 丽,耿 辉*
(1.华中师大一附中,武汉 430223;2.华中师范大学生命科学学院,武汉 430079)
邻苯二甲酸二-2-乙基己酯(di-2-ethylhexylphthalate,DEHP),又名邻苯二甲酸二异辛酯,是邻苯二甲酸酯类化合物(PAE)的重要成员,是塑料材料中使用量最大的增塑剂,在PVC材料中DEHP含量高达30%~50%[1]。DEHP在塑料中以游离的形式存在,其与塑料成分之间不是以共价化学键结合,而是通过氢键或范德华力相连,因此极容易释放到环境中。据文献报道,DEHP在长江、黄河、珠江、辽河和海河等我国主要水系流域均有高浓度检出。有文献报道重庆市和三峡库区水环境中 DEHP 最高浓度达到 5.421 μg·L-1,对浙江省10个水厂的源水进行抽样分析,发现每个水厂均有邻苯二甲酸酯类检出,其中DEHP最高含量达到 17 μg·L-1[2]。而且 DEHP 很难降解,在环境中存留时间较长,在生物体内具有富集效应,对人体健康和环境安全造成极大的威胁。
DEHP受到广泛的关注还与其多重毒性作用有关。许多动物毒理学研究表明,DEHP具有肝脏毒性、生殖毒性、发育毒性和致癌性等多种毒性,并具有类雌性激素活性[1,3-7]。目前有关 DEHP 对免疫系统作用,特别是介导超敏反应发生已有一些研究。Lee等[8]报道DEHP可诱导CD4+T细胞向Th2型细胞分化并分泌IL-4,IL-4刺激B细胞产生IgE型抗体并通过介导炎症级联反应导致超敏反应。流行病学调查研究证实,职业性接触DEHP的人群发生哮喘的几率大幅增加。Hoppin等[9]报道DEHP及其体内代谢产物邻苯二甲酸单苄酯(Monobenzyl phthalate,MBzP)能够诱导与哮喘、花粉热、关节炎等疾病密切相关的19种特异性IgE抗体的产生,提示DEHP接触与哮喘、花粉热、关节炎等超敏反应及关节炎为代表的自身免疫性疾病的发病有关。DEHP可明显增加人和大鼠免疫细胞膜表面分子CD11b的表达,CD11b专司免疫细胞从血管至炎症部位的迁移与附着,表明DEHP能够影响免疫炎症反应[10]。Kuo等[11]发现DEHP通过抑制MAPKMEK1/2-ERK-ELK1和 NFκB 信号传导途径,抑制髓系DC细胞分泌IFN-α/IFN-β,从而削弱DC细胞对T细胞的辅佐作用,诱导免疫应答反应向Th2方向发展。Eljezi等[3]发现 0.1 μg·L-1浓度剂量的 DEHP 对鼠细胞系L929表现明显的细胞毒性作用。人角膜内皮细胞B4G12体外暴露于DEHP后,炎症相关因子IL-1β、IL-8 和 IL-16的分泌增加,基因表达水平也升高[12]。以上研究提示DEHP暴露可能从多方面影响免疫应答。
由于DEHP在日常用品中的广泛使用,土壤、水体等均已受到不同程度的DEHP污染。DEHP可以通过食品摄入、呼吸空气、饮用水、皮肤吸收等多种途径进入人体。2009年美国CDC开展的第四次针对环境化合物暴露检测报告显示,接受检查的2636例受检者体内都可以检测到DEHP及其代谢产物的存在(www.cdc.gov/exposurereport/pdf/fourthreport.pdf)。 本文选用小鼠巨噬细胞株RAW264.7细胞和腹腔巨噬细胞作为研究材料,通过检测DEHP对巨噬细胞吞噬活性、细胞因子产生、活性氧水平的变化,探讨DEHP暴露对机体免疫系统的毒性作用,为DEHP暴露对免疫系统干扰/毒性风险评价提供参考。
1 材料与方法
1.1 主要试剂及仪器
DEHP购于上海阿拉丁试剂公司(纯度≥98%),DMEM培养基购于Gibco公司,胎牛血清购于杭州四季青公司,Giemsa染色试剂购自南京建成生物公司,TNF-α、IL-12、IL-23 ELISA 检测试剂盒购自三鹰生物,2,7-二氯荧光素二乙酸酯(DCFH-DA)购自江苏凯基生物公司,其他相关试剂均为国产分析纯。二氧化碳培养箱型号为Thermo-BB15,倒置显微镜及照相系统型号为Olympus IX-50,Spectra Max M5多功能酶标仪型号为Molecular Devices-SpectraMax i3x。
1.2 巨噬细胞系RAW264.7细胞培养
巨噬细胞系RAW264.7细胞系华中科技大学基础医学院生物化学教研室惠赠。复苏冻存的RAW264.7细胞方法如下:从液氮罐中取出保存RAW264.7细胞的冻存管,立即将其置于40℃的温水中快速解冻。70%酒精喷洒细胞冻存管消毒,置于超净工作台内,移液器吸取将细胞转移至15 mL离心管中,再补加10倍体积的10%胎牛血清-DMEM培养基,1000 r·min-1离心 8 min,弃上清,重新加入含有10%血清的DMEM完全培养基,轻轻吹打混匀,转移至25 cm2细胞培养瓶,放入37℃、5%CO2培养箱静置培养。定时观察培养基颜色变化及细胞状态,及时更换新鲜培养基,待细胞长满整个培养瓶底部,进行传代培养。
1.3 DEHP处理RAW264.7细胞
将正常RAW264.7细胞接种到培养瓶中,待培养细胞的密度达到80%后进行DEHP暴露。设置1、5、10、20、40、80 mg·L-1DEHP 处理组、0.05%的丙酮溶剂和DMEM完全培养基对照组。DEHP暴露48 h更换正常培养基培养24~48 h,连续细胞传代和贴壁再生长,待培养细胞的密度达到80%后进行DEHP暴露,如此重复10代。染毒DEHP暴露10代后收获细胞,用于红细胞吞噬实验、细胞因子分泌、活性氧水平检测。巨噬存活率经0.04%台盼蓝染色确定细胞存活。
1.4 腹腔巨噬细胞分离培养
BALB/c小鼠购于湖北省疾病预防医学科学院。小鼠暴露浓度设计依据体外实验结果确定。选取30只8~12周龄雄性健康BALB/c小鼠随机分成5组,分别设置为 1、5、10 mg·L-1DEHP 处理组、0.05%的丙酮溶剂和蒸馏水对照组,采用自由饮水方式喂饲小鼠,连续饲养20周后颈椎脱臼处死小鼠,75%酒精浸泡5 min,剪开腹下部皮肤打开腹腔,用吸管吸取PBS反复冲洗腹腔,收集腹腔渗出液,1000 r·min-1离心 8 min,弃上清,PBS洗涤2遍。用10%胎牛血清-DMEM培养基调节细胞浓度至5×106细胞·mL-1,接种于24孔板中,每孔2 mL,置37℃、5%CO2培养箱培养,每2 h定时取出培养板于倒置显微镜下观察巨噬细胞贴壁情况。
1.5 红细胞吞噬实验
向培养有巨噬细胞的培养板中按1∶50比率加入绵羊红细胞,放回CO2培养箱中孵育,3 h后取出培养板,PBS反复冲洗未被巨噬细胞吞噬的红细胞,自然干燥后加入冷丙酮溶液固定5 min。滴加Giemsa染液10 min,自来水冲干净,在显微镜下观察计数吞噬百分率和吞噬指数。
吞噬百分率=吞噬红细胞的巨噬细胞/100个巨噬细胞×100%
吞噬指数=被吞噬的红细胞/100个巨噬细胞
1.6 ELISA 检测 TNF-α、IL-12、IL-23 细胞因子表达
将经过DEHP处理的RAW264.7细胞浓度调至1×107·mL-1,培养于 24 孔板中,每孔加入 1 mL 细胞悬液和 2×10-3μg·L-1LPS 刺激(每种剂量浓度 DEHP 均设3个重复孔),培养72 h后,吸取培养上清液用于细胞因子的测定。以双抗体夹心ELISA法,测定培养上清液中 TNF-α、IL-12、IL-23 细胞因子浓度。操作步骤按三鹰生物公司提供的检测试剂盒中说明书进行。
1.7 活性氧(ROS)水平检测
将经过DEHP连续处理10代的RAW264.7细胞浓度调至 1×107·mL-1,接种于 24 孔板,加入 2×10-3μg·L-1LPS刺激2 h后,按照凯基活性氧检测试剂盒的操作说明,采用对ROS敏感的荧光探针DCFH-DA标记细胞,利用荧光酶标仪在488nm激发波长、525nm发射波长下测定不同细胞样品中DCF的荧光值,检测DEHP不同浓度处理组细胞内活性氧的变化。
1.8 统计学处理
应用GraphPad Prism 5统计软件进行单因素方差分析(One-Way ANOVA),实验数据以 X±SD 表示,两组间计量资料的比较采用t检验。P<0.05为差异显著。
2 结果与分析
2.1 DEHP对RAW264.7细胞的毒性作用
为评估DEHP暴露对巨噬细胞的毒性作用,首先用不同浓度剂量的 DEHP(1、5、10、20、40、80 mg·L-1)处理巨噬细胞株RAW264.7细胞。RAW264.7细胞暴露于 1、5、10 mg·L-1DEHP 48 h 后,未发现细胞活力状态及死亡细胞数目发生变化(图1)。然而经20、40、80 mg·L-1DEHP 处理后,RAW264.7 细胞的活力状态变弱,死亡细胞的数目显著增加(图2)。
2.2 DEHP对RAW264.7细胞吞噬能力的影响
鉴于动物与人体接触环境中DEHP的实际情况是低剂量长时间暴露,我们采用 1、5、10 mg·L-1浓度剂量的DEHP对巨噬细胞株RAW264.7进行持续染毒。经连续染毒处理10代后,RAW264.7细胞的活力、形态以及繁殖传代时间未见显著变化(结果未显示)。细胞吞噬功能测定显示,向DMEM完全培养基和丙酮对照组RAW264.7细胞中加入绵羊红细胞2 h后,可观察到巨噬细胞吞噬红细胞,被吞噬红细胞及巨噬细胞形态轮廓清晰可辨,被吞噬红细胞数目从一个到多个不等,有部分红细胞粘附在巨噬细胞外围将要被吞噬(图3)。而经DEHP连续处理10代后,RAW264.7细胞的吞噬红细胞能力显著减弱(图3)。每组实验重复3次,统计结果显示DMEM完全培养基与丙酮对照组相比,吞噬百分率和吞噬指数无统计学差异(表 1),而 1、5、10 mg·L-1DEHP 各暴露组与丙酮对照组相比,吞噬百分率和吞噬指数均呈现显著下降趋势(P<0.05)。
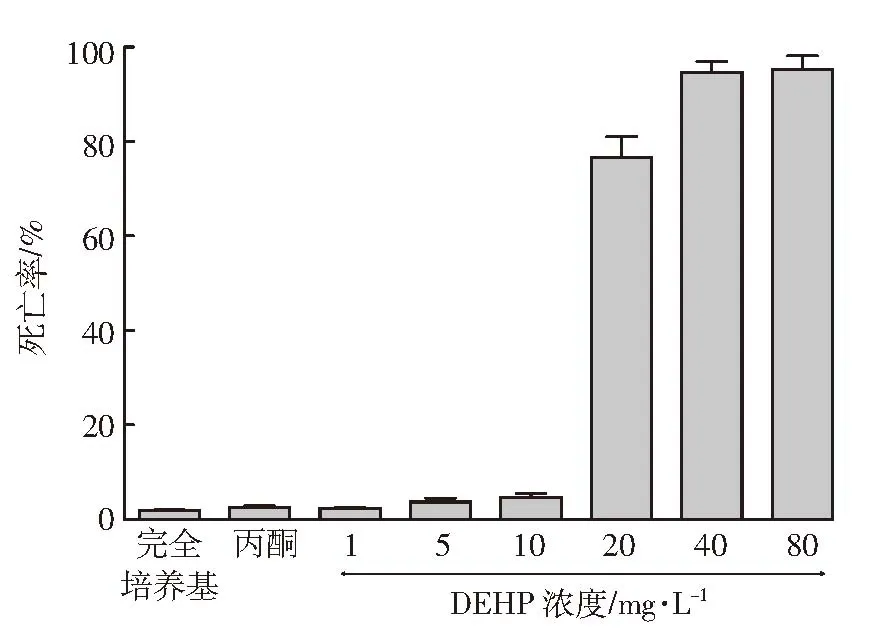
图2 RAW264.7细胞接受不同浓度剂量DEHP处理后的死亡率(n=3)Figure 2 The mortality of RAW264.7 cells by treated with different dosages of DEHP(n=3)

图1 不同浓度剂量DEHP处理RAW264.7细胞48 h后的镜检结果(放大倍数:×200)Figure 1 Microscopic images of RAW264.7 cells treated with different dosages of DEHP after 48 h treatment(Magnification:×200)

图3 RAW264.7细胞吞噬红细胞镜检结果(放大倍数:×400)Figure 3 Microscopic examination of phagocytosis efficiency with RAW264.7 cell(Magnification:×400)
2.3 DEHP 对 RAW264.7细胞分泌 TNF-α、IL-12、IL-23细胞因子的影响
1、5、10 mg·L-1DEHP 连续处理 10 代后,换用正常培养基继续培养24~48 h,再接受LPS刺激72 h后收集细胞上清液,TNF-α、IL-12、IL-23 的变化趋势见图 4。由图 4 可以看出,经 1、5、10 mg·L-1的 DEHP 连续处理后,RAW264.7 细胞分泌 TNF-α、IL-12、IL-23等细胞因子的能力较丙酮对照组比较显著降低。并且TNF-α、IL-12、IL-23 下降趋势与 DEHP 暴露浓度呈现剂量-效应关系,提示DEHP能抑制RAW264.7细胞分泌 TNF-α、IL-12、IL-23等细胞因子。
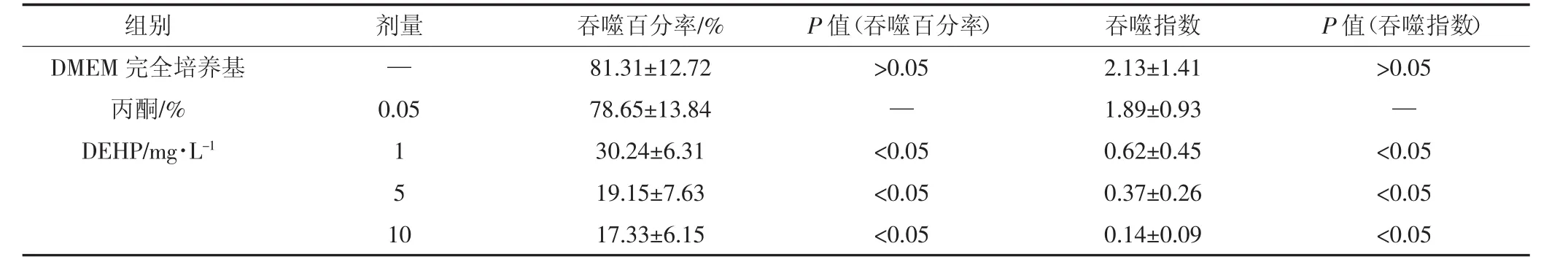
表1 不同剂量DEHP暴露对RAW264.7细胞吞噬活性的影响Table 1 Effects of different dose DEHP exposure on phagocytosis of RAW264.7

图4 DEHP暴露对RAW264.7细胞因子分泌的影响(OD:光密度,n=3,*P<0.05)Figure 4 Effects of different dosages of DEHP on cytokines secretion of RAW264.7(OD:Optical density,n=3,*P<0.05)
2.4 DEHP对RAW264.7细胞ROS产生的影响
1、5、10 mg·L-1DEHP 连续处理 10 代后,换用正常培养基继续培养 48 h,加入 2×10-3μg·L-1LPS 刺激2 h后,用DCFH-DA荧光探针标记RAW264.7细胞,测定细胞内荧光强度以反映ROS的产生量。图5显示,经 1、5、10 mg·L-1浓度剂量的 DEHP 连续染毒后,RAW264.7细胞内的ROS水平与丙酮对照组相比显著下降,随着DEHP浓度的加大,DEHP对RAW264.7细胞ROS水平的抑制作用逐渐增强,当DEHP浓度达到10 mg·L-1时,细胞内ROS水平降至对照组水平的34.69%。
2.5 DEHP对腹腔巨噬细胞贴壁及吞噬能力的影响
为进一步验证DEHP对巨噬细胞免疫功能的影响,我们还选用了小鼠腹腔巨噬细胞作为研究材料。采用 1、5、10 mg·L-1DEHP 喂饲小鼠,连续饲养 20 周后收集小鼠腹腔巨噬细胞,隔2 h于倒置显微镜下观察巨噬细胞粘附贴壁情况及形态变化。对照组腹腔巨噬细胞于体外培养2 h后逐渐伸展增大,4 h后能粘附到24孔培养板上,形状呈梭形或不规则形并有伪足或突起伸出。而各剂量浓度DEHP对巨噬细胞黏附伸展能力均有一定的影响,其中5、10 mg·L-1DEHP暴露组巨噬细胞黏附伸展能力下降显著,分别需要12、14 h才能完全贴壁。红细胞吞噬实验显示,各剂量浓度DEHP暴露与丙酮对照组相比,巨噬细胞吞噬红细胞数目、吞噬百分率及吞噬指数均显著降低(表2)。
3 讨论
DEHP是日常生活中使用和接触最多的增塑剂,DEHP可不断地从塑料中释放。从近年来我国各大水系的检测结果来看,水环境中DEHP的含量已经超出我国水环境中允许的浓度范围[13]。由于DEHP具有较高的脂-水分配系数,可被土壤吸附并且可被生物富集,因此生物体中DEHP的含量要远高于水体和土壤[14]。

表2 不同剂量DEHP暴露对小鼠腹腔巨嗜细胞吞噬活性的影响Table 2 Effects of different dose DEHP exposure on phagocytosis of murine peritoneal macrophages

图5 DEHP对RAW264.7细胞ROS产生的影响(n=3,重复检测次数:2 次,*P<0.05)Figure 5 DEHP inhibited ROS production in RAW264.7 cells(n=3,Repeated detection times:2,*P<0.05)
自1981年首次报道DEHP诱发啮齿类动物肿瘤以来,关于DEHP毒性研究的文献日渐增多。巨噬细胞是机体内重要的免疫效应细胞,具有多种免疫功能,包括免疫防御、免疫监视、免疫调节以及抗原呈递等,在机体的免疫系统中起着重要作用[15]。由于巨噬细胞株RAW264.7细胞已经成功建系,易于体外传代培养,因此本研究首先选用RAW264.7细胞作为研究对象,探讨DEHP对巨噬细胞功能的影响。结果显示,虽然较低浓度剂量(1、5、10 mg·L-1)DEHP 暴露并没有急性毒性作用,然而经连续10代持续暴露后,DEHP对细胞株RAW264.7吞噬功能有明显抑制作用。接受外来抗原刺激后分泌细胞因子(如TNF-α、IL-12、IL-23)是巨噬细胞应答的基本反应[16]。本研究证实,DEHP对RAW264.7细胞接受LPS刺激后分泌TNF-α、IL-12、IL-23 等细胞因子有明显的抑制作用,且呈一定的剂量-效应关系。细胞内ROS水平也是反映巨噬细胞功能的指标之一[17]。吞噬细胞受到刺激时通过呼吸暴发机制,产生大量ROS,ROS是吞噬细胞发挥吞噬和杀伤作用的主要介质。在机体免疫防御过程中,巨噬细胞通过产生一定量的ROS,破坏细菌的细胞膜和病毒的蛋白质,从而消灭外来病原微生物。本研究发现,DEHP连续处理巨噬细胞株RAW264.7后,再接受LPS刺激2 h后,用DCFH-DA荧光探针法检测ROS的产生,显示细胞ROS的产生受到抑制,并且随着DEHP浓度的增大,细胞内ROS水平下降愈加明显。这些结果说明DEHP对巨噬细胞正常功能发挥具有显著的抑制作用。
由于腹腔巨嗜细胞游离存在于腹腔的腹水中,易于获得,因此本研究还选用腹腔巨噬细胞作为研究对象。结果表明DEHP对腹腔巨噬细胞粘附贴壁及吞噬能力均有显著抑制作用。粘附贴壁能力反应巨噬细胞的活力状态,吞噬能力是反映其免疫防御能力的一个重要指标[18],DEHP抑制腹腔巨噬细胞的粘附贴壁及吞噬能力,表明DEHP可影响巨噬细胞的免疫防御功能,从而对机体的免疫能力产生抑制作用。
4 结论
(1)高浓度(20、40 和 80 mg·L-1)DEHP 暴露可对巨噬细胞株RAW264.7细胞造成急性损伤。
(2)低浓度(1、5、10 mg·L-1)DEHP 长时间暴露对RAW264.7和腹腔巨噬细胞有免疫毒性作用。
(3)本研究评估了DEHP对巨噬细胞的免疫毒性作用,这对全面了解DEHP的毒性具有十分重要的意义,研究结果可为DEHP的免疫毒性风险评估提供一定的科学依据。
参考文献:
[1]Erythropel H C,Maric M,Nicell J A,et al.Leaching of the plasticizer di(2-ethylhexyl)phthalate(DEHP)from plastic containers and the question of human exposure[J].Apply Microbiol Biotechnol,2014,98(24):9967-9981.
[2]Liu X W,Shi J H,Bo T,et al.Occurrence of phthalic acid esters in source waters:A nationwide survey in China during the period of 2009—2012[J].Environmental Pollution,2014,184:262-270.
[3]Eljezi T,Pinta P,Richard D,et al.In vitro cytotoxic effects of DEHP-alternative plasticizers and their primary metabolites on a L929 cell line[J].Chemosphere,2017,173:452-459.
[4]Nardelli T C,Erythropel H C,Robaire B.Toxicogenomic screening of replacements for di(2-Ethylhexyl)phthalate(DEHP)using the immortalizedTM4sertolicellline[J].PLoSOne,2015,10(10):e0138421.
[5]Qureshi M S,Yusoff A R,Wirzal M D,et al.Methods for the determinationofendocrine-disruptingphthalateesters[J].Critical Reviews in Analytical Chemistry,2016,46(4):146-159.
[6]Mallow E B,Fox M A.Phthalates and critically ill neonates:Device-related exposures and non-endocrine toxic risks[J].Journal of Perinatology,2014,34(12):892-897.
[7]刘 瑾,叶萍英,蔡 军,等.邻苯二甲酸二(2-乙基己基)酯对小鼠子宫发育的毒性作用[J].环境与健康杂志2012,29(10):894-899.LIU Jin,YE Ping-ying,CAI Jun,et al.Toxic effect of DEHP on uterus development in mice[J].Journal of Environmentl Health,2012,29(10):894-899.
[8]Lee M H,Park J,Chung S W,et al.Enhancement of interleukin-4 production in activated CD4+T cells by diphthalate plasticizers via increased NF-AT binding activity[J].Internation Archievs of Allergy Immunology,2004,134(3):213-222.
[9]Hoppin J A,Jaramillo R,London S J,et al.Phthalate exposure and allergy in the U.S.population:Results from NHANES 2005—2006[J].Environ Health Perspect,2013,121(10):1129-1134.
[10]Gourlay T,Samartzis I,Stefanou D,et al.Inflammatory response of rat and human neutrophils exposed to di-(2-ethyl-hexyl)-phthalateplasticized polyvinyl chloride[J].Artif Organs,2003,27(3):256-260.
[11]Kuo C H,Hsieh C C,Kuo H F,et al.Phthalates suppress type Ⅰ interferon in human plasmacytoid dendritic cells via epigenetic regulation[J].Allergy,2013,68(7):870-879.
[12]Kruger T,Cao Y,Kjaergaard S K,et al.Effects of phthalates on the humancornealendothelialcelllineB4G12[J].InternationalJournalofToxicology,2012,31(4):364-371.
[13]陈济安,邱志群,舒为群,等.我国水环境中邻苯二甲酸酯污染现状及其生物降解研究进展[J].癌变·畸变·突变,2012,19(3):212-215.CHEN Ji-an,QIU Zhi-qun,SHU Wei-qun,et al.Pollution of PAEs in water and the biodegradations studies in China[J].Carcinogenesis,Teratogenesis&Mutagenesis,2012,19(3):212-215.
[14]Fromme H,Kuchler T,Otto T,et al.Occurrence of phthalates and bisphenol A and F in the environment[J].Water Research,2002,36(6):1429-1438.
[15]金柏泉.医学免疫学[M].5版.人民卫生出版社,2008.JIN Bo-quan.Medical immunology[M].Fifth Edition.People′s Medical Press,2008.
[16]周宪宾,姚成芳.巨噬细胞M1/M2极化分型的研究进展[J].中国免疫学杂志,2012,28(10):957-960.ZHOU Xian-bin,YAO Cheng-fang.Advances in M1/M2 polarization typing of macrophages[J].Chinese Journal of Immunology,2012,28(10):957-960.
[17]黄行许,马晓冬,乔东访,等.ROS对小鼠腹腔巨噬细胞凋亡的影响[J].免疫学杂志 2000,16(5):334-338.HUANG Xing-xu,MA Xiao-dong,QIAO Dong-fang,et al.Effects of ROS on apoptosis in murine peritoneal macrophage[J].Journal of Immunology,2000,16(5):334-338.
[18]MurrayPJ,WynnTA.Protectiveandpathogenicfunctionsofmacrophage subsets[J].Natural Review Immunology,2011,11(11):723-737.
