熊果酸对动脉粥样硬化大鼠氧化应激和炎性反应的影响
2018-05-02王金艳孟祥茹肖亚利杨晓龙
王金艳,孟祥茹,肖亚利,杨晓龙
(涿州市医院心血管内一科,河北 涿州 072750)
动脉粥样硬化(AS)的发病机制非常复杂[1-2],其中氧化应激损伤和炎性反应在AS的发生发展过程中发挥着关键作用[3-4]。熊果酸(UA)是一种具有抗氧化、抗炎等多种生物学活性的五环三萜类化合物[5-6],但UA是否对AS大鼠氧化应激损伤和炎性反应具有抑制作用尚未见文献报道。本实验通过高脂饲料喂养结合腹腔注射VD3的方法建立AS大鼠模型,并同步给予UA进行干预治疗,研究UA对AS大鼠氧化应激和炎性反应的影响并探讨其机制。
1 材料与方法
1.1 药物与试剂
UA购自陕西慧科植物开发有限公司(纯度≥98%);辛伐他汀片购自山东方明药业股份有限公司;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、丙二醛(MDA)、活性氧簇(ROS)试剂盒均购自南京建成生物工程研究所;C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)试剂盒和苏木精-尹红(HE)试剂盒均购自北京博奥森科技有限公司。
1.2 动物
清洁级雄性SD大鼠(清洁级,鼠龄6周龄,体质量180~220 g)购自河北省实验动物中心,许可证号:SCXK(冀)2013-1-003。
1.3 方法
1.3.1AS大鼠模型的制备、分组与给药 本实验将通过制备AS大鼠模型,并于开始制备模型时便开始灌胃给予UA进行干预治疗,通过相关指标检测并参照健康对照组和阳性药辛伐他汀(SV)干预组实验数据,进而研究分析UA对AS大鼠氧化应激以及炎性反应的影响。取120只实验用大鼠根据体质量采用随机数字表法随机分为健康对照组、模型组、UA(10、20、40 mg·kg-1·d-1)干预组和SV(1.8 mg·kg-1·d-1)干预组,各组均为20只。参照杨宏辉等[7]报道的实验方法,通过喂食高脂饲料结合腹腔注射VD3的方法建立AS大鼠模型,健康对照组喂食正常饲料并腹腔注射生理盐水,共12周。造模开始同一天,各组大鼠即开始灌胃给药,健康对照组和模型组灌胃给予等体积生理盐水,共12周。治疗完成后,取材并进行各指标检测。
1.3.2血清中抗氧化酶活性和MDA、ROS含量的测定 麻醉后经腹主动脉取血,离心(2 000 r·min-1,离心半径:4.9 cm,10 min)取血清,依照试剂盒说明书步骤进行处理,采用比色法测定血清中抗氧化酶(SOD、GSH-Px、CAT)活性和MDA、ROS含量。
1.3.3血浆中炎性细胞因子含量的测定 取血浆并按照ELISA试剂盒说明进行处理,通过酶标仪测定血浆中炎性细胞因子(CRP、TNF-α、IL-1β、IL-6、IL-10)含量水平。
1.3.4主动脉形态结构改变的观察及病变分级 麻醉后剥取全长主动脉,经4%多聚甲醛液中固定、常规脱水、石蜡包埋、切片、常规HE染色、复染和封片处理后,通过显微镜观察主动脉形态结构改变;主动脉病变标准[8]:0级:结构正常;1级:内膜有少量泡沫细胞积聚,无明显的凸起斑块;2级:内膜可见大量泡沫细胞积聚,有明显的粥样斑块,部分斑块融合成片;3级:内膜表面几乎全被粥样斑块覆盖,斑块内可见组织坏死、钙化,斑块底部肌层萎缩变薄。
1.4 统计学方法
采用SPSS13.0软件进行统计学分析,多组间均数比较采用one-way ANOVA检验,两两比较采用LSD-t检验;主动脉病变分级采用秩和检验;P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清中抗氧化酶活性
结果如表1所示:模型组大鼠血清中抗氧化酶(SOD、GSH-Px、CAT)活性较健康对照组显著降低(P<0.01);与模型组比较发现,经UA(20、40 mg·kg-1·d-1)干预能够显著改善AS大鼠血清中SOD、CAT活性(P<0.05,P<0.01),其中40 mg·kg-1·d-1干预组GSH-Px活性较模型组显著升高(P<0.05);SV 1.8 mg·kg-1·d-1干预组大鼠血清抗氧化酶(SOD、GSH-Px、CAT)活性较模型组差异无统计学意义(P>0.05)。
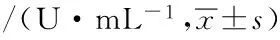
表1 各组大鼠血清中抗氧化酶活性
注:与健康对照组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01。
2.2 各组大鼠血清中MDA、ROS含量
结果如表2所示:模型组大鼠血清中MDA、ROS含量较健康对照组均显著升高(P<0.01);与模型组比较发现经UA(20、40 mg·kg-1·d-1)或SV 1.8 mg·kg-1·d-1干预能够显著降低AS大鼠血清中MDA、ROS含量(P<0.05,P<0.01)。
2.3 各组大鼠血浆中炎性细胞因子含量
结果如表3所示:模型组大鼠血浆中炎性细胞因子(CRP、TNF-α、IL-1β、IL-6)含量较健康对照组均显著升高(P<0.01),而炎性细胞因子IL-10含量显著降低(P<0.01);与模型组比较发现经UA(20、40 mg·kg-1·d-1)干预能够显著降低AS大鼠血浆中CRP、TNF-α、IL-1β、IL-6含量(P<0.05,P<0.01),其中UA 40 mg·kg-1·d-1干预组IL-10含量较模型组显著升高(P<0.01);SV 1.8 mg·kg-1·d-1干预组大鼠血浆TNF-α含量水平较模型组显著降低(P<0.05)。
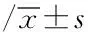
表3 各组大鼠血浆中炎性细胞因子含量
注:与健康对照组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01。
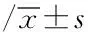
表2 各组大鼠血清中MDA、ROS含量
注:与健康对照组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01。
2.4 各组大鼠主动脉形态结构改变及病变分级
通过显微镜观察HE染色病理切片,结果如图1所示:模型组大鼠主动脉较健康对照组呈现内皮细胞受损、慢性炎性病变、泡沫细胞形成,并伴有粥样硬化斑块形成等明显的病理性形态结构改变;与模型组比较,发现经UA预处理能够明显减轻AS病变程度。主动脉病变分级结果如表4所示:模型组大鼠主动脉病变2级及以上共17例(85%),模型组病变分级较健康对照组显著升高(P<0.01);UA 40 mg·kg-1·d-1干预组和SV 1.8 mg·kg-1·d-1干预组主动脉病变分级较模型组均显著降低(P<0.01)。
3 讨论
AS的病理机制非常复杂,近年来“氧化反应学说”和“炎性学说”逐渐得到认可,王爽等[9]和沈建飞等[10]经动物实验研究发现通过药物抑制氧化应激和炎性反应能够抑制AS的发生发展。

表4 各组大鼠主动脉病变分级/只
注:与健康对照组比较,aP<0.05;与模型组比较,bP<0.01。
UA是一种具有抗氧化、抗炎等多种生物学活性的五环三萜类化合物,本实验研究结果显示:与模型组比较发现经UA(10、20、40 mg·kg-1·d-1)干预能够有效抑制AS大鼠主动脉病变,其中UA 40 mg·kg-1·d-1组主动脉病变分级较模型组显著降低(P<0.01),提示UA对AS大鼠具有一定的保护作用。
氧化应激损伤在AS的发生及其发展过程中起着非常重要的作用,ROS本身并不损伤血管,但ROS生成的活性氧和NO将破坏血管壁的光滑性,从而形成斑块、斑块破裂与形成血栓[12-13]。常态下ROS的产生与清除处于动态平衡,其中体内抗氧化酶(SOD、GSH-Px、CAT)在ROS的清除过程中发挥着重要的催化作用[14-15];而当抗氧化酶活性降低时将导致ROS过剩,导致动脉血管的过氧化损伤;因此,过氧化终产物MDA的含量也能够间接反映动脉血管氧化应激损伤程度。本实验研究结果显示:与模型组比较发现经UA(20、40 mg·kg-1·d-1)干预能够显著提高抗氧化酶(SOD、CAT)活性并显著降低MDA、ROS含量(P<0.05,P<0.01),40 mg·kg-1·d-1组优于20 mg·kg-1·d-1组;并且40 mg·kg-1·d-1干预组GSH-Px活性显著提高(P<0.05),提示UA具有降低AS大鼠氧化应激损伤的作用。
Ovsepyan等[16]研究发现,AS斑块将促进巨噬细胞分泌大量促炎性细胞因子(CRP、TNF-α、IL-1β、IL-6)并抑制抑炎性因子IL-10的分泌,从而介导炎性反应的发生,诱导平滑肌细胞的凋亡、促进AS发展。本实验研究结果显示:与模型组比较发现经UA(20、40 mg·kg-1·d-1)干预能够显著降低AS大鼠血浆中CRP、TNF-α、IL-1β、IL-6含量(P<0.05,P<0.01),并且40 mg·kg-1·d-1组IL-10含量显著升高(P<0.01),提示UA具有抑制AS大鼠炎性反应的作用。
综上所述,经UA干预能够有效改善AS大鼠抗氧化酶活性、降低氧化应激损伤,抑制炎性反应,从而表现出UA对AS大鼠具有一定的保护作用。
(本文图1见插图5-1)
[1] WANG CN,LIU CW,LAI ZC,et al.Logistic regression analysis of depression in Aarteriosclerosis obliterans patients and its risk factors[J].Zhongguo Yi Xue Ke Xue Yuan Xue Bao,2015,37(5):557-561.
[2] ZIQIANG X,JINGJUN W,JIANJIAN Z,et al.Tadalafil attenuates graft arteriosclerosis of aortic transplant in a rat model[J].Iran J Basic Med Sci,2015,18(9):927-931.
[3] QIANG G,WENZHAI C,HUAN Z,et al.Effect of Sancaijiangtang on plasma nitric oxide and endothelin-1 levels in patients with type 2 diabetes mellitus and vascular dementia:a single-blind randomized controlled trial[J].J Tradit Chin Med,2015,35(4):375-380.
[4] 宋磊,钱之玉,陈真,等.动脉粥样硬化与炎症的关系及相关治疗药物[J].药学进展,2013,37(2):49-57.
[5] 郝冉冉,王晨静,仲伟珍,等.熊果酸对ox-LDL诱导的人脐静脉内皮细胞氧化损伤的保护作用[J].中药药理与临床,2014,30(4):29-32.
[6] 谭娟,黄微,陈善龙,等.熊果酸衍生物与查耳酮缀合物的合成及抗炎活性[J].药学学报,2016,51(6):938-946.
[7] 杨宏辉,高传玉,徐予,等.动脉粥样硬化SD大鼠模型的建立[J].医药论坛杂志,2009,30(2):18-22.
[8] 王伟,杨滨,王岚,等.丹参山楂药对对大鼠动脉粥样硬化的影响[J].中国中药杂志,2011,36(6):784-789.
[9] 王爽,陈潇,孟国梁,等.灵芝多糖对动脉粥样硬化大鼠氧化应激的影响[J].中药药理与临床,2011,27(6):38-42.
[10] 沈建飞,盛一梁,徐丹,等.降脂丸对动脉粥样硬化大鼠模型炎症因子表达的影响[J].中国医院药学杂志,2013,33(19):1600-1603.
[11] CONSIDINE MJ,SANDALIO LM,FOYER CH.Unravelling how plants benefit from ROS and NO reactions,while resisting oxidative stress[J].Ann Bot,2015,116(4):469-473.
[12] QIANG G,WENZHAI C,HUAN Z,et al.Effect of Sancaijiangtang on plasma nitric oxide and endothelin-1 levels in patients with type 2 diabetes mellitus and vascular dementia:a single-blind randomized controlled trial[J].J Tradit Chin Med,2015,35(4):375-380.
[13] LARTIGUE A,BURLAT B,COUTARD B,et al.The megavirus chilensis Cu,Zn-superoxide dismutase:the first viral structure of a typical CCS-independent hyperstable dimeric enzyme[J].J Virol,2014,2588(14):254-261.
[14] 刘颖,谭波宇.乌头提取物对心衰大鼠抗氧化能力的研究[J].安徽医药,2015,19(9):1661-1664.
[15] 刘秀芳,李婷婷,蔡光明,等.小叶黑柴胡茎叶总黄酮体外抗氧化活性的研究[J].中南药学,2011,9(3):173-175.
[16] OVSEPYAN VA,GABDULKHAKOVA AKH,SHUBENKIVA AA,et al.Role of Interleukin-10 Gene Promoter Region Polymorphism in the Development of Chronic Lymphoid Leukemia[J].Bull Exp Biol Med,2015,160(2):275-277.
