海水中小球藻对Q235碳钢腐蚀行为的影响
2018-04-27,,,,,
,, ,,,
(1. 江苏科技大学 材料科学与工程学院,镇江 212003; 2. 中国科学院海洋研究所 海洋环境腐蚀与生物污损重点实验室 中国科学院海洋研究所,青岛 266071; 3. 国网浙江省电力公司 电力科学研究院,杭州 310006)
工程材料浸入海洋环境中会发生一系列的腐蚀失效,从而带来巨大的经济损失,而大部分腐蚀是由海洋生物造成的。据统计,全世界每年由于海洋生物腐蚀导致的损失就高达上千亿美元[1-2],因此越来越多的学者开始关注海洋生物腐蚀并对其进行了大量研究,提出了微生物腐蚀的机理及控制方法[3]。由微生物的活性导致的金属破坏被称为生物腐蚀或微生物腐蚀(MIC),它是非生物腐蚀产物、生物及其代谢产物在金属材料表面共同作用的结果。后者主要指有机酸或无机酸。大部分腐蚀发生在微生物群之间的区域,微生物的聚集导致电化学活性梯度,例如藻的光合作用能够改变金属表面的状态(pH和溶解氧含量等)[4-5],进而改变其腐蚀过程。微生物的聚集能够形成一道扩散阻挡层,该部分成为阴极区;在未被微生物覆盖的区域,海水中的氯化物和硫酸盐仍可与材料表面接触发生腐蚀成为阳极区,从而使电化学反应加快。
近年来,关于微生物腐蚀研究主要集中在细菌方面[6-7],例如硫酸盐还原菌(SRB)和铁细菌,而关于海洋藻类对金属腐蚀的研究较少。像大多数微生物一样,微藻会附着在固体表面形成微生物膜,进而改变材料局部的物理化学特性[8-9],导致材料的损坏或腐蚀等严重问题。LANDOULSI等[10]认为微藻通过光合作用产生的氧气及其代谢产物等生物活动都会影响微生物腐蚀。王伟等[11]研究了微藻对碳钢腐蚀电位的影响,结果显示:在动态海水中由于金属表面很难形成完整稳定的附着层,导致碳钢的腐蚀电位随着浸泡时间的延长而负移。同时LIU等[12]研究了小球藻对碳钢腐蚀行为的影响。但目前关于单一海洋微藻对材料的腐蚀仍然较少。小球藻(chlorella vulgaris)是一种在海洋中分布比较广泛,且生长迅速、适应力强的单细胞绿藻,也是微生物膜的重要组成部分[13-14]。小球藻主要由多糖,蛋白质脂肪酸等构成,同时包含官能团,例如羧酸和氨基酸,它们呈酸性,有可能和溶液中的金属离子相结合[15-16],对金属的腐蚀产生影响。
Q235钢因其性能良好、价格低廉而被广泛应用于海洋设备及船舶制造,但在复杂的海洋环境中,Q235钢极易发生腐蚀破坏,尤其是微生物腐蚀,这对海洋设施的正常使用造成严重影响。因此,本工作通过表面分析技术和电化学测试研究了海水中小
球藻对Q235碳钢腐蚀行为的影响。
1 试验
1.1 试样的制备
试验采用Q235碳钢试片,尺寸为10 mm×10 mm×10 mm,化学成分(质量分数)为:0.1% C,0.4% Mn,0.12% Si,0.02% S,0.05% P,其余为Fe。电化学测试试样背面用铜导线连接,环氧树脂封嵌。表面分析试验时,为保证小球藻与钢片充分接触,仅将其中的一个面用704硅胶密封,其余面均暴露在培养液中。使用1 000号的水磨砂纸对试样进行打磨,并用乙醇超声除油,去离子水清洗,干燥放置备用。使用前对试样进行紫外灭菌处理。
1.2 小球藻的培养
试验所用的小球藻来源于中科院海洋所,培养液为f/2,其成分见表1,培养液采用高温灭菌锅在121 ℃灭菌30 min。培养过程中,将小球藻接种在盛有100~150 mL培养液的250 mL锥形瓶中,并放置在智能光照培养箱中。培养温度为23 ℃,光照强度为3 000 lx,按12 h∶12 h进行光暗的周期交替。
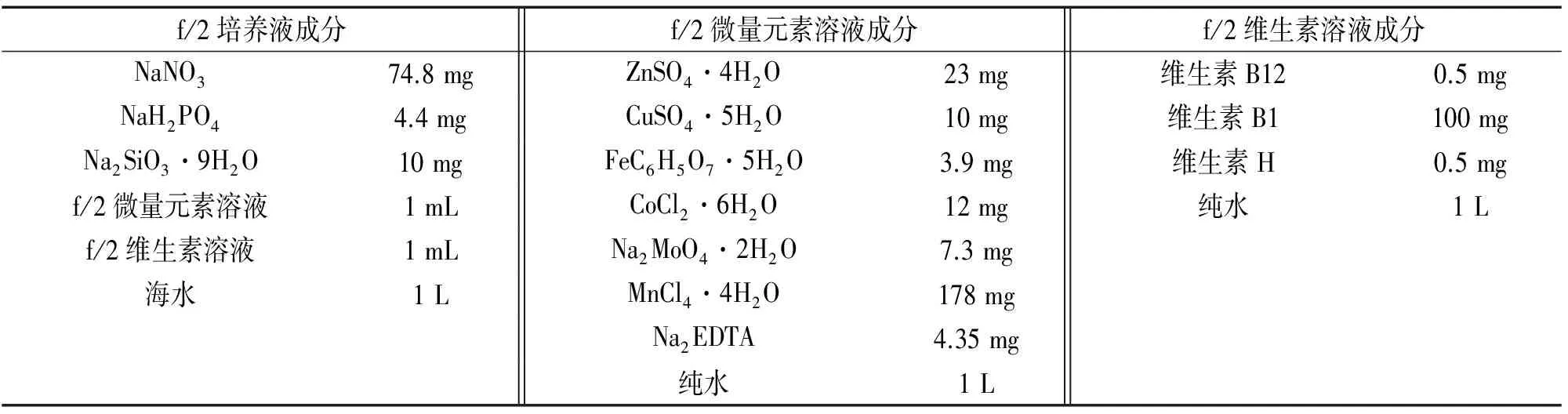
表1 f/2培养液成分Tab. 1 Composition of f/2 culture medium
1.3 小球藻生长曲线测定
由于微生物在培养液中的含量与光密度(OD值)成正比[17],因此本工作采用紫外分光光度计测培养液的OD值研究小球藻的生长。
生长曲线的测定大概分为三个步骤:接种、培养和测定。首先,准备3个500 mL的三角瓶,每个三角瓶中倒入300 mL的f/2培养液,将处于生长期的小球藻接种到培养液中(每100 mL培养液中接种5个小球藻),摇匀放入培养箱中。每天在特定的时间分别从3个三角瓶中取出10 mL溶液装入15 mL的离心管中(该操作在无菌超净台中进行),进行标记,立即放入冰箱中4 ℃保存,待培养结束之后一起采用紫外分光光度计进行测量。测量时将未接种小球藻的培养液倒入比色杯中,采用680 nm波长作为零点参比对照,对培养不同时间的培养液进行OD值测定。
1.4 表面分析试验
取两个灭菌后的三角瓶分别倒入350 mL的f/2培养液。其中一个加入35 mL处于生长期的藻液。把制备好的Q235碳钢试样各放入两个三角瓶中,采用透气膜将瓶口封住。将三角瓶放置在光照培养箱中,10 d后把试样分别从两个三角瓶中取出并进行处理,然后采用JSM-5600LV型扫描电子显微镜对处理好的试样进行观察。
1.5 电化学试验
电化学测试采用三电极体系。其中,Q235碳钢为工作电极,铂电极和饱和甘汞电极(SCE)分别为辅助电极和参比电极。测试仪器为GAMRY1000电化学工作站,测试周期为15 d。设定扫描频率为10 mHz~100 kHz,扰动电位为10 mV。测试得到的数据用ZSimpWin软件分析。
2 结果与讨论
2.1 小球藻的生长周期
小球藻在培养液中的生长曲线如图1所示。其生长过程大致分为4个阶段:分别为调整期、对数期、稳定生长期及衰亡期。初始阶段小球藻刚接种到培养液中,小球藻的密度较低且分裂缓慢,因此小球藻的生长较为缓慢;刚接种藻的培养液中含有丰富的营养物质,待小球藻在培养液中适应一段时间之后开始以二次分裂的方式进行快速繁殖,其增长方式呈指数形式;随着小球藻的快速繁殖,培养液中的营养物质被大量消耗,代谢产物增加,使得小球藻的增长逐渐放缓,并有部分藻类出现死亡,在整个体系中小球藻的生长达到一个动态平衡的状态;平衡阶段维持一段时间后,培养液中的营养物质被耗尽,小球藻的繁殖速率小于衰亡速率,最终导致活性小球藻的数量减少。
2.2 表面分析
图2为Q235碳钢在不含小球藻和含小球藻培养液中浸泡10 d后的腐蚀形貌。通过比较发现,Q235碳钢在不含小球藻的培养液中发生的是均匀腐蚀,材料表面均匀地分布着大大小小的腐蚀坑;而在含小球藻培养液中Q235碳钢表面发生的是不均匀腐蚀,在部分表面出现了较为严重的腐蚀坑洞,与无藻体系相比,腐蚀坑洞较大,这说明在小球藻体系中Q235碳钢的腐蚀较为严重。这是因为在含藻体系中,小球藻的光合作用会产生大量的氧气,使得培养液中的溶解氧含量明显升高,从而加速了阴极的氧去极化反应。同时培养液中的小球藻在Q235碳钢表面附着形成一层生物膜对其起到保护作用。但由于Q235碳钢极易腐蚀,表面的腐蚀产物不断更新,小球藻很难长期在试样表面附着,部分已形成的生物膜也会随着腐蚀产物一起脱落,未能起到很好的保护效果。即使某些位置形成的生物膜较为致密,也会由于金属表面的生物膜分布不均而产生不同的阴极活性区域。生物膜覆盖的区域氧含量较低,成为阳极区,未覆盖的区域氧含量较高,成为阴极区,从而形成氧浓差电池。含氧条件下金属表面自然不均匀分布的生物膜会导致氧浓差电池,加速金属材料的腐蚀[18]。
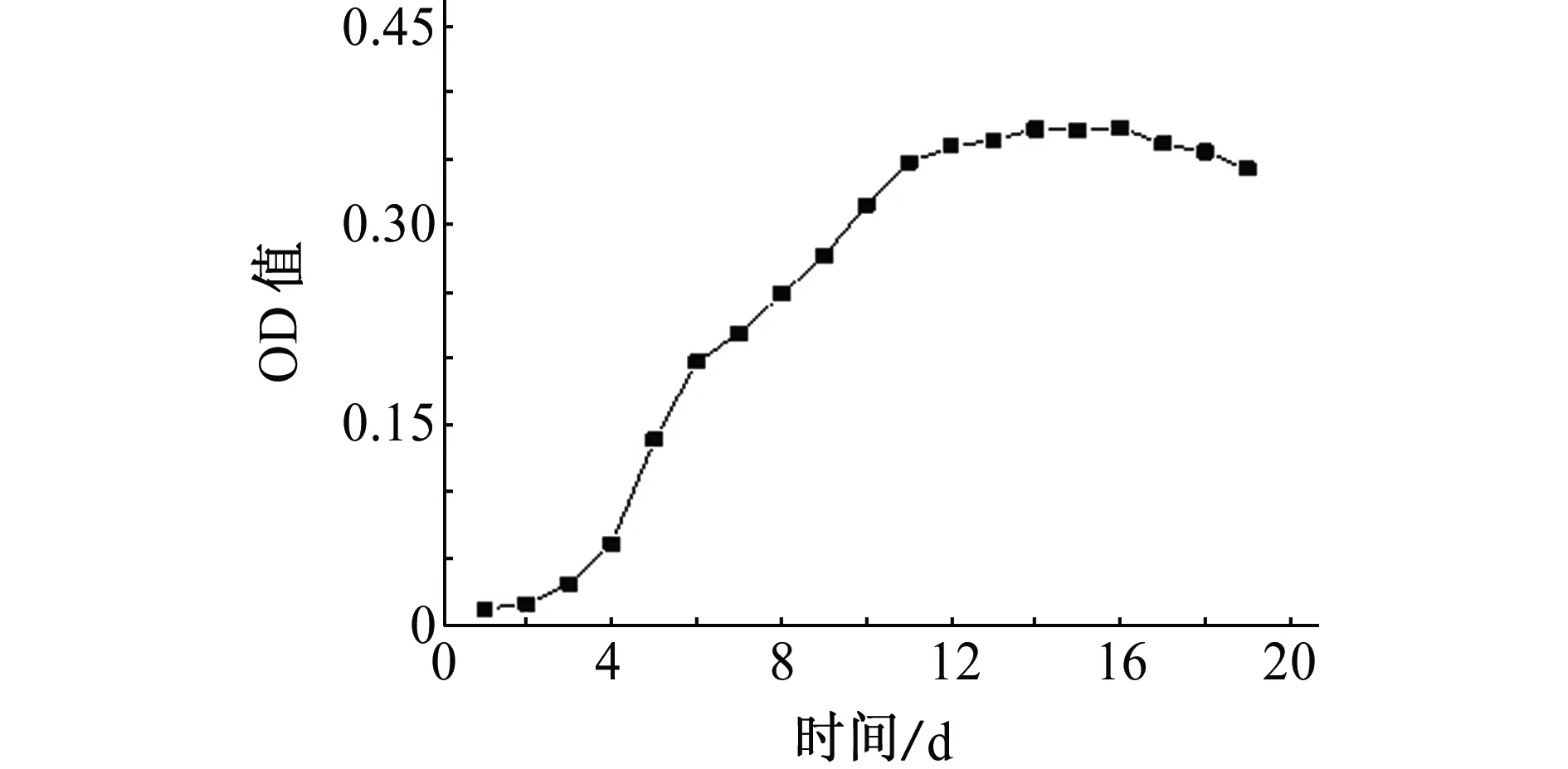
图1 小球藻生长曲线Fig. 1 Growth curve of chlorella vulgaris
对分别浸泡在不含和含小球藻培养液中10 d后的Q235碳钢表面进行EDS分析,结果如表2所示。与不含小球藻的培养液相比,浸泡在含小球藻培养液中的试样表面硫元素和磷元素的质量分数分别从1.059%和0.075%增加到2.748%和1.221%。
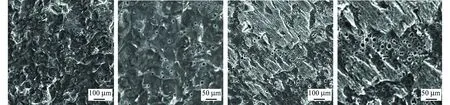
(a) 不含小球藻,低倍(b) 不含小球藻,高倍(c) 含小球藻,低倍(d) 含小球藻,高倍 图2 Q235碳钢在不含小球藻(a,b)和含小球藻培养液(c,d)中浸泡10 d后的腐蚀形貌Fig. 2 Corrosion morphology of Q235 carbon steel immersed in culture medium without (a,b) and with (c,d) chlorella vulgaris for 10 days at low and high magnifications

这是由于试样所用的f/2培养液中含有一定量的生物素(C10H15N2O3S)和维生素B12(C63H88CoN14O14P),这些有机分子被小球藻吸收以后随着小球藻一起附着在试样的表面。此外浸泡在含小球藻体系中的试样表面有硅元素和镁元素存在,硅是小球藻生长所需要的营养成分,可促进小球藻的生长及光合作用,而镁元素是构成叶绿素的重要元素,小球藻中富含大量的叶绿素a和叶绿素b,当附着在试样表面的小球藻死亡后,细胞内的色素则会被释放出来[12,19],所以试样表面含有镁元素。
2.3 电化学测试结果
图3为在不含小球藻和含有小球藻培养液中Q235碳钢的开路电位随时间的变化曲线。由图3可见:在不含小球藻培养液中浸泡0~15 d时,Q235碳钢的开路电位从-722.11 mV逐渐负移至-728.97 mV,这期间腐蚀速率较大;随后开路电位正移至-715.02 mV,这是由于随着反应的进行,腐蚀产物不断积累在材料表面形成产物膜,该产物膜对基体具有保护作用,腐蚀趋势减弱;之后开路电位基本保持在-715 mV左右。在含小球藻培养基中Q235碳钢的开路电位随时间的变化较为复杂,与光照有明显的关系。经12 h光照后,Q235碳钢的开路电位逐渐负移,其中负移最多的接近30 mV,由-718.41 mV负移至-745.64 mV,因为在12 h光照条件下,小球藻进行光合作用产生氧气,溶液中氧含量升高,氧在浓度梯度下通过生物膜达到金属表面发生氧去极化反应,使开路电位负移;在12h黑暗条件下,小球藻的呼吸作用消耗氧气,使Q235碳钢的开路电位逐渐正移,正移最多的接近24 mV,由-745.64 mV正移至-721.76 mV。总体来看,小球藻在培养液中接种前3 d时,由于小球藻生长不旺盛,数量较少,因此开路电位与光照关系不大;接种4 d后,开路电位随时间的变化比较规律,呈现出与光照有关的周期振荡。
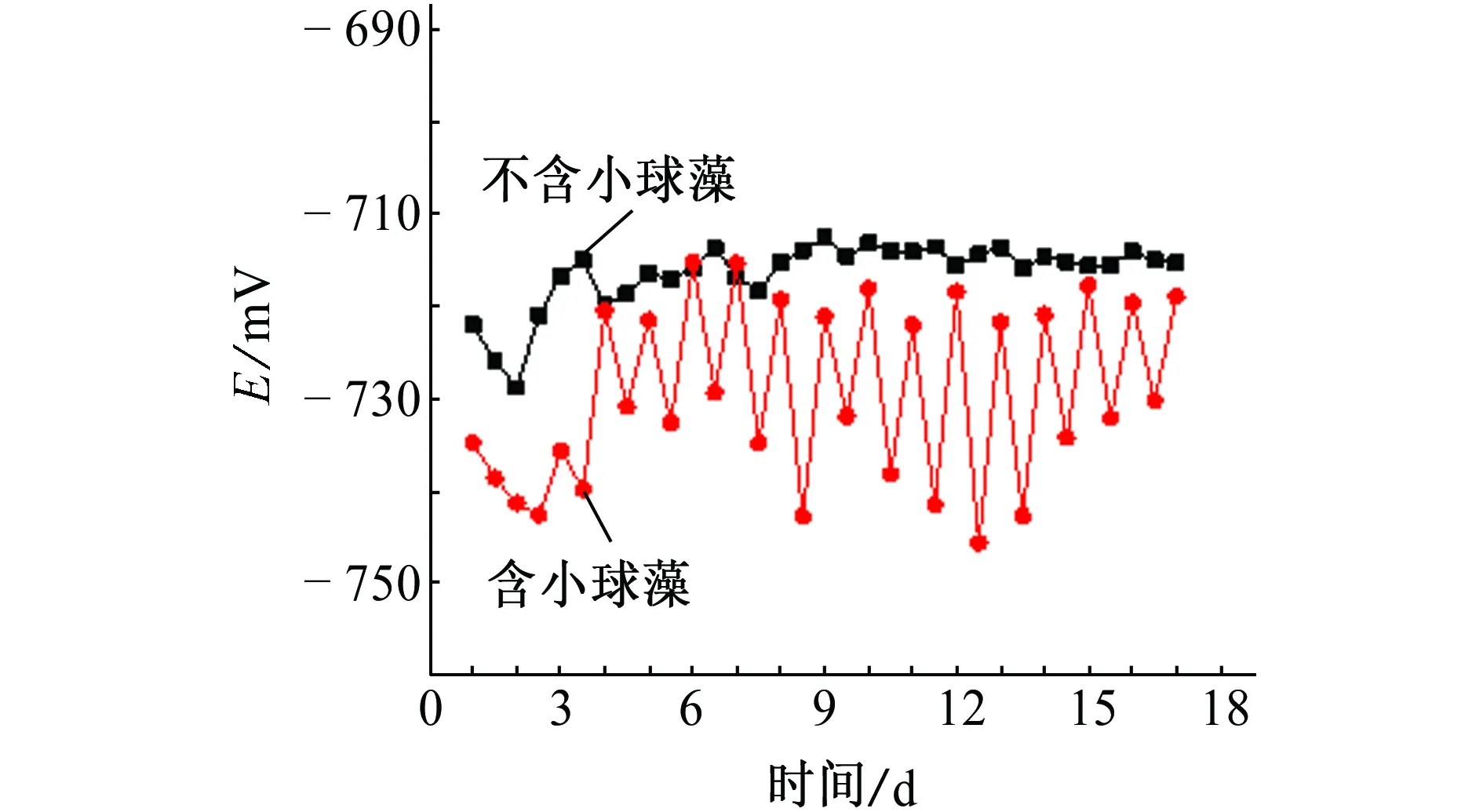
图3 不含和含有小球藻培养液中的Q235碳钢 开路电位随浸泡时间的变化Fig. 3 Open circuit potential vs immersion time for Q235 carbon steel immersed in culture medium with and without chlorella vulgaris
由以上结果可以看出,在有藻和无藻体系中,Q235碳钢开路电位的变化趋势明显不同,但两者都有不同程度的正移,这与王伟等[11]报道的动态海水环境中Q235碳钢的腐蚀电位变化规律相反。因为在静态海水中的腐蚀产物和微藻代谢产物膜构成的复合膜层能够附着在Q235碳钢表面,对Q235碳钢起到保护作用。
图4为Q235碳钢在不含和含小球藻培养液中的电化学阻抗谱,采用Zsimpwin软件按图5所示的等效电路对电化学阻抗谱进行拟合,拟合得到的参数见表3和表4。其中,Rs为溶液电阻;Qf为表面层的常相位角元件;Rf为表面层电阻;Qdl为界面双电层的常相位角元件;Rct为电荷传递电阻,可以用来表征金属的腐蚀速率,Rct越小,金属腐蚀速率越大[20]。
从表3中可以看出:Rct在整个试验周期内的变化较小,最低为1 266 Ω·cm2,最高为1 877 Ω·cm2,基本稳定在1 500 Ω·cm2左右,说明在不含小球藻培养液中Q235钢的电化学性能较为稳定。
从表4中可以看出:试验初期小球藻数量较少,Rct小于1000 Ω·cm2,金属的腐蚀速率较高;随着浸泡时间的延长,Rct呈增大趋势,在浸泡9 d时达到最大值,为1626 Ω·cm2,因为此时小球藻处于指数生长阶段,培养液中藻的数量增多,同时培养液中营养物质丰富,小球藻新陈代谢旺盛,其代谢产物膜与腐蚀产物构成的复合膜层附着在金属表面,对金属具有保护效果,能够减缓溶液中Cl-对金属的腐蚀;试验后期小球藻进入衰亡阶段,微生物和腐蚀产物形成的复合膜逐渐疏松并脱落,对金属的保护作用减弱,腐蚀速率逐渐增大。
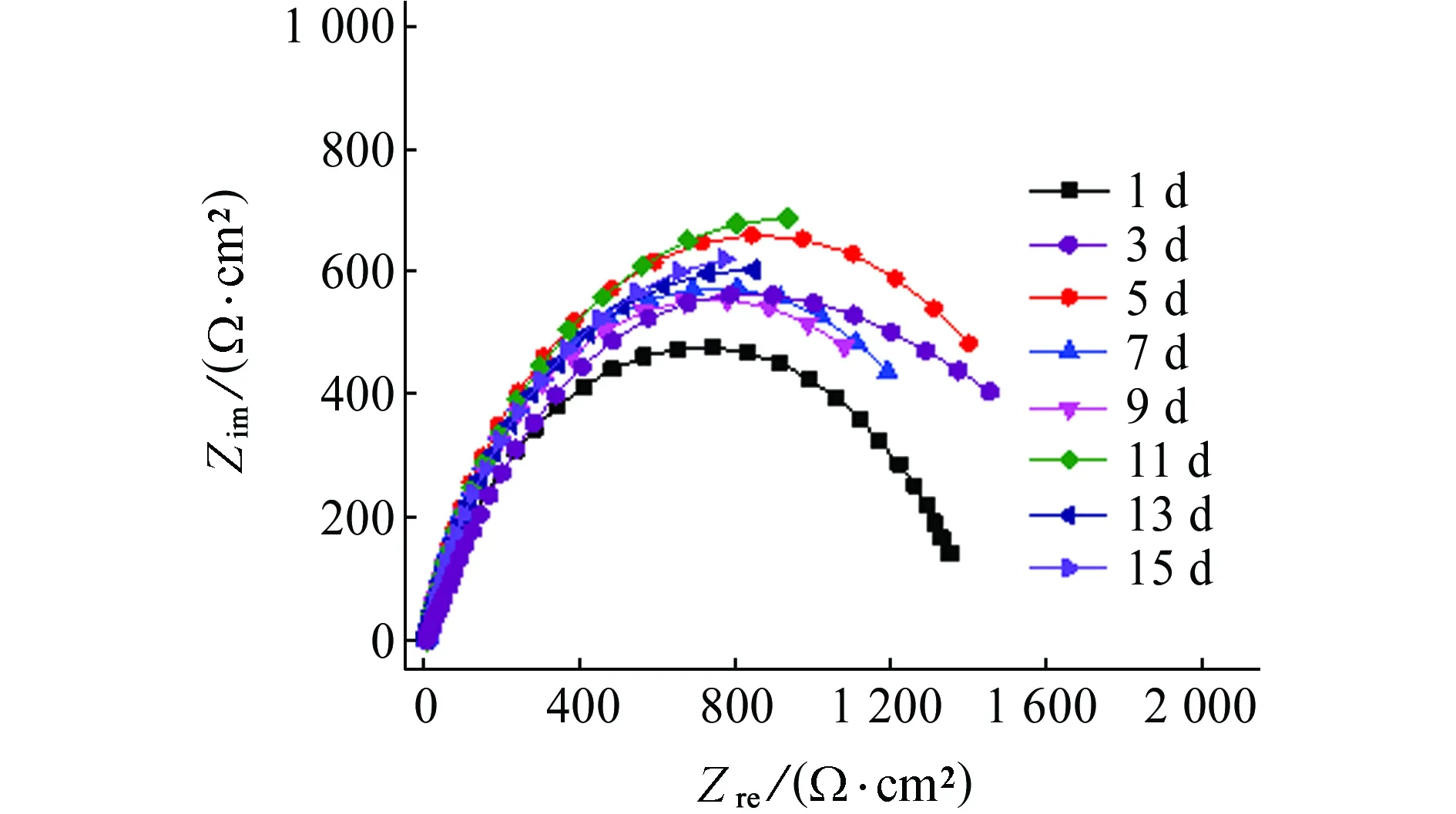
(a) 不含小球藻
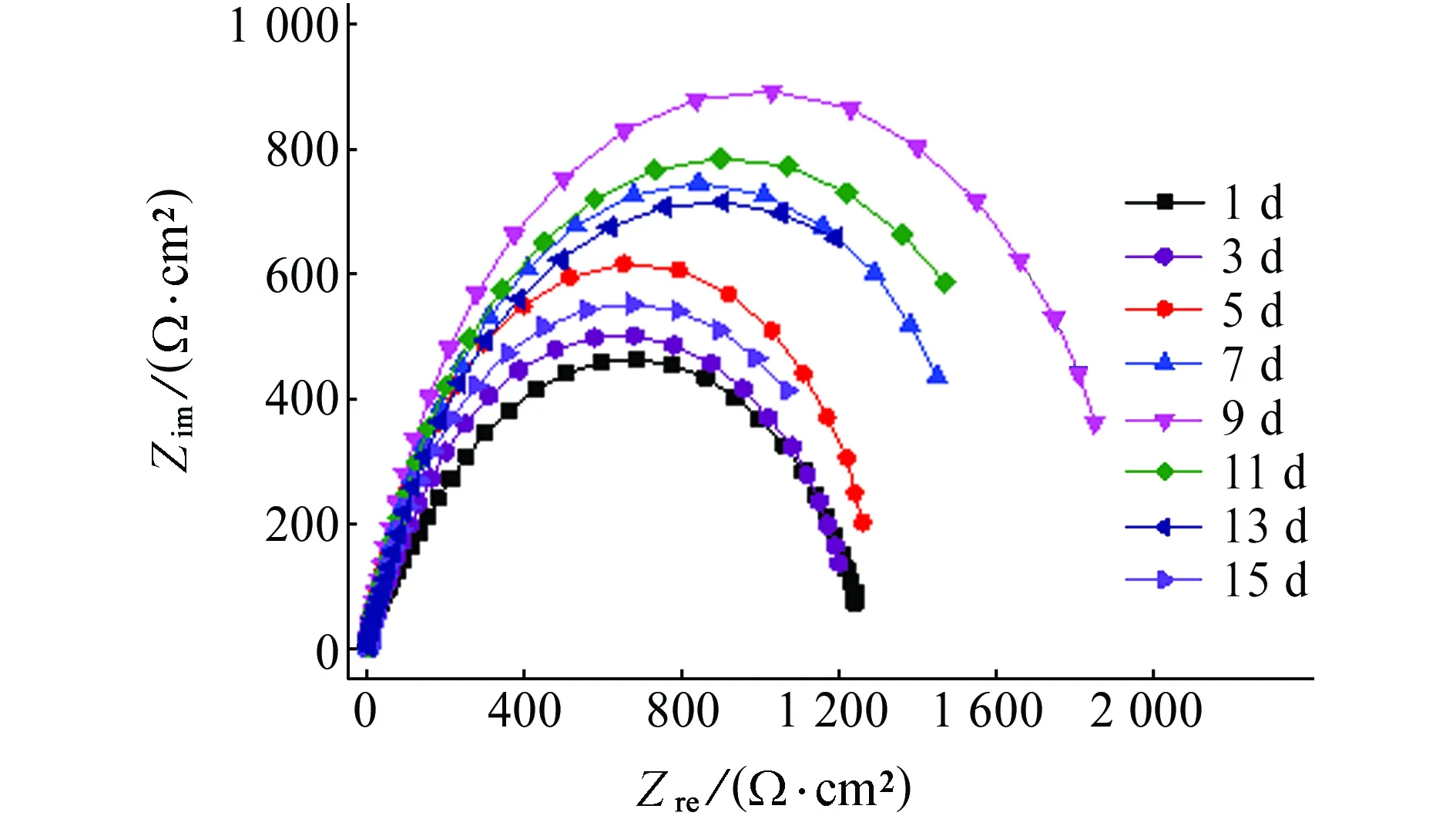
(b) 含小球藻 图4 在不含小球藻和含小球藻培养液中 Q235碳钢的电化学阻抗谱Fig. 4 EIS of Q235 carbon steel immersed in culture medium without (a) and with (b) chlorella vulgaris

(a) 不含小球藻
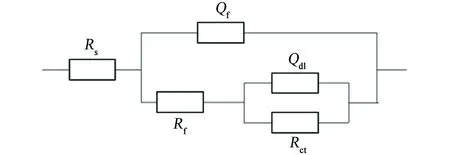
(b) 含小球藻 图5 在不含小球藻和含小球藻培养液中Q235碳钢 的电化学阻抗谱的等效电路Fig. 5 Equivalent circuits of EIS of Q235 carbon steel immersed in culture medium without (a) and with (b) chlorella vulgaris
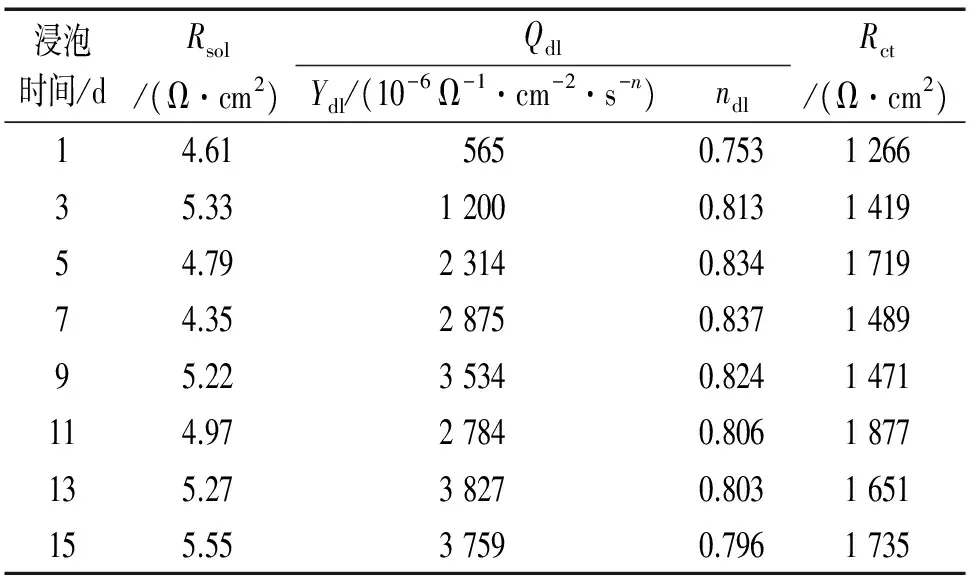
表3 Q235碳钢在不含小球藻培养液中电化学阻抗谱的拟合参数Tab. 3 Fitted parameters of EIS of Q235 carbon steel immersed in culture medium without chlorella vulgaris
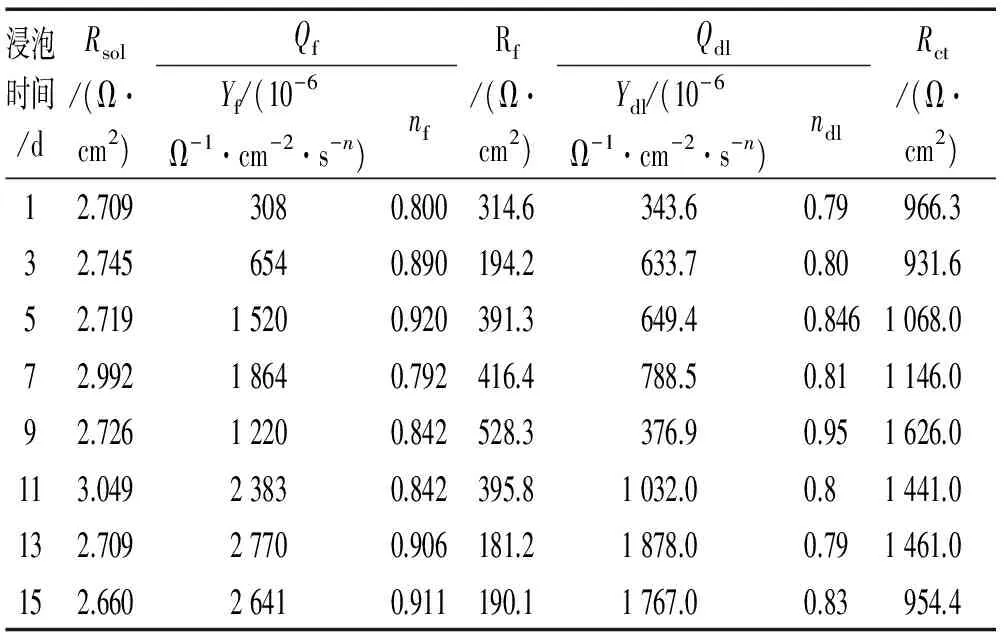
表4 Q235碳钢在含小球藻培养液中电化学阻抗谱的拟合参数Tab. 4 Fitted parameters of EIS of Q235 carbon steel immersed in culture medium with chlorella vulgaris
从整个试验周期来看,Q235碳钢在不含小球藻体系中的腐蚀速率低于在含藻体系中的。由于培养液中的小球藻发生光合作用产生氧气,使得溶液中氧含量升高,阴极氧去极化加速金属的腐蚀[21],且阴极氧去极化腐蚀对金属的影响远远大于生物膜对金属的保护,所以电极过程还是以金属的腐蚀为主。此外,由于Q235碳钢的活性较高,腐蚀速率较快,从而使金属表面不断更新,导致小球藻很难在一块稳定不变的金属表面稳定附着,形成阴阳极区域,加速腐蚀。
3 结论
(1) 在不含小球藻培养液中Q235碳钢发生均匀腐蚀,而在含小球藻培养液中碳钢发生不均匀腐蚀,且与无藻体系相比,其点蚀坑较大;Q235碳钢在含小球藻培养液中的腐蚀速率高于在不含小球藻培养液中的,且受溶液中氧含量变化的影响,在含小球藻体系中,开路电位随浸泡时间的变化呈周期性振荡。
(2) 小球藻在Q235碳钢表面附着形成不完整的生物膜,产生不同阴极活性区域,形成氧浓差电池,加速金属材料的腐蚀,同时小球藻的光合作用产生大量氧气,引起金属的氧去极化反应,也使腐蚀加快。
(3) 小球藻附着形成的生物膜与腐蚀产物覆盖在试样表面能够抑制溶液中的离子向金属表面扩散,对金属基体起到保护作用,腐蚀速率降低,使浸泡后期金属的腐蚀速率低于浸泡初期的。
参考文献:
[1] BHADURY P,WRIGHT P C. Exploitation of marine algae:biogenic compounds for potential antifouling applications[J]. Planta,2004,219(4):561-78.
[2] FITRIDGE I,DEMPSTER T,GUENTHER J,et al. The impact and control of biofouling in marine aquaculture:a review[J]. Biofouling,2012,28(7):649-69.
[3] BEECH I B. Corrosion of technical materials in the presence of biofilms-current understanding and state-of-the art methods of study[J]. International Biodeterioration & Biodegradation,2004,53(3):177-183.
[4] STAROSVETSKY J,STAROSVETSKY D,POKROY B,et al. Electrochemical behaviour of stainless steels in media containing iron-oxidizing bacteria (IOB) by corrosion process modeling[J]. Corrosion Science,2008,50(2):540-547.
[5] WANG H,HU C,HU X,et al. Effects of disinfectant and biofilm on the corrosion of cast iron pipes in a reclaimed water distribution system[J]. Water Research,2011,46(4):1070-1078.
[6] SAN N O,NAZIR H,DÖNMEZ G. Microbially influenced corrosion and inhibition of nickel-zinc and nickel-copper coatings by pseudomonas aeruginosa[J]. Corrosion Science,2014,79(2):177-183.
[7] EMERSON D,FLEMING E J,MCBETH J M. Iron-oxidizing bacteria:an environmental and genomic perspective[J]. Annual Review of Microbiology,2010,64(64):561-583.
[8] ROLF B,MEI H C,BUSSCHER H J. Physico-chemistry of initial microbial adhesive interactions-its mechanisms and methods for study[J]. Fems Microbiology Reviews,1999,23(2):179-230.
[9] JAIN A,BHOSLE N B. Biochemical composition of the marine conditioning film:implications for bacterial adhesion[J]. Biofouling,2009,25(1):13-9.
[10] LANDOULSI J,COOKSEY K E,DUPRES V. Review-Interactions between diatoms and stainless steel:focus on biofouling and biocorrosion[J]. Biofouling,2011,27(10):1109-24.
[11] 王伟,王佳,徐海波,等. 海洋环境中微生物膜吸附动力学过程对钝态金属开路电位变化特征的影响[J]. 中国腐蚀与防护学报,2006,26(2):65-69.
[12] LIU S,WANG Y,ZHANG D,et al. Electrochemical behavior of 316L stainless steel in f/2 culture solutions containing chlorella vulgaris[J]. International Journal of Electrochemical Science,2013,8(4):5330-5342.
[13] SEKAR R,VENUGOPALAN V P,SATPATHY K K,et al. Laboratory studies on adhesion of microalgae to hard substrates[M]. Berlin:Springer Netherlands,2004:109-116.
[14] IRVING T E,ALLEN D G. Species and material considerations in the formation and development of microalgal biofilms[J]. Applied Microbiology & Biotechnology,2011,92(2):283-94.
[15] GEESEY G G,JANG L,JOLLEY J G,et al. Binding of metal ions by extracellular polymers of biofilm bacteria[J]. Water Science & Technology,1988,20(11/12):161-165.
[16] GU J D,ROMAN M,ESSELMAN T,et al. The role of microbial biofilms in deterioration of space station candidate materials[J]. International Biodeterioration & Biodegradation,1998,41(1):25-33.
[17] DAHMS H U,DOBRETSOV S,QIAN P Y. The effect of bacterial and diatom biofilms on the settlement of the bryozoan Bugula neritina[J]. Journal of Experimental Marine Biology & Ecology,2004,313(1):191-209.
[18] ISHIHARA Y,TSUJIKAWA S. Effect of bacteria combined with diatom on ennoblement of electrode potential for stainless steels in natural sea water[J]. Corrosion Engineering,1999,48:520-527.
[19] ZHANG J,SUN C,YU Z,et al. The performance of zinc sacrificial anode in simulating marine fouling environment[J]. International Journal of Electrochemical Science,2014,9(10):5712-5721.
[20] 张杰,宋秀霞,栾鑫,等. 海藻希瓦氏菌对Zn-Al-Cd牺牲阳极的腐蚀性能影响[J]. 金属学报,2012(12):1495-1502.
[21] ATES M. Review study of electrochemical impedance spectroscopy and equivalent electrical circuits of conducting polymers on carbon surfaces[J]. Progress in Organic Coatings,2011,71(1):1-10.
