HPLC法测定冻干粉针中AOH的含量
2018-04-27刘婷杨建云肖炳坤杨怀霞黄荣清
刘婷 杨建云 肖炳坤 杨怀霞 黄荣清
1.河南中医药大学药学院,郑州 450046;2.军事科学院军事医学研究院辐射医学研究所,北京 100850
AOH是一种雄甾酮衍生物,具有抗糖皮质激素活性的作用[1]。AOH能够刺激机体细胞因子的分泌,促进辐射诱导造血损伤恢复,可以明显提高全身辐射小鼠和猕猴的存活率,增强机体辐射后抗感染能力,有很好的抗辐射效果[2-7]。此外,组织病理学检查和临床试验结果表明AOH的毒性较低[8]。AOH具有较强的抗辐射作用和较低的毒性,使其成为一个引人关注的候选抗辐射药物,对其进行含量测定可以为药物的有效性提供质量控制办法。AOH不溶于水而溶于有机溶剂,将AOH做成冻干粉针注射剂,可降低给药剂量,提高生物利用度[9]。AOH冻干粉针剂是一种注射给药新剂型,本文建立了一种简便、准确、可行、高效 的HPLC 分析方法,用于测定冻干粉针中AOH含量,为其质量控制奠定基础。
1 仪器与试药
仪器 :Waters 2795 高效液相色谱仪(美国Waters 公司) ;2996 二极管阵列检测器 ;Empower 数据处理系统 ;BP211D型十万分之一天平(德国塞多利斯集团) ;KQ3200 型超声仪(宁波新芝生物科技股份有限公司),UV-2501PC 紫外分光光度仪(日本岛津公司)。色谱柱 Dikma, Diamonsil C18柱 (250mm×4.6 mm,5 μm),甲醇和乙腈均为色谱纯,甘露醇、吐温80、磷酸二氢钠和磷酸氢二钠均为分析纯(AR),PH6.0 PBS缓冲液为磷酸二氢钠和磷酸氢二钠的混合液,氢氧化钠(纯度≥96%),盐酸(纯度为36%~38%),30%过氧化氢。AOH 对照品(含量:100.02%,军事医学科学院放射与辐射医学研究所自制);AOH冻干粉针(含主药100 mg/瓶)及空白辅料(军事医学科学院放射与辐射医学研究所自制 )。
2 冻干粉针制备
称取AOH对照品13.0g,1.5g吐温80,3.0g甘露醇。将吐温80加入研钵,倒入甘露醇,研匀后采用少量递加法加入已研细 AOH 粉末,研磨均匀,加入 PBS 缓冲液,少量多次将上述药物辅料混合物从研钵转移至烧杯中,加入剩余PBS溶液,简单搅拌后,水浴超声处理15min,转入胶体磨研磨40min,中间停机10min散热,之后由胶体磨倒出,超声处理15 min后,用注射器吸取1.8mL混悬液置安瓿管内,冻干得疏松状固体后,封口即可。
3 溶液的制备
3.1 对照品溶液制备
取 AOH对照品约 25 mg,精密称定,置 50 mL量瓶中,加适量甲醇超声溶解并稀释至刻度,摇匀,作为对照品溶液。
3.2 供试品溶液制备
称取供试品约 25mg,精密称定,置 50 mL 量瓶中,加适量甲醇超声 15 min,并稀释至刻度,摇匀,作为供试品溶液。
3.3 空白溶液制备
称取处方量的空白辅料适量,置100mL量瓶中,用甲醇适量,超声处理15min,加甲醇稀释至刻度,摇匀,离心,取上清液。
4 色谱条件与系统适用性试验
采用 Diamonsil C18(250 mm×4.6 mm,5 μm)色谱柱 ;流动相 : 乙腈 - 水(45:55);检测波长 206nm ;流速 1.0 mL·min-1;进样量20 μL ;柱温:室温。理论塔板数以 AOH计算不低于 5000。
按上述色谱条件,将对照品溶液、供试品溶液及空白辅料溶液分别进样,AOH 冻干粉针保留时间为 13.389 min,空白辅料在此处无色谱峰出现,说明辅料对 AOH检测无影响。色谱图见图 1。
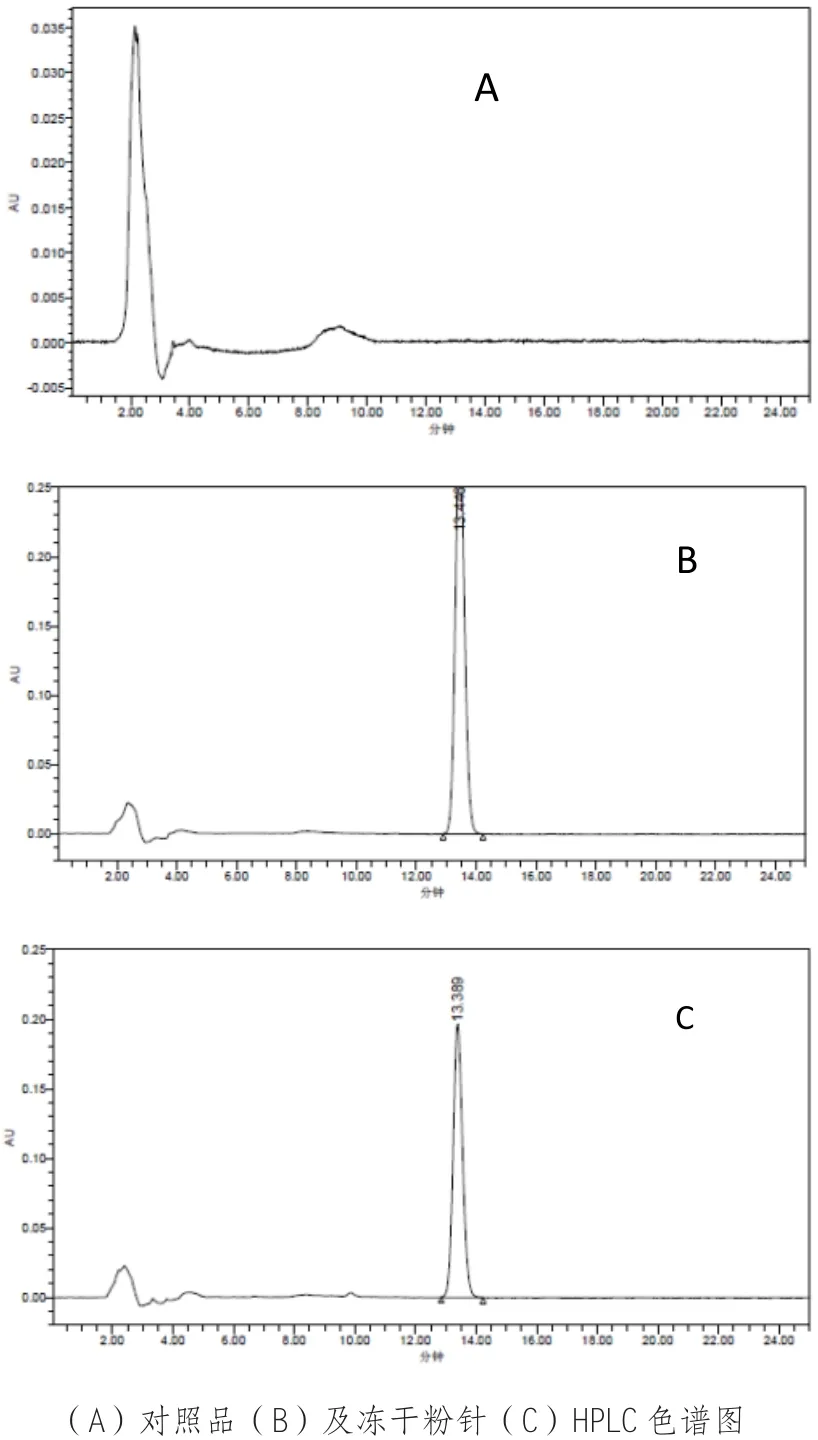
图1 空白辅料
5 方法学验证[10]
5.1 检测限、定量限
取AOH约10mg,精密称定,置10mL量瓶中,加乙腈超声溶解并稀释至刻度,摇匀,再用乙腈逐级稀释成一系列浓度,精密量取20μL,10μL,5μL,分别注入液相色谱仪,记录色谱图。在信噪比(S/N)为3:1时测得的检测限为50ng,在信噪比(S/N)为10:1时测得的定量限为200ng。
5.2 线性关系考察
取对照品约50mg,精密称定,置50mL量瓶中,加乙腈超声溶解并稀释至刻度,摇匀,作为对照品储备液。分别量取2mL、3mL、4mL、5mL、6mL、7mL、8mL溶液于10mL量瓶中,加乙腈超声溶解并稀释至刻度,摇匀,取20ul进样测定,记录色谱图。以峰面积 A 对浓度 C(mg·mL-1)进行线性回归,得回归方程是A=1E+07C-60480(n=7)(r=0.9994)。结果表明,AOH冻干粉针在0.2~0.8mg/mL范围内与峰面积呈良好线性关系。
5.3 仪器精密度试验
取浓度约为0.5mg/mL的标准品溶液,连续进样6次,每次20μL,以峰面积计算所得RSD为0.93%,表明仪器有良好的精密度。
5.4 稳定性试验
取一系列浓度为0.4mg/mL、0.5mg/mL、0.6mg/mL的供试品溶液,分别于0h、2h、4h、6h、8h、10h、24h、48h、72h各取20μL进样,照“4”项下色谱条件测定峰面积。结果 24h 内 3 种浓度峰面积 RSD 分别为 0.63%、0.38%、0.68%,72h 内3 种浓度峰面积 RSD 分别为 1.47%、0.95%、1.47%,表明样品溶液在3天内比较稳定。
5.5 重复性试验
分别精密称取样品9份,配制成浓度为0.4mg/mL、0.5mg/mL、0.6mg/mL的供试品溶液,每个浓度制备3份,照“4”项下色谱条件测定峰面积,按外标法以峰面积计算得平均标示量为0.67mg/mg。RSD为1.57%,表明方法有良好的重复性。
5.6 加样回收测定
取AOH冻干粉5瓶,将倾出内容物混匀后,精密称取供试品适量,9 份分别精密加入对照品适量,配制成低、中、高3种浓度,摇匀,过滤后进样 20 μL,测定回收率,结果(见表 1)AOH 冻干粉针平均回收率为 101.72%,RSD=1.21%。说明用本法测定 AOH 冻干粉针含量准确度良好。

表 1 AOH冻干粉针加样回收(n=9) 测定结果
5.7 专属性考察
为进一步考察色谱系统的分离效果,对样品分别进行了过氧化氢氧化破坏、碱破坏、酸破坏与加热破坏试验。
取AOH冻干粉适量,精密称定,置25mL量瓶中,照下述方法进行操作:酸破坏:用5mol·L-1的氢氧化钠10mL,90℃水浴中加热8h,再加5mol·L-1的盐酸,调节pH至中性,过滤,滤渣晾干;②碱破坏:用5mol·L-1的氢氧化钠10mL,90℃水浴中加热8h,再加5mol·L-1的盐酸,调节pH至中性,过滤,滤渣晾干;③氧化破坏:加30%过氧化氢10mL,放置3天后于90℃水浴中加热8h,过滤,滤渣晾干;④高温破坏:置120℃下放置10h。取上述滤渣加甲醇超声溶解并稀释至刻度,分别进样 20μL,照“4”项下色谱条件测定。
6 样品分析
取3批供试品,称取供试品约 25mg,精密称定,置50 mL 量瓶中,加适量甲醇超声 15 min,并稀释至刻度,摇匀,作为供试品溶液,取 AOH对照品同法操作,得对照品溶液。取上述溶液 20 μL 注入液相色谱仪,按照“4”项下色谱条件测定,记录色谱图。批号20170301、20170302、20170303含量为0.68 mg/mg、0.69 mg/mg、0.71 mg/mg。
7 讨论
7.1 波长的选择
配制一定浓度的对照品溶液,在 190~800 nm 范围内进行全扫描(见图 3),可以看出本品为末端吸收,与AOH结构式中只有一个双键的特征相符合,选择 206 nm 作为检测波长,既保证主药能有相应吸光值,有关物质也在此波长处有较强吸收;流动相在该波长处无吸收,不会干扰被测组分。
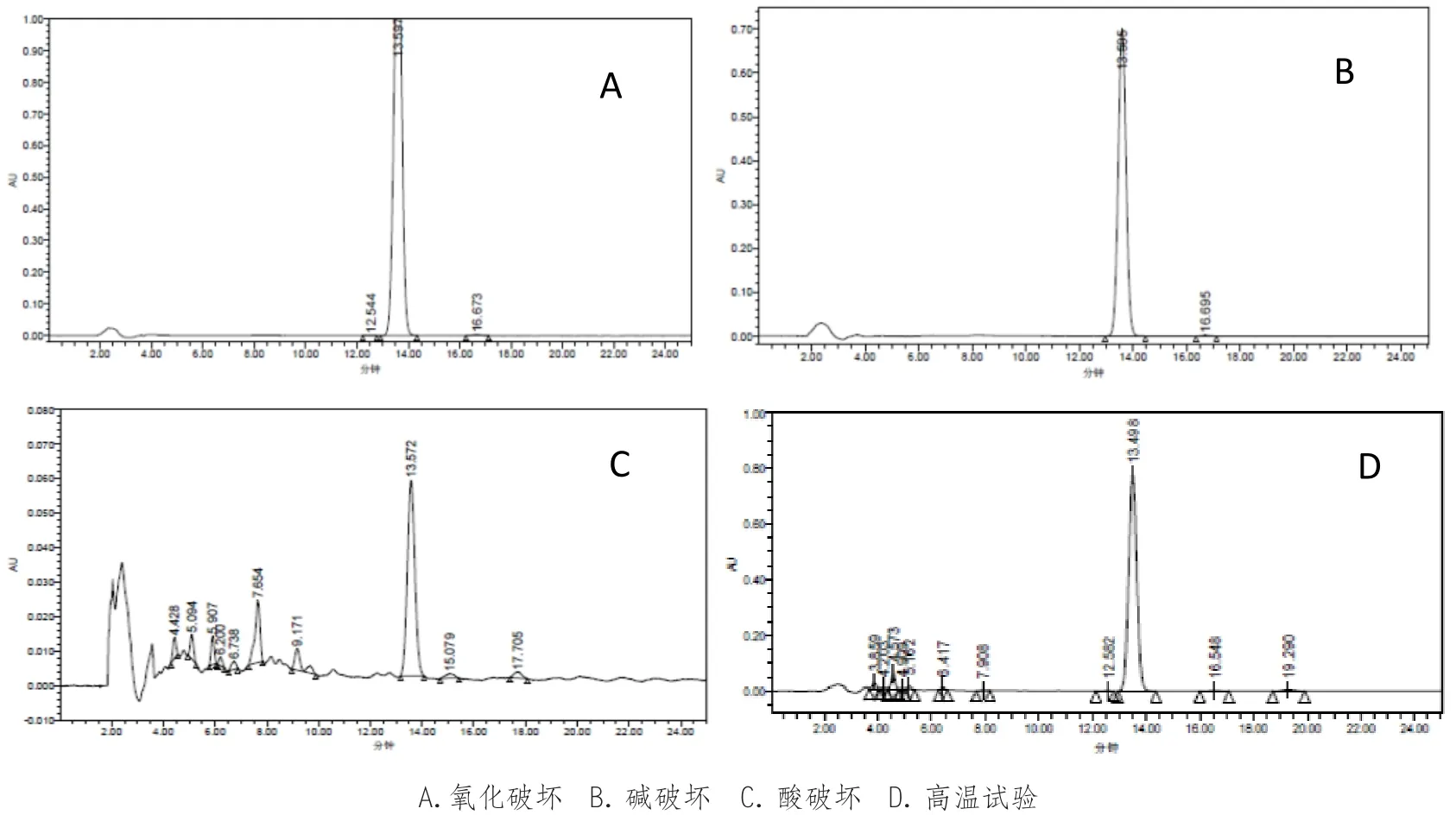
图2 AOH冻干粉针专属性 HPLC 分析结果
7.2 AOH冻干粉针破坏实验
从破坏试验中可知,本品在高温、氧化、碱性和酸性条件下稳定。用检查有关物质的色谱条件,可以检查到过氧化氢氧化破坏、碱破坏、酸破坏、加热破坏后的降解产物。本品与降解产物能很好分离,色谱图见图2。说明所建立的HPLC方法专属性好,该色谱条件可用于AOH冻干粉的含量测定和有关物质的检查。
7.3 辅料的影响
冻干粉针中主药 AOH 不溶于水,可溶于有机溶剂,但辅料为水溶性,采用纯有机溶剂提取,这就大大减少了辅料对其干扰,由液相色谱图也可以进一步验证,空白辅料对测定无干扰。
8 结论
冻干粉针剂相对于水针剂质量更稳定,也更适合于给药剂量较小药物。作为一种新的辐射防护药物,AOH给药剂量小,对辐射有较好治疗作用,制成冻干粉针剂,不仅可以提高生物利用度,也可以相对降低潜在毒副作用,进一步增加了药物给药方式选择途径。本实验通过HPLC对冻干粉中AOH定量研究,经方法学研究结果表明,该方法简便、准确、重现性好、专属性强,可为AOH冻干粉针剂质量标准的制订提供可靠的依据。
[1] 胡秋菊,杨代晓,杨建云,等.GC-MS衍生化法测定大鼠血浆中内源性5-雄烯二醇及药动学研究[J].药物分析杂志 ,2016,36(6):961-967.
[2] WHITNALL M H, ELLIOTT T B, HARDING R A,et al.Androstenediol stimulates myelopoiesis and enhances resistance to infection in gamma-irradiated mice[J].Int J Immun opharmacol,2000,22(1):1-14.
[3] STICKNEY DR,DOWDING C,AUTHIER S,et al.5-Androstenediol improves survival in clinically unsupported rhesus monkeys with radiation-induced myelosuppressio[J]. Int Immunopharmacol,2007,7(4):500-505.
[4] WHITNALL M H, VILLA V, SEED T M, et al. Molecular Specif i city of 5-Androstenediol as a Systemic Radioprotectant in Mice[J]. Immunopharmacology Immunotoxicology, 2005,27(1):15-32.
[5] 丁桂荣,郭国祯.抗辐射损伤药物的研究现状[J].辐射研究与辐射工艺学.2007,25(6):321-325.
[6] WHITNALL MH,INAL CE,JACKSON WE,et al.In vivo Radioprotection by 5-androstenediol:stimulation of the innate immune system[J].Radiat Res,2001,156(3):283.
[7] GRACE MB,SINGH VK,RHEE JG,et al.5-AED enhances survival of irradiated mice in a G-CSF-dependent manner,stimulates innate immune cell function,reduces radiation-induced DNA damage and induces genes that modulate cell cycle progression and apoptosis[J].Radiat Res,2012,53(6):840.
[8] 石童,王陈,蒋辉,等.抗辐射生物药物的研究进展[J].国际药学研究杂志 ,2014,41(6):658-662.
[9] 陈晓静,何杰,杨建云,等.RP-HPLC 法测定冻干粉针中DHEA 的含量[J].现代仪器与医疗,2015,21(6):71-73.
[10] 国家药典委员.中华人民共和国药典(四部)[M].北京:中国医药科技出版社 ,2015: 374-377.
