P ML-RARα和IFN-γ重组载体的构建
2018-04-26胡刚
胡刚
(广东省惠东县人民医院内六科,广东 惠东 516300)
联合化疗和诱导分化治疗已经显著改善了急性早幼粒细胞白血病患者的预后,但微小残留病变(minimal residual disease,MRD)仍是患者日后复发的根源。利用特异免疫治疗,尤其是在疾病处于缓解期,利用白血病疫苗诱导患者产生抗白血病的特异免疫功能,是一种理想的预防疾病复发的方式。我们在前期研究已经发现利用PML-RARα基因片段与IL-2等构建的重组表达载体能够诱导特异性免疫应答,但其免疫原性欠佳,难以获得足够的免疫保护作用[1-3]。本研究将PML-RARα基因与IFN-γ基因同时插入到一个载体中,构建含有PML-RARα及IFN-γ双基因表达载体,IFN-γ作为免疫佐剂可以增强DNA疫苗的免疫效应。
1 材料与方法
1.1 材料 本实验所使用的质粒和细胞株(pIRES质粒、IFN-γ质粒、NB4细胞株)由暨南大学血液病研究所提供。用于转化的菌株(DH5α感受态菌株)购自北京天为时代生物公司。LB培养基购自上海生工生物工程技术服务有限公司。
1.2 方法 p IRES-PML-RARα-IFN-γ真核双表达质粒构建过程见图1。
1.2.1 引物设计与合成 结合待扩增基因的自身特点,利用引物设计软件设计用于扩增PMLRARα和IFN-γ基因的引物,在设计过程中向引物中加入酶切位点,设计的引物标记为P1 P2和P3 P4,设计的引物由上海博亚生物公司合成,引物序列:(1)引物P1 P2:(用于扩增PML-RARα基因):上游引物 P1:5′-CAAGCTAGCAGCATG GTCTCCAATACAACGA-3',下 游 引 物 P2:5'-GCGACGCGTTCAGTCCTGACAGACAAAG-3';(2)引物P3 P4:(用于扩增IFN-γ基因):上游引物P3:5'-GCTCTAGAGATTTCAACTTCTTTGGCTTA-3',下 游 引 物 P4:5'-TTGTCGACGCAGGCAGGA CAACCATTACT-3'。2对引物扩增的目的基因片段大小分别为384 bp和553 bp。
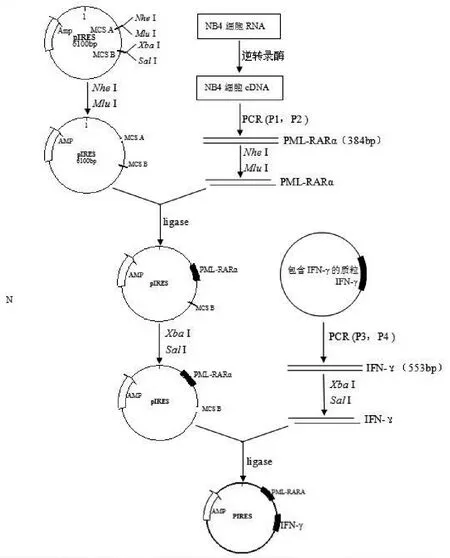
图1 p IRES-PML-RARα-IFN-γ真核双表达载体构建过程图
1.2.2 PCR获取PML-RARα基因 由于NB4细胞株中含有PML-RARα基因,因此我们选取该细胞株用常规方法提取出细胞的总RNA,以RNA作为模板合成cDNA,然后以该cDNA作为模板,以P1和P2作为引物获取PML-RARα基因。PCR反应体系(总体积20μl),其中包括2μl cDNA和1 U聚合酶,其余试剂的浓度分别为引物0.5μmol/L,dNTP 0.1 mmol/L,MgCl21.5 mmol/L。PCR反应条件:94℃预变性3min;94℃变性1min,56℃退火1min,72℃延伸1min,连续循环30次;最后72℃延伸6min。反应在德国BioMetra公司生产的PCR扩增仪上进行,常规电泳并用试剂盒回收经过电泳验证的PCR产物,PCR产物标记为PCR1。
1.2.3 PCR扩增IFN-γ基因 以商品质粒作为模板,以P3和P4作为引物,通过PCR获取IFN-γ基因。PCR反应体系(总体积20μl),其中包括2 μl cDNA和1 U聚合酶,其余试剂的浓度分别为引物0.5μmol/L,dNTP 0.1mmol/L,MgCl21.5mmol/L。PCR反应条件:94℃预变性3min;94℃变性1min,56 ℃退火1 min,72 ℃延伸1min,连续循环30次;最后72℃延伸6min。PCR产物标记为PCR2。
1.2.4 pIRES-PML-RARα重组质粒的构建和鉴定 以NheⅠ和MluⅠ作为内切酶,对PCR产物(PCR1)进行酶切,然后与经过同样切割处理的载体进行连接,将连接产物转化大肠杆菌(DH5α感受态菌)。转化过程如下:取10μl连接产物加入100μl DH5α感受态菌中,冰上孵育30min;置于42℃水浴90 s;加入800μl SOC培养基后于37℃摇床130 r/min 1.5 h;菌液铺于LB琼脂培养皿中,37℃温箱过夜。
1.2.5 p IRES-PML-RARα-IFN-γ重组质粒的构建和鉴定 以SalⅠ和XbaⅠ作为内切酶,对PCR2进行酶切处理后与质粒pIRES-PML-RARα进行连接,连接产物转化大肠杆菌(DH5α感受态菌)。转化过程:挑取阳性克隆置于100μl LB培养基中,用载体上的公共引物进行菌落PCR鉴定;筛选出产物大小正确的克隆,取80μl菌液置于10ml LB培养基中于37℃摇床130 r/min过夜培养;常规提取质粒。
1.2.6 DNA序列分析 取1μl构建的质粒DNA作为样本交由上海博亚生物技术公司进行序列分析。
2 结果
2.1 目的基因的扩增 利用引物P1 P2和P3 P4分别从相应的模板(NB4细胞的cDNA和IFN-γ质粒)中扩增出大小为384 bp和553 bp的基因片段。电泳结果显示,两种PCR产物大小符合预期,见图2。
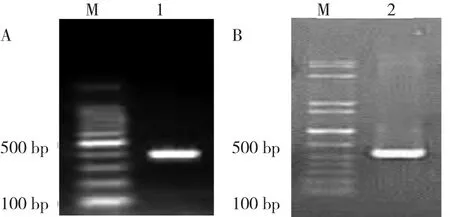
图2 PML-RARα基因和IFN-γ基因PCR产物电泳图
2.2 菌落平板 被pIRES-PML-RARα-IFN-γ质粒转化后的DH5α感受态菌,见图3。
图3 转化了p IRES-PML-RARα-IFN-γ的菌落
2.3 菌落PCR 取出单个菌落,溶解于100μl LB培养液中,取1μl溶解液作为模板,以P1P2作为引物,进行PCR,PCR结果见图4,第5泳道为目的基因PML-RARα片段(384 bp)PCR结果,第1、3泳道为另一PML-RARα片段(245 bp)PCR结果。
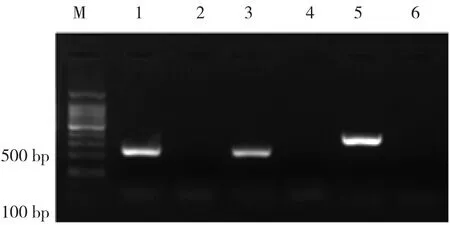
M:Marker,1、3、5泳道为阳性结果,2、4、6泳道为阴性结果。其中第5泳道为目的基因PML-RARα片段(384 bp)PCR结果,第1、3泳道为另一PML-RARα片段(245 bp)PCR结果
2.4 重组质粒的构建及鉴定 依照p IRES-PMLRARα-IFN-γ构建过程图所示的方法分别构建pIRES-PML-RARα和pIRES-PML-RARα-IFN-γ载体。构建的重组载体通过双酶切(2组内切酶分别为NheⅠ、MluⅠ和XbaⅠ和SalⅠ)证实有大小为384 bp和553 bp的目的片段插入,见图5。
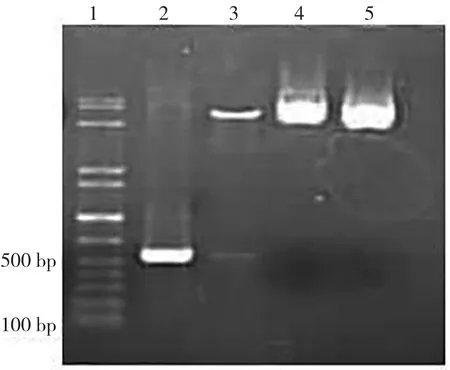
图5 p IRES-PML-RARα-IFN-γ重组质粒双酶切鉴定
2.5 序列分析结果 经过序列分析,插入到pIRES质粒中的两个目的基因片段与预期完全一致,测序结果证实重组质粒中外源插入片段分别与GenBank中PML-RARα基因和IFN-γ基因序列完全一致,PML-RARα基因测序结果见图6。
2.6 序列比对结果 比对结果显示:插入到PIRES质粒多克隆位点A(MCS A)中的PMLRARα基因片段和插入到多克隆位点B(MCSB)中的IFN-γ基因序列,与Genebank中的PMLRARα基因和IFN-γ基因序列完全一致。
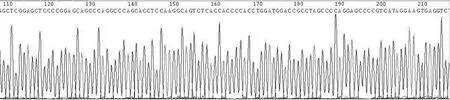
图6 p IRES-PML-RARα-IFN-γ重组质粒中PML-RARα基因片段序列分析结果
3 讨论
对于急性早幼粒细胞白血病患者,应用全反式维甲酸诱导分化治疗可以使大部分患者得到缓解甚至治愈。而作为靶向治疗最为经典的代表药物甲磺酸伊马替尼的出现,则让无数慢性粒细胞白血病患者大大增强了战胜白血病的信心,但是MRD的存在却让临床医生和研究人员大为苦恼。所谓MRD是指白血病经过化疗或骨髓抑制等治疗后,体内仍然残留少许白血病细胞,这些细胞难以用传统方法检测到,但却是患者日后白血病复发的根源。如何根除MRD已经成为血液科医生和研究人员所面临的一个共同难题。
作为抗肿瘤治疗的一个重要手段,免疫治疗是有可能根除MRD的方法之一。DNA疫苗制备过程简单,不会引起自身免疫反应,可以诱导针对肿瘤细胞的特异性杀伤性T细胞(CTL),并且不会与宿主DNA整合。在DNA疫苗的研发过程中,首先需要选择合适的基因片段用于诱导机体产生保护性免疫反应,然后还需要通过各种技术手段增强疫苗的免疫效应。融合基因存在于许多白血病患者体内,它既是致病的根源,也是治疗的靶点,因此利用融合基因制备DNA疫苗可用于治疗白血病。有研究发现应用BCR-ABL融合基因制备的DNA疫苗,可以在动物体内诱导产生针对含有BCR-ABL融合基因的白血病细胞的CTL[4-5]。而PML-RARα融合基因片段或者由该基因翻译的多肽在动物实验中均可诱导产生针对该基因的特异性免疫应答。然而,通过这些方法获得的免疫效应比较微弱,并不能对机体产生足够的保护作用,必须采取一定的技术手段以增强DNA疫苗的免疫原性。IFN-γ主要由活化的T细胞和NK细胞产生,IFN-γ能够诱导巨噬细胞、T细胞、B细胞等细胞MHCⅡ分子表达,从而提高抗原提呈能力[6-7],为了增强 p IRES-PML-RARα质粒的免疫原性,我们选择将IFN-γ插入到该质粒中使PML-RARα基因和IFN-γ基因同时表达于相同的微环境,利用IFN-γ的佐剂作用增强pIRES-PML-RARα质粒的免疫原性。我们的实验成功构建了PML-RARα-p IRES-IFN-γ质粒,下一步我们将通过体外实验和动物实验进一步验证该质粒的有效性。
参考文献:
[1]Lin C,Li Y.The role of peptide and DNA vaccines in myeloid leukemia immunotherapy[J].Cancer Cell Int,2013,13 (1):13.
[2]Li Y,Lin C,Schmidt CA.New insights into antigen specific immunotherapy for chronic myeloid leukemia[J].Cancer Cell Int,2012,12(1):52.
[3]胡刚,周羽竝,岑东芝,等.PML-RARα245与hGM-CSF双基因DNA疫苗的构建与表达[J].江苏医药,2013,39(8):878-881.
[4]Sun JY,Krouse RS,Forman SJ,etal.Immunogenicity of a p210(BCR-ABL) fusion domain candidate DNA vaccine targeted to dendritic cells by a recombinant adeno-associated virus vector in vitro[J].Cancer Res,2002,62(11):3175-3183.
[5]Cen D,Hu G,Zhou Y,et al.Enhancement of specific cellular immune response induced by DNA vaccines encoding PMLRARalpha and hIL-2 genes[J].Hematology,2010,15 (2):88-95.
[6]曹雪涛,何维.医学免疫学[M].北京:人民卫生出版社,2016:109-115.
[7]Saade F, Petrovsky N.Technologies for enhanced efficacy of DNA vaccines[J].Expert Rev Vaccines,2012,11 (2):189-209.
