青岛地区奶牛场金黄色葡萄球菌的分离鉴定及耐药性分析
2018-04-25刘宝涛刘焕奇
孙 彬, 刘宝涛, 邹 明, 刘焕奇
(青岛农业大学动物医学院, 山东 青岛 266109)
金黄色葡萄球菌(Staphylococcus aureus,S. aureus )是导致奶牛乳房炎的主要病原菌之一,占到奶牛乳房炎中病原体的50%以上,是奶牛临床上最难治疗,并且造成经济损失最大的致病菌。 另外,金黄色葡萄球菌还是一种人兽共患菌,能够通过乳制品等食物传递给人类,可引起人的尿路感染、骨髓炎、关节炎、肠炎等,同时也是造成食物中毒的常见致病菌之一[1-2],严重影响公共卫生食品安全。
目前,用抗生素仍是治疗S. aureus 感染的主要措施,但随着抗生素的过量及高频率的使用、甚至滥用,使其耐药谱不断增大,出现对β-内酰胺类、四环素类、大环内酯类等多类抗生素耐药现象,包括重要的人医用药万古霉素都出现对金黄色葡萄球菌的耐药菌株,并且对金黄色葡萄球菌的最小抑菌浓度(MIC)有逐年增高的趋势[3-4],使得细菌耐药性问题更加突出和复杂。 食源性细菌能够将耐药性传递给人类,对于临床治疗奶牛乳房炎和人类健康带来巨大挑战和隐患。 青岛地区奶牛养殖量大,用药情况复杂,并且与其相关的报道较少,本研究通过对青岛地区奶牛场进行S. aureus 的分离鉴定及药敏试验,为指导治疗奶牛乳房炎的合理用药提供参考依据,为食品安全保障提供重要的科学依据。
1 材料与方法
1.1 样品 对青岛地区14 个奶牛场进行样品的采集,分别采取奶样613 份、鼻拭子476 份、奶牛场饮水32 份、污水51 份及土壤样品60 份,共计1 232 份样品。 所采样品放入冰盒中,3 h 内运回实验室进行处理。 牛乳样品:对乳头进行消毒后,弃三把奶后取奶样置于灭菌的10 mL 离心管中编号,保存备用;鼻拭子样品:用灭菌的棉签蘸取奶牛的鼻液,放入装有7.5% NaCl LB 的5 mL 离心管中编号,保存备用;饮水、污水及土壤样品:用灭菌的10 mL 离心管对不同牛舍的饮水及污水进行采集,对牛场的不同区域进行土壤样品的采集。
1.2 试剂与药品 Baird-Parker 琼脂基础、MH 肉汤、MH 琼脂、LB 肉汤和亚碲酸盐卵黄增菌液,均购自北京陆桥生物技术有限责任公司;细菌生化微量鉴定管,购自青岛高科技工业园海博生物技术有限公司;Taq 酶、Marker,购自TaKaRa 试剂公司;药敏试验药物(青霉素、苯唑西林、头孢西丁、万古霉素、庆大霉素、红霉素、克林霉素、左氧氟沙星、利福平、甲氧苄啶、氨苄西林、头孢噻呋、泰妙菌素、恩诺沙星、环丙沙星、四环素、利奈唑胺、氯霉素),购自上海麦克林试剂公司。
1.3 方法
1.3.1 增菌培养 将采集的鼻拭子置于37 ℃培养箱培养20 ~24 h;将奶样以4 000 r/min 离心5 min,弃上清,加入7.5% NaCl LB 吹匀,置于37 ℃培养箱培养20 ~24 h;分别吸取100 μL 的饮水和污水加入到7.5% NaCl LB 中吹匀,置于37 ℃培养箱培养20 ~24 h;向土壤中加入LB 肉汤,放置5 ~10 min,吸取上清加入到7.5% NaCl LB 中吹匀,置于37 ℃恒温培养箱培养20 ~24 h。
1.3.2 分离培养 将各种样品的增菌液划线接种于Baird-Parker 琼脂上,37 ℃培养20 ~24 h 后,观察其菌落形态特征。
1.3.3 纯化培养 在Baird-Parker 平板上挑取疑似菌落进行纯化,重复两次然后进行革兰染色。 纯化后,进行增菌及保菌,-20 ℃保存备用。
1.3.4 血浆凝固酶试验 接种肉汤培养物于兔血浆中,充分混合,37 ℃培养,每30 min 观察1 次,将安瓿瓶倒置或倾斜,内容物不流动为阳性,若2 h 后无上述现象,则放置过夜后再观察。
1.3.5 PCR 鉴定 参考文献[5],根据S. aureus 的特异性基因—耐热核酸酶基因nuc 合成引物,引物序列如下nuc F:5′-GCGATTGATGGTGATACGGTT-3′;nuc R:5′-AGCCAAGCCTTGACGAACTAAAGC-3′。采用CTAB- NaCl 法提取细菌组DNA,进行PCR 检测。 扩增片段长度270 bp。 反应体系25 μL:水18.375 μL,PCR Buffer 2.5 μL,dNTP 2 μL,上下游引物各0.5 μL,模板DNA 1 μL,Taq 酶0.125 μL。扩增条件为:95 ℃预变性5 min,95 ℃30 s,55 ℃30 s,72 ℃30 s 30 个循环,再延伸5 min。
1.3.6 药敏试验 金黄色葡萄球菌ATCC 29213作为药敏试验的质控菌株。 对PCR 鉴定得到的S. aureus 根据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)标准采用琼脂稀释法对青霉素(PEN)、苯唑西林(OXA)、头孢西丁(FOX)、万古霉素(VAN)、庆大霉素(GEN)、红霉素(ERY)、克林霉素(CLI)、左氧氟沙星(OFL)、利福平(RIF)、甲氧苄啶(TRI)、氨苄西林(AMP)、头孢噻呋(CEF)、泰妙菌素(TIA)、恩诺沙星(ENR)、环丙沙星(CIP)、四环素(TET)、利奈唑胺(LZD)、氯霉素(CHL)18 种抗菌药物进行药敏试验,获得其MIC 值,判断药物的敏感性。
2 结果
2.1 分离纯化结果 采集样品经分离纯化后,在BP 琼脂上呈现圆形、凸起、灰色或黑色、有光泽、周围伴有沉淀环的菌株挑选为疑似菌株,共计78 株。
2.2 凝固酶试验结果 对78 株疑似菌株进行凝固酶试验,有59 株呈现凝固酶阳性。
2.3 PCR 鉴定结果 经PCR 鉴定,59 株凝固酶阳性菌株均扩增出270 bp 大小的目的片段,鉴定结果如图1,由于菌株较多,只挑选几株菌的电泳图,并随机挑选部分菌株进行测序,结果进行BLAST,相似度高于99%确定为金黄色葡萄球菌。 从不同样品的分离结果可以看出(见表1),59 株金黄色葡萄球菌在奶样中的分离率为5.5%(34/613),在鼻拭子中的分离率为3.6%(17/476),在饮水中的分离率为6.3%(2/32),在污水中的分离率为5.9%(3/51),在土壤中的分离率为5%(3/60)。
从不同养殖场的分离结果看,59 株金黄色葡萄球菌来自14 个养殖场中的7 个场,阳性场率为50%,其中有6 个场的分离率介于3.5%-12.9%之间,差别不等,另外1 个养殖场的分离率为33.8%,差别明显,其分离率见表2。
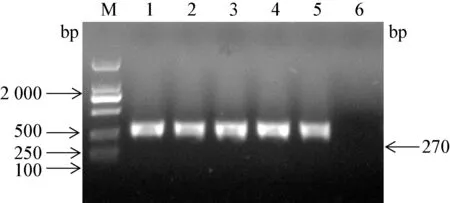
图1 nuc 基因(270 bp)的琼脂糖凝胶电泳图
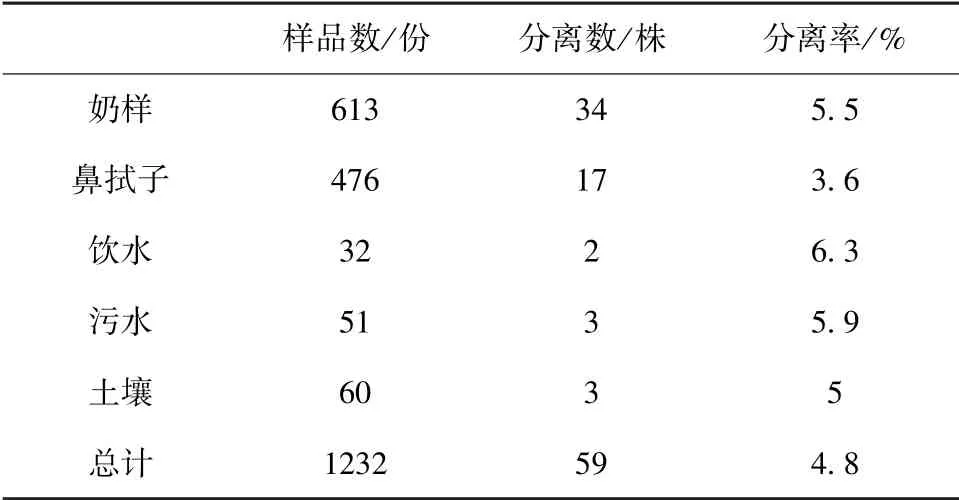
表1 不同样品的分离率
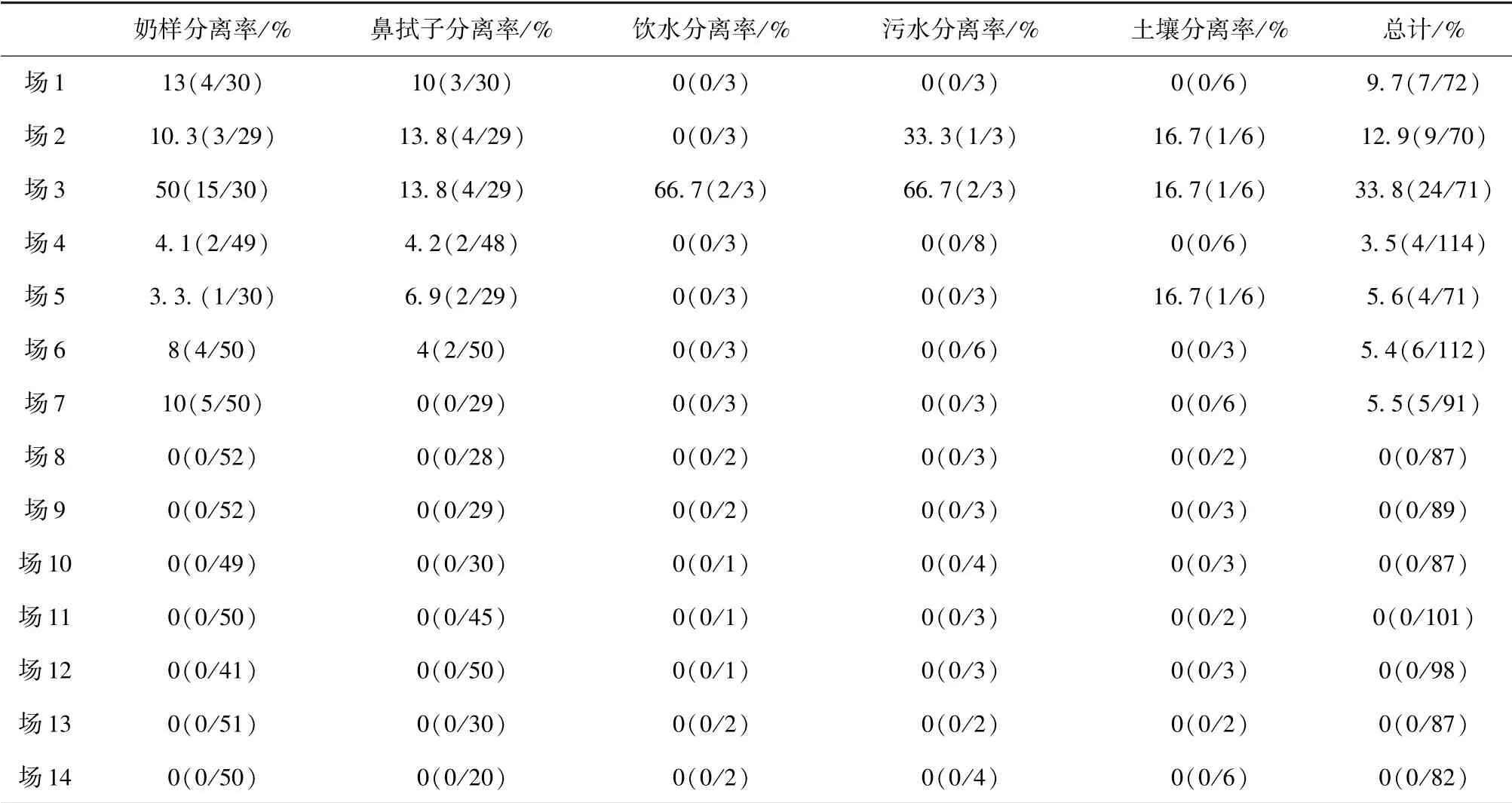
表2 14 个奶牛场的S. aureus 分离率/%(阳性数/样品数)
2.4 药敏试验结果 59 株金黄色葡萄球菌除对氯霉素表现为全部敏感外,对其他17 种药物(共12 类抗菌药物)均出现了不同程度的耐药,其中以2 耐为主,占分离菌株的40.7%,3 耐及3 耐以上菌株占分离菌株的42.5%,有1 株耐药菌表现出对10 类抗生素耐药,多重耐药结果见表3。
59 株金黄色葡萄球菌对氨苄西林耐药率最高,为86.4%,对青霉素、苯唑西林和甲氧苄啶耐药率较高,分别为71.2%、74.6%和74.6%,对红霉素的耐药率为44.1%,对第2 代头孢菌素类头孢西丁的耐药率为30.5%,对第3 代动物专用头孢菌素头孢噻呋和庆大霉素的耐药率较低,都为3.4%。 本试验检测到重要的人医临床用药万古霉素和利奈唑胺耐药菌株,耐药率分别为8.5%(5/59)和10.2%(6/59),从分离出万古霉素和利奈唑胺耐药菌株的阳性场情况看,万古霉素耐药细菌阳性场占全部采样场的14.3%(2/14),且分离得到的5 株万古霉素耐药菌株均来自牛乳样品中,利奈唑胺耐药细菌阳性场占全部采样场的21.4%(3/14),6 株利奈唑胺耐药菌株分别来自污水3 株、牛乳样品2 株和土样1 株,具体耐药情况见表4。
3 讨论
3.1 金黄色葡萄球菌的分离率分析 本试验通过微生物学方法及PCR 鉴定,从1 232 份样品中分离出59 株金黄色葡萄球菌,分离率为4.8%,其中共采集奶样613 份,分离出34 株金黄色葡萄球菌,分离率为5.5%,明显低于刘文进报道[6]的金黄色葡萄球菌分离率78.98%,并且从表2 中可以看出,场3 与其他各场的分离率相差较大,并且饮水和土壤中都分离得到金黄色葡萄菌,可见其污染严重,这可能与奶牛场的饲养管理、养殖环境条件有关,因此应该注意养殖场的环境,完善其管理制度,提高工作人员的防污染意识以及挤奶人员的熟练度。
在污水、饮水及土壤中分离出来的金黄色葡萄球菌可能是引起奶牛感染的一条重要途径,需要进一步的研究。 本试验使用PCR 方法,根据金黄色葡萄球菌特有的耐热核酸酶基因(nuc),在该菌DNA片段中为高保守的序列[7],查找引物进行鉴定,该方法具有较好的特异性、快速敏捷、操作方便,已经广泛应用于致病菌的检测中[8-9]。

表3 59 株金黄色葡萄球菌的多重耐药情况
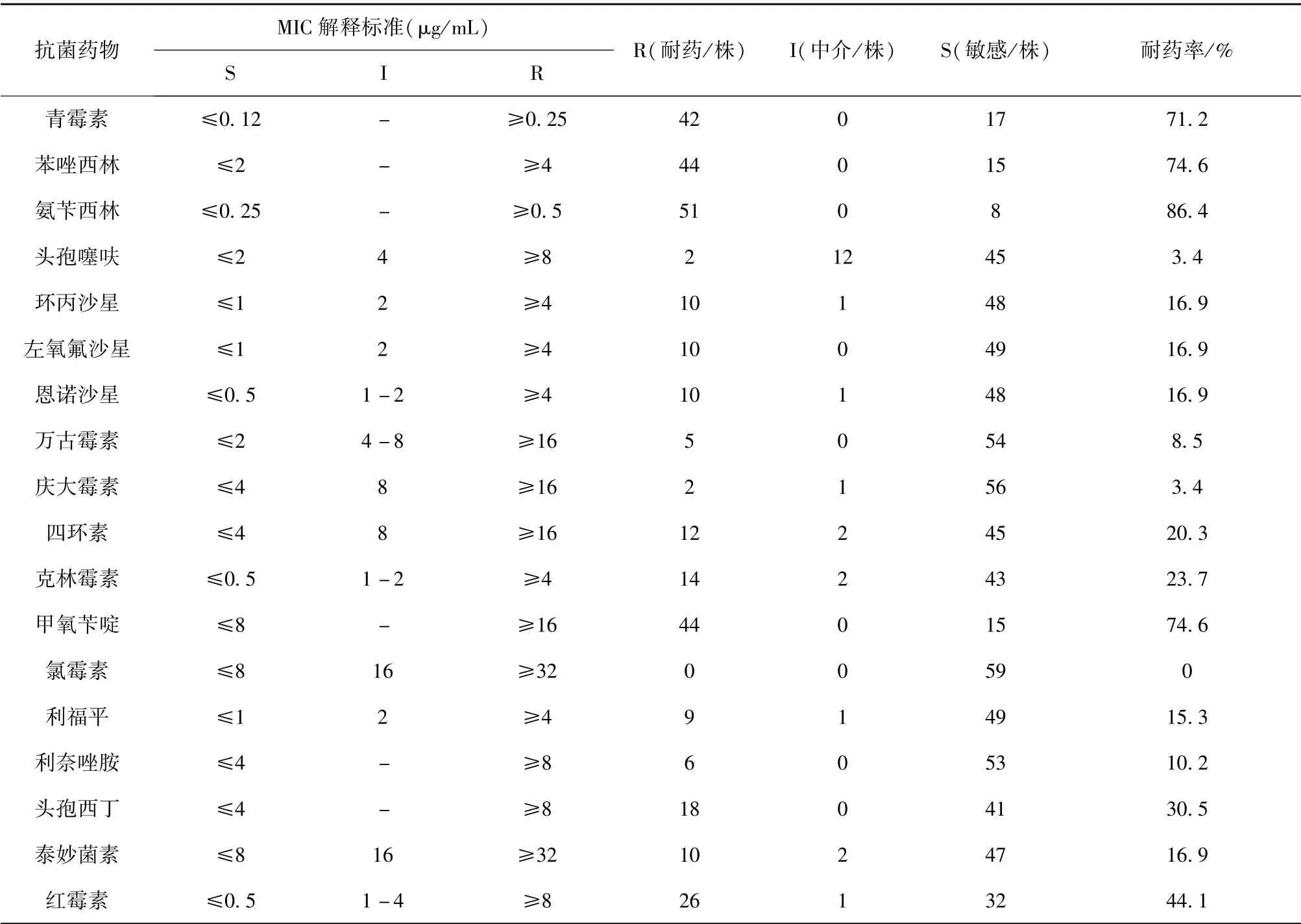
表4 59 株金黄色葡萄球菌的药敏试验结果___________________________________
3.2 金黄色葡萄球菌的药物敏感性分析 随着抗生素的长期使用,使得耐药菌大量出现,造成许多常用抗生素降低甚至失去其治疗效果。 本研究表明,分离得到的59 株金黄色葡萄球菌除了10 株菌只对一类抗生素(1 株对利福霉素类,6 株对β-内酰胺类,3 株对磺胺类)耐药,其余各菌都具有较广的耐药谱,三耐及三耐以上菌株占所有菌株的42.5%,其中有1 株对10 类抗生素耐药,说明本试验获得的菌株多重耐药现象严重,应该注意合理科学用药,避免抗生素的滥用和超剂量使用,以免到时出现无药可医的现象。
59 株金黄色葡萄球菌对青霉素、氨苄西林、甲氧苄啶及苯唑西林耐药率较高,分别为71.2%、86.4%、74.6%和74.6%,低于王冰[10]报道的青霉素G(99.5%),氨苄西林(100%) 和甲氧苄啶(100%),高于刘敬兰[11]报道的苯唑西林耐药率(49%)。 对庆大霉素和头孢噻呋的敏感性也很高,均为96.6%,与锡林高娃等[12]报道的庆大霉素敏感性(100%)和J. G. Rola[13]报道的头孢噻呋敏感性(100%)相接近,对第二代头孢菌素类头孢西丁的耐药率为30.5%,要高于刘敬兰[11]报道的头孢西丁耐药率(17%),对氯霉素的敏感性最高,为100%。
如上所述,59 株金黄色葡萄球菌对常用药物表现出不同程度耐药,并且对分离出金黄色葡萄球菌的7 个奶牛场的用药史进行调查,发现7 个场均长期使用β-内酰胺类药物,并且有3 个场还经常使用红霉素,对于其他抗菌药物使用较少,这种频繁的使用单一抗菌药物对致病菌已没有明显的效果,所以为减缓耐药菌株的出现,可以考虑对金黄色葡萄球菌病的治疗采用联合用药和轮转用药。
值得注意的是,万古霉素作为人类对付顽固性耐药细菌的“最后一道防线”及重要的人医用药,可以通过抑制细菌细胞壁结构中的磷脂和多肽来干扰细菌的生长和繁殖,并且不易和其他抑制细菌蛋白合成的抗菌药物产生交叉耐药,具有无交叉耐药性特点,很少出现耐药菌株,因此对于治疗多重耐药革兰阳性球菌引起的感染很有效果,并且是治疗MRSA 感染的一线用药。 在本研究中共分离得到5株耐万古霉素金黄色葡萄球菌(Vancomycin resistant S, aureus, VRSA),且均来自奶样品中,虽然其耐药率为8.5%(5/59),相比其他抗生素耐药率而言较低,但也存在人与动物之间进行传播的可能性以及将耐药性通过奶制品传递给人类的风险性,发展成为重要的公共卫生隐患,所以应该了解VRSA 的分布及耐药情况,找出导致VRSA 的感染途径,控制其感染并指导合理用药,不断提高VRSA 的防治水平。
利奈唑胺属于 恶唑烷酮类化学合成的抗生素,我国于2007 年9 月仅批准用于人医临床治疗MRSA 等,对于多重耐药革兰阳性球菌的感染,并未批准用于兽医临床,但本研究中确检测到利奈唑胺耐药菌株,其耐药率为10.2%(6/59),一方面可能是因为在使用利奈唑胺时未按照要求,将其直接用于奶牛疾病的治疗,导致耐药性产生;另一方面,介导利奈唑胺耐药的cfr 基因大多数位于质粒上,可在不同种细菌或不同属细菌间进行水平转移,在临床分离细菌之间、甚至动物来源细菌以及环境细菌之间相互传播,导致耐药性的产生。
