软枣猕猴桃花药发育过程中主要激素及矿质元素含量特征分析
2018-04-24李志军
石 峰,李志军
(1.兵团第二师林业工作管理站,新疆 库尔勒841000;2.辽宁省经济林研究所)
软枣猕猴桃(Actinidia arguta)又名软枣子、猕猴梨、藤瓜,属于猕猴桃科(Actinidiaceae)、猕猴桃属(Actinidia)多年生落叶藤本植物,多为野生,主要分布于我国东北、华北、西南及华东各省[1]。软枣猕猴桃是9种光果猕猴桃种类之一[2]。软枣猕猴桃(Actinidia arguta)绝大多数是雌雄异株,但偶有少数是雌雄同株或两性花,存在性别的多样性[3-4]。软枣猕猴桃的雄花、雌花都是形态上的两性花,生理上的单性花。猕猴桃雄株可育花粉粒量大且均匀饱满,萌发沟宽而深未及两端。雌株不育花粉粒量小,外观不均匀,有些甚至内陷至“帽子”状,但萌发沟窄,并且萌发沟宽度保持不变[5]。
软枣猕猴桃果实、根、茎、叶具有止泻、解烦热、利尿、祛痰、健胃等作用,对胃癌及肿瘤有一定疗效[6]。具有丰富营养成分、保健以及庭园绿化功能的新兴水果软枣猕猴桃具有巨大的发展空间,目前对软枣猕猴桃的研究多集中在组织培养、资源分布和开发利用与栽培等方面,关于花粉相关研究内容鲜有报道。花粉发育过程是多因素共同作用的结果,在发育的各时期受外部环境、内部生理因素以及大量基因精确调控,是一个极其复杂的过程。针对软枣猕猴桃小孢子发育过程中内源激素及矿质营养的变化,从生理生化的角度分析软枣猕猴桃花粉发育特性,研究结果可为其科学合理的栽培管理措施提供理论依据。
1 材料与方法
1.1 软枣猕猴桃花药中内源激素的测定
1.1.1 试验材料
供试材料均选择生长发育正常、管理水平基本一致、长势一致和花量基本相同的软枣猕猴桃雌株和雄株作为试验材料。从5月份开始,分别在不同时期收集雌株和雄株花朵,置冰瓶中带回,在冰浴条件下用镊子迅速取花药,用锡纸包好立即放入液态氮中处理2~3 min,然后将样品在遮光条件下进行真空冷冻干燥,待样品充分干燥后密封放入-80℃超低温冰箱中保存。
1.1.2 试验方法
植物激素的提取、纯化和检测参照王若仲等的方法进行[7]。准确称取冷冻干样品1 g左右(精确到0.1 mg),分4次加入预冷的80%甲醇11 mL(5 mL+2 mL+2 mL+2 mL),在弱光下冰浴中研磨成匀浆,于4℃冰箱中浸提过夜(15 h)。3 000 r下离心(4℃)20 min,倒出上清液,残渣加入2 mL预冷的80%甲醇后旋涡振荡5 min,再离心(3 000 r下20 min),倒出上清液,残渣重复上述操作1次后丢弃,合并上清液加入0.1g PVPP吸附酚类物质和色素,然后3 000 r下离心(4℃)20 min,取上清液得到初提液,旋转蒸发浓缩近干,然后用1 mL色谱纯甲醇溶解残渣,过0.45 um滤膜,再进行色谱分析。检测仪器为Agilent1100 LC-Trap.SC,定量分析采用峰面积-标准曲线法定量。试验结果通过SPSS统计分析软件进行分析。
1.2 软枣猕猴桃花药中矿质元素的测定
1.2.1 试验材料
供试材料均选择生长发育正常、管理水平基本一致、长势一致和花量基本相同的软枣猕猴桃雌株和雄株作为试材。从5月份开始,分别在不同时期收集雌株和雄株花朵,用镊子剥取花药,样品用水洗净,再用蒸馏水冲洗,置于80℃恒温烘箱中干燥24 h,粉碎后备用。
1.2.2 试验方法
植物矿质元素的提取和检测参照张敏等的方法进行[8]。准确称取粉碎样1 g于瓷坩埚中,在电炉中灰化2 h冷却,取出,缓慢加入15 mL 20%盐酸溶浸灰分,小火加热至近干,取下冷却,用蒸馏水喷洗坩埚壁,移入100 mL容量瓶中,用重蒸水定容到刻度,摇匀。然后各取上述溶液0.2 mL分别移入25 mL容量瓶中,并加入0.5 mL 10%的氯化锶溶液,2 mL 2%的氯化铯溶液,用水定容到刻度,摇匀,经原子吸收分光光度法分析。检测仪器为日立Z-2000系列偏振塞曼原子吸收分光光度计,定量分析采用吸光值-标准曲线法。试验结果通过SPSS统计分析软件进行分析。
2 结果与分析
2.1 软枣猕猴桃不同类型花药发育过程中主要激素的含量特征
孢子母细胞时期含量较高,随后下降,在四分体时期含量最低(244.3ng/g),随着小孢子的发育及有丝分裂的进行又快速上升,并于小孢子单核花粉期达到高峰(740.7ng/g),随着花粉发育成熟而降低。雌株不育花药IAA含量变化趋势与可育花药基本一致,雄株各个时期IAA含量均高于雌株,除四分体时期差异不显著之外,其他时期均存在显著差异(图1)。可见,小孢子发育过程中需要IAA的参与,在单核花粉期需要较高含量的IAA。
雄株可育花药ABA含量从小孢子母细胞到四分体时期逐渐增加(1 140.7ng/g),在四分体时期出现拐点,随着小孢子的有丝分裂而又逐渐下降,雌株不育花药ABA含量从小孢子母细胞到单核花粉期一直增加,并在单核花粉期达到高峰(2 911.67ng/g)。雄株可育花药各个时期ABA含量均低于雌株不育花药,且各个时期含量呈显著差异(图2)。尤其是单核花粉期和成熟期2个时期,说明ABA在这2个时期抑制了花粉的萌发。

图1 花粉发育过程中IAA含量的变化
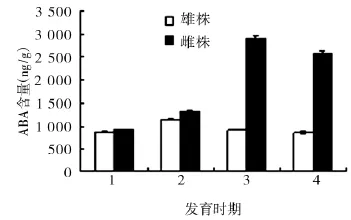
图2 花粉发育过程中ABA含量的变化

图3 花粉发育过程中GA3含量的变化

图4 花粉发育过程中ZR含量的变化
雄株可育花药GA3在不同发育时期存在差异,在小孢子母细胞时期含量较高 (372ng/g),随后下降,在四分体时期含量最低,为356.7ng/g,随着小孢子的发育及有丝分裂的进行又快速上升,并于小孢子单核花粉期达到高峰(465.7ng/g),随着花粉发育成熟而降低。而雌株不育花药各时期GA3含量变化趋势不大,雄株可育花药和雌株不育花药只在花粉母细胞和单核花粉期GA3含量差异显著,其他时期含量差异不明显(图3)。说明在小孢子单核花粉期需要较高含量的GA3发挥一定的作用。
雄株可育花药ZR含量从花粉母细胞时期(177.7ng/g)一直升高,在单核花粉期达到最大值(550.3ng/g),与其他时期差异显著,成熟期含量骤降为222ng/g。不育花药ZR含量在小孢子母细胞时期含量最高(346ng/g),随后降低,但除花粉母细胞外,各时期差异不显著。可育花药ZR含量除花粉母细胞时期低于不育花药,其他时期均高于不育花药,且差异显著(图4)。可见,小孢子发育过程中需要ZR的参与,在单核花粉期需要较高含量的ZR。
2.2 软枣猕猴桃不同类型花药发育过程中矿质元素的含量特征
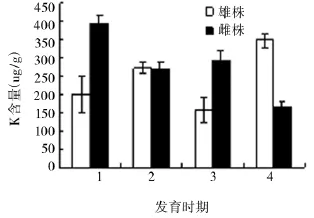
图5 花粉发育过程中K含量的变化
雄株可育花药和雌株不育花药K含量变化趋势相反,雄株可育花药变化趋势呈W型,而雌株不育花药变化趋势呈M型。可育花药在单核期K含量达到最低值157.9 ug/g,不育花药K含量在成熟期之前(393.2 ug/g)高于可育花药(200.3 ug/g),成熟期含量(166.3 ug/g)低于可育花药(348.3 ug/g)。 可育花药和不育花药K含量除在四分期时期差异不显著外,其他时期差异显著(图5)。
雄株可育花药Mg含量在单核期含量最低,为42.9 ug/g,其他时期含量差异不显著。不育花药在成熟期Mg含量达到最低值,仅27.7 ug/g,其他时期含量差异不显著。雄株可育花药单核期Mg含量显著低于不育花药,而成熟期可育花药Mg含量显著高于不育花药(图6)。
雄株可育花药Ca含量呈现上升的趋势,在成熟期达到最高值(138.5 ug/g)。雌株不育花药Ca含量变化趋势呈M型,花粉母细胞时期至四分体时期Ca含量上升,并在四分体时期达到最大值153.7 ug/g。不育花药各时期Ca含量均高于可育花药,在四分体时期差异显著(图7)。
雄株可育花药Fe含量变化趋势呈W型,在四分体时期含量最低为2 ug/g,单核花粉期含量达到最大值37.7 ug/g。雌株不育花药Fe含量花粉母细胞时期含量最低(0.7 ug/g),在四分体时期达到最大值13.8 ug/g,随后降低,成熟期已经检测不到其含量。雄株可育花药Fe含量和雌株不育花药Fe含量相比在各个时期差异显著(图8)。

图6 花粉发育过程中Mg含量的变化

图7 花粉发育过程中Ca含量的变化
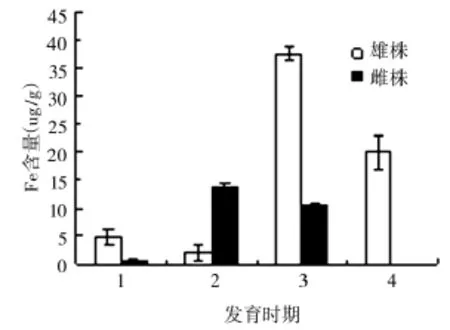
图8 花粉发育过程中Fe含量的变化
可育花药和不育花药微量元素Zn变化趋势不明显,但在单核期Zn含量表现出明显差异,单核期可育花药Zn含量(3.6 ug/g)高于不育花药(0.5 ug/g)(图9)。
可育花药和不育花药微量元素Mn变化趋势不明显,但在四分体时期和单核期Mn含量表现出明显差异,四分体时期不育花药Mn含量为2.6 ug/g,单核期为2.7 ug/g,均高于可育花药(1.0 ug/g和1.1 ug/g)(图10)。
3 讨论与结论
植物激素作为植物体内的微量信号分子,控制着植物的雄蕊发育进程。一些拟南芥激素不敏感型突变体表现为雄性不育[9]。IAA含量高的组织和器官是营养物质的输入库,在调节养分竞争方面起着重要作用,低的IAA含量使花粉母细胞可能处于营养饥饿状态[10]。本试验发现雌株不育花药从花粉母细胞开始IAA含量显著低于雄株可育花药。这一结果与上述研究结果一致。Singh等认为,激素含量的升高或降低直接诱发大多数植物产生雄性不育[11]。何钢等发现冬枣花药一开始ABA含量就很高,可能促使花粉母细胞死亡[9]。但本试验发现,可育花药和不育花药ABA含量在花粉母细胞时期差异不显著,随着花粉发育进程,经过四分体和单核期,差异达到显著水平。可能因为ABA含量在达到一定值后抑制了花粉发育的进程,导致了雌株花粉不育的发生。已知GA3能增强植物细胞壁的伸展性,促进细胞的伸长和体积的增大,细胞分裂素类主要作用是促进细胞分裂和组织分化。前期花粉扫描结构发现,不育花粉在形态上不饱满,超微结构发现外壁没有基粒棒的形成。本试验结果也发现,单核期不育花粉GA3含量低于可育花粉,而且可育花药ZR含量除花粉母细胞时期低于不育花药,其他时期均高于不育花药,且差异显著。

图9 花粉发育过程中Zn含量的变化
通过对软枣猕猴桃可育孢子和不育孢子发育四个主要时期内(小孢子母细胞、四分体时期、单核期和成熟期)主要5种激素(IAA、ABA、GA3、ZR和ZT)含量变化的分析可知,虽然5种激素在花粉发育过程中含量和变化趋势各有不同,但在单核期其含量都达到最大值或其最低值,且可育花药和不育花药之间含量在此时期内差异水平基本呈显著水平。前期对可育和不育花药的组织解剖学研究发现,在绒毡层细胞代谢异常的的同时,由于雌株的四分体小孢子在胼胝质解体后,没有经有丝分裂而停留在单核状态,也导致了雌株小孢子的不育。这可能说明,5种激素在单核期含量的表现导致了物质的供应和生理代谢活动发生了紊乱,引起了小孢子在形态学上不能进行有丝分裂,最终导致了败育的发生。各激素在成熟期和单核期含量的变化也可能是与此生理活动相适应的结果。

图10 花粉发育过程中Mn含量的变化
植物激素对雄性不育的发生具有重要调节作用,但由于作物不同,或作物相同但所用材料不同或雄性不育类型不同,所得结果存在一些差别。对油菜、白菜、辣椒、水稻和萝卜等多种作物雄性不育材料研究结果表明,就每一种激素而言,均存在2种相反的报道结果[12-16]。因此激素如何以极其微量的成分调控植物生长、发育及其对环境适应的机制,以及如何合理利用激素对植物生长进行有目的的调控都有待于深入研究。
通过对软枣猕猴桃可育孢子和不育孢子发育4个主要时期内(小孢子母细胞、四分体时期、单核期和成熟期)3种大量元素(K、Ca和Mg)以及3种微量元素(Fe、Mn和Zn)含量变化的分析可知,虽然6种矿质元素在花粉发育过程中含量和变化趋势各有不同,但除Mg外,可育花药和不育花药之间含量在花粉母细胞时期、单核期以及成熟期差异达显著水平。矿质元素与植物正常的新陈代谢、正常发育有着密切的关系,它们有的是酶的活性因子,起着激活酶的作用,有的参与激素的生理作用,促进激素发挥作用[17]。因此在软枣猕猴桃雌株和雄株花药发育的过程中,矿质元素直接或间接的参与到花粉育性的生理调控中去。
植物花粉要经历一系列形态和生理生化的变化,这期间任何一个过程受到直接或间接的影响都可能会导致小孢子不育的出现。K和Mg作为酶的激活剂,糖酵解、蛋白质的合成以及核酸的代谢都需要其参与,在碳水化合物代谢、呼吸作用及蛋白质代谢中起重要作用[18]。可育花药从单核期到成熟期这一过程中含量增加,而不育花药在这一过程含量减少。花粉发育过程中对细微的生理生化变化都十分敏感。不育花药K和Mg含量的减少必然对小孢子的发育产生影响。Ca能保持细胞结构以及膜上蛋白的稳定性,同时作为第二信使参与调节生殖生长[19],此外,其在细胞程序性死亡的重要作用也已经被认识并受到重视[20]。通过前期可育花粉和不育花粉的观察,以及不育花药发育过程中Ca含量一直高于可育花药,可能在细胞程序性死亡方面调控猕猴桃雌株小孢子的败育。Fe能形成螯合物,在酶系统中作为CAT、POD、细胞色素氧化酶等酶系统的辅基,影响电子传递、呼吸链、光合链等[18]。可育花药从单核期含量达到最大值,而不育花药在这一过程含量开始减少直至消失。可见Fe在雌株花粉败育过程中发挥了一定作用。Zn作为锌指蛋白的组成成分,参与调控遗传物质的活动,从而影响基因的表达[21]。现已从矮牵牛中克隆了一系列花药特异表达或优先表达的锌指蛋白基因,其中ZPT3-2主要在花药的绒毡层组织中表达,从四分体小孢子期开始一直持续到绒毡层的降解;ZPT4-3、ZPT3-1特异地在小孢子单核期表达[22],这与本试验结果一致。Mn是形成叶绿素和维持叶绿素正常结构的必需元素,与光合和呼吸作用均有关系,Mn还是硝酸还原的辅助因素,缺Mn时植物合成氨基酸和蛋白质受阻[18]。试验结果可知,可育花药单核期和成熟期Mn含量保持不变,而不育花药从单核期到成熟期含量减少,差异显著,可能与从单核期到成熟期氨基酸和蛋白质合成受阻有关。
雌株不育花药IAA含量显著低于雄株可育花药。可育花药和不育花药ABA含量随着花粉发育进程,经过四分体和单核期,差异达到显著水平,ABA含量在达到一定值后抑制了花粉发育的进程,导致了雌株花粉不育的发生。单核期不育花药GA3含量低于可育花粉,而且可育花药ZR含量高于不育花药,且差异显著。低含量的细胞分裂素类抑制了细胞分裂和组织分化,从而导致了小孢子的败育。可育花药和不育花药之间矿质元素含量在花粉母细胞时期、单核期以及成熟期呈显著水平。
[1]周繇.长白山植物资源学[M].吉林:吉林人民出版社,2008.[2]曹家树,秦岭.园艺植物种质资源学[M].北京:中国农业出版社,2005.
[3]杨妙贤,梁红,贺苏丹.猕猴桃性别分化与鉴定研究进展[J].仲恺农业工程学院学报,2009,22(1):57-60.
[4]杨妙贤,肖得兴,梁红,等.中华猕猴桃性别分化的细胞形态学观察[J].园艺学报,2011,38(2):257-264.
[5]李志军,刘国成.软枣猕猴桃大小孢子发育过程的细胞形态学观察[J].林业科学,2016,52(7):158-164.
[6]王晓东,段全猛.软枣猕猴桃的利用与栽培[J].特种经济动植物,2009(2):33-34.
[7]王若仲,萧浪涛,蔺万煌,等.亚种间杂交稻内源激素的高效液相色谱测定法[J].色谱,2002,20(2):148-150.
[8]张敏,于华忠,曹庸,等.不同季节的虎杖根茎中8种矿质元素的光谱测定[J].光谱学与光谱分析,2004,24(12):1669-1671.
[9]Peng J R.Gibberellin and Jasmonate Crosstalk during Stamen Development[J].Journal of Integrative Plant Biology,2009,51(12):1064-1070.
[10]何钢,李攀,唐宁浩,等.南方枣品种花粉育性与花药内源激素的变化[J].中南林业科技大学学报,2010,30(10):47-50.
[11]Singh S,Sawhney.Cytokinins in a normal line and the ogura(ogu)cytoplasimic male-sterile line of rapeseed(Brassica napus)[J].Plant Science,1992,86(2):147-154.
[12]田长恩,张明永,段俊,等.油菜细胞质雄性不育株及其保持系不同发育阶段内源激素动态变化初探[J].中国农业科学,1998,31(94):20-25.
[13]史公军,侯喜林,胡巍.细胞质雄性不育白菜败育过程中激素和多胺含量的变化[J].西北植物学报,2004,24(11):2109-2112.
[14]吴智明,胡开林,符积钦,等.辣椒胞质雄性不育与花蕾内源激素含量的关系[J].华南农业大学学报,2010,31(2):1-4.
[15]赵玉锦,童哲,陈华君,等.内源植物激素与光敏核不育水稻农垦58S育性的关系[J].植物学报,1996,38(12):936-941.
[16]邓代信,汪隆植,龚义勤,等.萝卜雄性不育株内源激素及游离氨基酸分析[J].种子,2006,25(3):31-34.
[17]王元忠,李淑斌,郭华春,等.大百合中微量元素测定的研究[J].光谱学与光谱分析,2007,27(9):1854-1857.
[18]陆景陵.植物营养学(第二版)[M].北京:中国农业大学出版社,2007,23-100.
[19]Miedema H,Bothwell J H F,Brownlee C.Calcium uptake by plant cells-channels and pumps acting in concert trends in Plant[J].Science,2001,6(11):169-179.
[20]于明革,杨洪强,赵福庚.植物细胞程序性死亡的调控[J].植物生理学通讯,2002,38(5):493-499.
[21]Vodkin M,Vodkin L.A conserved zine finger domain in higher Plants.[J].Plant Mol.Biol,1989(12):593-594.
[22]Kobayashi A,Sakamoto A,Kubo K,et al.Seven zine-finger transcription factors are expressed sequentially during the development of anthers in Petunia.[J].Plant J,1998(13):571-576.
