拉莫三嗪对癫痫大鼠海马组织中Caspase-3和热休克蛋白70表达的影响
2018-04-24石景鹤王家勤张迎辉
高 静,石景鹤,王家勤,张迎辉
(1.新乡医学院第三附属医院儿科,河南 新乡 453003;2.郑州儿童医院儿科,河南 郑州 450053;3.新乡医学院第三附属医院儿童康复科,河南 新乡 453003)
癫痫是一种由多种病因引起的、以大脑神经元异常同步过度放电而导致的突然、短暂并反复发作的中枢神经系统功能失常为特征的脑部疾患,是神经系统的常见疾病之一。全世界癫痫患病率约为8‰,发展中国家的患病率高于发达国家,约60%的癫痫患者于儿童期起病,儿童癫痫患病率高达0.40%~0.58%[1],其发病机制较为复杂,迄今为止尚未完全阐明。目前,癫痫仍以抗癫痫药物(antiepileptic drug,AED)治疗为主,AED根据其作用靶标可分为影响钠离子通道的药物、影响钙离子通道的药物以及影响神经递质γ-氨基丁酸(γ-aminobutyric acid,GABA)激活的药物3类。拉莫三嗪是一种新型抗癫痫药物,其主要是选择性作用于电压门控钠离子通道,抑制病灶内神经元反复异常放电,同时抑制谷氨酸的病理性释放,其作用机制异于其他常用的AED[2],尤其是对患儿的认知功能影响较小[3]。Caspase-3是介导细胞凋亡的核心蛋白酶,是Caspases家族的核心成员,HSP70可维持神经元内蛋白自稳,对神经元有保护作用[4]。拉莫三嗪剂量变化是否会对Caspase-3和热休克蛋白70(heat shock protein 70,HSP70)水平造成影响,目前尚未见相关研究证实。基于此,本研究应用戊四氮建立癫痫大鼠模型后给予不同浓度的拉莫三嗪进行干预,观察拉莫三嗪对戊四氮致癫痫大鼠海马神经元的保护作用及对Caspase-3和HSP70表达的影响,现报道如下。
1 材料与方法
1.1实验动物清洁级健康6周龄雄性Sprague-Dawley (SD)大鼠100只,体质量(180.0±20.0)g,由新乡医学院实验动物中心提供。SD大鼠饲养于新乡医学院人体解剖学与组织胚胎学重点实验室,于12 h光亮/黑暗、环境温度18~25 ℃下分笼喂养,普通饲料,自由进食、进水,每2 d更换1次垫料。
1.2主要试剂与仪器戊四氮(美国Sigma公司),拉莫三嗪(波兰GlaxoSmithKline Pharmaceuticals SA公司,进口药品注册证号H20140478),HSP70一抗(bs-0126R)、Caspase-3一抗(bs-0081R)(北京博奥森生物技术有限公司),SP-9001免疫组织化学染色试剂盒、3,3′-二氨基联苯胺(3,3′-diaminobenzidine,DAB)辣根过氧化氢酶(北京中杉金桥生物技术有限公司),Z-H-9507285显微镜(重庆光学仪器厂),切片机(德国LEICA公司)。
1.3方法
1.3.1实验分组及各组大鼠干预措施将100只SD大鼠随机分为正常对照组、模型组和拉莫三嗪低、中、高剂量组,每组20只。模型组及拉莫三嗪低、中、高剂量组大鼠每天腹腔注射戊四氮35 mg·kg-1,并观察其行为学变化30 min;正常对照组大鼠腹腔注射等体积的生理盐水。行为学判断按Racine分级法[5]:0级:无任何反应;Ⅰ级:湿狗样抖动,面肌痉挛、眨眼、动须、抽搐及节律性咀嚼;Ⅱ级:颈部肌肉痉挛,点头和(或)甩尾;Ⅲ级:一侧前肢痉挛;Ⅳ级:双侧前肢痉挛伴伸直站立;Ⅴ级:全身阵挛甚至失去平衡及摔倒。以连续出现3次Ⅳ级及以上发作作为点燃标准,即癫痫动物模型建立成功。点燃后,正常对照组大鼠继续每日腹腔注射生理盐水;其余4 组大鼠继续腹腔注射戊四氮维持点燃,在此基础上,拉莫三嗪低、中、高剂量组大鼠分别给予拉莫三嗪 20、30、60 mg·kg-1·d-1灌胃,模型组大鼠给予生理盐水灌胃,共2周。
1.3.2各组大鼠海马组织形态学观察大鼠采用100 g·L-1水合氯醛溶液按照3 mL·kg-1腹腔注射行全身麻醉,9 g·L-1生理盐水及40 g·L-1多聚甲醛溶液灌注固定,断头取脑,剪除颅骨外软组织,完整取出大脑组织,置入40 g·L-1多聚甲醛溶液中固定24 h,常规脱水、透明、浸蜡、包埋,在视交叉后海马区行连续冠状切片,切片厚度为4 μm,将切片在37 ℃单蒸水中捞于多聚赖氨酸玻片上,置于58~60 ℃ 烤箱中干燥3 h后取出。切片经尼氏染色后在光学显微镜于400倍视野下观察各组大鼠海马组织形态学表现。
1.3.3免疫组织化学法检测各组大鼠海马CA3区Caspase-3和HSP70蛋白表达取各组大鼠海马组织,按照免疫组织化学染色步骤进行脱蜡、水化、去离子水孵育、滴加一抗、滴加生物素标记山羊抗兔IgG、DAB显色,其中正常对照组不加一抗,以 0.01 mol·L-1磷酸盐缓冲溶液代替一抗。每只大鼠随机选择2张切片,每个切片选定CA3区的任意3个高倍视野(400倍)。阳性结果判断:Caspase-3和HSP70阳性表达为细胞质中出现棕黄色颗粒。利用Imagepro-plus 6.0图像分析系统测量分析每个视野中Caspase-3和HSP70阳性细胞数目及平均吸光度值。
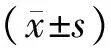
2 结果
2.1各组大鼠行为学表现正常对照组大鼠均无痫性发作。模型组、拉莫三嗪低、中、高剂量组大鼠在给予戊四氮腹腔注射后3~7 min出现湿狗样抖动,面肌痉挛、眨眼、动须、面部抽搐,直至出现3次Ⅳ级及其以上发作。全部点燃后,模型组大鼠在腹腔注射戊四氮后1~3 min即出现面部及颈部肌肉痉挛、双侧前肢痉挛、全身痉挛及摔倒,部分发作形式表现为口鼻青紫、流出血性泡沫、强直阵挛,痫性发作达到 Ⅳ~Ⅴ级。拉莫三嗪各剂量组大鼠在腹腔注射戊四氮后5~8 min出现眨眼、节律性咀嚼、动须、一侧前肢痉挛、双侧前肢痉挛伴伸直站立等,多表现为 Ⅲ~Ⅳ 级,个别发作表现为 Ⅴ 级,但未出现全身阵挛强制发作。模型组及拉莫三嗪低、中、高剂量组分别有14、18、16、18只大鼠造模成功。
2.2各组大鼠海马组织形态学表现正常对照组大鼠海马神经元形态及结构完整,呈锥体形、梭形、三角形、长条形或多边形,细胞核多为椭圆形,淡染,细胞质染色清晰,齿状回(dentategyrus,DG)区神经细胞密度大,形态规则,排列整齐,为均匀紫蓝色,尼氏小体着蓝色,未见明显丢失(图1A)。模型组大鼠海马区神经元肿胀,包膜皱缩,形态不规则,无层次感,密度增大,细胞核染色不均匀,大小不一,胞内尼氏小体明显减少,部分神经元丢失(图1B)。拉莫三嗪低、中、高剂量组大鼠海马神经元皱缩,体积缩小,DG区可见杂乱排列的神经元细胞,与周围组织有脱离,核深染,有核固缩、分裂及核溶解,具有凋亡特征,损伤细胞外可见多数细胞质呈水肿性空泡状(图1C~E)。
A:正常对照组;B:模型组;C:拉莫三嗪低剂量组;D:拉莫三嗪中剂量组;E:拉莫三嗪高剂量组。
图1各组大鼠海马组织形态(尼氏染色,×400)
Fig.1Hippocampalmorphologyofratsineachgroup(Nisslstaining,×400)
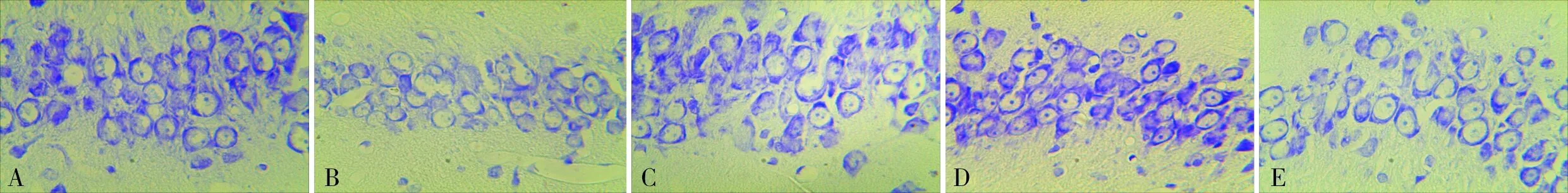
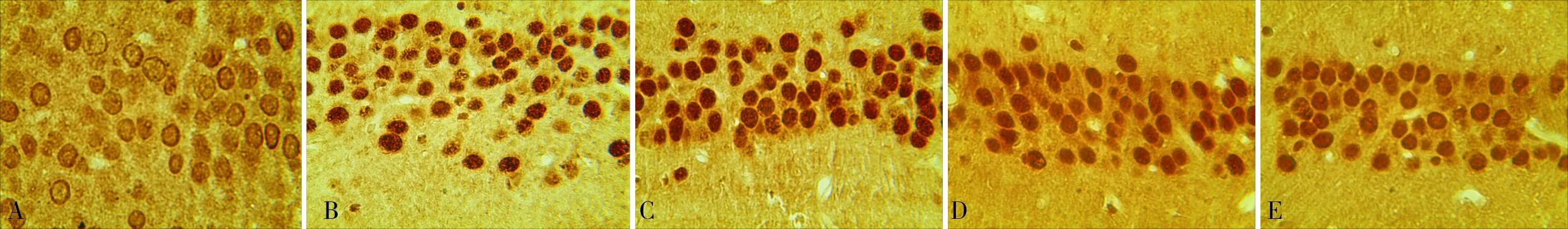
2.3各组大鼠海马CA3区Caspase-3和HSP70阳性细胞数比较结果见图2、图3和表1。与正常对照组比较,模型组大鼠海马CA3区Caspase-3和HSP70阳性细胞数增多(P<0.01);拉莫三嗪低、中、高剂量组大鼠海马CA3区Caspase-3阳性细胞数均少于模型组,HSP70阳性细胞数均高于模型组(P<0.05);拉莫三嗪低、中、高剂量组大鼠海马CA3区Caspase-3阳性细胞数随着剂量的增加而减少,HSP70阳性细胞数随着剂量的增加而增加,拉莫三嗪低、中、高剂量组大鼠海马CA3区Caspase-3、HSP70阳性细胞数两两比较差异均有统计学意义(P<0.05)。
A:正常对照组;B:模型组;C:拉莫三嗪低剂量组;D:拉莫三嗪中剂量组;E:拉莫三嗪高剂量组。
图2各组大鼠海马CA3区Caspase-3蛋白表达(DAB,×400)
Fig.2ExpressionsofCaspase-3proteininCA3zoneofhippocampusofratsineachgroup(DAB,×400)
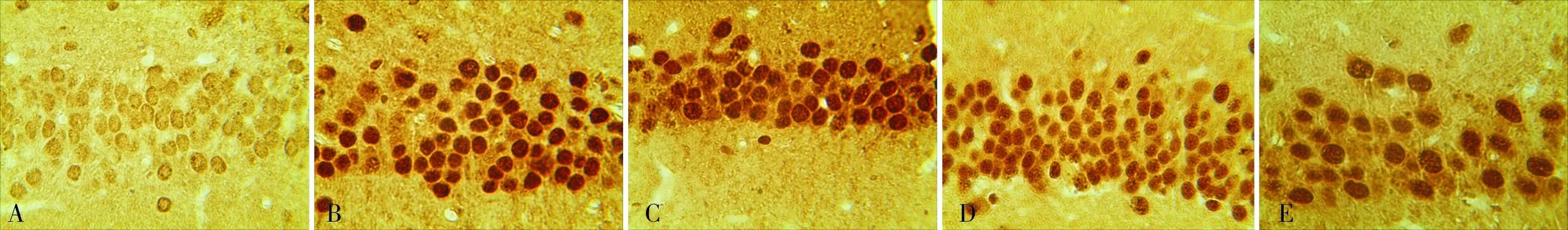
A:正常对照组;B:模型组;C:拉莫三嗪低剂量组;D:拉莫三嗪中剂量组;E:拉莫三嗪高剂量组。
图3各组大鼠海马CA3区HSP70蛋白表达(DAB,×400)
Fig.3ExpressionsofHSP70proteininCA3zoneofhippocampusofratsineachgroup(DAB,×400)
表1各组大鼠海马CA3区Caspase-3和HSP70阳性细胞数比较

组别nCaspase⁃3阳性细胞数HSP70阳性细胞数正常对照组207.40±3.25 3.20±2.58 模型组1433.20±3.94a19.50±4.03a拉莫三嗪低剂量组1830.00±1.83b21.20±3.49b拉莫三嗪中剂量组1627.00±3.40bc23.10±3.73bc拉莫三嗪高剂量组1821.20±4.52bcd26.10±4.15bcd
注:与正常对照组比较aP<0.01;与模型组比较bP<0.05;与拉莫三嗪低剂量组比较cP<0.05;与拉莫三嗪中剂量组比较dP<0.05。
2.4各组大鼠海马CA3区Caspase-3和HSP70蛋白表达比较结果见表2。与正常对照组比较,模型组大鼠海马CA3区Caspase-3及HSP70蛋白表达均增加,差异有统计学意义(P<0.05)。拉莫三嗪低、中、高剂量组Caspase-3蛋白表达低于模型组,HSP70蛋白表达高于模型组,差异均有统计学意义(P<0.05)。拉莫三嗪低、中、高剂量组大鼠海马CA3区Caspase-3蛋白的表达随着剂量的增加而降低,HSP70蛋白表达随着剂量的增加而增加,拉莫三嗪低、中、高剂量组大鼠海马CA3区Caspase-3、HSP70蛋白的表达两两比较差异均有统计学意义(P<0.05)。
表2各组大鼠海马CA3区Caspase-3和HSP70蛋白表达比较
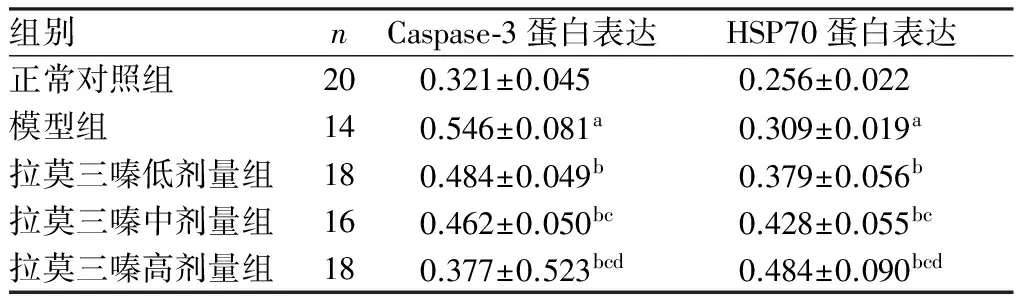
组别nCaspase⁃3蛋白表达HSP70蛋白表达正常对照组200.321±0.045 0.256±0.022 模型组140.546±0.081a0.309±0.019a拉莫三嗪低剂量组180.484±0.049b0.379±0.056b拉莫三嗪中剂量组160.462±0.050bc0.428±0.055bc拉莫三嗪高剂量组180.377±0.523bcd0.484±0.090bcd
注:与正常对照组比较aP<0.01;与模型组比较bP<0.05;与拉莫三嗪低剂量组比较cP<0.05;与拉莫三嗪中剂量组比较dP<0.05。
3 讨论
癫痫是儿童神经科的多发病,严重危害儿童的身心健康。拉莫三嗪作为广谱的新型抗癫痫药物,具有抗癫痫以及神经保护双重作用,目前已广泛应用于临床。癫痫反复发作所致的脑部不可逆性损伤一直是人们研究的焦点。目前,点燃动物模型主要分为急性点燃动物模型和慢性点燃动物模型[6]。刘智良等[7]研究证明,慢性点燃效应最符合人类癫痫发生机制。本实验采用不具有神经毒性的戊四氮制作慢性点燃癫痫大鼠模型,通过尼氏染色发现,模型组及拉莫三嗪低、中、高剂量组大鼠海马神经元皱缩、核分裂及核溶解,具有凋亡特征。经拉莫三嗪干预后损伤神经元较模型组减少,证实拉莫三嗪对癫痫损伤的脑功能改善作用与阻止神经元死亡及维持神经元结构完整性有关。
痫性发作可造成大量神经元凋亡,在神经元凋亡的级联反应中,Caspases家族发挥了重要作用,其中Caspase-3是介导细胞凋亡的核心蛋白酶[8-12],被称为死亡蛋白。KRAJEWSKA等[13]发现,在脑损伤大鼠海马组织内存在大量表达的Caspase-3及凋亡神经元,推测Caspase-3可能在癫痫发作时表达增加,并促进细胞凋亡,最终使海马神经元凋亡。而有研究显示,HSP70的神经保护作用主要表现在抑制线粒体细胞色素C的释放,并阻止Caspase-3活化[14],从而起到抗凋亡作用,通过对戊四氮制作的大鼠癫痫模型的研究发现,癫痫发作后海马区HSP70表达增加[15]。本研究观察到正常对照组大鼠海马Caspase-3和HSP70蛋白均呈低表达,模型组大鼠海马Caspase-3和HSP70在海马神经元细胞中表达量开始较正常对照组增多,说明处于癫痫状态下,死亡蛋白Caspase-3和保护性蛋白HSP70表达均增多,拉莫三嗪低、中、高剂量组大鼠随着拉莫三嗪剂量逐渐增大,Caspase-3表达逐渐降低,HSP70表达逐渐增多,推测拉莫三嗪可能在癫痫发生过程中通过降低Caspase-3的表达、增加HSP70的表达来减少神经元凋亡,发挥神经保护的作用。拉莫三嗪可以降低癫痫大鼠海马Caspase-3的表达、增加HSP70的表达,减轻癫痫发作后大鼠海马神经元的凋亡,对戊四氮致痫大鼠海马神经元有保护作用。随着拉莫三嗪剂量的增加,Caspase-3蛋白表达逐渐降低,HSP70蛋白表达逐渐增多,说明拉莫三嗪对戊四氮致痫大鼠的神经保护作用随着剂量的增加而增强。
参考文献:
[1] 张晓莉,曾皎,顾家鹏,等.5种抗癫痫药物单药治疗初诊癫痫患儿2 a单药保留率比较[J].新乡医学院学报,2016,33(4):297-301.
[2] SITGES M,GUAMEROS A,NEKRASSOV V,etal.Effects of carbamazeping,phenytion,valproic acid,oxcarbazepine,lamotrigine topiramate and vinpoceting on the presynapic Ca2+channel mediated release of glutamate:comparison with the Na+channel-mediated release[J].Neuropharmacology,2007,53(7):854-862.
[3] VALENCIA I,PINOL-RIPOLL G,KHURANA D S,etal.Effcacy and safety of lamotrigine monotherapy in chlidren and adolescents with epilepsy[J].PaediatrNeurol,2009,13(2):141-145.
[4] 王劲,陈燕,王琳.高体积分数氧对骨髓间充质干细胞含半胱氨酸的天冬氨酸蛋白水解酶-3和增殖细胞核抗原表达的影响[J].中华实用儿科临床杂志,2016,31(3):217-220.
[5] RACINE R J,STEINGART M,MEINTYRE D C.Development of kindlingprone and kindingresistant rats:selective breeding and electrophysiological studies[J].EpilepsyRes,1999,35(3):183-195.
[6] 谢学孔.癫痫病学[M].北京:人民卫生出版社,1995:233-239.
[7] 刘智良,徐如祥,张新伟.点燃效应癫痫动物模型研究状况及评价[J].第一军医大学学报,2001,21(8):621-623.
[9] 王怀立,陈继红,禚志红,等.甘草甜素通过抑制癫痫幼鼠高迁移率族蛋白1减轻神经元损伤的研究[J].中华实用儿科临床杂志,2017,32(14):1111-1115.
[10] GLUSHAKOVA O,GLUSHAKOV A O,BORLONGAN C,etal.Role of Caspase-3-mediated apoptosis in chronic Caspase-3-cleaved tau accumulation and blood-brain barrier damage in the corpus callosum after traumatic brain injury in rats[J].JNeurotrauma,2018,35(1):157-173.
[11] 蔡丽,周炼红,易贝茜,等. 提前光照刺激对早产近视小鼠视网膜中caspase-3表达的影响[J].眼科新进展,2017,37(9):819-823.
[12] 张婷婷,赵岩松,王海宇,等.N-乙酰-5-羟色胺(NAS)对视网膜缺血再灌注损伤(RI-RI )大鼠视网膜活性 Caspase-3、 Bcl-2、Bax表达的影响[J].眼科新进展,2017,37(8):701-704, 708.
[13] KRAJEWSKA M,YOU Z,RONG J,etal.Neuronal deletion of caspase 8 protects against brain injury in mouse models of controlled cortical impact and kainic acid-induced excitotoxicity[J].PLoSOne,2011,6(9):e24341.
[14] LI C Y,LEE J S,KO Y G,etal.Heat shock protein 70 inhibits apoptosis ownstream of cytochrome creleasc and upstream of Caspase-3 activation[J].JBiolChem,2000,275(33):25665-25671.
[15] EKIMOVA I V,NITSINSKAYA L E,ROMANOVA I V,etal.Exogenous protein HSP70/HSC70 can penetrate into brain structures and attenuate the severity of chemically-induced seizures[J].JNeurochem,2010,115(4):1035-1044.
