自噬通路相关调节基因与甲状腺癌
2018-04-24普梦娴柯亭羽
普梦娴 柯亭羽*
(昆明医科大学第二附属医院内分泌科二病区,云南 昆明 650101)
甲状腺癌(thyroid carcinoma,TC)是源于甲状腺上皮细胞的恶性肿瘤包括乳头状甲状腺癌(papillary thyroid carcinoma,PTC)、滤泡状甲状腺癌(follicular thyroid carcinoma,FTC)、未分化甲状腺癌(anaplastic thyroid cancer,ATC)及髓样癌(medullary thyroid carcinoma,MTC)。其中PTC、FTC又称分化型甲状腺癌(differentiated thyroid carcinoma,DTC),占甲状腺癌的90%[1]。甲状腺癌是最常见的内分泌恶性肿瘤,尽管甲状腺肿瘤在大多数肿瘤中属于预后较好的一类,但是当DTC不再对传统的手术治疗和碘剂化疗产生应答时,DTC的预后则显著恶化[2-3]。随着Yeung等在研究ATC时,第一次描述了自噬与TC之间的相关性之后,目前越来越多的研究表明自噬功能TC中所起到的作用[4]。自噬可参与TC起始、发展、转归及耐药等多个过程,其对甲状腺癌细胞的清除、抑制或是促进增殖的作用与上述TC分型有密切联系。目前,自噬通路与TC相关基因是自噬与TC相互联系研究的热点。与自噬联系紧密的抑癌基因、致癌基因可直接或间接作用于自噬通路里的各个环节包括通路中的基础分子(图1),导致的自噬功能下调或自噬过度而影响TC的发生、发展及转归[5]。下文就近年来自噬主要的信号转导通路及相关调控基因在甲状腺癌临床及基础研究进展作一综述。
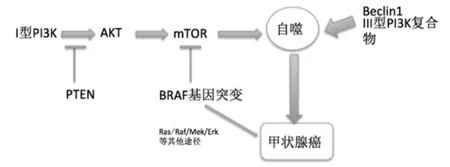
图1 PI3K/Akt/mTOR是自噬主要的信号转导通路,PTEN、BRAF、Beclin1等相关基因可通过参与该通路的各个过程调节自噬水平从而影响甲状腺肿瘤的发生、发展
1 自噬作用主要通路
在目前发现的自噬相关通路中,研究较为深入的是磷脂酰肌醇-激酶/蛋白激酶B/雷帕霉素靶蛋白(phosphatidylinositol3-kinase/protein kinaseB/the mammalian target of rapamycin PI3K/Akt/mTOR)信号通路,该通路是参与自噬调控通路中一条经典途径,主要作用为抑制自噬,促肿瘤细胞增值和抑制凋亡从而促进肿瘤的发生、发展[6]。PI3K可分为I型PI3KI、II型PI3K及III型PI3K三类。在PI3K/Akt/mTOR中的PI3K主要是指I型PI3KI,可被Ras蛋白、生长因子、集落刺激因子等激活在细胞质膜上产生第二信使PIP3[7]。III型PI3K可以与Beclin1蛋白结合成复合体参与早期的自噬过程。Akt主要活化并调控信号通路下游多个靶点,其与PIP3形成复合体可被磷酸肌醇依赖性蛋白激酶1(phosphoinositide dependent kinase-1 PDK1)磷酸化形成活化的Akt起到抑制自噬的作用[8]。mTOR在人体内以mTORC1及mTORC2两种形式存在,可对多种细胞外刺激产生应答。在一般情况下,结节性脑硬化复合物1/2(Tuberous Sclerosis Alliance TSC1/TSC2)可抑制mTOR的功能,当Akt活化后可磷酸化TSC2,抑制TSC1/TSC2复合物形成,从而促使mTOR被激活[9]。
2 影响该通路的相关基因
2.1 Beclin1基因:Beclin1是第一个被发现与自噬相关的抑癌基因,定位于染色体17q21上,包括12个外显子及11个内含子[10]。研究表明Beclin1编码的蛋白可以与III型PI3K形成复合物,该复合物是参与自噬起始以及调节自噬的关键分子。不同于传统的抑癌基因,Becline只有在双等位基因均表达是才能发挥抑癌作用[11]。Yue等在Beclin敲除的小鼠研究时发现,Beclin1单倍等位基因缺乏而导致自噬功能缺陷的小鼠随着自然进程恶性肿瘤的发生率显著增高[12]。随后Beclin1单倍等位基因缺乏引起Beclin1蛋白低表达导致自噬功能缺陷在乳腺癌、肝癌、黑色素瘤、前列腺癌中都得以证实[13-14]。张艳红等研究表明Beclin1在PTC组织中阳性表达率为43.6%显著低于正常对照组,认为自噬功能的下降在乳头状甲状腺的发生过程中可能起重要作用[15]。然而Kandemir等在对136例甲状腺癌术后患者的标本进行免疫组化试验发现,有98.9%的PTC和57.1% FTC患者的癌组织中可检测到Beclin1阳性表达[16]。同时在另一项研究中,LI等通过免疫组化在86例乳头状甲状腺癌PTC(57例有淋巴结转移)为研究对象的试验中发现,在PTC组织样本中,Beclin1增加了88%,转移的淋巴结中增加了98%。然而在同一个患者身上,正常的甲状腺组织和没有转移的淋巴结中,Beclin1呈低表达或无表达状态,因此认为Beclin1的表达与肿瘤发生和淋巴结转移相关[17]。但目前在这些研究中没有提到Beclin1单倍等位基因对TC所产生的影响。Beclin1的功能很复杂,不仅仅是自噬,还包括自噬与凋亡之间的关系。因此,尽管Beclin1的准确功能在TC的发展中并不十分清楚,但是目前这些研究数据表明Beclin1参与的自噬过程与甲状腺癌的发生机制相关。
2.2 BRAF基因:BRAF基因位于人染色体7q34,是Ras/Raf/Mek/Erk信号转导通路的重要的转导因子。致癌性BRAF变异是目前TC中为常见的基因突变,即BRAF基因上密码子600位的缬氨酸被谷氨酸替代,形成BRAFV600E[18]。BRAFV600E可持续激活Ras/Raf/Mek/Erk信号转导通路,导致细胞的过度增值、分化,在TC的发生和发展中起到主要作用[19]。Maddodi等在黑色素瘤研究中发现致癌性BRAF蛋白的表达水平与自噬标志物呈正相关,无论在原发性或转移性的黑色素瘤中都可观察到自噬被抑制程度与致癌性BRAF基因表达强度相关。结合既往研究成果,Maddodi等认为致癌性BRAF主要通过抑制mTOR,尤其是mTORC1从而参与自噬信号通路的调节[20]。BRAF激活的长链非编码RNA(BRAF-activated long non-coding RNA BANCR)是一种与BRAFV600E联系紧密的突变基因,位于人9号染色体。目前认为长链非编码基因(Long non-coding RNAs IncRNAS)是一种新的肿瘤调控基因[21-22]。在Romana等的研究中,共检测了6组PTC癌组织与其临近的正常甲状腺组织,发现BANCR在PTC癌细胞中表达明显高于正常组织,且与自噬密切相关。在体外实验中表明,低表达的BANCR在PTC癌细胞中可抑制癌细胞增殖并且能诱导癌细胞凋亡。进一步研究其相关调控机制发现BANCA能够显著激活自噬。过度表达的BANCR抑制PTC癌细胞凋亡,促使癌细胞增值,而通过抑制自噬可以抵消BANCR过度表达所引起的癌细胞增值[23]。
2.3 PTEN基因:PTEN基因定位于人染色体10q23.3,包括9个外显子和8个内含子,是一种重要的抑癌基因[24]。我国学者张艳红等研究发现,PTEN表达在正常甲状腺组织、甲状腺良性病变组织及甲状腺癌组织中依次下降,分别为86.67%、64.71%、32.91%。结果表明PTEN表达水平降低或缺失与TC的发生有密切的关系[15]。PTEN主要通过参与PI3K/AKT通路调节自噬过程,PTEN本身是一磷酸酶基因,其编码的蛋白质可以降解PI3K在信号通路中的中间产物PIP3,进一步使活化的AKT减少可以诱导自噬从而降低肿瘤的发生。当PTEN减少时,PI3K/AKT通路可被激活,活化的AKT过度积累导致自噬抑制,使得细胞不受凋亡刺激的作用可促进肿瘤的发生、发展[8]。此外,线粒体呼吸链上的琥珀酸脱氢酶(Succinate dehydrogenase SDH)又称线粒体复合物II,其亚单位编码基因SDHD位于11q23,包含4个外显子,3个内含子,目前被认为是一种抑癌基因与多种内分泌肿瘤、家族性或散发性副神经节瘤相关[25]。先前的研究证明,SDH亚单位编码基因突变与遗传性和散发性TC有关[26],SDHD变异可以促进FTC细胞凋亡[27]。目前越来越多的证据表明PTEN与线粒体信号通路之间有错综复杂的相关性。Wan等研究结果表明SDHD两种基因变异SDHD-G12S与SDHDH50R产生的生物学效应与TC有关,且SDHD相关线粒体信号通路可依赖PTEN功能作用参与调节自噬。SDHD-G12S和SDHD-H50R能够激发PTEN泛素化,导致PTEN功能缺陷,如上述PTEN表达减少可致活化的AKT增多抑制自噬。研究者提出尽管该实验受到细胞系的限制,但能够为自噬引起肿瘤相关基因及通路提供新的位点[28]。
3 小 结
自噬对肿瘤具有双重作用机制,即可在早期应对理化因素对细胞的伤害,稳定细胞功能;也可提高肿瘤细胞对化疗药物的耐受性,抑制放化疗对肿瘤细胞的杀伤作用;研究利用某些自噬相关基因检测可以判断患者预后[29]。Zhang等研究表明在应用顺铂治疗ATC时,Beclin1能够帮助ATC细胞逃避顺铂引起的凋亡作用,且通过mi-R30d干预抑制Beclin1对自噬的调控,可增加顺铂对ATC细胞的伤害[30]。目前,自噬在TC中的预后及治疗价值暂未形成可靠的系统研究,但一些体外试验结果已经证明自噬参与了TC治疗的抗肿瘤药物细胞毒性反应,表明自噬在治疗TC方面可以被开发应用[31]。因此,有必要在将来的研究中进一步明确自噬在肿瘤发生、发展、转归及治疗方面的通路及基因作用机制。
[1]Van der Zwan JM.Carcinoma of endocrine organs: results of the RARECARE project[J].Eur J Cancer,2012,48(13):1923-1931.
[2]Settas N,Faucz FR, Stratakis CA.Succinate dehydrogenase (SDH)deficiency,Carney triad and the epigenome[J].Mol Cell Endocrinol,2017,pii: S0303-7207(17)30392-1.
[3]Tuttle RM.Thyroid carcinoma[J].J Natl Compr Canc Netw,2010,8(11):1228-1274.
[4]Yeung SC.Combination chemotherapy including combretastatin A4 phosphate and paclitaxel is effective against anaplastic thyroid cancer in a nude mouse xenograft model[J].J Clin Endocrinol Metab,2007,92(8):2902-2909.
[5]Netea-Maier RT.Autophagy in thyroid cancer:present knowledge and future perspectives[J].Front Endocrinol (Lausanne),2015,6(1):22.
[6]Liu L,Liao JZ,He XX,et al.The role of autophagy in hepatocellular carcinoma:friend or foe[J].Oncotarget,2017,8(34):57707-57722.
[7]Kim J.miR-221 regulates CD44 in hepatocellular carcinoma through the PI3K-AKT-mTOR pathway[J].Biochem Biophys Res Commun,2017,487(3):709-715.
[8]Lin YX.Similar PDK1-AKT-mTOR pathway activation in balloon cells and dysmorphic neurons of type II focal cortical dysplasia with refractory epilepsy[J].Epilepsy Res,2015,112: 137-149.
[9]Adjei AA,Hidalgo M.Intracellular signal transduction pathway proteins as targets for cancer therapy[J].J Clin Oncol,2005,23(23):5386-5403.
[10]Morani F.Autophagy and thyroid carcinogenesis:genetic and epigenetic links[J].Endocr Relat Cancer,2014,21(1):13-29.
[11]Zhang HY.Beclin 1 enhances proteasome inhibition-mediated cytotoxicity of thyroid cancer cells in macroautophagy-independent manner[J].J Clin Endocrinol Metab,2013,98(2):E217-226.
[12]Yue Z.Beclin 1,an autophagy gene essential for early embryonic development,is a haploinsufficient tumor suppressor[J].Proc Natl Acad Sci USA,2003,100(25):15077-15082.
[13]Yu M.Beclin 1 expression is an independent prognostic factor for gastric carcinomas[J].Tumour Biol,2013,34(2):1071-1083.
[14]Zhao Y.Aberrant Beclin 1 expression is closely linked to carcino genesis,differentiation,progression,and prognosis of ovarian epithelial carcinoma[J].Tumour Biol,2014,35(3):1955-1964.
[15]张艳红,王桂琴.自噬相关基因PTEN和Beclin1在乳头状甲状腺癌中的表达和意义[J].临床合理用药杂志,2011,4(2A):34-35.
[16]Yesil C.Is BECLIN-1 Immunoreactivity More Effective than HBME-1 in Diagnosis of Papillary Thyroid Cancer? [J].Acta Chir Belg,2015,115(4):299-305.
[17]Li X,Xu H,Ma H.Beclin 1 is highly expressed in papillary thyroid carcinoma and correlates with lymph node metastasis[J].Acta Chir Belg,2013,113(3):175-181.
[18]Li F.BRAFV600E mutation in papillary thyroid microcarcinoma:a meta-analysis[J].Endocr Relat Cancer,2015,22(2):159-168.
[19]Ni Y.Germline and somatic SDHx alterations in apparently sporadic differentiated thyroid cancer[J].Endocr Relat Cancer,2015,22(2):121-130.
[20]Maddodi N.Induction of autophagy and inhibition of melanoma growth in vitro and in vivo by hyperactivation of oncogenic BRAF[J].J Invest Dermatol,2010,130(6):1657-1667.
[21]Nakagawa T.Large noncoding RNA HOTAIR enhances aggressive biological behavior and is associated with short disease-free survival in human non-small cell lung cancer[J].Biochem Biophys Res Commun,2013,436(2):319-324.
[22]Zhu L,Xu PC.Downregulated LncRNA-ANCR promotes osteoblast differentiation by targeting EZH2 and regulating Runx2 expression[J].Biochem Biophys Res Commun,2013,432(4):612-617.
[23]Wang Y. BRAF-activated long non-coding RNA contributes to cell proliferation and activates autophagy in papillary thyroid carcinoma[J].Oncol Lett,2014,8(5):1947-1952.
[24]Morani F.PTEN deficiency and mutant p53 confer glucose-addiction to thyroid cancer cells: impact of glucose depletion on cell proliferation,cell survival,autophagy and cell migration[J].Genes Cancer,2014,5(7/8):226-239.
[25]Settas N,Faucz FR,Stratakis CA.Succinate dehydrogenase (SDH)deficiency,Carney triad and the epigenome[J].Mol Cell Endocrinol,2017,pii: S0303-7207(17)30392-1.
[26]Von Dobschuetz E,Leijon H,Schalin-Jantti C,et al.A registrybased study of thyroid paraganglioma: histological and genetic characteristics[J].Endocr Relat Cancer,2015,22(2):191-204.
[27]Yu W,He.X,Ni Y,et al.Cowden syndrome-associated germline SDHD variants alter PTEN nuclear translocation through SRC-induced PTEN oxidation[J].Hum Mol Genet,2015,24(1):142-153.
[28]Yu W,Ni Y,Saji M,et al.Cowden syndrome-associated germline succinate dehydrogenase complex subunit D (SDHD) variants cause PTEN-mediated down-regulation of autophagy in thyroid cancer cells[J]. Hum Mol Genet,2017,26(7):1365-1375.
[29]Yi H,Long B,Ye X,etal.Autophagy: A potential target for thyroid cancer therapy (Review)[J].Mol Clin Oncol,2014,5(2):661-665.
[30]Zhang Y,Yang WQ,Zhu H,et al.Regulation of autophagy by miR-30d impacts sensitivity of anaplastic thyroid carcinoma to cisplatin[J].Biochem Pharmacol,2014,87(4):562-570.
[31]Li LC. Autophagy,a novel target for chemotherapeutic intervention of thyroid cancer.Cancer Chemother Pharmacol[J].Cancer Chemother Pharmacol,2014,73(3):439-449.
