SFRP1蛋白在前列腺腺癌中的表达及意义
2018-04-24张丽何洪敏张楠
张丽 何洪敏 张楠
前列腺腺癌是一类严重危害男性健康的疾病,在过去几十年中,前列腺腺癌的发病人数持续上升。其发生发展是一个长期的、多因素的复杂的过程。近年来的研究发现,Wnt信号通路及其抑制剂分泌型卷曲相关蛋白1(Secreted Frizzled-related Proteins 1,SFRP1)与前列腺腺癌的发生发展密切相关。Wnt信号通路由Wnts基因调控,通过Wnt相关蛋白与其位于细胞表面的受体结合来完成对细胞间生长、发育信号的转导和调控[1]。Wnt信号通路的关键蛋白及调控蛋白在多种不同的前列腺癌细胞中存在着表达差异[2]。Thiele等[3]在前列腺癌细胞株中对SFRP1从mRNA水平进行了相关的研究。Wnt信号通路中涉及很多因子,而作为SFRP家族成员之一的SFRP1是Wnt信号通路的负性调节剂,它通过干扰配体和受体间的相互作用而阻断Wnt信号通路[4]。目前国内外有关SFRP1蛋白在前列腺腺癌中研究报道较少,本研究应用免疫组化PV二步法分别检测52例前列腺腺癌和68例良性前列腺增生组织中SFRP1蛋白的表达情况,并分析其与前列腺腺癌临床病理参数之间的关系,以探讨其在前列腺腺癌发生、发展中的作用。
1 材料与方法
1.1 材料 选取2014年1月-2016年10月枣庄市立医院病理科存档的经穿刺、电切或手术切除的男性前列腺腺癌石蜡包埋组织52例。每例标本均经两名主治医师及以上的病理医师阅片确认。患者年龄53~82岁,中位年龄68岁;术前血清PSA值18.6~100 ng/mL,平均(58.6±27.4)ng/mL;所有患者术前均未进行放化疗及内分泌治疗;Gleason评分5~6分(中分化)17例,Gleason评分7~10分(低分化)35例;根据WHO的TNM分期,Ⅰ期+Ⅱ期(T1、T2期)23例,Ⅲ期+Ⅳ期(T3、T4期)29例;有骨转移者18例,无骨转移者34例。选取同期存档的68例经病理诊断及免疫组化证实的良性前列腺增生的石蜡包埋组织做对照。
1.2 主要试剂 兔抗人SFRP1多克隆抗体购自美国santa cruz公司(工作浓度为1∶100),PV-9000检测试剂盒及DAB显色试剂盒均购于北京中杉公司。
1.3 方法 采用免疫组织化学PV-9000两步法,所有蜡块进行厚4 μm的切片后脱蜡至水。后滴加3%H2O2室温孵育10 min以灭活内源性过氧化物酶的活性。经抗原热修复后,室温放置自然冷却,滴加一抗,4 ℃过夜。PBS缓冲液冲洗2 min×3次,滴加内源性过氧化物酶阻断剂,置于37 ℃温箱内孵育20 min。PBS缓冲液冲洗2 min×3次,滴加反应增强液,置于37 ℃温箱内孵育30 min。PBS缓冲液冲洗2 min×3次,DAB显色剂显色,蒸馏水冲洗、苏木素衬染、梯度酒精脱水、二甲苯透明、中性树胶封片。用PBS缓冲液代替一抗作阴性对照,用已知表达阳性的切片做阳性对照。
1.4 结果判定 由两位主治医师及以上的病理医师采用双盲法观察每张切片。判定阳性反应依据以下两个方面:(1)按显色强度评分:细胞无显色为0分;细胞呈浅黄色为1分;细胞呈棕黄色为2分;细胞呈深棕褐色为3分。(2)按阳性细胞百分率评分:光镜下随机选取10个视野(×400倍),每个视野计数100个细胞,阳性细胞百分率<25%为0分,25%~50%为1分,51%~75%为2分,>75%为3分。SFRP1蛋白以细胞浆内出现棕黄色颗粒染色为阳性(见图1),阴性表达见图2。上述(1)+(2)>3分为阳性,≤3分为阴性。
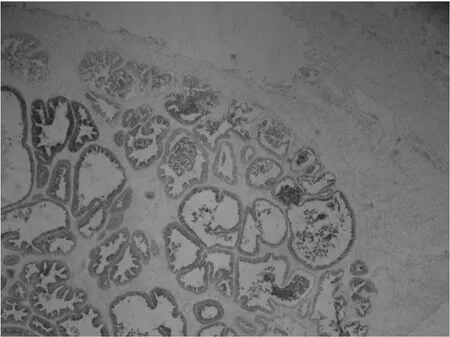
图1 SFRP1蛋白在良性前列腺增生组织中的阳性表达(PV两步法,×200)

图2 SFRP1蛋白在前列腺腺癌中的阴性表达(PV两步法,×200)
1.5 统计学处理 采用SPSS 17.0统计软件,计数资料以率(%)表示,比较采用 字2检验,相关性分析采用Spearman相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 SFRP1蛋白在前列腺腺癌及良性前列腺增生组织中的表达 SFRP1蛋白在前列腺腺癌组中的阳性表达率为23.08%(12/52),低于良性前列腺增生组织组的80.88%(55/68),差异有统计学意义( 字2=39.928,P<0.001)。
2.2 SFRP1蛋白失表达与前列腺腺癌临床病理参数的关系
2.2.1 SFRP1蛋白失表达与Gleason评分的关系 SFRP1蛋白在中分化的前列腺癌患者中的阳性表达率为41.18%(7/17), 高 于 低 分 化 的 14.29%(5/35),差异有统计学意义( 字2=4.661,P=0.042)。随着Gleason评分的增加,SFRP1阳性表达率降低,故SFRP1蛋白的失表达与前列腺腺癌Gleason评分呈负相关(P<0.05)。
2.2.2 SFRP1蛋白失表达与年龄之间的关系 SFRP1蛋白在≤68岁前列腺癌患者中阳性表达率为26.32%(5/19),在>68岁前列腺癌患者中阳性表达率为21.21%(7/33),两者比较差异无统计学意义( 字2=0.177,P=0.739)。
2.2.3 SFRP1蛋白失表达与术前血PSA值之间的关系 SFRP1蛋白在术前血PSA值≤58.6 ng/mL前列腺癌患者中的阳性表达率为30.00%(9/30),在术前血PSA值>58.6 ng/mL的阳性表达率为13.64%(3/22),两者比较差异无统计学意义( 字2=1.915,P=0.200)。
2.2.4 SFRP1蛋白失表达与TNM分期之间的关系 SFRP1蛋白在Ⅰ期+Ⅱ期(T1、T2期)的前列腺癌患者中阳性表达率为17.39%(4/23),在Ⅲ期+Ⅳ期(T3、T4期)的阳性表达率为27.59%(8/29),两者比较差异无统计学意义( 字2=0.751,P=0.513)。
2.2.5 SFRP1蛋白失表达与骨转移之间的关系 SFRP1蛋白在有骨转移的前列腺癌患者中阳性表达率为33.33%(6/18),在无骨转移的前列腺癌患者中阳性表达率为17.65%(6/34),两者比较差异无统计学意义( 字2=1.631,P=0.300)。
3 讨论
Wnt信号通路调控着细胞增殖、分化和凋亡等诸多过程,它的异常激活与人类多种肿瘤的发生、发展密切相关[5]。SFRP1基因位于染色体8p11.2区,该位点在多种肿瘤中存在缺失现象。它编码的SFRP1蛋白是Wnt信号通路的负性抑制剂。SFRP1通过结构上有同源性的CRD与Wnt信号通路的特异性受体Fz(Frizzled)受体竞争性结合而阻断Wnt信号通路,从而起到抑癌作用[6]。
国外的一项研究表明,在结肠癌中SFRP1是一种新的肿瘤抑制基因,通过CpG岛启动子的异常甲基化而失活[7]。文献[8]研究表明,在胃癌中SFRP1表达的降低与组织病理学分级和预后显著相关。SFRP1基因启动子频繁甲基化导致SFRPl蛋白的表达沉默是Wnt通路异常引发肿瘤的可能机制[9]。目前有关前列腺腺癌组织中SFRP1蛋白的失表达情况报道较少,且意义尚不清楚。有学者做Western分析显示,SFRP1在前列腺癌中的表达是降低的[10]。文献[11]研究显示,与正常的前列腺细胞株相比,在前列腺癌细胞株,SFRP家族的5个成员的表达均是明显降低的。并且还发现,SFRP1基因的甲基化在PC3细胞启动子,但不在LNCaP。
本研究应用免疫组织化学方法检测52例前列腺腺癌及68例良性前列腺增生组织中SFRP1蛋白的表达情况,结果显示,SFRP1蛋白在前列腺腺癌组织中的阳性表达率(23.08%)显著低于良性前列腺增生组织(80.88%)(P<0.05)。提示SFRP1可能在抑制前列腺腺泡细胞的异常增殖和恶性转化中起着一定作用:SFRP1基因CpG岛启动子的异常甲基化,致使SFRP1失活并蛋白表达降低,对Wnt信号通路抑制作用减弱,导致前列腺腺泡上皮的异常增殖和前列腺腺癌的发生。Lo等[12]采用了甲基化特异性PCR方法在浸润性乳腺癌中证明了上述观点,此外,在子宫颈癌、胃癌、肝细胞癌、结直肠癌、肾细胞癌中也相继发现了SFRP1启动子的异常甲基化现象[13-17]。这有可能为恶性肿瘤的临床诊治和判断预后提供一定的帮助。本研究还发现:SFRP1蛋白的失表达与前列腺腺癌Gleason评分呈负相关(P<0.05),即随着前列腺腺癌Gleason评分的增加,SFRP1蛋白表达降低;而与患者年龄、术前血PSA值、TNM分期、是否有骨转移均无相关性(P>0.05),表明SFRP1可能是前列腺腺癌组织学进展的一个相关因子,SFRP1蛋白的失表达有可能参与了前列腺腺癌的组织学进展。Zheng等[18]的研究也表明:在前列腺癌和良性前列腺增生患者相比,SFRP1和β-catenin的表达率与前列腺癌的Gleason评分有关,也与患者的预后生存率和内分泌治疗有关。但这之间的具体的作用机制和对临床的诊疗、预后等还需要进一步的研究。另外文献[19]认为SFRP1在前列腺癌的骨转移中也发挥一定的作用。甚至在肺腺癌中,某些药物可以通过提升SFRP1基因的表达和改变其甲基化状态,从而对治疗起到一定作用[20]。
总之,SFRP1在前列腺腺癌的发生、发展中起重要作用,临床上对它们进行分子水平的检测和研究将有可能对于前列腺腺癌的诊断、治疗和预后起到一定的帮助。是否有新的药物可以改变其甲基化状态和表达,是否能作用于临床,还需要进一步的研究和证实。
[1]王晓辉.Wnt信号通路与乳腺癌[J].中国肿瘤,2006,15(11):768-771.
[2]姜永光,赵佳晖,罗勇,等.Wnt/β-catenin信号通路在多种人前列腺癌细胞系中的表达研究及意义[J].中华男科学杂志,2009,15(4):310-313.
[3] Thiele S,Rauner M,Goettsch C,et al.Expression profile of WNT molecules in prostate cancer and its regulation by aminobisphosphonates[J].J Cell Biochem,2011,112(6):1593-1600.
[4] Matsuda Y,Schlange T,Oakeley E J,et al.WNT signaling enhances breast cancer cell motility and blockade of the WNT pathway by sFRP1 suppresses MDA-MB-231 xenograft growth[J].Breast Cancer Research Bcr,2009,11(3):R32.
[5]周凯.Wnt信号通路抑制因子SFRPs在肿瘤发生发展中的研究进展[J].医学研究生学报,2012,25(9):997-1001.
[6] Hunter T,Pines J.Cyclins and cancer Ⅱ:Cyclin D and CDK inhibitors come of age[J].Cell,1994,79(4):573-582.
[7] Takada T,Yagi Y,Maekita T,et al.Methylation-associated silencing of the Wnt antagonist SFRP1, gene in human ovarian cancers[J].Cancer Science,2004,95(9):741-744.
[8] Zhang T,Wu Y,Fang Z,et al.Low expression of RBMS3 and SFRP1 are associated with poor prognosis in patients with gastriccancer[J].Am J Cancer Res,2016,6(11):2679-2689.
[9] Zhou P,Jiang W, Zhang Y J,et al.Antisense to cyclin D1 inhibits growth and reverses the transformed phenotype of human esophageal cancer cells[J].Oncogene,1995,11(3):571-580.
[10] Hirata H,Hinoda Y,Shahryari V,et al.Genistein downregulates onco-miR-1260b and upregulates sFRP1 and Smad4 via demethylation and histone modification in prostate cancer cells[J].Br J Cancer,2014,110(6):1645-1654.
[11] García-Tobilla P,Solórzano S R,Salido-Guadarrama I,et al.SFRP1 repression in prostate cancer is triggered by two different epigenetic mechanisms[J].Gene,2016,593(2):292-301.
[12] Lo P K,Mehrotra J,D’Costa A,et al.Epigenetic suppression of secreted frizzled related protein 1 (SFRP1) expression in human breast cancer[J].Cancer Biology & Therapy,2006,5(3):281-286.
[13] Sova P,Feng Q,Geiss G,et al.Discovery of novel methylation biomarkers in cervical carcinoma by global demethylation and microarray analysis[J].Cancer Epidemiol Biomarkers Prev,2006,15(1):114-123.
[14] Nojima M,Suzuki H,Toyota M,et al.Frequent epigenetic inactivation of SFRP genes and constitutive activation of Wnt signaling in gastric cancer[J].Oncogene,2007,26(32):4699-4713.
[15] Shih Y L,Hsieh C B,Lai H C,et al.SFRP1 suppressed hepatoma cells growth through Wnt canonical signaling pathway[J].Int J Cancer,2007,121(5):1028-1035.
[16] Qi J,Zhu Y Q,Luo J,et al.Hypermethylation and expression regulation of secreted frizzled-related protein genes in colorectal tumor[J].World J Gastroenterol,2006,12(44):7113-7117.
[17] Dahl E,Wiesmann F,Woenckhaus M,et al.Frequent loss of SFRP1 expression in multiple human solid tumours:association with aberrant promoter methylation in renal cell carcinoma[J].Oncogene,2007,26(38):5680-5691.
[18] Zheng L,Sun D,Fan W,et al.Diagnostic value of SFRP1 as a favorable predictive and prognostic biomarker in patients with prostate cancer[J].PLoS One,2015,10(2):e0118276.
[19] Larson S R,Zhang X,Dumpit R,et al.Characterization of osteoblastic and osteolytic proteins in prostate cancer bone metastases[J].Prostate,2013,73(9):932-940.
[20] Yang X,Han S W,Liu H,et al.Secreted frizzled-related protein 1 (SFRP1) gene methylation changes in the human lung adenocarcinoma cells treated with L-securinine[J].Journal of Asian Natural Products Research,2017,26:1-9.
