植物乳杆菌和酿酒酵母发酵菠萝汁的性能比较及产物分析
2018-04-23马立娟杜丽平韩晓霞李大雷郭高杰
马立娟,王 超,杜丽平*,韩晓霞,孙 文,李大雷,郭高杰
(天津科技大学 生物工程学院 工业发酵微生物教育部重点实验室 天津市工业微生物重点实验室,天津 300457)
随着经济的发展和社会的进步,人们对日常饮食的营养价值与保健功能提出了更高的要求。益生菌不仅具有促进食物消化吸收等功能,而且对糖尿病等慢性病还具有一定的预防功能,因此,益生菌产品日益受到人们的关注[1],与益生菌相关的食品和饮料产品在国际市场中种类越来越多,份额越来越大[2-3]。除占市场份额最大的益生菌发酵乳制品以外,目前以谷物、果蔬汁等不同原料作为发酵载体进行益生菌发酵的研究与相关产品日趋增多[4]。
果蔬具有低蛋白、低脂肪的特点,含有大量的矿物质与丰富的维生素,具有天然的令人愉悦的口感风味。将果蔬汁进行益生菌发酵是一种优良的加工方式,相关研究也日趋增多。YOON K Y等[5]采用干酪乳杆菌(Lactobacillus casei)A4、植物乳杆菌(Lactobacillus plantarum)C3和德式乳酸杆菌(Lactobacillusdelbrueckii)D7发酵甘蓝汁,获得了含有大量活菌并且具有缓解乳糖不耐症功能的发酵甘蓝汁。FILANNINO P等[6]采用植物乳杆菌(Lactobacillus plantarum)发酵石榴汁,开发健康功效与口感风味俱佳的益生菌产品。菠萝又名凤梨,是热带、亚热带特产水果之一,在我国水果市场占有重要地位。菠萝含有丰富的糖、蛋白质、维生素C(vitamin C,VC)、β-胡萝卜素、膳食纤维以及钙、钾、镁等矿物质,具有利尿、解热解暑、解酒、降血压、预防便秘和抗癌等功效[7-8]。菠萝香气诱人、风味独特,菠萝经益生菌发酵会产生使人愉悦的酒香和果香[9]。潘咏梅[10]通过气质联用色谱定性及气相色谱定量方法对菠萝鲜汁及菠萝加热汁、菠萝发酵汁中挥发性风味物质的变化进行了总体分析。朱龙宝等[11]研究发现,在菠萝汁澄清处理过程中会引起菠萝汁组成成分的变化,对发酵过程和菠萝酒酯类等风味物质均产生较大的影响。目前以酿酒酵母发酵生产菠萝汁饮料的研究报道较多,但采用植物乳杆菌单独或其与酿酒酵母混菌发酵的还少见相关报道。
本研究采用新鲜的菠萝汁为原料,利用本实验室从水果发酵体系中筛选得到的植物乳杆菌(Lactobacillus plantarum)和酿酒酵母(Saccharomyces cerevisiae)分别进行单菌与混菌发酵,对不同接菌方式发酵菠萝汁的益生菌活菌数、酸度、糖、氨基酸态氮、有机酸以及风味物质进行比较分析,为高品质菠萝发酵饮品的研制提供技术参考和理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
植物乳杆菌(Lactobacillusplantarum)和酿酒酵母(Saccharomycescerevisiae)均由本实验室筛选获得。
1.1.2 实验原料
新鲜菠萝(食品级):市售。
1.1.3 化学试剂
蛋白胨、牛肉膏、酵母膏、琼脂粉(均为生化试剂),葡萄糖、柠檬酸二胺、磷酸氢二钾、乙酸钠、MgSO4·7H2O、MnSO4·4H2O、氯霉素、吐温80(均为分析纯):天津市英博生化试剂有限公司;蔗糖、果糖、葡萄糖(纯度>98%):南京化学试剂股份有限公司;甲酸、乙酸、丙酸、乳酸、苹果酸、琥珀酸(纯度>98%):上海麦克林生化科技有限公司。
1.3.4 培养基
酸化MRS培养基:葡萄糖20g,蛋白胨10g,牛肉膏10 g,酵母膏5 g,柠檬酸二胺2 g,磷酸氢二钾2 g,乙酸钠5 g,MgSO4·7H2O 0.58 g,MnSO4·4H2O 0.25 g,吐温80 1 mL,溶解于1 000 mL蒸馏水中,搅拌均匀,分装到三角瓶,121℃湿热灭菌15 min(固体培养基添加2%琼脂粉后灭菌)。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:葡萄糖20 g,蛋白胨20 g,酵母膏10 g,溶解于1 000 mL蒸馏水中,搅拌均匀,分装到三角瓶,121℃湿热灭菌15 min(固体培养基添加2%琼脂粉后灭菌)。
酵母粉浸出粉葡萄糖氯霉素(yeast extract dextrose chloramphenicol,YEDC)培养基:酵母膏5.0g,葡萄糖20.0g,氯霉素0.1 g,溶解于1 000 mL蒸馏水中,搅拌均匀,分装到三角瓶,121℃湿热灭菌15 min(固体培养基添加2%琼脂粉后灭菌)。
1.2 仪器与设备
ZHJH-C1115B型超净工作台、2XJD-A1270型电热恒温培养箱:郑州南北仪器设备有限公司;IS-RDS3叠加式恒温振荡器:河南兄弟仪器设备有限公司;YXQ-LS-50SII立式压力蒸汽灭菌器:上海博讯实业有限公司设备厂;HWS24电热恒温水浴锅:上海一恒科学仪器有限公司;pHS-3C精密pH计:梅特勒-托利多仪器有限公司;Centrifuge 5430R离心机:德国艾本德有限公司;HR2874/00榨汁机:荷兰飞利浦电子有限公司;Agilent 1200高效液相色谱仪、Agilent 7890A-5975CGC/MS气质联用色谱仪:美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 菠萝汁的制备
选新鲜的菠萝,去掉果皮后用清水冲洗,切粒,按照菠萝∶水=1∶1(g∶g)的比例,将菠萝与水一同放入榨汁机打浆过滤得到菠萝汁。将菠萝汁放入75℃的水浴锅中,待菠萝汁升温至75℃并维持15 min(巴氏消毒法),将菠萝汁灭菌与灭酶。降温至40℃左右,待用。
1.3.2 菌种的活化
乳酸菌活化:用接种环从保存菌种的斜面上挑取乳酸菌,接种到装有10 mL MRS液体培养基的试管中,把试管置于37℃恒温培养箱中,静置培养16 h,再将其倒入装有200 mL MRS液体培养基的三角瓶中,把三角瓶置于37℃恒温培养箱中,静置培养20 h。
酵母菌活化:将0.1 g的冻干酵母粉倒入装有10 mL YEPD液体培养基的试管中,把试管置于30℃、150 r/min振荡培养12 h,再将其倒入装有200 mL YEPD液体培养基的三角瓶中,置于30℃、150 r/min振荡培养24 h。
1.3.3 菠萝汁发酵
单菌发酵:对活化好的植物乳杆菌和酿酒酵母,分别测定其活菌数,然后以6%的接种量分别接种到灭菌后的菠萝汁中(3个平行)。37℃密封静置发酵72 h,发酵结束取样测定发酵液中活菌数、pH、酸度、氨基氮、葡萄糖、果糖、蔗糖、有机酸、乙醇以及挥发性成分。
混菌发酵:对活化好的且已测定活菌数的植物乳杆菌和酿酒酵母培养液,按照植物乳杆菌接种量为4%,酿酒酵母接种量为2%时接种到灭菌后的菠萝汁中(3个平行)。37℃密封静置发酵7 h,发酵结束取样测定发酵液中活菌数、pH、酸度、氨基氮、葡萄糖、果糖、蔗糖、有机酸、乙醇以及挥发性成分。
1.3.4 分析方法
活菌数测定:取0.1 mL样液于0.9 mL灭菌水中稀释,然后用同样的方法进行梯度稀释,选3个稀释度,吸取0.1 mL的液体,进行平板涂布。单菌发酵计数时,植物乳杆菌用MRS培养基平板进行涂布计数,酿酒酵母用YEPD培养基平板进行涂布计数。混菌发酵计数时,酵母菌用YEDC培养基平板进行计数,乳酸菌用添加了放线菌酮的MRS培养基平板进行计数。用于乳酸菌计数的平板置于37℃的培养箱中培养3 d后计数,用于酵母菌计数的平板置于30℃的培养箱中培养3 d后计数,每个梯度涂布3个平行。菌落计数单位为CFU/mL。全程要求无菌操作。
pH测定:pH计测定各样液pH。
氨基酸态氮含量的测定:参照文献[12]进行测定。
糖类含量测定:采用高效液相色谱法测定蔗糖、果糖、葡萄糖含量。高效液相色谱检测条件:Prevail Carbohydrate ES 5u色谱柱(250 mm×4.6 mm,5μm);流动相乙腈∶水=75∶25(V/V);流速为0.6 mL/min;柱温30 ℃;检测器为蒸发光散射检测器(evaporativelight scatteringdetector,ELSD);载气(氮气)流量2.2 mL/min;增益1;进样量10.0μL。
有机酸含量测定:采用高效液相色谱法测定各有机酸(甲酸、乙酸、丙酸、乳酸、苹果酸、琥珀酸)含量。高效液相色谱检测条件:Aminex HPX-87H色谱柱(300 mm×7.8 mm);流动相5 mmol/L H2SO4;流速0.6 mL/min;柱温60 ℃;检测器为可变波长检测器(variablewavelength detector,VWD);波长210 nm;进样量20μL。
香气物质测定:用气质联用(gaschromatography-mass spectrometer,GC-MS)方法测定挥发性香气物质。气相色谱检测条件:HP-5色谱柱(30 m×0.25 mm×0.25μm);进样温度250℃;分流进样,分流比20∶1;程序升温:初始45℃(保留2 min),3.5℃/min升至220℃(保留2 min);载气流量1.0 mL/min。质谱检测条件:离子源:电子电离(electronic ionization,EI)源;离子源温度:230 ℃;电子能量:70 eV;发射电流:34.6μA;接口温度:280℃;扫描质量范围:30~550 amu。
2 结果与分析
2.1 不同接菌方式对活菌数的影响

表1 菠萝汁发酵前后总活菌数的比较Table 1 Comparison of total viable count before and after pineapple juice fermentation
取已灭菌的菠萝汁,分别接入植物乳杆菌、酿酒酵母、植物乳杆菌∶酿酒酵母(2∶1)(活菌数约为6×106CFU/mL),37℃静置发酵72 h后,发酵结束分别对发酵液中的活菌进行计数,结果如表1所示。
由表1可知,相同接种量的条件下,植物乳杆菌单独发酵菠萝汁72 h后活菌数最多,可达2×108CFU/mL,是酿酒酵母单独发酵的3倍多,约为二者混合发酵总活菌数的10倍,二者单独发酵最终总活菌数均高于混合发酵的总活菌数。贾磊等[13]研究表明,通常情况下,酵母菌与乳酸菌之间不会表现出特别明显的促进或抑制关系,但某些特定的乳酸菌与某些特定的酵母菌之间会有一定程度上的促进或抑制关系。BROOMEM C等[14]研究表明,酵母菌生长过程中会代谢产生脂肪酸等一些抑制乳酸菌生长代谢的物质,同时,乳酸菌在生长过程中会产生苯乳酸等一些抑制酵母菌生长代谢的物质[15],这可能是本研究中植物乳杆菌与酿酒酵母混合发酵总活菌数降低的原因。
2.2 不同接菌方式对发酵液pH和滴定酸度的影响
不同接菌方式菠萝汁发酵72 h后的pH值和滴定酸度检测结果见表2。
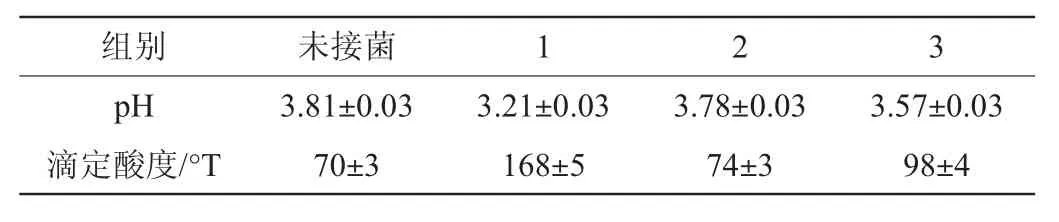
表2 不同接菌方式菠萝汁发酵72 h后pH值和滴定酸度检测结果Table 2 Determination results of pH value and titratable acidity of pineapple juice fermented by different inoculation ways for 72 h
由表2可知,未接菌的菠萝汁初始pH值最高,为3.81,滴定酸度最低,为70°T,无论是单菌还是混菌发酵,pH值均有所降低,滴定酸度均明显升高。单独接入酿酒酵母发酵72 h后,菠萝汁pH值(3.78)和滴定酸度(74°T)变化不明显;而单独接入植物乳杆菌发酵72h后的菠萝汁,pH值最低(3.21),滴定酸度最高(168°T);混菌发酵72 h后的菠萝汁pH值(3.57)变化不大,滴定酸度有所提高(98°T)。这是由于乳酸菌通常在密封缺氧条件下利用葡萄糖等碳水化合物产生乳酸等有机酸物质,从而引起pH降低;而酵母菌在无氧环境下利用葡萄糖等碳水化合物主要生成CO2与乙醇等,对pH值没有明显影响。
2.3 不同接菌方式发酵体系中底物的消耗的比较
2.3.1 氨基酸态氮的消耗
不同接菌方式菠萝汁发酵72 h后发酵液中氨基酸态氮含量检测结果见图1。
由图1可知,菠萝汁的氨基酸态氮含量为7.56×10-4mg/L,与之相比,接入植物乳杆菌单独发酵72 h后菠萝汁中氨基酸态氮的含量为7.84×10-4mg/L,含量没有明显变化,而接入酿酒酵母发酵72 h后菠萝汁中氨基酸态氮的含量为3.15×10-4mg/L,含量明显降低,其中,植物乳杆菌与酿酒酵母混菌发酵的氨基酸态氮含量最低(2.92×10-4mg/L)。林朴[16]实验表明,酵母菌发酵第1~2天内可迅速并大量利用氨基酸态氮,本实验所得结果与其基本一致。此外,植物乳杆菌∶酿酒酵母(2∶1)混合发酵(2.66×10-4mg/L)时菠萝汁中的氨基酸态氮含量比酿酒酵母单独发酵(3.15×10-4mg/L)时略低,可见植物乳杆菌与酵母菌混菌发酵在氨基酸态氮利用方面有微弱的促进作用。
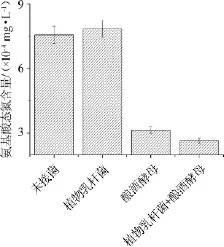
图1 不同接菌方式菠萝汁发酵72 h后的氨基酸态氮含量检测结果Fig.1 Determination results of amino nitrogen contents in pineapple juice fermented by different inoculation ways for 72 h
2.3.2 糖类物质的消耗
不同接菌方式菠萝汁发酵72 h后发酵液中糖类物质含量的检测结果见表3。
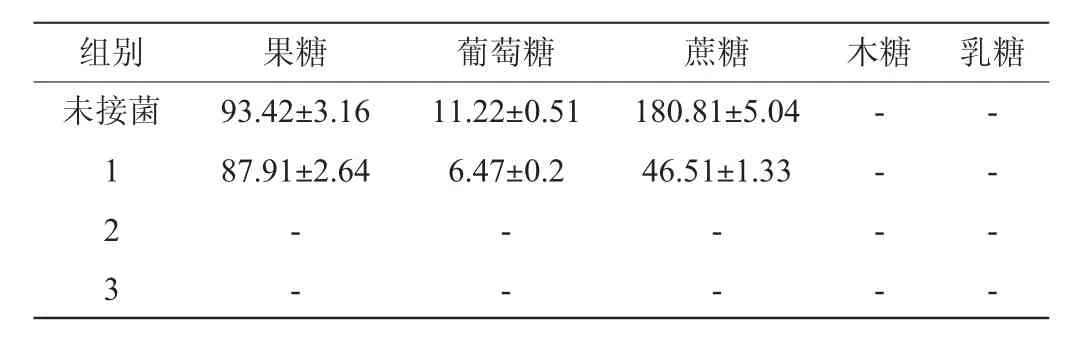
表3 不同接菌方式菠萝汁发酵72 h后糖类物质含量检测结果Table 3 Determination results of carbohydrates contents in pineapple juice fermented by different inoculation ways for 72 h g/L
由表3可知,未接菌的菠萝汁与菠萝汁发酵液中均未检测到木糖与乳糖。菠萝汁中蔗糖、果糖和葡萄糖的含量分别为180.81 g/L、93.42 g/L和11.22 g/L。发酵72 h后,菠萝汁中的蔗糖、果糖与葡萄糖的含量均有不同程度的减少,其中,接入酿酒酵母发酵后的菠萝汁中的这三种糖已基本被消耗完,而单独接入植物乳杆菌发酵72 h后的菠萝汁中蔗糖、果糖和葡萄糖的残余量分别为87.91 g/L、6.47 g/L和46.51 g/L。由此可见,酿酒酵母对这三种糖的利用能力非常强,几乎可以完全把菠萝汁中的糖消耗殆尽;而植物乳杆菌对这三种糖有一定的消耗能力,但比酿酒酵母小很多。
2.4 不同接菌方式发酵体系中产物分析
2.4.1 有机酸
食品中有机酸的作用是非常重要的,首先有机酸具有一定的抑制致病菌的能力[17]。并且有机酸对人维持自身身体健康也有很大作用。本实验对不同接菌方式的菠萝汁发酵72 h后进行各种有机酸进行定量分析[18],测定结果见图2。

图2 不同接菌方式菠萝汁发酵72 h后有机酸含量检测结果Fig.2 Determination results of organic acids contents in pineapple juice fermented by different inoculation ways for 72 h
由图2可知,菠萝汁与菠萝汁发酵液中,没有检测到酒石酸与丁酸。菠萝汁中含有一定量苹果酸(1892.77mg/L)、甲酸(486.78mg/L)、乳酸(200.27mg/L)、琥珀酸(1147.96mg/L)、乙酸(1 070.48 mg/L)、丙酸(1 836.93 mg/L)。发酵后,菠萝汁中除酒石酸与丁酸,其余各种有机酸的含量相较于发酵前都有一定程度的变化。
发酵后菠萝汁与未发酵菠萝汁的有机酸组成出现了差异,这将构成发酵后菠萝汁与未发酵菠萝汁之间的口感差异,同时,各种发酵菠萝汁之间的有机酸组成也存在着明显的差异,这也是各发酵菠萝汁形成自己独特的口感的原因。植物乳杆菌单独发酵的乳酸产量很高,酵母的加入可以降低乳酸的含量;酿酒酵母会产生甲酸,而植物乳杆菌的加入会抑制甲酸的产生;两种菌的加入都会降低琥珀酸和苹果酸的含量。这些有机酸也是良好的抑菌剂、防腐剂,有机酸的增加或减少关系着发酵菠萝汁的货架期。
2.4.2 乙醇
乙醇是含醇饮料中极为常见的组成成分。乙醇的含量关系着饮料的口感,对于发酵饮料来说,适量的乙醇将有助于延长发酵饮料的货架期。实验中分别对不同接菌方式的菠萝汁发酵72h后进行乙醇含量的检测,检测结果如图3所示。

图3 不同接菌方式菠萝汁发酵72 h后乙醇含量检测结果Fig.3 Determination results of ethanol contents in pineapple juice fermented by different inoculation ways for 72 h
由图3可知,菠萝汁中与单独接入植物乳杆菌发酵72 h的菠萝汁中乙醇的含量几乎为零,由于植物乳杆菌主要进行乳酸发酵,仅当进行异型乳酸发酵时可能生成少量的乙醇。而接入酿酒酵母及混菌发酵72 h,菠萝汁中乙醇的含量分别为17.03 g/L和15.28 g/L,含量明显增加这是因为酿酒酵母主要进行的是乙醇发酵。
2.4.3 香气物质
不同接菌方式的菠萝汁发酵72 h后的香气物质成分检测结果见表4。
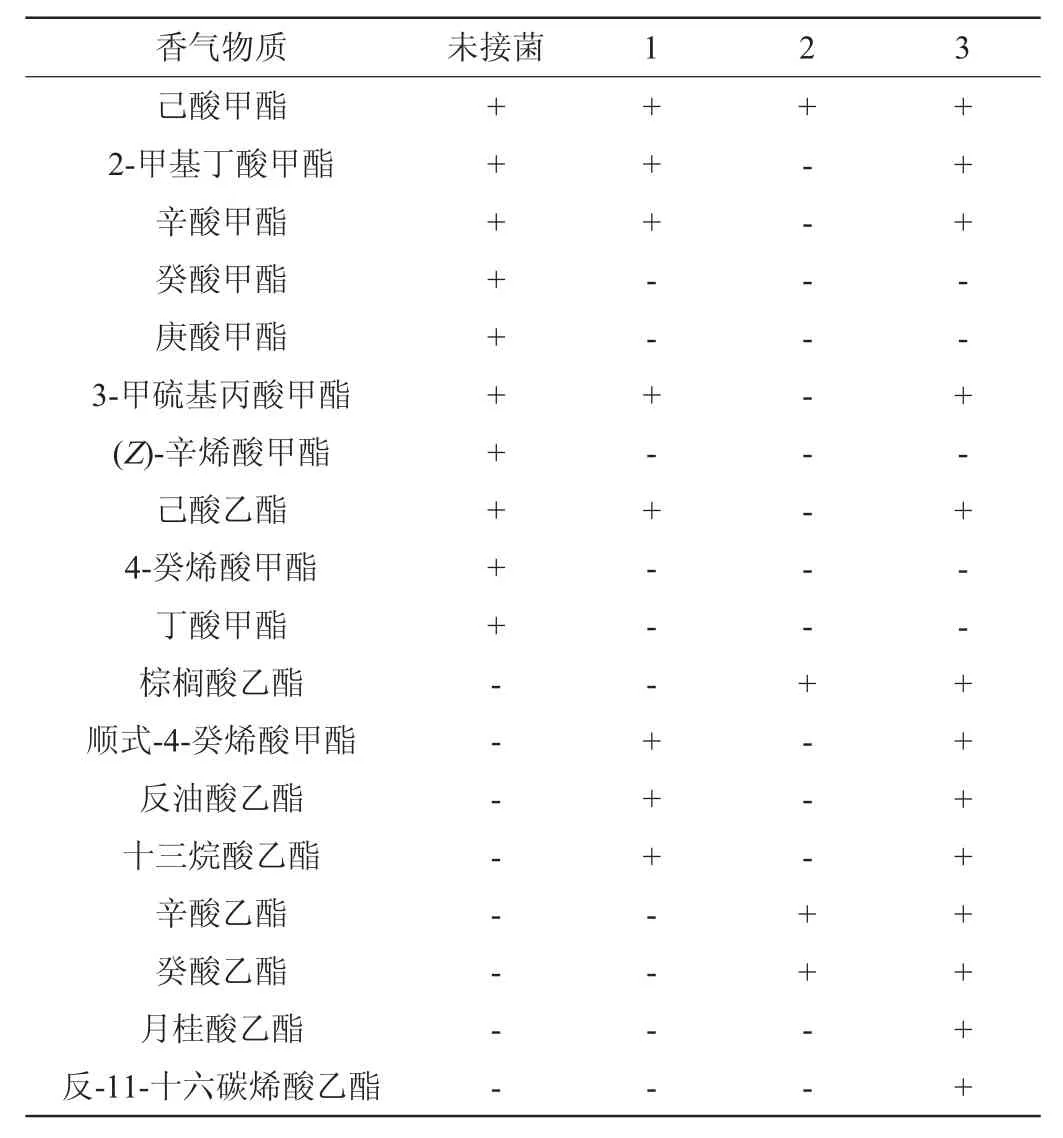
表4 不同接菌方式菠萝汁发酵72 h后香气物质检测结果Table 4 Determination results of aroma compounds contents in pineapple juice fermented by different inoculation ways for 72 h
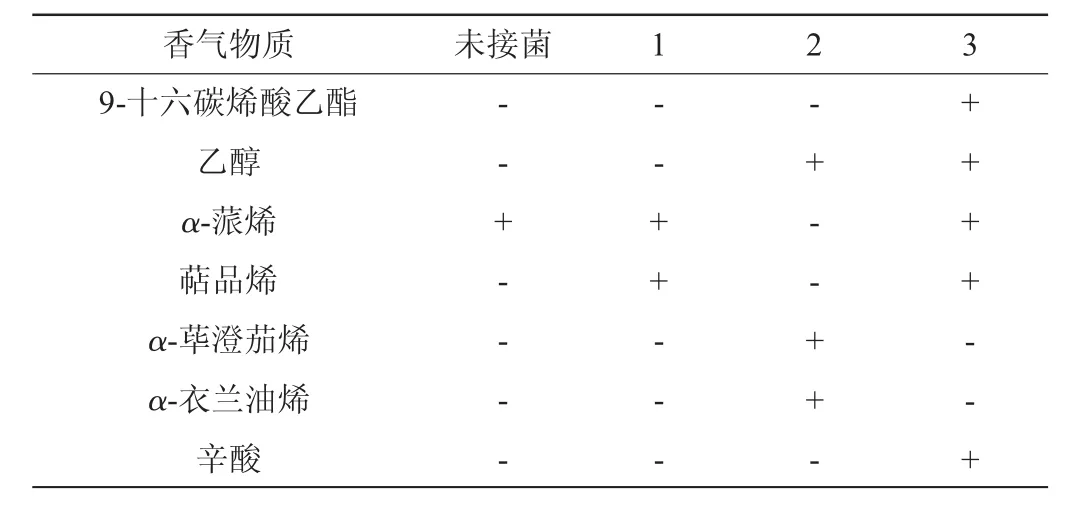
续表
由表3可知,菠萝汁原料中可检测到的香气物质有11种(己酸甲酯、2-甲基丁酸甲酯、辛酸甲酯、癸酸甲酯、庚酸甲酯、3-甲硫基丙酸甲酯、(Z)-辛烯酸甲酯、己酸乙酯、4-癸烯酸甲酯、丁酸甲酯、α-蒎烯)。其中,己酸甲酯、3-甲硫基丙酸甲酯、己酸乙酯、丁酸甲酯具有菠萝味香气,2-甲基丁酸甲酯和辛酸甲酯具有独特的果香,α-蒎烯具有独特香气,庚酸甲酯常用于香料的合成。因此,在发酵过程中尽可能保留这几种香气成分,有助于保存菠萝的独特风味。经过对比,用植物乳杆菌单菌发酵的菠萝汁香气成分有9种,菠萝的主要香气物质基本得以保留,也有原料中不存在的物质生产如萜品烯;而用酿酒酵母进行发酵时菠萝的主要香气物质共7种,只有己酸甲酯是菠萝汁中的成分,其余6种挥发性物质都是新生成的;而植物乳杆菌与酿酒酵母混菌发酵的菠萝汁香气成分有16种,菠萝汁的大部分香气物质得以保留,新增的香气物质还起到调节发酵菠萝汁风味的作用,有助于形成较为独特的风味。由此可见,采用植物乳杆菌和酿酒酵母进行混合发酵,既可保有菠萝本身的营养物质和特有香气,又赋予其一定的发酵风味,获得口感良好的菠萝发酵饮品。
3 结论
本研究以菠萝作为发酵原料,对比了采用植物乳杆菌和酿酒酵母分别进行单菌与混菌发酵时的发酵性能,结果发现,无论单菌还是混菌,均能够在菠萝汁生长繁殖并发酵;发酵的菠萝汁pH均会下降,滴定酸度均升高;混菌发酵时植物乳杆菌和酿酒酵母的生长状态均不如单菌发酵时,但综合考虑乳酸、乙醇以及香气物质的生成情况,采用植物乳杆菌和酿酒酵母进行混合发酵,既可保有菠萝本身的营养物质和特有香气,又可赋予其一定的发酵风味,获得口感良好的菠萝发酵饮品。
参考文献:
[1]秦晓东.美华生物公司益生菌市场营销策略研究[D].长春:吉林大学,2010.
[2]杜 磊,杜 杨.发酵乳制品的现状和发展趋势[J].河南畜牧兽医:市场版,2014,35(12):13-15.
[3]肖 平,吕嘉枥,沈 文.益生菌的保健功能及其在食品中的应用概述[J].食品科技,2009,34(10):23-26.
[4]胡学智.益生菌、益生元机器保健功能和安全性[J].上海医药,2001,22(8):256-358.
[5]YOON K Y,WOODAMS E E,HANG Y D.Production of probiotics cabbage juice by lactic acid bacteria[J].Bioresource Technol,2006,97(12):1427-1430.
[6]FILANNINO P,AZZIL,CAVOSKII,et al.Exploitation of the healthpromotingand sensory propertiesof organic pomegranate(Punicagranatum L.)juicethroughlactic acid fermentation[J].Int J Food Microbiol,2013,16(23):184-192.
[7]张秀梅,杜丽清,孙光明,等.3个菠萝品种果实香气成分分析[J].食品科学,2009,30(22):275-279.
[8]张庆庆,郑天柱,汤文晶,等.红曲菠萝酒发酵及香气成分的分析[J].食品工业科技,2015,36(19):299-303,317.
[9]吴惠婵,王秀杏,宁正祥,等.发酵菠萝酒的风味及其稳定性研究[J].现代食品科技,2012,28(2):191-194.
[10]潘咏梅.菠萝汁及加工、发酵过程中风味变化的研究[D].北京:北京化工大学,2007.
[11]朱龙宝,杨幼慧,周冠华.菠萝汁的澄清处理对菠萝酒发酵的影响[J].中国食品学报,2006,6(1):120-123.
[12]朱益波,张建华.高温瞬时α化大米中可酶促水解α氨基氮含量的测定[J].氨基酸和生物资源,2007,29(2):59-62.
[13]贾 磊.酵母与乳酸菌发酵特性研究及混合乳开菲尔的研究[D].天津:天津科技大学,2010.
[14]BROOME M C,THOMAS M P,HILLIER A J,et al.The effect of linoleic acid on the growth and metabolismsof Streptococcus lactis[J].Aust J Dairy Technol,1979,34(4):163-168.
[15]NIELSEN M S,FRISVAD J C,NIELSEN P V.Protection by fungal starters against growth and secondary metabolite production of fungal spoilersof cheese[J].Int J Food Microbiol,1998,42(1-2):91-99.
[16]林 朴.贵人香葡萄中的氨基氮含量及其对酵母发酵的影响[J].中外葡萄与葡萄酒,2013(5):17-21.
[17]RUBIN H E,NERAD T,VAUGHAN F.Lactate acid inhibition of Salmonellatyphimurium in yogurt[J].J Dairy Sci,1982,65(2):197.
[18]莫海涛,杜玉兰,黎庆涛,等.反相高效液相色谱法测定发酵饮料中有机酸和维生素C的含量[J].食品工业科技,2007(2):230-232.
