超敏CRP室间质评偏倚较大的原因及对策分析
2018-04-20罗映杰刘艳婷肖光军
罗映杰 刘艳婷 肖光军

摘 要:目的 探討我科室超敏CRP检测系统室间质评偏倚较大的原因及对策。方法 将卫生部临检中心室间质评成绩回报主页中超敏CRP的临检中心数据按方法、试剂、校准物及EQA分组统计后,分别观察5个EQA样品在各组中的中位数,并与我科室检测系统所属组的中位数进行比较,并以重新分组后的中位数为靶值,分别计算我科室EQA网络回报结果和冻存样品复测结果与此靶值的bias%和正确度。结果 EQA网络回报结果与冻存样品复测的结果一致,以试剂和校准物生产厂家进行分组时,两次检测结果与中位数的bias%均<1/3TEa,正确度验证通过;而以方法和EQA分组方法分组时bias%则明显增高,虽然均
关键词:超敏CRP;室间质评;偏倚
中图分类号:R446.1 文献标识码:A DOI:10.3969/j.issn.1006-1959.2018.05.028
文章编号:1006-1959(2018)05-0087-04
Analysis of the Reasons and Countermeasures for the Bias of Ventricular Quality Evaluation in Hypersensitive CRP
LUO Ying-jie,LIU Yan-ting,XIAO Guang-jun
(Department of Laboratory,Suining Central Hospital,Suining 629000,Sichuan,China)
Abstract:Objective To explore the causes and countermeasures of the bias of the room quality evaluation in the hypersensitive CRP detection system in our department.Methods The Ministry of health clinical center of clinical laboratory data results in return home HS CRP inspection center EQA according to statistical method,reagents,calibrators and EQA packet,5 EQA samples were observed in each group of the median,and compared with the median of our department detection system belongs to the group,and median again after grouping as the target value were calculated in our department EQA network return results and frozen sample survey results and the target value and accuracy of bias%.Results EQA network returns with the results of frozen sample survey,grouped by the reagent and calibrator manufacturer,the two test results with a median of bias%<1/3TEa,the accuracy is verified by the method;and EQA packet bias% grouping method was significantly increased,although the<TEa,there still are 3 or more samples of bias%>1/2TEa, accuracy verification failed.Conclusion It may not be appropriate to use instruments to calculate the target values in the room quality assessment of hypersensitive CRP.It is suggested that the bias of EQA samples should be evaluated by the group of reagent manufacturers or by reference method.At the same time,the traceability and interoperability of calibration products should be strengthened by reagent manufacturers,and the concentration of calibration products should include the concentration of different medical decision levels.
Key words:Hypersensitive CRP;Ventricular quality evaluation;Bias
在实验室质量管理中,室间质量评价(EQA)越来越受到医院和临床实验室用户的重视,它是多家实验室分析同一标本并由外部独立机构收集和反馈实验室上报结果评价实验室操作的过程,可为客户、认可机构和法规部门提供实验室检测能力的客观证据,同时也是一种质量控制工具,可帮助实验室采取相应的措施提高检验质量[1]。我科室于2017年卫生部临检中心组织的第一次心肌标志物EQA活动中首次回报了超敏C-反应蛋白(CRP)的检测结果,5个EQA样品的检测结果均在所属组(Hitachi组)的允许范围内,但与靶值的相对偏倚(bias%)均较大。本文通过对临检中心的数据进行分析和利用,以探讨超敏CRP的 bias%较大的原因及对策。
1 材料与方法
1.1仪器与试剂 仪器:Hitachi 7600(P-P模块)全自动生化分析仪;成都水之纯反渗透纯水机。试剂:血清超敏CRP检测试剂盒(四川迈克,批号:),校准品批号为5个EQA樣品由卫生部临检中心提供(201711~201715);室内质控(IQC)采用Bio-rad液体未定值中、高两水平质控血清(Lot:23912和23913)。
1.2方法
1.2.1超敏CRP偏倚评估 按EQA活动的要求在建议时间内完成5个EQA样品的检测并回报结果,然后将剩余样品分装后保存于-20 ℃条件下冻存。EQA成绩发放后对冻存样品进行复测,计算每一样品与靶值的bias%,并于EQA回报结果的bias%比较。EQA活动中按仪器分组,且实验室数>18家才独立分组,并以ISO13528方法计算的稳健均值作为靶值。超敏CRP的总允许误差(TEa)为靶值±30%。
1.2.2不同分组方法对超敏CRP检测结果偏倚的影响 登陆卫生部临检中心室间质评成绩回报主页的临检中心数据分析处,查询除外均值加减3倍标准差的数据,按方法、试剂、校准物及EQA分组统计观察实验室数大于18家的各独立分组中检测结果的中位数,并与我科室检测系统5个EQA样品的中位数进行比较,再以其中位数为靶值,分别重新计算我科室EQA回报结果和冻存样品复融后检测结果与靶值的bias%,并进行正确度验证判断。若5个EQA样品与靶值的bias%均≤TEa,且至少4个样品≤1/2TEa,则通过正确度验证[2]。
2 结果
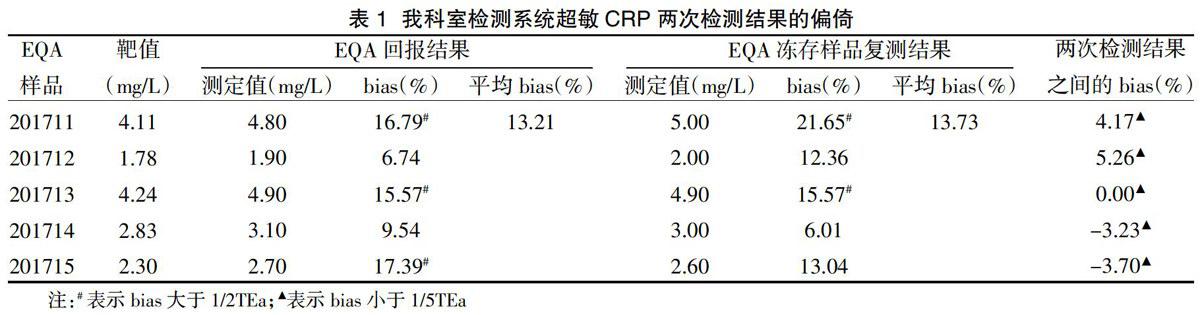
2.1我科室检测系统超敏CRP两次检测结果的偏倚
5个EQA样品两次检测结果一致,与靶值的bias%均
2.2按不同方法分组后各组超敏CRP检测结果中位数的比较 按试剂厂家分组后,四川迈克在201711和201713两个样品中其中位数的值均最高,其余3个样品则居于第二位,见图1;按校准物分组后,四川迈克组在所有能独立分组的小组中5个样品中位数的值均最高,见图2;按方法分组统计后发现免疫比浊法仍然是超敏CRP检测的最常用方法,其中位数与所有方法的中位数基本一致,见图3;EQA根据仪器进行分组,Hitachi组与Roche组及缺省组的中位数较一致,见图4。
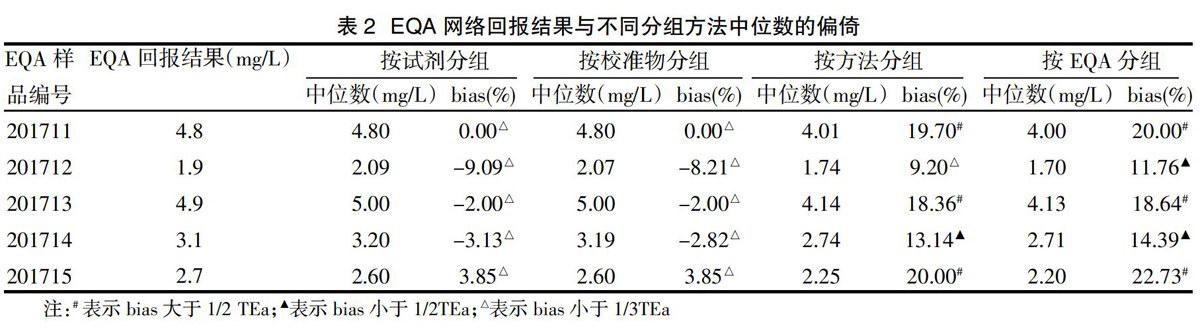
2.3我科室超敏CRP检测系统按不同方法分组后检测结果与中位数的偏倚 分别按试剂厂家及校准物厂家分组后,5个EQA样品网络回报结果和冻存样品复融后的检测结果与中位数的bias均小于1/3TEa,正确度验证通过;而按检测方法和EQA仪器分组时,虽然bias均小于TEa,但正确度验证未通过,见表2、表3。
3 讨论
C-反应蛋白(CRP)是机体一种重要的急性时相蛋白,正常状态下血液中含量极低,但机体受炎症、感染及组织损伤时,在细胞因子(如肿瘤坏死因子、白细胞介素-6)等的刺激下,主要由肝脏大量合成并释放入血,参与多种自身生理及病理生理过程[3-5]。临床常通过检测血液中CRP的含量用于感染、心脑血管性疾病、糖尿病、代谢综合征、外周血管病、慢性阻塞性肺病、哮喘、肿瘤等多种疾病中的诊疗,尤其在心脑血管疾病方面,其已成为健康人及冠脉疾病患者心血管疾病风险及脑血管意外的预测因子之一,也是预后与评价疗效的指标之一[3-5]。研究表明,超敏CRP≥2.0 mg/L是中国人发生心血管疾病的有效预测因子[3]。在实验室检测中,常规CRP、超敏CRP及全程CRP三者是同一种物质,在化学本质上无区别,只是检测方法的线性范围不同,常规CRP的线性范围常在10~150 mg/L,超敏CRP线性范围至少在0.5~30 mg/L,全程CRP范围则至少在0.5~150 mg/L[6]。
我科室以Hitachi 7600(P-P模块)全自动生化分析仪及四川迈克生产的试剂和校准品组建了一个非配套检测系统,参加卫生部临检中心心肌标志物的EQA活动,从表1可发现,5个EQA样品与所属组(Hitachi组)靶值的bias%均较大,未能通过正确度的验证。通过对临检中心除外均值加减3倍标准差的超敏CRP检测数据进行分析,从图1~图4可发现:超敏CRP检测方法仍以免疫比浊法为主,按试剂及校准物厂家分组后四川迈克组5个样品的中位数均明显高于EQA活动中所采用的仪器分组中Hitachi组的中位数。通过表2和表3进一步分析发现,我科室检测系统分别以试剂和校准物生产厂家进行分组时,EQA网络回报结果和冻存样品复融后检测结果与中位数的bias%均<1/3TEa,正确度验证通过;以方法和EQA仪器进行分组时bias%则明显增高,虽然均小于TEa,但仍有3个及以上样品的bias%>1/2TEa,正确度验证未通过。Hitachi全自动生化分析仪是一个开放式的平台,实验室常采用A厂家仪器+B厂家试剂+B厂家校准品或C厂家校准品的模式组成一个非配套检测系统,EQA仍以仪器进行分组计算靶值的方式可能不适当,建议按试剂厂家进行分组或以参考方法对EQA样品赋值后进行偏倚的评估[7],以正确指导临床实验室进行质量改进。本文以EQA样品的中位数为靶值评估检测系统的bias%和正确度,对EQA样品的互通性、中位数与以ISO13528方法计算的稳健均值之间的差异等仍需进一步的讨论。
另一方面,通过查看四川迈克两个批号校准品的溯源性报告,发现Hitachi生产的全自动生化中仅对7180这一个型号进行了赋值,而其它型号的Hitachi全自动生化分析仪均使用此值进行校准,未提供互通性报告;同时,两个批号校准品的最低浓度均大于4.0 mg/L,校准后的工作曲线可能导致患者标本浓度为0.5~4.0 mg/L时的正确度下降,从而直接影响着临床的诊疗工作。因此,试剂厂家生产的校准品应具有完整的溯源链及互通性报告,且校准品的浓度建议包含不同的医学决定水平处的浓度;实验室则应使用具有溯源性的校准品进行校准,若使用第三方的校准品用于方法的校准,需评价和确认校准品的互通性,对于缺乏互通性的校准品其统一定值则不能用于其它方法。
综上所述,室间质量评价回报的结果包含了大量信息,只有认真分析、充分利用,才能有助于解决实际工作中存在的问题,并能指导临床实验室进行实验方法、检测仪器及试剂厂家的选择。
参考文献:
[1]张路,王薇,王治国.卫生部临床检验中心开展临床实验室室间质量评价活动满意度的调查[J].现代检验医学杂志,2016,31(3) :144-148.
[2]张秀明.浅析定量检验程序分析性能验证实验方案设计[J]. 中华检验医学杂志,2015,38(6):428-430.
[3]张晓慧,李光韬,张卓莉.C反应蛋白与超敏C反应蛋白的检测及其临床意义[J].中华临床免疫和变态反应杂志,2011,05(1):74-79.
[4]彭瑛,邓剑,邓正华,李林.超敏C反应蛋白与冠心病相关性分析[J].国际检验医学杂志,2010,31(5):456-457.
[5]孙玉艳.超敏C反应蛋白对新发心、脑血管事件预测价值的研究[J].中国综合临床,2012,28(5):557-560.
[6]孙莉,赵阳,李正. C-反应蛋白测定试剂(盒)技术评审规范要点概述[J].首都食品与医药,2015 (2):5-6.
[7]徐春芝,吴继明,王蕾,等. 室间质量评价不合格项目的实例分析及方法体会[J]. 中华检验医学杂志,2011,32(18):2113-2115.
