不同雷公藤制剂中6个成分的含量研究
2018-04-20祁爱蓉傅博刘小燕李顺民文善适郑平陈剑平
祁爱蓉 傅博 刘小燕 李顺民 文善适 郑平 陈剑平


摘 要:目的 建立測定雷公藤制剂中的6种成分(雷公藤甲素、雷公藤内酯酮、雷酚内酯、雷公藤次碱、雷公藤红素及雷公藤内酯甲)的高效液相色谱方法。方法 采用Agilent TC-C18柱(250 mm×4.6 mm,5 μm),以10 mmol/L乙酸铵水溶液-乙腈为流动相梯度洗脱,流速为0.75 ml/min,检测波长为225 nm,柱温为25 ℃。结果 6种成分的进样浓度为0.1~156.25 μg/ml范围内与峰面积积分值线性关系良好,平均回收率为98.5%(RSD=1.9%)、99.2%(RSD=1.9%)、99.5%(RSD=1.5%)、98.7%(RSD=1.2%)、98.8%(RSD=1.6%)、99.0%(RSD=1.7%)。结论 所建立的测定方法操作方便,重复性强,结果准确,可用于雷公藤及其相关产品的质量分析;不同雷公藤制剂中6个成分的含量存在差异。
关键词:雷公藤制剂;雷公藤化学成分;反相高效液相色谱法
中图分类号:R284.1 文献标识码:A DOI:10.3969/j.issn.1006-1959.2018.05.023
文章编号:1006-1959(2018)05-0070-04
Study on the Content of Six Components in Different Tripterygium Wilfordii Preparations
QI Ai-rong1,FU Bo1,LIU Xiao-yan1,LI Shun-min1,WEN Shan-shi2,ZHENG Ping3,
CHEN Jian-ping3
(1.4th College of Clinical Medicine,Guangzhou University of Traditional Chinese Medicine,Shenzhen 518033,Guangdong,China;
2.Nanao People's Hospital,Dapeng New District,Shenzhen 518121,Guangdong,China;
3.Key Laboratory of Traditional Chinese Medicine Preparations,Shenzhen Traditional Chinese Medicine Hospital,Shenzhen 518033,Guangdong,China)
Abstract:Objective To establish a high performance liquid chromatography method for the determination of 6 components in Tripterygium wilfordii(Triptolide,triptolide,lycopolide,Tripterygium,tripterin,and triptolide a).Methods A Agilent TC-C18 column of (250 mm×4.6 mm,5 μm)was used.The mobile phase gradient elution was 10 mmol/L ammonium acetate aqueous solution and acetonitrile.The flow rate was 0.75 ml/min,the detection wavelength was 225 nm,and the column temperature was 25 ℃.Results The injection concentration of the six components was 0.1~156.25 μg/ml and the peak area integral value was linear,the average recovery rate was 98.5%(RSD=1.9%),99.2%(RSD=1.9%),99.5%(RSD=1.5%),98.7%(RSD=1.2%),98.8%(RSD=1.6%),99.0%(RSD=1.7%).Conclusion The established method is convenient, reproducible and accurate.It can be used for the quality analysis of Tripterygium wilfordii and its related products,and the content of 6 components in different Tripterygium wilfordii preparations is different.
Key words:Tripterygium wilfordii preparation;Chemical constituents of Tripterygium wilfordii;Reversed phase high performance liquid chromatography
中药雷公藤(tripterygium wilfordii)属于卫矛科雷公藤属藤本植物,主要分布于中国东部及南部,具有抗炎、抑制免疫、抗肿瘤等作用,现广泛应用于治疗系统性红斑狼疮、类风湿性关节炎、肾病综合征和癌症等多种疾病[1,2]。目前雷公藤制剂是治疗慢性肾炎是最为有效的中成药之一,包括火把花根片、雷公藤多苷片、昆仙胶囊等。但雷公藤制剂投入临床使用以来,相关不良反应仍时有报道,主要存在于消化道系统、泌尿系统、生殖系统、神经系统、皮肤黏膜、血液系统,主要原因在于雷公藤所含的主要活性成分二萜类、生物碱类、三萜类在产生毒性的同时又发挥着药理作用,如雷公藤甲素是雷公藤中活性最高的环氧二萜内酯化合物,同时也是雷公藤引起毒副作用的主要成分[3,4]。此外雷公藤通常以单一成分作为提取指标,不能反映雷公藤提取物的整体情况,加上雷公藤提取工艺多样化,各工艺质量存在差异化,无法判定其科学性、合理性、可行性、优劣性。故存在着临床用药安全性的威胁。临床实践证明:上述单体成分相同但含量不同的雷公藤制剂在治疗作用及副作用发生率方面存在明显差异。为探讨其内在质量,确保临床疗效稳定可靠,本实验基于现有的研究基础上[5-8],采用高效液相色谱(HPLC)法测定雷公藤多苷片中6种成分即雷公藤甲素、雷公藤内酯酮、雷酚内酯、雷公藤次碱、雷公藤红素及雷公藤内酯甲的含量,为评价雷公藤制剂的质量提供参考手段。
1仪器与试药
1.1仪器 岛津LC-20AT高效液相色谱仪(上海纳锘仪器有限公司),HHS型电热恒温水浴锅(上海博迅实业有限公司),AUW220D电子天平(日本岛津公司),HKD1002VS型数控超声波清洗器(深圳市和科达超声设备有限公司),Aquelix 5实验室纯水机(美国默克密理博公司)。
1.2试药 雷公藤多苷片(江苏美通制药有限公司,批号为20160701,160401);昆明山海棠片(云南植物药业有限公司,批号为20150508-025,20160302);昆仙胶囊(广州白云山陈李济药厂有限公司,批号为D31001);雷公藤甲素(批号150713,纯度不少于98%)、雷公藤内酯酮(150805,纯度不少于98%)、雷酚内酯(150826,纯度不少于98%)、雷公藤次碱(150614,纯度不少于98%)、雷公藤红素(150627,纯度不少于98%)、雷公藤内酯甲(160107,纯度不少于98%)均购于四川省维克奇生物科技有限公司。甲醇、三氯甲烷、乙酸铵为分析纯,乙腈为色谱纯,水为超纯水。
2方法与结果
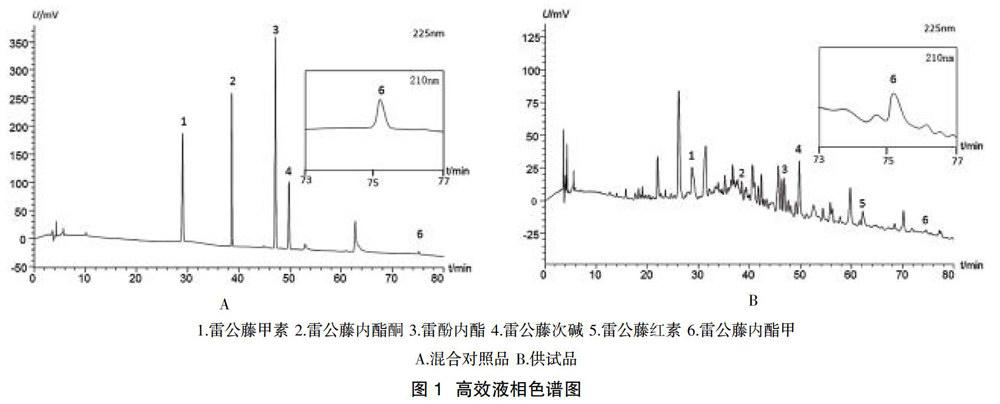
2.1色谱条件与系统适用性试验 色谱柱:Agilent TC-C18柱(250 mm×4.6 mm,5 μm);流动相:流动相A为10 mmol/L乙酸铵水溶液,流动相B为乙腈,梯度洗脱(0~15 min,90%A→65%A;15~22 min,65%A→65%A;22~30 min,65%A→45%A;30~35 min,45%A;35~40 min,45%A→40%A;40~70 min,40%A→15%A;70~75 min,15%A→5%A;75~80 min,5%A→90%A);流速0.75 ml/min;进样量20 μl;检测波长:225 nm;柱温:25 ℃。色譜图见图1。
2.2溶液制备
2.2.1对照品溶液 分别取雷公藤甲素、雷公藤内酯酮、雷酚内酯、雷公藤次碱、雷公藤红素、雷公藤内酯甲适量,精密称定,加甲醇溶解并稀释,制成质量浓度分别为1 mg/ml、1 mg/ml、1 mg/ml、5 mg/ml、1 mg/ml、1 mg/ml的单个对照品贮备液。
2.2.2供试品溶液 取样品适量,研细,精密称取药粉约0.15 g,置25 ml量瓶中,用氯仿溶解后定容。精密移取5 ml,加于硅胶层析柱(100~200目,6 g,内径为10~15 mm),用氯仿-甲醇(97∶3)洗脱3次,每次25 ml,收集洗脱液,蒸干,残渣加2 ml甲醇使溶解,即得。
2.3方法学考察
2.3.1线性关系考察 分别精密吸取以上对照品贮备液适量,混匀,加甲醇逐级稀释,分别制得质量浓度在0.09~156.5 μg/ml 6个浓度的对照品溶液,分别吸取20 μl注入液相色谱仪,记录峰面积,以对照品进样量(X,μg)为横坐标、峰面积积分值(Y)为纵坐标进行线性回归,得回归方程。结果表明,各成分在相应的线性范围内线性关系良好,见表1。
2.3.2精密度试验 精密吸取混合对照品溶液20 μl,连续进样6次,计算峰面积。结果雷公藤甲素峰面积RSD=0.87%(n=6);雷公藤内酯酮峰面积RSD=0.43%(n=6);雷酚内酯峰面积RSD=0.03%(n=6);雷公藤次碱峰面积RSD=0.08%(n=6);雷公藤红素峰面积RSD=0.35%(n=6);雷公藤内酯甲峰面积RSD=0.98%(n=6)。表明仪器精密度良好。
2.3.3稳定性试验 精密吸取同一供试品溶液,在室温下放置0 h、2 h、4 h、8 h、12 h、24 h后,分别进样20 μl,记录峰面积。结果:雷公藤甲素、雷公藤内酯酮、雷酚内酯、雷公藤次碱、雷公藤红素、雷公藤内酯甲的峰面积RSD值分别为1.2%、1.5%、1.7%、1.8%、1.4%、1.3%(n=6)。表明供试品溶液在24 h内稳定。
2.3.4重复性试验 称取同一批样品(批号:160401)6份,依法制备供试品溶液,按拟定色谱条件依次进样,记录峰面积。结果雷公藤甲素平均峰面积RSD=1.01%(n=6);雷公藤内酯酮平均峰面积RSD=1.72%(n=6);雷酚内酯平均峰面积RSD=0.69%(n=6);雷公藤次碱平均峰面积RSD=0.93%(n=6);雷公藤红素平均峰面积RSD=1.22%(n=6);雷公藤内酯甲平均峰面积RSD=1.77%(n=6)。表明本法重复性好。
2.3.5加样回收试验 取6份批号为160401的雷公藤多苷片约0.075 g,精密称定;分别精密加入与供试品中各成分相同含量的6个对照品,按2.2项下供试品溶液制备方法平行制备6份供试品溶液,按拟定色谱条件进行分析,计算回收率。结果见表2。
2.4样品含量测定 取市售临床常用的雷公藤产品,按拟订色谱条件测定样品中的6个成分的含量。结果见表3。
3讨论
本试验在流动相优化中选用乙腈为有机相(A)分离效果较好,保留时间适中,色谱信息丰富。同时发现在碱性条件下,可以更好的分离不同色谱峰,故为保护色谱柱选用低浓度的乙酸铵(10 mmol/ml)作为流动相(B)(0~15 min,10%B→35%B;15~22 min,35%B→35%B;22~30 min,35%B→55%B;30~35 min,55%B;35~40 min,55%B→60%B;40~70min,60%B→85%B;70~75 min,85%B→95%B;75~80 min,95%B→10%B)进行梯度洗脱。选用梯度洗脱的色谱条件,可更好的分离不同的色谱峰,使实验数据更为准确。实验中曾采用:①WondaSil-C18(4.6 mm×250mm,5 μm);②Sapphire-C18柱(4.6 mm×250 mm,5 μm);③Agilent TC-C18(4.6 mm×250 mm,5 μm)色譜柱进行比较,但实验图谱显示①和②的分离效果不好,后来选用Agilent TC-C18(4.6 mm×250 mm,5 μm),发现基线和柱压平稳,且测出来的色谱峰值、分离度等指标值均较为理想。雷公藤多苷的化学组成较为复杂,虽经上柱除杂等前处理,色谱分析所得图谱上仍显示样品液中众多化合物的存在,分离起来有一定的困难,故现有文献基本对其进行1个或2个组分的测定。同时,通过对样品前处理进行优化,以达到处理后样品较未处理样品,目标物没有减少,而且目标峰更为清晰。
雷公藤制剂在肾脏病治疗方面,疗效确切,作用途径多样化,在中医药防治肾脏病方面,临床优势明显,但其毒副作用也不容忽视,主要表现在消化、泌尿、生殖、造血系统及皮肤等多系统方面,可能引起多器官的损害,有效成份与毒性成分较难区别[9,10]。本次研究结果表明:不同厂家生产的雷公藤多苷提取物化学组成存在明显的差异。如:雷公藤红素和雷公藤甲素最高和最低含量之间相差10倍,其它组分的含量差异也较大。不同厂家的雷公藤制剂成分含量有一定差异,同一厂家不同批号的雷公藤制剂之间成分含量也有一定差异。分析其原因,除与雷公藤药材本身的来源有关外,也与制作工艺、条件、剂型的不同有必然的关系。但如何质控仍在探索阶段[11]。
雷公藤甲素是该类药物的主要有效成分,但毒性也很大,近年来有关其结构修饰等减毒研究为其热点,如雷公藤甲素脂质体、雷公藤红素固体脂质纳米粒、雷公藤红素缓释滴丸[12-14]等单体成分缓释制剂等。以雷公藤甲素为例,正在进行Ⅰ期临床试验的新药(5R)-5-羟基雷公藤甲素就是以雷公藤甲素为母体并修饰而成,其具有显著的体内抗炎作用和免疫抑制活性,未见受试者体内有药物累积现象,减毒增效作用显著[15]。本试验对临床上常用的雷公藤多苷片、昆明山海棠片、昆仙胶囊,采用HPLC方法测定其主要成分:雷公藤甲素、雷公藤内酯酮、雷酚内酯、雷公藤次碱、雷公藤红素、雷公藤内酯甲的含量,为下一步研究其不同单体组合对体外培养的卵巢细胞的生殖毒性作用,并在配伍中药辨证治疗后分析其毒副作用的情况,从体内和体外实验阐述其增效减毒的效应和作用机理奠定基础。
参考文献:
[1]Ma B,Hu T,Li P,et al.Phylogeographic and phylogenetic analysis for Tripterygium species delimitation[J].Ecology&Evolution,2017,7(20):8612-8623.
[2]Li XJ,Jiang ZZ,Zhang LY.Triptolide:progress on research in pharmacodynamics and toxicology[J].Journal of Ethnopharmacology,2014,155(1):67-79.
[3]昊霞,王忠震,林兵,等.雷公藤毒性作用机制研究进展[J].中国医院药学杂志,2015,35(16):1519-1523.
[4]张世应.雷公藤的毒性研究[J].湖北中医杂志,2015,37(3):71-73.
[5]郭建龙,刘利民,江振洲.原料雷公藤多苷的化学成分研究[J].现代中药研究与实践,2011,2(4):41-44.
[6]高丽,聂中标,岳晓华.不同产地雷公藤药材中雷公藤甲素含量测定[J].山西中医,2012,28(8):42.
[7]Luo XL,Shao Q,Qu HB,et al.Simple method for determination of five terpenoids from different parts of Tripterygium wilfordii and its preparations by HPLC coupled with evaporative light scattering detection[J].J Sep Sci,2007,30(9):1284-1291.
[8]国家药典委员会.2015版中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2015:751-754.
[9]李进,王均宁,张成博.雷公藤的毒性考证与预防分析研究[J].辽宁中医药大学学报,2013,15(8):74-77.
[10]姚金成,刘颖,胡领,等.雷公藤甲素对人肝细胞L-02氧化损伤的初步研究[J].中南药学,2012,10(8):581-584.
[11]杨迎光,张渝渝,翁代群,等.UPLC-MS测定不同产地及不同部位昆明山海棠中6种活性成分含量[J].天然产物研究与开发,2016,28(3):382-387.
[12]王淑娟.雷公藤甲素脂质体的制备及质量的初步研究[D].扬州大学,2010.
[13]王敏,谢鹏.雷公藤红素固体脂质纳米粒的制备及理化性质[J].中国医院药学杂志,2014,34(1):46-49.
[14]夏海建,张振海,贾晓斌.雷公藤红素缓释滴丸的研究[J].中草药,2013,44(7):834-838.
[15]赵舜波,黄海华,陈笑艳,等.微生物转化法从雷公藤甲素合成雷腾舒[J].中国新药杂志,2012(3):303-309.
