壳寡糖对小鼠生长性能、血清免疫和抗氧化指标的影响
2018-04-20张南南李兰兰张晓昀闻正顺邹晓庭
张南南 李兰兰 张晓昀 闻正顺 邹晓庭*
(1.浙江大学饲料科学研究所,农业部动物营养与饲料科学重点实验室,杭州 310058;2.浙江海洋大学食品与医药学院,舟山 316022)
抗生素的禁用和有效疫苗的缺乏,在一定程度上促进了益生菌、益生元、免疫增强剂、植物提取物等的应用[1]。壳寡糖(chitosan oligosaccharide,COS)属于益生元的一种,它作为自然界中唯一一种带正电荷的碱性氨基多糖[2],具有较好的溶解度和中性pH下的低黏度,且在胃肠道内不易被分解,可被直接吸收入血发挥作用[3],引起了研究人员的普遍关注。最近的研究多集中于报道COS的多种生物学效应,包括促生长、抗感染、抗肿瘤、降血压、降低胆固醇等。研究表明,饲粮中添加COS可提高断奶仔猪的肠道绒毛高度并降低隐窝深度,进而提高营养物质的消化率,对仔猪的生长性能有积极的改善作用[4];进一步研究表明,COS可提高吉富罗非鱼幼鱼血清中溶菌酶和超氧化物歧化酶(SOD)活性以及抗嗜水气单胞菌感染的能力,进而对生长性能和免疫性能具有一定的调节作用[5];大量体外研究表明COS可刺激巨噬细胞分泌肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)等细胞因子[6-8],进而增强巨噬细胞的活性,COS是否可引起正常动物分泌细胞因子的研究报道不多;此外,在哺乳动物中COS的抗氧化研究多集中于妊娠后期母猪阶段和仔猪阶段等易发生应激的时间段[9],在普通时间段的研究较少。因此,本试验拟研究在正常生理状态下COS对小鼠生长性能、免疫功能和抗氧化性能的改善作用,以期为利用COS生产功能性食品提供理论依据。
1 材料与方法
1.1 试验材料
试验所用COS由浙江维丰生物科技有限公司提供,纯度为99%,分子质量为1 000 u,脱乙酰度为85%~90%,聚合度为5~10,溶于水,为黄色粉末状固体,生产批号为KG-1503029。
1.2 试验设计与饲养管理
试验动物为4周龄、体重14~16 g的雄性无特定病原体(SPF)级ICR小鼠,购买于上海莱克斯生物科技有限公司,生产许可证号为SCXK(沪)2002-0002。65只小鼠随机分笼适应1周后,选取体重均一、健康的60只小鼠,随机分为6组,每组10只。试验设置1个对照组和5个试验组,壳寡糖剂量分别为0、0.2、0.4、0.6、0.8和1.0 g/kg BW,采用灌胃的方式给药,灌胃时以生理盐水(NS)为溶剂将壳寡糖配成0、10、20、30、40和50 mg/mL浓度的溶液,按0.02 mL/g BW给予相应剂量组动物灌胃,每天定时灌胃。每周称量1次体重,根据体重的大小来控制灌胃体积,灌胃42 d,试验小鼠饲养于浙江大学试验动物中心半封闭通风系统环境,控制环境温度在(24±1) ℃,湿度为(50±10)%,自由清洁饮水、采食(小鼠基础饲粮由浙江大学试验动物中心提供),每周换2次垫料,小鼠饲养试验过程按照国家《实验动物管理条例》执行。
1.3 测定指标与方法
1.3.1 体重测定
在试验第1天、第8天、第15天、第22天、第29天、第36天和第43天清晨对每只小鼠分别进行空腹称重,分析体重变化。
1.3.2 免疫器官指数的测定
试验结束时,禁食24 h(自由饮水)后称重,每组10只小鼠全部摘眼球取血收集血液后,断头脱臼处死,剥离出胸腺和脾脏,称重并计算免疫器官指数。
胸腺指数(mg/g)=胸腺重(mg)/体重(g);
脾脏指数(mg/g)=脾脏重(mg)/体重(g)。
1.3.3 血清免疫指标的测定
收集的每组10只小鼠的血液,室温静置2 h,3 000 r/min离心10 min,收集血清,用以测定免疫球蛋白含量、细胞因子水平和抗氧化酶活性,每组10个重复。
1.3.3.1 血清免疫球蛋白含量的测定
血清免疫球蛋白A(IgA)、免疫球蛋白G(IgG)和免疫球蛋白M(IgM)含量均采用试剂盒测定,试剂盒购自于武汉博士德生物工程有限公司,并按其说明书进行试剂配制和指标测定。
1.3.3.2 血清细胞因子水平的测定
血清IL-6、白细胞介素-10(IL-10)、IL-1β、转化生长因子-β(TGF-β)和TNF-α水平均采用试剂盒测定,试剂盒购自于武汉博士德生物工程有限公司,并按其说明书进行试剂配制和指标测定。
1.3.3.3 血清抗氧化酶活性的测定
血清SOD、髓过氧化物酶(MPO)、过氧化物酶(POD)和碱性磷酸酶(AKP)活性均采用试剂盒测定,试剂盒购自于南京建成生物工程研究所,并按其说明书进行试剂配制和指标测定。
1.4 数据分析
试验数据使用SPSS 20.0统计软件分析试验数据,采用单因素方差分析(one-way ANOVA)比较各组间的统计学差异,差异显著时采用Duncan氏法进行多重比较,测定结果以平均值±标准误(mean±SE)表示,P<0.05表示差异显著。
2 结 果
2.1 各组小鼠体重变化
在连续灌胃COS 42 d中,各组小鼠均未出现任何异常反应和死亡现象。试验结束时,灌胃不同剂量的COS对小鼠生长性能未产生显著影响(P>0.05)(表1),对照组、0.2 g/kg BW COS组、0.4 g/kg BW COS组、0.6 g/kg BW COS组、0.8 g/kg BW COS组和1.0 g/kg BW COS组小鼠体重分别增长了6.12、5.51、5.29、5.15、6.44、5.21 g,其中0.8 g/kg BW COS组小鼠体增重较对照组提高了5.23%,其他试验组体增重较对照组略有降低。
2.2 COS对小鼠免疫器官指数的影响
从表2中可以看出,0.6 g/kg BW COS组胸腺指数较对照组显著提高(P<0.05),提高了32.87%,其他剂量组胸腺指数较对照组有所提高,但未至显著水平(P>0.05);灌胃不同剂量的COS对小鼠的脾脏指数无显著影响(P>0.05)。

表1 试验期间各组小鼠体重变化
同行数据肩标不同小写字母表示差异显著(P<0.05),无字母或相同字母表示差异不显著(P>0.05)。表2同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), while with no letter or the same letter superscripts mean no significant difference (P>0.05). The same as Table 2.
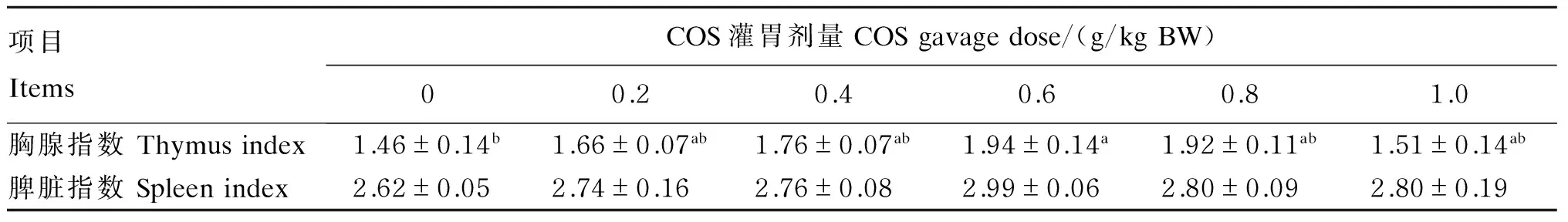
表2 COS对小鼠免疫器官指数的影响
2.3 COS对小鼠血清免疫球蛋白含量的影响
从表3中可以看出,随COS灌胃剂量的增加,血清IgA、IgG和IgM含量总体呈现先升高后降低的趋势,且都在灌胃剂量为0.6g/kg BW时达到最大值。其中,0.6 g/kg BW COS组血清IgA、IgG和IgM含量较对照组分别提高了12.14%(P<0.05)、6.89%(P>0.05)和20.69%(P<0.05)。

表3 COS对小鼠血清免疫球蛋白含量的影响
同列数据肩标不同小写字母表示差异显著(P<0.05),无字母或相同字母表示差异不显著(P>0.05)。下表同。
In the same column, values with different small letter superscripts mean significant difference (P<0.05), while with no letter or the same letter superscripts mean no significant difference (P>0.05). The same as below.
2.4 COS对小鼠血清细胞因子水平的影响
从表4中可以看出,灌胃不同剂量的COS对小鼠血清IL-6、IL-10、IL-1β、TGF-β和TNF-α水平均无显著影响(P>0.05),但各试验组血清IL-6、IL-1β、TGF-β水平与对照组相比总体呈现下降的趋势,且均在0.6 g/kg BW COS组有最小值,较对照组分别降低了6.92%、20.27%和9.34%(P>0.05);血清IL-10水平较对照组整体呈现上升趋势,且在0.4 g/kg BW COS组有最大值,较对照组提高了34.00%(P>0.05)。

表4 COS对小鼠血清细胞因子水平的影响
2.5 COS对小鼠血清抗氧化酶活性的影响
从表5中可以看出,灌胃COS具有提高小鼠血清SOD和POD活性的趋势,其中SOD活性在0.4 g/kg BW COS组最高,与对照组相比提高了11.31%(P>0.05),POD活性在0.8 g/kg BW COS组最高,与对照组相比提高了45.08%(P<0.05);随COS灌胃剂量的增加,血清MPO和AKP活性呈现先升高后降低的趋势,其中MPO活性在0.6 g/kg BW COS组最高,与对照组相比提高了27.61%(P<0.05),AKP活性在0.4 g/kg BW COS组最高,较对照组提高了21.30%(P>0.05)。

表5 COS对小鼠血清抗氧化酶活性的影响
3 讨 论
3.1 COS对小鼠生长性能的影响
有关COS对动物生长性能的影响报道不尽相同,一些研究者认为在基础饲粮中添加COS对仔猪的生长性能具有促进作用[10-11],但乔丽红等[12]认为COS对断奶仔猪的生长性能无显著影响,产生这些差异的原因可能是因为不同试验所选用的COS的分子质量和溶解度不同,也可能是因为动物种类及生活环境不同。从上述讨论得知,COS的促生长效果不稳定,受饲养环境卫生条件的影响较大。同时,在COS具有促生长作用的研究中发现,随着COS剂量的增加,生长性能并不是呈线性增加,而是有一个最佳值,随后呈现下降趋势[13]。本试验结果显示,试验前期(第1~22天),低灌胃剂量COS组(0.2 g/kg BW COS组)小鼠体重增加量高于对照组,中、高灌胃剂量COS组(0.6 g/kg BW COS组、0.8 g/kg BW COS组和1.0 g/kg BW COS组)体重增加量低于对照组。这表明,在0.6~0.8 g/kg BW的灌胃剂量范围内,COS对小鼠的生长性能具有提高的趋势,当COS灌胃剂量至1.0 g/kg BW时,生长性能反而具有降低的趋势,这与上述研究结果类似。可见,COS的添加剂量有一个适宜的范围,过量添加可能会对动物的生长性能产生不利影响,目前对COS副作用的研究尚未见报道,具体原因有待于进一步的研究。目前研究认为,哺乳动物对碳水化合物的消化主要限于以α-1,4糖苷键连接而成的多糖,对其他形式的糖苷键不分解或分解能力弱,而COS是由β-1,4-糖苷键连接而成的,在哺乳动物小肠内不能被消化酶分解,直接被小肠吸收,过量添加会导致动物不良性腹泻,对生长产生负效应[14]。试验后期(第22~43天),中、高灌胃剂量组(0.6 g/kg BW COS组、0.8 g/kg BW COS组)小鼠体重增加量高于对照组及低灌胃剂量组(0.2 g/kg BW COS组、0.4 g/kg BW COS组),可能是试验后期小鼠对COS产生了适应性,具体原因有待进一步研究。
3.2 COS对小鼠免疫器官指数的影响
免疫器官包括中枢免疫器官和外周免疫器官两部分,中枢免疫器官包括骨髓和胸腺,外周免疫器官包括淋巴结、脾脏和黏膜相关淋巴组织等。胸腺是T细胞分化和发育成熟的主要场所,其作用是诱导淋巴细胞产生成熟的免疫细胞进行免疫应答;脾脏是机体最大的外周免疫器官,是机体进行免疫应答的主要场所[15]。胸腺指数和脾脏指数可作为基本的免疫指标直接反映机体的免疫功能[16-17]。目前认为COS对免疫器官发育存在着一定作用,本试验结果显示灌胃0.6 g/kg BW COS可显著提高胸腺指数,灌胃0.6~0.8 g/kg BW COS对脾脏指数具有提高趋势。邓阳勇等[18]研究表明芦荟多糖可使胸腺皮质增厚,皮质和髓质分解明显,淋巴细胞更密集。推测本次试验中0.6 g/kg BW COS组小鼠胸腺指数显著提高的原因可能是添加COS可促进小鼠胸腺中淋巴细胞的发育,提高胸腺中淋巴细胞数目,进而促进免疫器官发育,提高免疫机能。
3.3 COS对小鼠血清免疫球蛋白含量的影响
体外研究表明COS可以刺激巨噬细胞分泌多功能的细胞因子,这些细胞因子刺激T细胞和B细胞的分化,并促进免疫球蛋白的产生[19]。本试验结果显示灌胃0.6 g/kg BW COS可显著提高小鼠血清中IgA和IgM含量,推测其原因可能是COS的活性基团直接刺激了小鼠的免疫应答反应[20]。此外,免疫球蛋白是化学结构与抗体相似或具有抗体活性的一类糖蛋白,其结构中的大部分糖是以聚糖的形式结合形成的,聚糖有2种类型,N-乙酰基半乳糖和N-乙酰基葡萄糖,COS可以提供N-乙酰基葡萄糖的残基,并可以结合到具有免疫活性的存在于细胞表面的残基受体,进而提高免疫能力;此外,COS携带的正电荷可与T淋巴细胞及巨噬细胞表面的负电荷相互吸引,激发免疫细胞向B细胞发出指令,产生免疫球蛋白[21]。另有研究表明,在动物胃肠道内寄居的乳酸杆菌、双歧杆菌等有益菌可以分泌打开β-1,4糖苷键的酶,进而利用COS[4]。双歧杆菌和乳酸菌利用COS可产生琥珀酸、乳酸、短链脂肪酸,降低肠道的pH,产生酸性的肠道环境,有利于乳酸菌的增殖[22]。肠道内的有害菌如沙门氏菌、大肠杆菌等由于不能分泌分解COS的酶类而不能利用COS,COS可通过携带正电荷的游离氨基与细菌细胞壁或者细胞表面所携带的阴离子物质相结合,阻止营养物质的进入或使细胞变形,进而干扰其正常的物质代谢,发挥抑制有害菌增殖的作用[23]。因此,COS也可能是通过促进有益菌的生长和抑制有害菌的生长来提高免疫机能。
3.4 COS对小鼠血清细胞因子水平的影响
作为免疫促进剂的COS可与淋巴细胞或吞噬细胞的特异性受体结合,通过与细胞因子的协同作用,有效刺激机体的免疫应答[24],此过程中释放的细胞因子包括白细胞介素类、干扰素类等。有关COS对细胞因子水平的影响报道不一致,Deng等[25]研究表明COS可刺激巨噬细胞释放IL-1β、IL-6和TNF-α,从而提高肉鸡的免疫力;而Walsh等[26]在断奶仔猪上的研究发现COS并没有影响IL-6、IL-10、TNF-α等的表达。本试验结果表明试验组小鼠血清中IL-6、IL-1β、TGF-β水平与对照组相比总体呈现下降的趋势,血清IL-10水平较对照组整体呈现上升趋势。COS分子结构中含有的氨基可被机体的免疫系统识别,结合到巨噬细胞表面的受体,刺激巨噬细胞释放细胞因子,同时可引起T细胞表面的白细胞介素-2(IL-2)受体的表达,加速T细胞成熟而释放IL-2,其与受体结合后进一步加速了T细胞的成熟和分化,刺激血液循环中抗体的产生[21]。贾培媛等[27]研究发现COS可显著增加小鼠脾脏中CD8+T淋巴细胞的比例,而CD8+T淋巴细胞在IL-10产生的过程中发挥重要作用[28],IL-10在体内是免疫系统的中央调节器[29],它的缺失不仅会造成小鼠结肠性炎症,而且还可导致上皮渗透性炎症[30]。本试验中,灌胃不同剂量COS后小鼠血清IL-10水平整体呈现上升趋势,不会引发炎症反应。IL-10作为重要的抗炎性细胞因子,能过抑制活化的T细胞的产生过量的IL-6、IL-1β等炎性细胞因子,从而防止过度免疫应答对机体造成的伤害[31]。本试验显示,与对照组相比,试验组小鼠血清IL-6、IL-1β水平整体呈现下降趋势,不会引发过度的免疫反应,同时这也与试验组小鼠血清IL-10水平的升高相吻合。本研究结果与Walsh等[26]的研究结果相符,与Deng等[25]的结果不同,因猪和小鼠同属于哺乳动物,而鸡属于鸟类,因而推测COS在哺乳动物和鸟类上产生的效果可能不同。
3.5 COS对小鼠血清中抗氧化酶活性的影响
4 结 论
在本试验条件下,灌胃不同剂量COS对小鼠的生长性能、脾脏指数以及血清IgG含量、细胞因子水平、SOD和AKP活性均无显著影响,但灌胃剂量为0.6~0.8 g/kg BW时,小鼠脾脏指数有增加的趋势,且胸腺指数以及血清IgA和IgM含量、MPO和POD活性均有不同程度提高。
参考文献:
[1] ELALA N M A,RAGAA N M.Eubiotic effect of a dietary acidifier (potassium diformate) on the health status of culturedOreochromisniloticus[J].Journal of Advanced Research,2015,6(4):621-629.
[2] WAN J,JIANG F,XU Q S,et al.New insights into the role of chitosan oligosaccharide in enhancing growth performance,antioxidant capacity,immunity and intestinal development of weaned pigs[J].RSC Advances,2017,7(16):9669-9679.
[3] 谭利伟,管昶,周鲁宁,等.壳寡糖在动物营养中的研究与应用[J].中国畜牧杂志,2016,52(17):91-97.
[4] ZHOU T X,CHO J H,KIM I H.Effects of supplementation of chito-oligosaccharide on the growth performance,nutrient digestibility,blood characteristics and appearance of diarrhea in weanling pigs[J].Livestock Science,2012,144(3):263-268.
[5] 孙立威,文华,蒋明,等.壳寡糖对吉富罗非鱼幼鱼生长性能、非特异性免疫及血液学指标的影响[J].广东海洋大学学报,2011,31(3):43-49.
[6] YOON H J,MOON M E,IM S Y,et al.Chitosan oligosaccharide (COS) inhibits LPS-induced inflammatory effects in RAW 264.7 macrophage cells[J].Biochemical & Biophysical Research Communications,2007,358(3):954-959.
[7] MA P,LIU H T,WEI P,et al.Chitosan oligosaccharides inhibit LPS-induced over-expression of IL-6 and TNF-α in RAW264.7 macrophage cells through blockade of mitogen-activated protein kinase (MAPK) and PI3K/Akt signaling pathways[J].Carbohydrate Polymers,2011,84(4):1391-1398.
[8] 麻攀,于炜婷,魏鹏,等.壳寡糖作用于巨噬细胞的机制初探[J].天然产物研究与开发,2012(5):660-662.
[9] 汤峻,黄皓源,周乐礼,等.壳寡糖对妊娠后期母猪免疫功能和仔猪初生重的影响[J].安徽农业科学,2016,44(6):174-176.
[10] 张玲,陈代文,杨继文,等.壳寡糖对环磷酰胺应激仔猪生产性能和免疫功能的影响[J].中国畜牧杂志,2013,49(17):58-62.
[11] 李阳,常文环,张姝,等.饲粮添加壳寡糖和干酪乳杆菌对肉鸡生长性能、肌肉品质及抗氧化性能的影响[J].动物营养学报,2016,28(5):1450-1461.
[12] 乔丽红,赵颖,倪红玉,等.低聚壳聚糖对断奶仔猪血清生化指标、抗氧化性能和粪便微生物的影响[J].粮食与饲料工业,2013(3):47-50.
[13] 徐小龙,周鲁宁,张斌,等.壳寡糖替代抗生素对肉仔鸡生长性能及免疫功能的影响[J].饲料广角,2016(17):33-37.
[14] 黄钦成,申光荣,谭北平,等.饲料中添加壳寡糖和/或霉菌毒素吸附剂对凡纳滨对虾生长性能、非特异性免疫力及抗病力的影响[J].动物营养学报,2017,29(11):4036-4047.
[15] 侯改凤,李瑞,黄兴国.寡糖的免疫调节作用及其在动物生产中的应用[J].中国饲料,2015(4):28-30.
[16] CHEN B,LIU L F,XU H Y,et al.Effectiveness of immune therapy combined with chemotherapy on the immune function and recurrence rate of cervical cancer[J].Experimental and Therapeutic Medicine,2015,9(3):1063-1067.
[17] YU G P,CHEN G Q,HUANG B,et al.Effect of early enteral nutrition on postoperative nutritional status and immune function in elderly patients with esophageal cancer or cardiac cancer[J].Chinese Journal of Cancer Research,2013,25(3):299-305.
[18] 邓阳勇,伍参荣,杨旭丽,等.芦荟多糖对衰老小鼠胸腺组织结构的影响[J].中南医学科学杂志,2011,39(6):626-628.
[19] DANG Y B,LI S,WANG W X,et al.The effects of chitosan oligosaccharide on the activation of murine spleen CD11c+dendritic cells via Toll-like receptor 4[J].Carbohydrate Polymers,2011,83(3):1075-1081.
[20] 崔健,康鹏天.壳寡糖的生理功能及在水产养殖中的作用[J].甘肃畜牧兽医,2015,45(4):21-24.
[21] 陈虹,臧素敏,侯伟革.不同浓度壳寡糖对蛋用鹌鹑免疫功能的影响[J].中国畜牧兽医,2013,40(1):108-111.
[22] 占秀安,胡彩虹,许梓荣.果寡糖对肉鸡生长、肠道菌群和肠形态的影响[J].中国兽医学报,2003,23(2):196-198.
[23] 孙忠保,阎宏,马永军.寡糖在动物生产中的应用[J].农业科学研究,2004,25(4):80-84.
[24] 孟晓,王纪亭,万文菊,等.低分子质量壳寡糖对蛋鸡生产性能、蛋品质、血清生化指标、盲肠微生物数量及脾脏白细胞介素-2、肿瘤坏死因子-α基因表达的影响[J].动物营养学报,2017,29(5):1590-1599.
[25] DENG X Z,LI X J,LIU P,et al.Effect of chito-oligosaccharide supplementation on immunity in broiler chickens[J].Asian-Australasian Journal of Animal Sciences,2008,21(11):1651-1658.
[26] WALSH A M,SWEENEY T,BAHAR B,et al.The effect of chitooligosaccharide supplementation on intestinal morphology,selected microbial populations,volatile fatty acid concentrations and immune gene expression in the weaned pig[J].Animal,2012,6(10):1620-1626.
[27] 贾培媛,李海霞,巫亚俊,等.壳寡糖对猪蓝耳病灭活疫苗的佐剂活性研究[C]//中国酶工程与糖生物工程学术研讨会论文摘要集.镇江:中国微生物学会酶工程专业委员会,2015:66-68.
[28] GELFANOVA V,LAI Y,GELFANOV V,et al.Modulation of cytokine responses of murine CD8+αβ intestinal intraepithelial lymphocytes by IL-4 and IL-12[J].Journal of Biomedical Science,1999,6(4):269-276.
[29] BERG D J,ZHANG J,WEINSTOCK J V,et al.Rapid development of colitis in NSAID-treated IL-10-deficient mice[J].Gastroenterology,2002,123(5):1527-1542.
[30] BERG D J,DAVIDSON N,KÜHN R,et al.Enterocolitis and colon cancer in interleukin-10-deficient mice are associated with aberrant cytokine production and CD4+TH1-like responses[J].Journal of Clinical Investigation,1996,98(4):1010-1020.
[31] SUN X Y,YANG H,NOSE K,et al.Decline in intestinal mucosalIL-10 expression and decreased intestinal barrier function in a mouse model of total parenteral nutrition[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2008,294(1):G139-G147.
[32] XIE W M,XU P X,LIU Q.Antioxidant activity of water-soluble chitosan derivatives[J].Bioorganic & Medicinal Chemistry Letters,2001,11(13):1699-1701.
[33] 王振伟,申森.超声波辅助酶法制备壳寡糖及抗氧化活性研究[J].中国食品添加剂,2014(4):70-75.
[34] 张吉,刘洪涛,李秀英,等.壳寡糖对自由基的清除及对N9小胶质细胞的保护作用[J].食品科学,2010,31(7):81-85.
[35] JOODI G,ANSARI N,KHODAGHOLI F.Chitooligosaccharide-mediated neuroprotection is associated with modulation ofHspsexpression and reduction of MAPK phosphorylation[J].International Journal of Biological Macromolecules,2011,48(5):726-735.
[36] 孙立威,文华,蒋明,等.壳寡糖对吉富罗非鱼幼鱼生长性能、非特异性免疫及血液学指标的影响[J].广东海洋大学学报,2011,31(3):43-49.
[37] 李振达,陈小娥,廖智,等.壳寡糖对三疣梭子蟹免疫力的影响[J].浙江海洋学院学报(自然科学版),2011,30(1):27-32.
[38] 李桂峰,钱沛锋,孙际佳,等.维生素C对胡子鲶血清免疫相关酶活性的影响[J].大连水产学院报,2004,19(4):301-305.
[39] 钟佳,刘进辉,肖定福,等.壳寡糖及其衍生物的抗氧化活性[J].动物医学进展,2015,36(7):118-121.
[40] FENG T,DU Y M,LI J,et al.Antioxidant activity of half N-acetylated water-soluble chitosaninvitro[J].European Food Research and Technology,2007,225(1):133-138.
