丁酸梭菌抑制脂多糖致急性应激大鼠肠道损伤的效果研究
2018-04-20李孝辉徐子伟
吴 杰 邓 波 李孝辉 徐子伟*
(1.浙江省农业科学院,畜牧兽医研究所,杭州 310021;2.浙江省农业科学院,植物保护与微生物研究所,杭州 310021)
畜禽生产中由于断奶等应激会引起肠道炎症及肠道屏障功能损伤,造成动物腹泻、消化功能紊乱。益生菌是一类对宿主有益的活性微生物,其能够定植于宿主体内,改善宿主肠道微生态平衡,发挥有益作用。在动物生产中益生菌常作为生长促进剂,可帮助畜禽建立和完善肠道微生物区系,提高饲料报酬,改善机体免疫力,提高畜产品质量,是一种较有潜力的抗生素替代品[1-2]。益生菌种类有很多,不同益生菌的功效有所差异。丁酸梭菌(Clostridiumbutyricum)是一种厌氧的革兰氏阳性芽孢杆菌,相较于其他益生菌,其主要以内生孢子形式存在,易贮藏且具有较好的抗逆性。研究表明丁酸梭菌能产生多种消化酶、维生素、丁酸等营养物质,具有较好的肠道营养功能[3]。此外,丁酸梭菌的代谢产物含有丁酸、乙酸、氢气等,能够降低肠道炎症,加速肠道损伤修复[4-5],对断奶引起的腹泻、肠道损伤、肠道菌群紊乱有较好的应用前景,已于2009年7月被农业部批准为新一代微生态饲料添加剂。目前丁酸梭菌在生产上的使用都是预防性添加在饲粮中,但预防性饲喂丁酸梭菌对健康机体急性应激致损时的应用效果目前研究的还不多,预防性添加能否帮助健康宿主缓解急性应激损伤还值得进一步研究确认。因此,本试验以大鼠为研究对象,研究预防性饲喂丁酸梭菌对健康大鼠生长性能及脂多糖(lipopolysaccharide,LPS)致急性应激大鼠肠道结构、肠道二糖酶活性及肠道炎症的修复效果,以期为预防性添加丁酸梭菌缓解动物急性应激损伤研究提供理论依据。
1 材料与方法
1.1 试验动物与材料
丁酸梭菌制剂由浙江省农业科学院植物微生物研究所提供,活菌数为4×109CFU/g。
体重为120 g左右的雄性SD试验大鼠36只,购自浙江省医学科学院;基础饲粮为维持鼠粮,购自浙江省医学科学院,其组成及营养水平见表1。
1.2 试验设计与饲养管理
将36只SD大鼠按体重随机分为对照组、LPS组、LPS+丁酸梭菌组,每4只大鼠1笼,每组3笼。室温控制在25 ℃,每3 d更换1次垫料,保持鼠笼清洁干燥,所有大鼠均自由饮水、自由采食。预饲3 d后开始试验,对照组和LPS组大鼠饲喂基础饲粮,LPS+丁酸梭菌组大鼠在基础饲粮基础上添加0.05%的丁酸梭菌,每5 d称重并记录采食量。试验第40天,所有大鼠称重后,LPS组与LPS+丁酸梭菌组大鼠按照4 mg/kg BW的剂量腹腔注射1 mL左右浓度为1.5 mg/mL的LPS,对照组腹腔注射1 mL生理盐水,3 h后处死所有大鼠并采集小肠。
1.3 样品采集与检测指标
各组大鼠断颈处死,剖开腹腔,分离肠道组织,剪取十二指肠、空肠、回肠组织各2份。一份肠道组织用4%多聚甲醛固定过夜后,石蜡包埋,连续切片,苏木精-伊红(HE)染色,封固,拍照(Olympus DP-71拍摄系统),采用Image-ProPlus 5.0系统采集、测量并统计绒毛高度、隐窝深度、黏膜厚度、上皮淋巴细胞(intraepithelial lymphocyte,IEL)数,计算绒隐比(V/C,绒隐比=绒毛高度/隐窝深度)。上皮淋巴细胞计数方法如下:每个标本观察3~6个绒毛,计数每个绒毛上皮层内每100个柱状上皮细胞间淋巴细胞数,再换算成百分比(%),最后取平均值代表该标本的上皮淋巴细胞数。另一份肠道组织置于离心管中,液氮速冻后-80 ℃保存待测。

表1 基础饲粮组成及营养水平(风干基础)
1)维生素预混料为每千克饲粮提供The vitamin premix provided the following per kg of the diet:VA 4 000 IU,VD 1 000 IU,VE 75 IU,VK 0.9 mg,VB15 mg,VB26 mg,VB330 mg,VB515 mg,VB66 mg,胆碱 choline 1 000 mg,叶酸 folic acid 2 mg,生物素 biotin 0.2 mg,VB120.025 mg。
2)矿物质预混料为每千克饲粮提供The mineral premix provided the following per kg of the diet:Ca 5 000 mg,P 3 000 mg,K 3 600 mg,Na 1 039 mg,Mg 513 mg,Fe 45 mg,Zn 38 mg,Mn 10 mg,Cu 6 mg,I 0.2 mg,Cr 1 mg,S 300 mg,Cl 1 631 mg。
肠道总蛋白含量以及髓过氧化物酶(myeloperoxidase,MPO)、蔗糖酶、乳糖酶、麦芽糖酶活性采用比色法测定,白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)含量采用酶联免疫吸附法测定,上述指标测定所用试剂盒均购自南京建成生物工程研究所。
1.4 数据处理
试验数据均以平均值±标准差表示,采用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),并用LSD法多重比较检测组间的差异显著性。以P<0.05为差异显著。
2 结果与分析
2.1 丁酸梭菌对健康大鼠生长性能的影响
由表2可知,所有大鼠体重变化基本一致,丁酸梭菌对大鼠平均日采食量、平均日增重及料重比均无显著影响(P>0.05)。

表2 丁酸梭菌对健康大鼠生长性能的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),相同或者无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant different (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2 丁酸梭菌对LPS处理大鼠肠道结构及上皮淋巴细胞数的影响
由表3可知,与对照组相比,LPS组大鼠注射LPS后十二指肠隐窝深度显著增加(P<0.05),绒隐比显著降低(P<0.05),但空肠、回肠黏膜绒毛结构未见显著破坏(P>0.05)。与LPS组相比,预防性饲喂丁酸梭菌可显著降低十二指肠隐窝深度(P<0.05),但并未抑制LPS对十二指肠绒隐比的降低,LPS+丁酸梭菌组十二指肠绒隐比与对照组相比仍显著降低(P<0.05)。与对照组相比,LPS组大鼠注射LPS会显著降低空肠黏膜厚度以及空肠、回肠上皮淋巴细胞数(P<0.05)。与LPS组相比,预防性饲喂丁酸梭菌能有效抑制LPS对黏膜厚度及上皮淋巴细胞数的影响,在空肠中的效果最为明显,LPS+丁酸梭菌组空肠黏膜厚度及上皮淋巴细胞数较LPS组显著提高(P<0.05),且与对照组差异不显著(P>0.05)。
2.3 丁酸梭菌对LPS处理大鼠肠道蔗糖酶、乳糖酶、麦芽糖酶活性的影响
由表4可知,与对照组相比,LPS组大鼠注射LPS后十二指肠蔗糖酶和空肠麦芽糖酶活性显著降低(P<0.05),其他肠段各二糖酶活性有降低趋势,但差异均不显著(P>0.05)。与LPS组相比,预防性饲喂丁酸梭菌能抑制LPS对大鼠十二指肠蔗糖酶活性的降低,使得LPS+丁酸梭菌组与对照组相比差异不显著(P>0.05)。
2.4 丁酸梭菌对LPS处理大鼠肠道炎症的影响
由表5可知,与对照组相比,LPS组大鼠注射LPS后空肠和回肠MPO活性及IL-6、TNF-α含量显著增加(P<0.05)。与LPS组相比,预防性饲喂丁酸梭菌能有效抑制空肠、回肠的炎症,LPS+丁酸梭菌组空肠与回肠MPO活性以及回肠IL-6、TNF-α含量均显著降低(P<0.05)。此外,LPS+丁酸梭菌组回肠IL-6、TNF-α含量虽较LPS组无显著降低(P>0.05),但较对照组也未见显著增加(P>0.05)。
3 讨 论
3.1 丁酸梭菌对健康大鼠生长性能的影响
益生菌在宿主肠道内能调节肠道菌群,并产生许多有益物质,对宿主体重起到积极作用。以高脂饲粮饲喂大鼠,在饲粮中添加乳酸杆菌能通过调节肠道菌群结构,并提高血液瘦素水平来降低大鼠体重,抑制肥胖[6]。而在动物生产中,益生菌常作为生长促进剂来缓解外界环境或饲料应激对动物造成的影响。Meng等[7]发现添加枯草芽孢杆菌和丁酸梭菌能有效提高生长肥育猪全期的平均日增重及料重比,同时总能和氮的表观消化率也显著提高。Cao等[8]发现在肉鸡饲粮中添加2.5×107或5.0×107CFU/kg丁酸梭菌均能显著提高其21及42日龄的平均日增重及料重比,并且效果与添加抗生素组一致。然而益生菌对体重的影
响并不总是效果显著,Kuo等[9]在为期3~4周的试验中发现,益生菌对健康小鼠体重及采食量的影响十分有限,结果与本研究一致。本研究发现,饲喂丁酸梭菌对健康大鼠包括平均日增重、料重比在内的生长指标均无显著影响,这可能和动物健康状态及生活环境有关,本试验使用的大鼠正处生长阶段,其正常生长速度较快,并且鼠笼环境清洁,卫生状况良好,这些都可能掩盖了益生菌对动物机体生长促进作用。

表3 丁酸梭菌对LPS处理大鼠肠道结构及上皮淋巴细胞数的影响
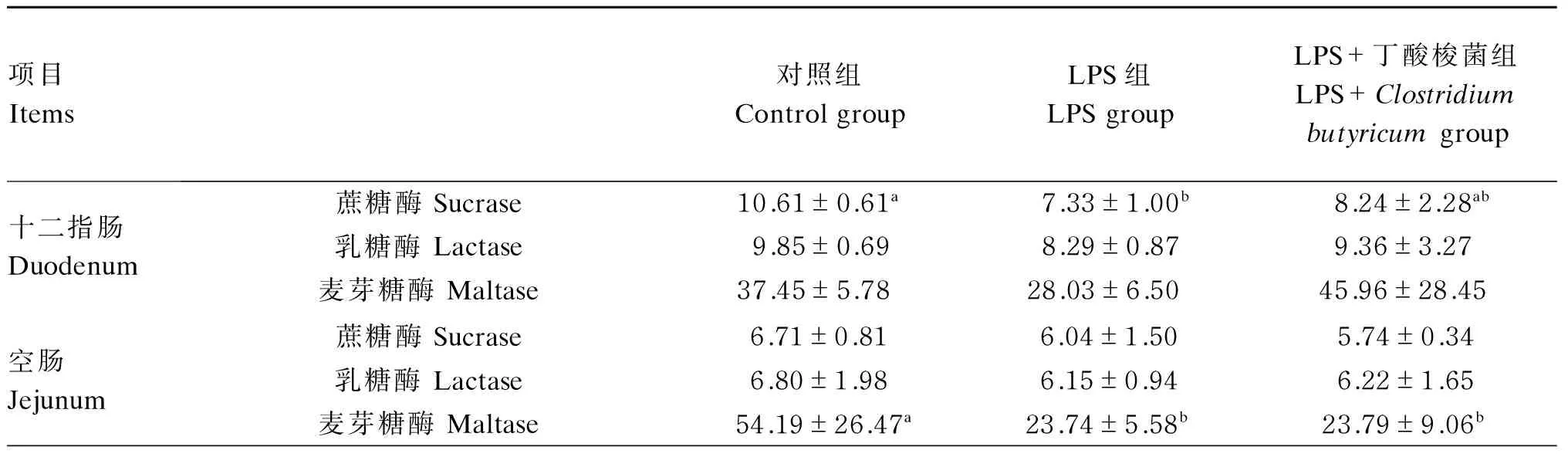
表4 丁酸梭菌对LPS处理大鼠肠道二糖酶活性的影响

续表4项目Items对照组ControlgroupLPS组LPSgroupLPS+丁酸梭菌组LPS+Clostridiumbutyricumgroup回肠Ileum蔗糖酶Sucrase5.33±0.134.64±1.035.85±0.86乳糖酶Lactase5.41±2.844.87±1.776.70±0.60麦芽糖酶Maltase14.87±0.4115.27±5.4715.63±3.07

表5 丁酸梭菌对LPS处理大鼠肠道MPO、IL-6、TNF-α含量的影响
3.2 丁酸梭菌对LPS处理大鼠肠道结构及上皮淋巴细胞数的影响
肠道的绒毛高度、隐窝深度、绒隐比及黏膜厚度是反映肠道发育状况及营养吸收的重要指标。王腾浩[10]研究表明,丁酸梭菌ZJU-F1可以抑制断奶应激对十二指肠、空肠和回肠绒毛高度及绒隐比的降低,在光镜下,饲喂丁酸梭菌的仔猪微绒毛结构更加整齐致密。刘亭婷[11]也得到相似结果,在肉鸡饲粮中添加1 000 mg/kg丁酸梭菌能显著提高十二指肠、空肠、回肠的绒毛高度及绒隐比,增加空肠黏膜厚度。本研究发现,饲喂丁酸梭菌能有效降低十二指肠隐窝深度,增加空肠黏膜厚度,结果与之前研究一致。丁酸梭菌的这种肠道营养功能可能与其产生的代谢产物有关。丁酸梭菌在发酵过程中能产生糖苷酶、纤维素酶、维生素、丁酸等,这些物质特别是丁酸能为肠道黏膜细胞供能,加速其增殖、成熟[3,12]。
上皮淋巴细胞分布在肠道黏膜上皮细胞间,是肠道的第1道免疫屏障,它直接参与肠黏膜免疫反应,抵抗肠道病原体入侵,并且能通过伪足与上皮细胞接触,加速上皮细胞的再生[13],上皮淋巴细胞数的增加有助于提高机体的免疫能力[14]。本研究发现,在大鼠饲粮中添加丁酸梭菌40 d后,LPS+丁酸梭菌组空肠上皮淋巴细胞数较LPS组显著提高,达到对照组水平,结果与之前研究结果相一致。Rieger等[15]在断奶仔猪中发现饲喂粪球杆菌能显著提高上皮内顶端及核位置处的上皮淋巴细胞数。Bai等[16]在肉鸡的试验中也发现,饲粮中添加0.1%或0.2%的益生菌能显著提高21及42日龄时肠道上皮淋巴细胞数,特别是T淋巴细胞数。以上结果表明饲喂丁酸梭菌等益生菌能提高动物机体肠道黏膜免疫水平,特别是细胞免疫水平。
3.3 丁酸梭菌对LPS处理大鼠肠道二糖酶活性的影响
动物主要的能量来源于碳水化合物,而碳水化合物的消化吸收主要依赖于小肠中的二糖酶,二糖酶活性可用于衡量肠道黏膜上皮细胞发育情况[17]。窦茂鑫[18]研究表明,饲粮中添加6×106CFU/g的乳酸杆菌能有效缓解LPS刺激导致的空肠、回肠乳糖酶活性的降低。在鞭毛虫感染的小鼠中也发现,在鞭毛虫感染前或感染同时给予乳酸杆菌能显著提高肠道蔗糖和乳糖酶活性[19]。本研究发现,饲喂丁酸梭菌对大鼠肠道蔗糖、乳糖酶活性有提高的趋势。
3.4 丁酸梭菌对LPS处理大鼠肠道炎症的影响
TNF-α、IL-6是重要的炎症介质,参与机体的免疫应答,其含量的增加会引起其他炎症因子瀑布式的释放而引发细胞损伤[20-21]。MPO是一种由中性粒细胞、巨噬细胞分泌的血红素蛋白酶,其活性的高低可以反映肠道炎症浸润程度。本研究发现,预防性饲喂丁酸梭菌能有效降低空肠与回肠MPO活性及空肠IL-6、TNF-α含量,回肠IL-6、TNF-α含量较对照组也未见显著降低,结果表明丁酸梭菌能有效抑制LPS引起的肠道炎症,结果与前人研究相一致。Zhang等[22]在结肠炎模型大鼠中发现,每日灌胃2 mL丁酸梭菌(2.3×1011CFU/L)21 d能有效降低血液中白细胞介素-23(IL-23)和TNF-α含量,抑制唑酮引起的结肠炎症。庞敏等[23]也发现灌服丁酸梭菌8 d能有效抑制腹泻大鼠血清中内毒素及D-乳酸的含量,降低回肠白细胞介素-10(IL-10)mRNA的表达。丁酸梭菌的这种抗炎效果主要是通过其代谢产物丁酸和氢来发挥作用的。研究表明丁酸能够促进上皮细胞增殖,加速损伤修复,降低炎症[4],而氢最近也被发现能够作为一种抗炎气体来缓解机体氧化应激,治疗多种炎症疾病[5,24]。此外,丁酸梭菌还能通过Toll样受体2(TLR2)/髓样分化因子88(MyD88)信号通路刺激炎症部位附近的巨噬细胞聚集,并激活IL-10的释放,抑制炎性因子的生成[25]。
4 结 论
① 在本试验条件下,饲粮中添加0.05%丁酸梭菌对健康大鼠生长性能无显著影响。
② 大鼠饲粮中预防性添加丁酸梭菌能抑制LPS对肠道蔗糖酶活性的降低,缓解LPS对肠道绒毛高度和隐窝深度的影响,提高肠道免疫功能,降低肠道炎症。
参考文献:
[1] ROSS G R,GUSILS C,OLISZEWSKI R,et al.Effects of probiotic administration in swine[J].Journal of Bioscience & Bioengineering,2010,109(6):545-549.
[2] GIANG H H,VIET T Q,OGLE B,et al.Growth performance,digestibility,gut environment and health status in weaned piglets fed a diet supplemented with a complex of lactic acid bacteria alone or in combination withBacillussubtilisandSaccharomycesboulardii[J].Livestock Science,2012,143(2/3):132-141.
[3] ARAKI Y,ANDOH A,FUJIYAMA Y,et al.Oral administration of a product derived fromClostridiumbutyricumin rats[J].International Journal of Molecular Medicine,2002,9(1):53-57.
[4] OKAMOTO T,SASAKI M,TSUJIKAWA T,et al.Preventive efficacy of butyrate enemas and oral administration ofClostridiumbutyricumM588 in dextran sodium sulfate-induced colitis in rats[J].Journal of Gastroenterology,2000,35(5):341-346.
[5] BUCHHOLZ B M,KACZOROWSKI D J,SUGIMOTO R,et al.Hydrogen inhalation ameliorates oxidative stress in transplantation induced intestinal graft injury[J].American Journal of Transplantation,2008,8(10):2015-2024.
[6] KANG J H,YUN S I,PARK M H,et al.Anti-obesity effect ofLactobacillusgasseriBNR17 in high-sucrose diet-induced obese mice[J].PLoS One,2012,8(1):e54617.
[7] MENG Q W,YAN L,AO X,et al.Influence of probiotics in different energy and nutrient density diets on growth performance,nutrient digestibility,meat quality,and blood characteristics in growing-finishing pigs[J].Journal of Animal Science,2010,88(10):3320-3326.
[8] CAO G T,XIAO Y P,YANG C M,et al.Effects ofClostridiumbutyricumon growth performance,nitrogen metabolism,intestinal morphology and cecal microflora in broiler chickens[J].Journal of Animal and Veterinary Advances,2012,11(15):2665-2671.
[9] KUO S M,MERHIGE P M,HAGEY L R.The effect of dietary prebiotics and probiotics on body weight,large intestine indices,and fecal bile acid profile in wild type andIL10-/-mice[J].PLoS One,2013,8(3):e60270.
[10] 王腾浩.新型丁酸梭菌筛选及其对断奶仔猪生长性能和肠道功能影响的研究[D].博士学位论文.杭州:浙江大学,2015.
[11] 刘婷婷.丁酸梭菌对肉鸡生产性能、小肠形态、免疫功能和肠道微生物的影响[D].硕士学位论文.杭州:浙江大学,2011.
[12] ICHIKAWA H,KUROIWA T,INAGAKI A,et al.Probiotic bacteria stimulate gut epithelial cell proliferation in rat[J].Digestive Diseases and Sciences,1999,44(10):2119-2123.
[13] ASAI K I,KOMINE Y,KOZUTSUMI T,et al.Predominant subpopulations of T lymphocytes in the mammary gland secretions during lactation and intraepithelial T lymphocytes in the intestine of dairy cows[J].Veterinary Immunology and Immunopathology,2000,73(3/4):233-240.
[14] 杨倩,张小飞.淋巴细胞在黏膜上皮中的运动[J].解剖学杂志,2005,28(2):145-148.
[15] RIEGER J,JANCZYK P,HÜNIGEN H,et al.Intraepithelial lymphocyte numbers and histomorphological parameters in the porcine gut afterEnterococcusfaeciumNCIMB 10415 feeding in aSalmonellatyphimuriumchallenge[J].Veterinary Immunology & Immunopathology,2015,164(1/2):40-50.
[16] BAI S P,WU A M,DING X M,et al.Effects of probiotic-supplemented diets on growth performance and intestinal immune characteristics of broiler chickens[J].Poultry Science,2013,92(3):663-670.
[17] LEE S H,YU S Y,NAKAYAMA J,et al.Core2O-glycan structure is essential for the cell surface expression of sucrase isomaltase and dipeptidyl peptidase-Ⅳ during intestinal cell differentiation[J].The Journal of Biological Chemisty,2010,285(48):37683-37692.
[18] 窦茂鑫.不同类型益生菌制剂对脂多糖刺激仔猪肠道吸收和屏障功能的影响[D].硕士学位论文.武汉:武汉轻工大学,2013.
[19] GOYAL N,RISHI P,SHUKLA G.LactobacillusrhamnosusGG antagonizesGiardiaintestinalisinduced oxidative stress and intestinal disaccharidases:an experimental study[J].World Journal of Microbiology and Biotechnology,2013,29(6):1049-1057.
[20] CHEN J W,CHEN Y H,LIN S J.Long-term exposure to oxidized low-density lipoprotein enhances tumor necrosis factor-α-stimulated endothelial adhesiveness of monocytes by activating superoxide generation and redox-sensitive pathways[J].Free Radical Biology and Medicine,2006,40(5):817-826.
[21] RAVAGLIA G,FORTI P,MAIOLI F,et al.Associations of the-174 G/C interleukin-6 gene promoter polymorphism with serum interleukin 6 and mortality in the elderly[J].Biogerontology,2005,6(6):415-423.
[22] ZHANG H Q,DING T T,ZHAO J S,et al.Therapeutic effects ofClostridiumbutyricumon experimental colitis induced by oxazolone in rats[J].World Journal of Gastroenterology,2009,15(15):1821-1828.
[23] 庞敏,卢庆萍,朱丽媛,等.益生菌抵御大鼠急性腹泻的效果及其对肠道黏膜屏障的影响[J].动物营养学报,2016,28(5):1462-1470.
[24] CARDINAL J S,ZHAN J H,WANG Y N,et al.Oral hydrogen water prevents chronic allograft nephropathy in rats[J].Kidney International,2010,77(2):101-109.
[25] HAYASHI A,SATO T,KAMADA N,et al.A single strain ofClostridiumbutyricuminduces intestinal IL-10-producing macrophages to suppress acute experimental colitis in mice[J].Cell Host & Microbe,2013,13(6):711-722.
