饲粮粗蛋白质水平对断奶仔猪肝脏氨基酸代谢酶活性及转运载体mRNA表达的影响
2018-04-20张相鑫唐志如甄吉福许庆庆孙志洪
张相鑫 陈 澄 唐志如 甄吉福 许庆庆 孙志洪*
(1.西南大学生物饲料与分子营养实验室,重庆 400715;2.西南大学动物科技学院,重庆 400715)
近年来,随着集约化程度的提高,养殖业产生的氮污染越来越严重。我国每年生猪养殖所带来的氮排放量在1 800 t左右。因此,提高猪对蛋白质的利用效率,减少氮排放量,具有重要的科学和社会意义。目前,低蛋白质饲粮是降低猪氮排放量的通用技术。研究表明,降低1%的猪饲粮粗蛋白质(crude protein,CP)水平可减少8%左右的氮排放量[1]。在补充必需氨基酸的情况下,饲粮CP水平可以降低2%~4%而不影响猪的生长发育[2]。课题组前期研究发现,降低饲粮CP水平,仅平衡重要的必需氨基酸(EAA)[赖氨酸(Lys)、蛋氨酸(Met)、色氨酸(Trp)和苏氨酸(Thr)]会显著增加EAA在肝脏组织中的消耗量[3]。本试验拟研究饲粮CP水平对断奶仔猪肝脏氨基酸代谢酶活性及转运载体mRNA表达的影响,为阐明低蛋白质饲粮增加EAA在猪肝脏中的消耗量、减少氮排放的机制及如何提高断奶仔猪肝脏氨基酸代谢转化效率提供科学依据。
1 材料与方法
1.1 试验设计与试验饲粮
选用28日龄、体重[(7.0±0.5) kg]相近、健康的“杜×长×大”杂交断奶仔猪54头(公母各占1/2),随机分为3组[20% CP组(对照组)、17%CP组和14% CP组],每组18个重复,每个重复1头猪。17%和14% CP组添加Lys、Met、Thr和Trp,使之水平与对照组一致。基础饲粮参照NRC(2012)进行配制,试验饲粮组成及营养水平见表1。
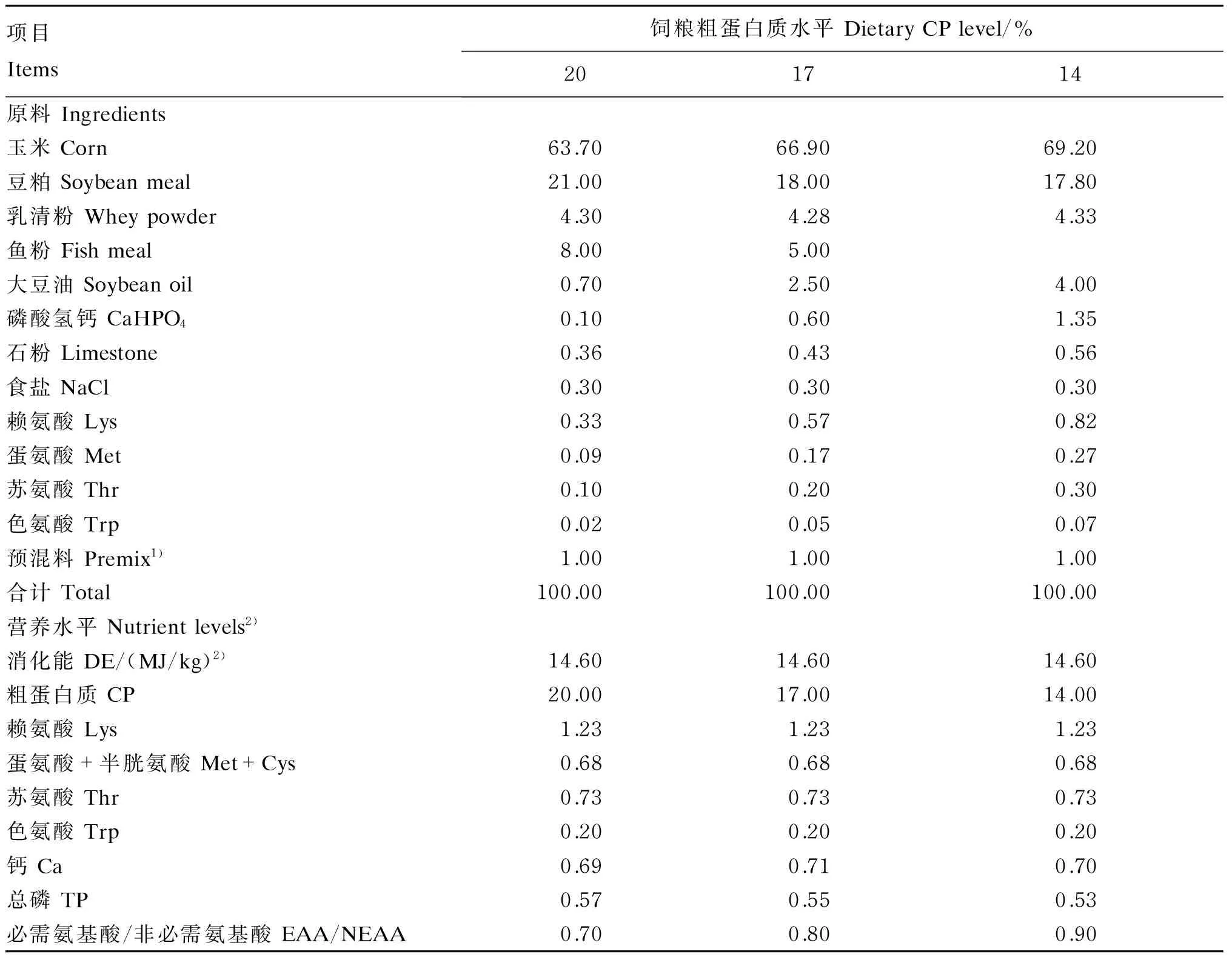
表1 试验饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供The premix provided the following per kg of diets:VA 10 500 IU,VD 4 500 IU,VE 5.4 IU,VK 0.9 mg,VB64.6 mg,VB120.016 mg,生物素 biotin 0.05 mg,叶酸 folic acid 0.29 mg,尼克酸 nicotinic acid 29.2 mg,泛酸 pantothenic acid 9.5 mg,胆碱 choline 0.45 g,核黄素 riboflavin 3.2 mg,硫胺素 thiamine 1.0 mg,Zn (as zinc sulfate) 86 mg,Fe (as ferrous sulfate) 97 mg,Mn (as manganese sulfate) 3.3 mg,Cu (as copper sulfate) 5.3 mg,I (as potassium iodide) 0.14 mg,Se (as sodium selenite) 0.265 mg。
2)消化能为计算值,其余为实测值。DE was a calculated value, while the others were measured values.
1.2 饲养管理
试验在西南大学动物养殖基地进行。预试期7 d,正试期45 d。试验仔猪置于不锈钢笼(1.50 m×0.68 m×0.75 m)中进行饲养,每笼1头。养殖房温度控制在(25±1) ℃,试验仔猪均自由采食、饮水。每天于08:00、18:00进行饲喂。试验期间保持圈内清洁、干燥。
1.3 样品采集
试验期间,利用四分法采集各组饲粮3次,混合后粉碎过40目筛,常温保存。参照《饲料分析及饲料质量检测技术》[4]检测饲粮的干物质、CP、钙、磷、粗纤维和氨基酸等的含量。
于正试期的第10、25和45天,从每组挑选与平均体重最为接近的6头仔猪进行屠宰。采集肝脏样品,液氮冷冻后于-80 ℃保存。
1.4 检测指标
1.4.1 肝脏氨基酸代谢酶活性
称取0.6~0.9 g肝脏组织,放入预先添加0.9%冷藏生理盐水的10 mL离心管中,肝脏重量与生理盐水体积比为1∶9,然后置于冰上匀浆。匀浆结束后在3 000 r/min、4 ℃条件下离心10 min,吸取上清液于-20 ℃保存,待测各种氨基酸代谢酶的活性。
比色法测定肝脏组织中谷丙转氨酶(glutamic-pyruvic transaminase,GPT)(C009-2)、谷草转氨酶(glutamic-oxalacetic transaminase,GOT)(C010-2)、谷氨酰胺合成酶(glutamine synthetase,GS)(A047)及谷氨酸脱氢酶(glutamic acid dehydrogenase,GDH)(A125)的活性,上述指标测定所用
试剂盒均购自南京建成生物工程研究所,测定方法严格根据说明书进行。
1.4.2 肝脏氨基酸转运载体mRNA表达
1.4.2.1 RNA提取及cDNA反转录
取-80 ℃保存的肝脏组织置于冰上,用已灭菌的剪刀将肝脏组织剪细,倒入液氮充分研磨(防止肝脏组织升温失活),待研磨均匀后将粉末状肝脏装入离心管内。用Total RNA Extractor(上海生物工程有限公司)提取肝脏组织RNA,已提取的肝脏组织RNA用MMLV First Strand cDNA Synthesis Kit(上海生物工程有限公司)进行反转录得到cDNA。
1.4.2.2 引物设计
采用Primer Premier 5.0软件进行引物设计,由上海生物工程有限公司合成。肝脏氨基酸转运载体可溶性载体6家族成员15(solute carrier family 6 member 15,SLC6A15)、可溶性载体6家族成员20(SLC6A20)、可溶性载体36家族成员1(SLC36A1)、可溶性载体38家族成员2(SLC38A2)及内参基因甘油醛-3-磷酸脱氢酶(GAPDH)的引物序列见表2。

表2 目的基因和内参基因的引物序列
1.4.2.3 荧光定量PCR
荧光定量PCR反应体系为50 μL,其中包括Hotstart Fluo-PCR mix 24 μL,上下游引物各2 μL(25 μmol/L),cDNA 2 μL,ddH2O 20 μL。荧光定量PCR反应条件:94 ℃预变性4 min,94 ℃变性30 s,60~63 ℃退火30 s(根据引物最适温度而定),72 ℃延伸30 s,共35个循环。反应试剂均购自上海生物工程有限公司。采用比较Ct值法进行相对定量表达差异的计算,目的基因的相对表达量=2-△△Ct(循环阈值,cycle threshold),△△Ct=(Ct目的基因-Ct内参基因)试验组-(Ct目的基因-Ct内参基因)对照组,2-△△Ct表示试验组目的基因的表达量相对于对照组的变化倍数。
1.5 数据统计分析
试验原始数据用Excel 2007进行整理,再使用SAS 8.2软件进行单因素方差分析(one-way ANOVA),LSD法进行多重比较,结果以“平均值±标准误”表示。P<0.05为差异显著。
2 结 果
2.1 饲粮CP水平对断奶仔猪肝脏氨基酸代谢酶活性的影响
由图1可知,试验第10天时,14%和17% CP
组断奶仔猪的肝脏GOT活性显著低于对照组(P<0.05);第25天时,14% CP组的肝脏GOT活性显著低于其他2组(P<0.05)。第25天时,14%和17% CP组的肝脏GPT活性显著低于对照组(P<0.05);第45天时,14% CP组的肝脏GPT活性显著低于其他2组(P<0.05)。试验期第10和45天时,14% CP组的肝脏GS活性显著低于其他2组(P<0.05);第25天时,14% CP组的肝脏GS活性显著低于对照组(P<0.05)。第25天时,14%和17% CP组的肝脏GDH活性显著低于对照组(P<0.05)。

图1 饲粮CP水平对断奶仔猪肝脏氨基酸代谢酶活性的影响
2.2 断奶仔猪肝脏氨基酸转运载体mRNA表达
2.2.1 荧光定量PCR扩增曲线和溶解曲线分析
由图2可知,在GAPDH、SLC6A15、SLC6A20、SLC36A1及SLC38A2的扩增过程中,基线平稳,说明产生干扰的信号小。此外,扩增中设计的非模板对照(NTC)为平稳直线,说明试验过程中溶液没有污染和引物二聚体出现。
由图3可知,在GAPDH、SLC6A15、SLC6A20、SLC36A1及SLC38A2的溶解曲线中均显示出1个单一尖锐峰,说明扩增过程中没有产生非特异性产物,引物特异性较好。
2.2.2 饲粮CP水平对断奶仔猪肝脏氨基酸转运载体mRNA表达的影响
由表3可知,试验第25和45天时,14% CP组断奶仔猪的肝脏SLC6A15的mRNA相对表达量显著低于其他2组(P<0.05);第25天时,14%和17% CP组的肝脏SLC36A1的mRNA相对表达量显著低于对照组(P<0.05),14% CP组的肝脏SLC38A2的mRNA相对表达量显著低于对照组(P<0.05);第45天时,14%和17% CP组的肝脏SLC6A20和SLC38A2的mRNA相对表达量显著低于对照组(P<0.05)。
图2 荧光定量PCR扩增曲线
图3 荧光定量PCR溶解曲线
3 讨 论
3.1 饲粮CP水平对断奶仔猪肝脏氨基酸代谢酶活性的影响
本试验结果显示,断奶仔猪肝脏GOT和GPT活性随饲粮CP水平的升高而增加。GOT又称天门冬氨酸氨基转移酶,可以催化α-酮戊二酸(α-KG)和天冬氨酸(Asp)形成谷氨酸(Glu)和草酰乙酸。GPT又名谷氨酸转氨酶,可以催化α-KG和丙氨酸(Ala)形成Glu与丙酮酸。GOT和GPT是氨基酸代谢转化过程中的重要酶,且在肝脏内活性较高。GOT和GPT主要存在于细胞内,当组织细胞受到损害时,GOT和GPT就会通过细胞流入血液,因此GOT和GPT是检验肝脏功能的一个重要指标[5]。有关饲粮CP水平对猪肝脏GOT和GPT活性影响的报道结果并不一致。罗钧秋[6]研究表明,当蛋白质营养供应不足时,会导致猪肝脏合成蛋白质的能力受到损伤,导致血浆GOT和GPT活性显著增加。罗洪明[7]报道认为,随饲粮CP水平的增加,仔猪血浆GOT和GPT活性呈先增加后下降再增加的趋势。从以上研究报道可以
看出,判定CP水平对GOT和GPT活性的影响,需要明确饲粮CP水平处于何种状态(正常、过营养、缺乏),处于不同状态降低或增加相同水平的CP对机体GOT和GPT活性的影响是不同的。本研究表明,降低饲粮CP水平可能会减少仔猪肝脏中Glu的合成量。
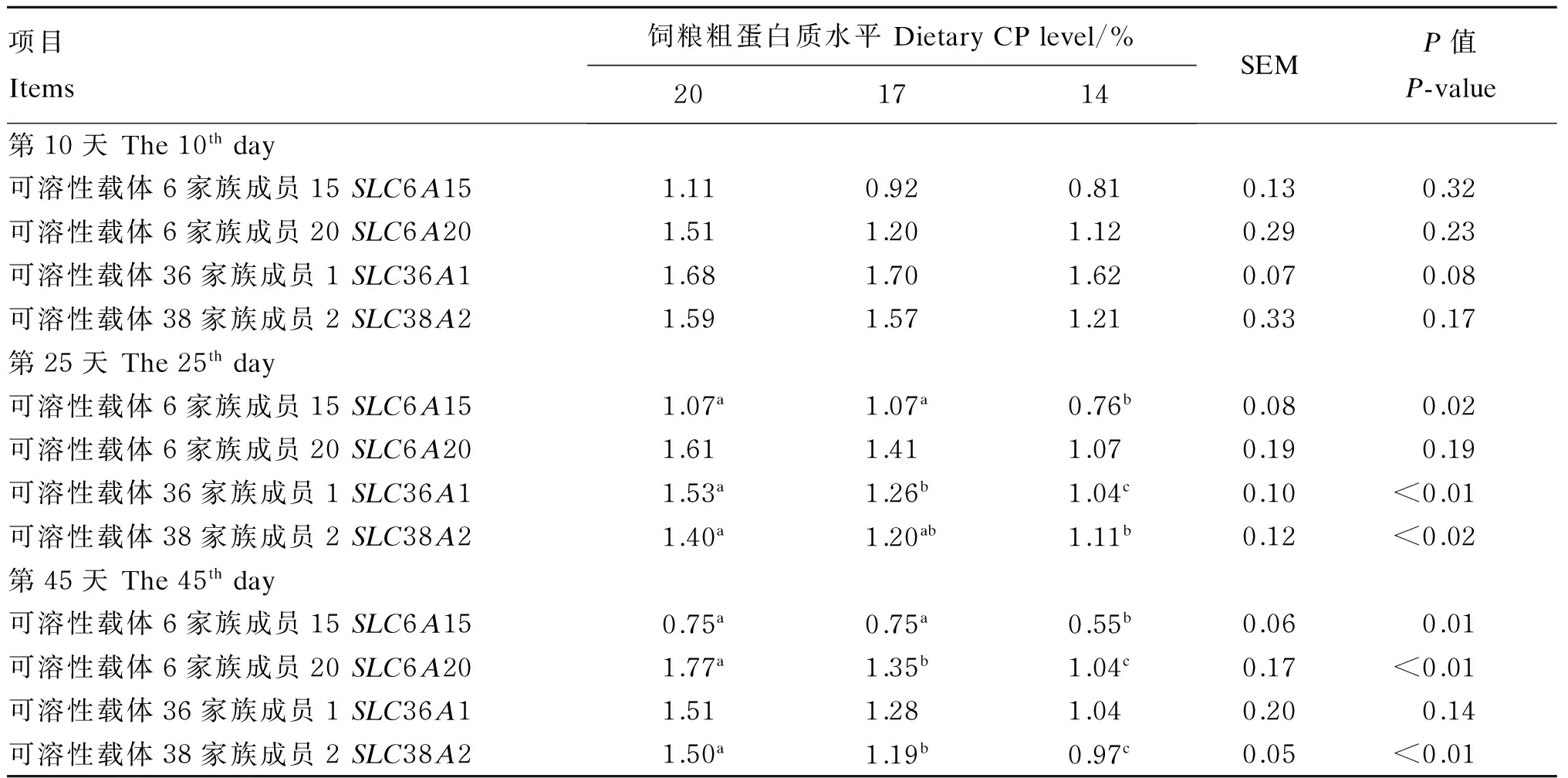
表3 饲粮CP水平对断奶仔猪肝脏氨基酸转运载体mRNA表达的影响
同行数据肩标不同小写字母表示差异显著(P<0.05)。
In the same row, values with different small letter superscripts mean significant difference (P<0.05).
本研究显示,降低饲粮CP水平会降低断奶仔猪肝脏GS和GDH活性。GS是参与氨代谢的一种关键酶,存在于所有生物体内,催化L-Glu转化为谷氨酰胺(Gln)[8]。GS在机体内具有重要的作用,不仅能够参与组织间氮的运输,降解体内高浓度的氨,而且还能够维持机体的酸碱平衡。GDH广泛存在于肝脏组织中,在氨基酸氧化脱氨基反应过程中具有重要作用。一般情况下,GDH可催化α-亚氨基戊二酸合成Glu。此外,在氨基酸脱氨基反应过程中,GDH能够和转氨酶形成Gln和天冬酰胺,并转化为尿素[9]。罗钧秋[6]研究报道,饲粮不同氨基酸组成对猪血浆GDH活性的影响不显著,结合本试验结果(降低饲粮CP水平会降低肝脏GDH和GS活性)可以推测,饲粮氨基酸的数量对肝脏GDH和GS活性具有重要影响。
3.2 饲粮CP水平对断奶仔猪肝脏氨基酸转运载体mRNA表达的影响
本研究结果显示,所检测的4种氨基酸转运载体的mRNA相对表达量均在不同程度上随饲粮CP水平的降低而降低。SLC6A15是可溶性载体6家族(solute carrier family 6,SLC6)的成员之一,是一种结合Na+和Cl-的中性氨基酸转运载体。Uhl等[10]于1992年发现了SLC6A15,并依据其在SLC6的作用,将其命名为SLC6A15、BoAT2、SBAT1或V7-3。Takanaga等[11]研究证实,SLC6A15可以调节脯氨酸(Pro)、Met、亮氨酸(Leu)、缬氨酸(Val)和异亮氨酸(Ile)的代谢转化。Hägglund等[12]研究发现,SLC6A15可以改变Leu的浓度,从而调节机体器官内的能量代谢。Drgonova等[13]研究表明,敲除小鼠的SLC6A15基因导致Leu和Pro摄取量分别下降40%和15%。Hägglund等[14]研究发现,SLC6A15的mRNA表达主要在大脑,在肌肉、肠道、肝脏和眼睛中也能检测到部分SLC6A15的mRNA表达。
SLC6A20又名SIT1,是一种结合Na+和Cl-的氨基酸转运载体。SLC6A20主要分布于哺乳动物的肠道和肾脏中,是Pro代谢过程中的重要成分,其通过结合Glu、精氨酸(Arg)和其他氨基酸而影响机体的糖稳态和能量稳态[15-16]。研究发现,SLC6A20在肾脏中可调节Ⅱ型糖尿病[17]。此外,亚氨基甘氨酸尿症与SLC6A20的突变也存在一定的联系[18]。由于SLC6A20发现的比较晚,目前关于其在肝脏中的调节机制报道较少。
SLC36A1又名PAT1,是一种编码质子结合氨基酸的转运载体,其主要分布于肠道和肾脏中,在肝脏中也有少量的mRNA表达[15]。SLC36A1能够转运机体内Ala、Pro、甘氨酸(Gly)等各类小氨基酸。在一定H+浓度条件下,SLC36A1选择性激活Na+/H+交换体Ⅲ产生亚氨基酸,从而使机体内H+浓度维持在正常水平[19]。Chen等[20]研究发现,SLC36A1在人体的小肠、大脑、肝脏、睾丸和肾脏组织中均有表达。
SLC38A2是SLC6家族成员之一,它是一种Na+依赖的中性氨基酸转运载体,存在于哺乳动物组织中。SLC38A2几乎在所有细胞类型中都能表达[21]。Ortiz等[22]研究发现,给大鼠饲喂高蛋白质饲粮可以增加SLC38A2的表达,这表明SLC38A2能够将机体内多余蛋白质通过氨基酸的形式进行氧化分解。Conti等[23]研究表明,SLC38A2能够结合Gln进入细胞内,并参与Glu-Gln代谢循环。本试验研究发现,断奶仔猪肝脏SLC38A2的mRNA相对表达量随饲粮CP水平的增加而增加,这与Ortiz等[22]的研究结果相一致。
仔猪肝脏氨基酸转运载体的mRNA相对表达量随饲粮CP水平的变化趋势与氨基酸代谢酶活性的变化趋势一致。总体来看,降低饲粮CP水平3%和6%会减少某些氨基酸(如Glu、Pro、Arg、Leu等)进入肝细胞的数量,从而降低这些氨基酸在肝脏中的代谢速率。
4 结 论
① 饲粮CP水平降低3%和6%会显著降低断奶仔猪肝脏氨基酸代谢酶(GOT、GPT、GS、GDH)活性。
② 饲粮CP水平降低3%和6%会显著降低断奶仔猪肝脏氨基酸转运载体(SLC6A15、SLC6A20、SLC36A1、SLC38A2)的mRNA相对表达量。
参考文献:
[1] KERR B J,EASTER R A.Effect of feeding reduced protein,amino acid-supplemented diets on nitrogen and energy balance in grower pigs[J].Journal of Animal Science,1995,73(10):3000-3008.
[2] LE BELLEGO L,VAN MILGEN J,NOBLET J.Effect of high temperature and low-protein diets on the performance of growing-finishing pigs[J].Journal of Animal Science,2002,80(3):691-701.
[3] 陈澄.日粮蛋白水平对仔猪肝脏氨基酸代谢转化的影响研究[D].硕士学位论文.重庆:西南大学,2015:21-24.
[4] 张丽英.饲料分析及饲料质量检测技术[M].3版.北京:中国农业大学出版社,2007.
[5] 邹思湘.动物生物化学[M].5版.北京:中国农业出版社,2008.
[6] 罗钧秋.猪饲粮不同来源蛋白质营养代谢效应的比较研究[D].博士学位论文.雅安:四川农业大学,2011.
[7] 罗洪明.饲粮不同蛋白水平对早期断奶仔猪生产性能、血液生化指标及免疫机能的影响[D]硕士学位论文.四川:四川农业大学,2005.
[8] SHAKED I,BEN-DROR I,VARDIMON L.Glutamine synthetase enhances the clearance of extracellular glutamate by the neural retina[J].Neurochem,2002,83(3):574-580.
[9] 李招权,魏明竟.血清谷氨酸脱氢酶的检测及临床意义[J].国外医学临床生物化学与检验学分册,2001,22(4):209-210.
[10] UHL G R,KITAYAMA S,GREGOR P,et al.Neurotransmitter transporter family cDNAs in a rat midbrain library:‘orphan transporters’ suggest sizable structural variations[J].Molecular Brain Research,1992,16(3/4):353-359.
[11] TAKANAGA H,MACKENZIE B,PENG J B,et al.Characterization of a branched-chain amino-acid transporterSBAT1 (SLC6A15) that is expressed in human brain[J].Biochemical and Biophysical Research Communications,2005,337(3):892-900.
[13] DRGONOVA J,LIU Q R,HALL F S,et al.Deletion of v7-3 (SLC6A15)transporter allows assessment of its roles in synaptosomal proline uptake,leucine uptake and behaviors[J].Brain Research,2007,1183:10-20.
[15] TAKANAGA H,MACKENZIE B,SUZUKI Y,et al.Identification of mammalian proline transporter SIT1 (SLC6A20) with characteristics of classical system imino[J].The Journal of Biological Chemistry,2005,280(10):8974-8984.
[16] JOBGEN W S,FRIED S K,FU W J,et al.Regulatory role for the arginine-nitric oxide pathway in metabolism of energy substrates[J].Journal of Nutritional Biochemistry,2006,17(9):571-588.
[17] PATTERSON A D,BONZO J A,LI F,et al.Metabolomics reveals attenuation of the SLC6A20 kidney transporter in nonhuman primate and mouse models of type 2 diabetes mellitus[J].Molecular Bases of Disease,2011,286(22):19511-19522.
[18] BRÖER S,BAILEY C G,KOWALCZUK S,et al.Iminoglycinuria and hyperglycinuria are discrete human phenotypes resulting from complex mutations in proline and glycine transporters[J].Journal of Clinical Invertigation,2008,118(12):3881-3892.
[19] ANDERSON C M H,THWAITES D T.Indirect regulation of the intestinal H+-coupled amino acid transporter hPAT1 (SLC36A1)[J].Journal of Cellular Physiology,2005,204(2):604-613.
[20] CHEN P E,GEBALLE M T,STANSFELD P J,et al.Structural features of the glutamate binding site in recombinant NR1/NR2A N-methyl-D-aspartate receptors determined by site-directed mutagenesis and molecular modeling[J].Molecular Pharmacology,2005,67(5):1470-1484.
[21] YAO D D,MACKENZIE B,MING H,et al.A novel system A isoform mediating Na+/neutral amino acid cotransport[J].The Journal of Biological Chemistry,2000,275(30):22790-22797.
[23] CONTI F,MELONE M.The glutamine commute:lost in the tube?[J].Neurochemistry International,2006,48(6/7):459-464.
