不同营养调控方式对牦牛僵牛生长发育、血常规、血浆抗氧化和免疫指标的影响
2018-04-20王泳杰王之盛彭全辉赵索南周玉清
王泳杰 王之盛* 胡 瑞 彭全辉 夏 科 赵索南 周玉清
(1.四川农业大学动物营养研究所,牛低碳养殖与安全生产四川省重点实验室,雅安 625014;2.中粮(成都)粮油工业有限公司,成都 611435;3.海北州高原现代生态畜牧业科技试验示范园,海北 810299)
牦牛是青藏高原牧区的传统优势家畜,是牧民赖以生存的生活资料来源,更是藏区经济的支柱性产业。然而,在靠天养畜的传统放牧生产养殖模式下,牦牛营养摄入会受到牧草产量与养分季节性变化的影响,当牧草供给量不足或营养水平过低,会造成妊娠母牛和出生犊牛长期营养缺乏,导致牦牛后天生长发育迟缓、甚至停滞,最终形成僵牛[1]。僵牛表现为吃料不长,体格矮小瘦弱,患病及死亡率高,生长性能远低于同龄同品种牛,僵牛的出现降低了牧民养殖牦牛的经济收益。
导致牦牛僵牛形成主要有以下几种原因:第一,牧区牦牛饲养主要采用靠天养畜的传统放牧生产方式,加上高原环境恶劣,冷季时间长,牧草供给量及营养水平的急剧下降[2],妊娠母牦牛易处于长期营养不足的状态,最终导致胎儿宫内发育迟缓,阻碍其后天生长发育[3];第二,带犊母牦牛由于营养摄入不足无法保证产奶量和奶品质,加之牧民对牦牛奶的需求,造成“人畜争奶”,进而导致犊牛营养摄入量不足,犊牛生长发育迟缓[4];第三,高原牧区环境恶劣导致犊牦牛患病率高,处于亚健康状态的犊牛易出现生长发育受阻现象[5]。本课题组前期研究表明,生长轴激素分泌不足是造成僵牛生长迟缓的一个主要原因,在精料中添加半胱胺可以促进僵牛生长轴激素分泌,从而促进其生长发育[6]。研究发现,哺乳动物细胞遭遇氧化应激会使细胞大分子损伤和器官功能障碍,降低生产性能,甚至感染各种疾病[7]。与此同时,免疫应激也会引起家畜行为、代谢和神经分泌的改变,最终抑制其生长。因此,处于亚健康状态的僵牛可能会受到氧化应激和免疫应激的影响,但目前还没有相关报道。有研究表明,半胱胺和活性干酵母可以提高动物机体抗氧化和免疫能力[8-9],并且对牦牛僵牛进行精料补饲以及在精料基础上添加半胱胺可以促进僵牛体尺和胃肠道发育[1]。
鉴于此,本试验拟通过研究不同营养调控方式对牦牛僵牛的生长性能、血常规、血浆抗氧化和免疫指标的影响,探讨营养手段启动僵牦牛补偿生长效应的可能性,以期为缓解牧区牦牛僵牛问题和推动牦牛高效健康养殖提供技术支撑。
1 材料与方法
1.1 试验动物
按小于同龄同品种牦牛群体平均体重1.5倍标准差的标准[10],选取自然放牧条件下的1周岁青海高原型牦牛僵牛40头,平均体重(72.7±6.0)kg,另选取相同条件下,同龄同品种正常牦牛10头,平均体重(93.5±6.0)kg。
1.2 试验设计
按体重将40头牦牛僵牛随机分为4组,分别为僵牛放牧组、精补组(补饲精料)、半胱胺组(补饲精料同时添加80 mg/kg BW半胱胺)、酵母组(补饲精料同时添加活性干酵母),正常牦牛作为正常牛放牧组,每组5个重复,每个重复2头牛。预试期15 d(僵牛放牧组和正常牛放牧组放牧饲养,其他3组均舍饲投喂相同基础饲粮),正试期60 d。
僵牛放牧组:自然放牧,无精料补饲;精补组:舍饲条件下饲喂基础饲粮;半胱胺组:舍饲条件下在饲喂基础饲粮的基础上于精料中添加半胱胺(有效含量30%,上海旭牧联生物科技有限公司)80 mg/kg BW[11];酵母组:舍饲条件下在饲喂基础饲粮的基础上于精料中添加活性干酵母(安琪酵母股份有限公司)0.3%[12];正常牛放牧组:自然放牧,无精料补饲。
1.3 基础饲粮
基础饲粮配制参考我国《肉牛饲养标准》(NY/T 815—2004)推荐公式按平均体重60 kg、日增重400 g计算,其组成及营养水平见表1。

表1 基础饲粮组成及营养水平(干物质基础)
1)预混料为每千饲粮提供 The premix provided the following per kg of diets:VA 97 mg,VD 12 mg,VE 11 mg,莫能菌素 monensin 100 mg,Cu (as copper sulfate) 32 mg,Fe (as ferrous sulfate) 254 mg,Mn (as manganese sulfate) 102 mg,Zn (as zinc sulfate) 224 mg,I (as potassium iodide) 8.6 mg。
2)增重净能为计算值,其余为实测值。NEgwas a calculated value, while the others were measured values.
1.4 饲养管理
试验牦牛进行统一编号,并进行免疫驱虫,其他消毒免疫程序按牛场饲养管理进行。放牧牦牛自然放牧,各补饲组牦牛均圈舍饲养,1个重复的2头牛饲养于1个圈,每天定时投喂2次(08:00和16:00),以预试期测定的采食量为基础投喂基础饲粮,按精粗比35∶65人工混合成全混合日粮(TMR)投喂,试验牦牛自由采食和自由饮水,保证每头牛采食后略有剩余,第2天早晨饲喂前收集并记录每个圈余料重量。每天打扫卫生,每周进行消毒1次。
1.5 样品采集
正试期第1和60天晨饲前对试验牦牛进行体尺测量。
正试期第1和60天晨饲前使用真空抗凝采血管对试验牦牛空腹颈静脉采血,采得样品进行分装。一份4 ℃保存,并迅速送检;另一份分离血浆,-20 ℃冻存备用。
1.6 测定指标
体尺指标:体高、体斜长、胸围、胸深、管围。
血常规指标:采用日本SYSMEX-XS-800i血细胞分析仪测定血液中红细胞(RBC)计数、血红蛋白(HGB)含量、白细胞(WBC)计数、血小板(PLT)数量。
血浆抗氧化指标的测定:谷胱甘肽过氧化物酶(GSH-Px)含量、总超氧化物歧化酶(T-SOD)活性、总抗氧化能力(T-AOC)、丙二醛(MDA)含量、过氧化氢酶(CAT)活性均采用南京建成生物工程研究所所提供的试剂盒测定。
血浆免疫指标:免疫球蛋白A(IgA)、免疫球蛋白G(IgG)和免疫球蛋白M(IgM)的含量采用免疫透射比浊法测定,试剂盒购自南京建成生物工程研究所。
1.7 数据处理
数据采用SPSS 19.0软件进行统计分析。试验组组间数据比较采用单因素方差分析,并采用Duncan氏法进行多重比较,第1天与第60天数据比较采用独立样本t检验。结果以平均值±标准差表示,以P<0.05为差异显著性水平。
2 结 果
2.1 不同营养调控方式对牦牛僵牛体尺的影响
由表2可知,第1天,与正常牛放牧组相比,各僵牛组体高、体斜长、胸围、胸深均显著低于前者(P<0.05)。通过60 d的营养调控后,在第60天,精补组、半胱胺组、酵母组的体高、胸围、胸深和管围均显著高于僵牛放牧组(P<0.05),并与正常牛放牧组无显著差异(P>0.05);精补组、半胱胺组和酵母组的胸围平均日增长均显著高于正常牛放牧组(P<0.05),酵母组的体高和体斜长平均日增长也显著高于正常牛放牧组(P<0.05);精补组的体斜长显著高于僵牛放牧组(P<0.05),但显著低于半胱胺组、酵母组、正常牛放牧组(P<0.05)。第60天精补组体斜长较第1天增长不显著(P>0.05),其余体尺显著高于第1天(P<0.05);第60天半胱胺组、酵母组各体尺指标较第1天均显著增长(P<0.05),且体斜长、胸围、管围日平均日增长显著高于僵牛放牧组(P<0.05),其中酵母组增幅最大。

表2 不同营养调控方式对牦牛僵牛体尺的影响
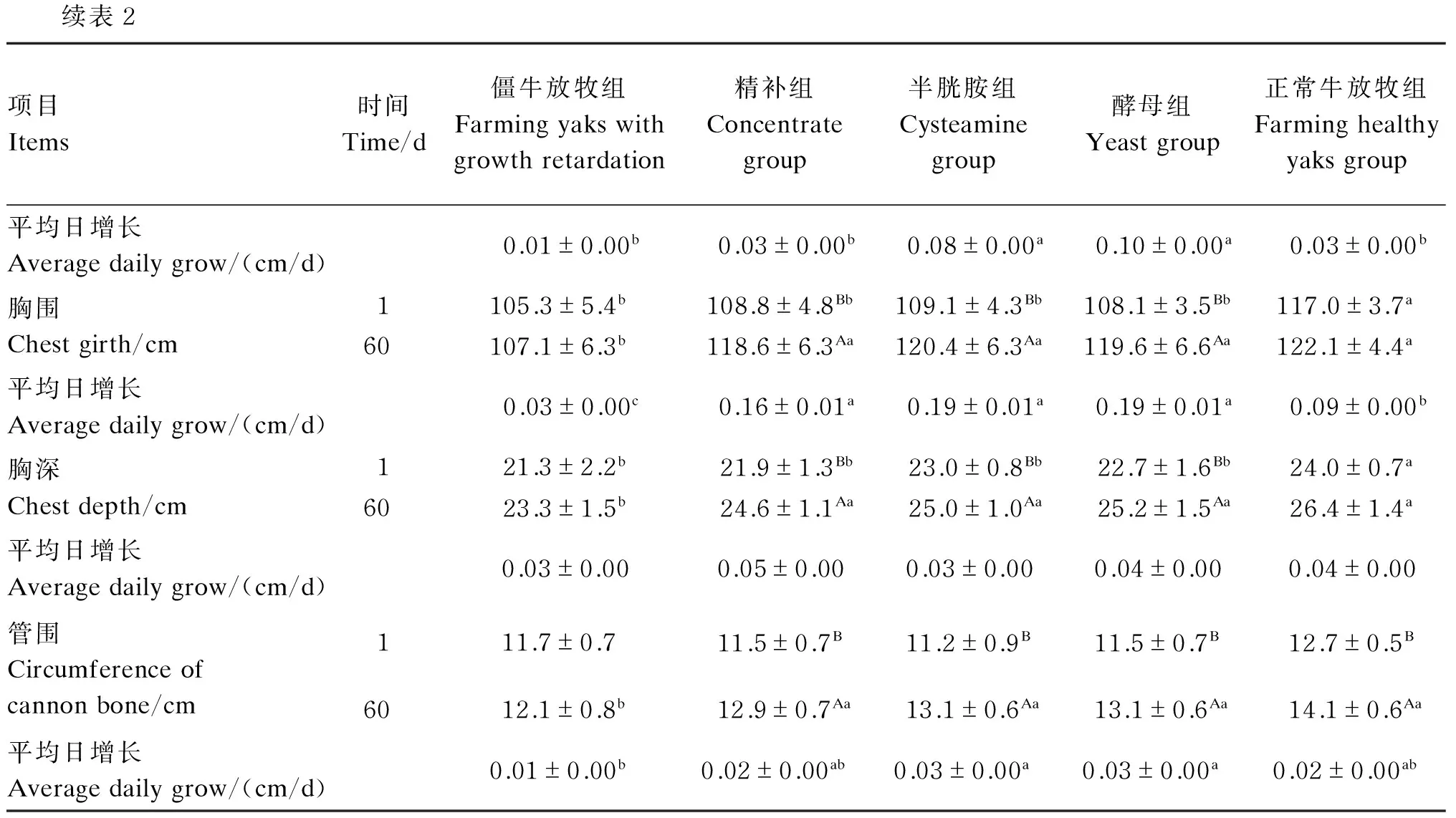
续表2项目Items时间Time/d僵牛放牧组Farmingyakswithgrowthretardation精补组Concentrategroup半胱胺组Cysteaminegroup酵母组Yeastgroup正常牛放牧组Farminghealthyyaksgroup平均日增长Averagedailygrow/(cm/d)0.01±0.00b0.03±0.00b0.08±0.00a0.10±0.00a0.03±0.00b胸围Chestgirth/cm1105.3±5.4b108.8±4.8Bb109.1±4.3Bb108.1±3.5Bb117.0±3.7a60107.1±6.3b118.6±6.3Aa120.4±6.3Aa119.6±6.6Aa122.1±4.4a平均日增长Averagedailygrow/(cm/d)0.03±0.00c0.16±0.01a0.19±0.01a0.19±0.01a0.09±0.00b胸深Chestdepth/cm121.3±2.2b21.9±1.3Bb23.0±0.8Bb22.7±1.6Bb24.0±0.7a6023.3±1.5b24.6±1.1Aa25.0±1.0Aa25.2±1.5Aa26.4±1.4a平均日增长Averagedailygrow/(cm/d)0.03±0.000.05±0.000.03±0.000.04±0.000.04±0.00管围Circumferenceofcannonbone/cm111.7±0.711.5±0.7B11.2±0.9B11.5±0.7B12.7±0.5B6012.1±0.8b12.9±0.7Aa13.1±0.6Aa13.1±0.6Aa14.1±0.6Aa平均日增长Averagedailygrow/(cm/d)0.01±0.00b0.02±0.00ab0.03±0.00a0.03±0.00a0.02±0.00ab
同行数据肩标相同或无小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05);同一指标、同列数据肩标无大写字母表示差异不显著(P>0.05),不同大写字母表示差异显著(P<0.05)。下表同。
In the same row, values with the same or no small letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05); in the same column, values of the same index with no capital letter superscripts mean no significant difference(P>0.05), while with different capital letter superscripts mean significant difference(P<0.05). The same as below.
2.2 不同营养调控方式对牦牛僵牛血常规的影响
由表3可知,在第60天,精补组血液红细胞计数显著高于僵牛放牧组(P<0.05);精补组、半胱胺组和酵母组血液血红蛋白含量显著高于僵牛放牧组(P<0.05),与正常牛放牧组差异不显著(P>0.05);僵牛放牧组的血液白细胞计数显著高于其他4个组(P<0.05)。各组牦牛血液血小板数量无显著变化(P>0.05)。与第1天相比,第60天僵牛放牧组、正常牛放牧组的血液红细胞计数显著降低(P<0.05)。

表3 不同营养调控方式对牦牛僵牛血常规的影响
2.3 不同营养调控方式对牦牛僵牛血浆抗氧化指标的影响
由表4可知,在第1天,僵牛放牧组、精补组、半胱胺组和酵母组的血浆中MDA含量显著高于正常牛放牧组(P<0.05);僵牛放牧组、精补组、半胱胺组和酵母组的血浆T-SOD、GSH-Px活性以及T-AOC显著低于正常牛放牧组(P<0.05)。在第60天,僵牛放牧组的血浆T-AOC显著低于第1天(P<0.05);精补组的血浆T-SOD活性和T-AOC显著高于僵牛放牧组(P<0.05);半胱胺组的血浆MDA含量显著低于第1天(P<0.05),且显著低于僵牛放牧组(P<0.05),血浆T-SOD活性、T-AOC显著高于第1天(P<0.05),且显著高于僵牛放牧组(P<0.05);酵母组的血浆MDA含量显著低于第1天(P<0.05),且显著低于僵牛放牧组(P<0.05),血浆T-SOD、GSH-Px活性和T-AOC显著高于第1天(P<0.05),且显著高于僵牛放牧组(P<0.05)。
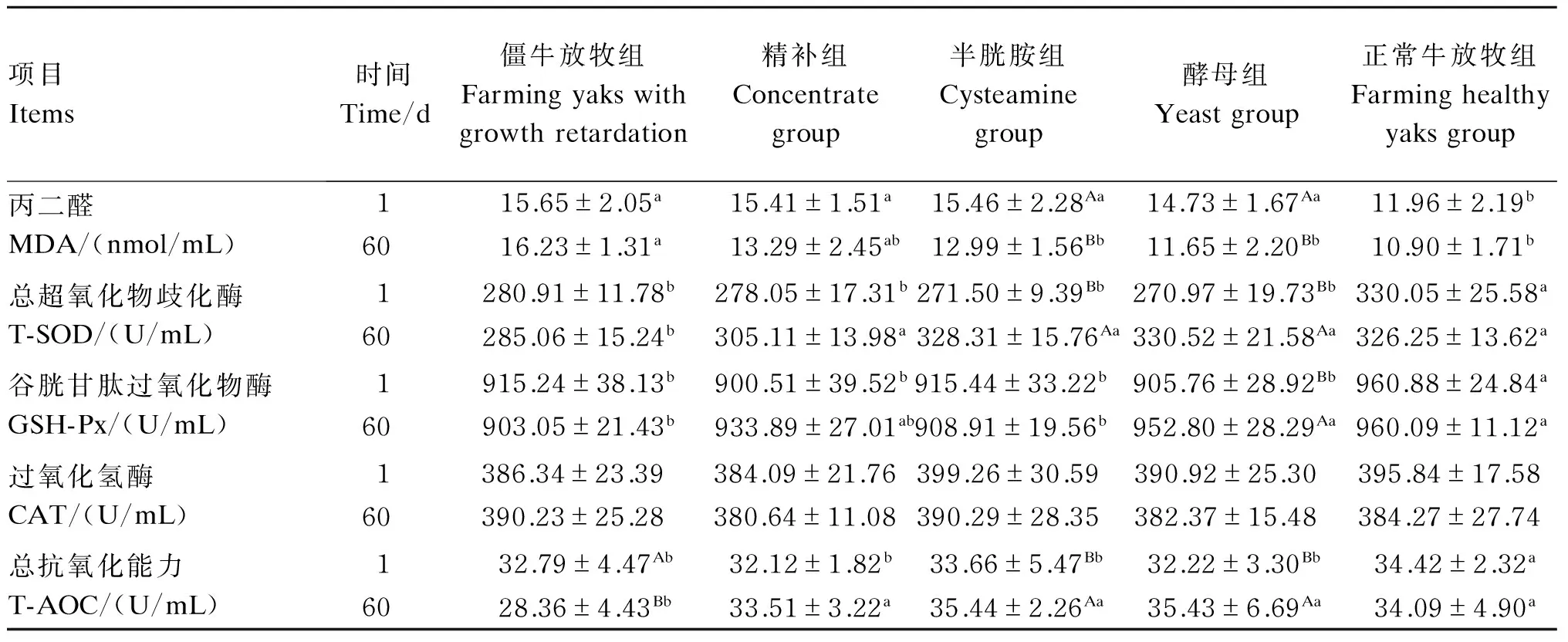
表4 不同营养调控方式对牦牛僵牛血浆抗氧化指标的影响
2.4 不同营养调控方式对牦牛僵牛血浆免疫指标的影响
由表5可知,在第1天,僵牛放牧组、精补组、半胱胺组及酵母组血浆IgA和IgG含量显著低于正常牛放牧组(P<0.05)。在第60天,精补组血浆IgG含量显著高于第1天(P<0.05),且显著高于僵牛放牧组(P<0.05);半胱胺组血浆IgA含量显著高于第1天(P<0.05),且显著高于僵牛放牧组(P<0.05);酵母组血浆IgA和IgG含量显著升高(P<0.05),且显著高于僵牛放牧组(P<0.05)。
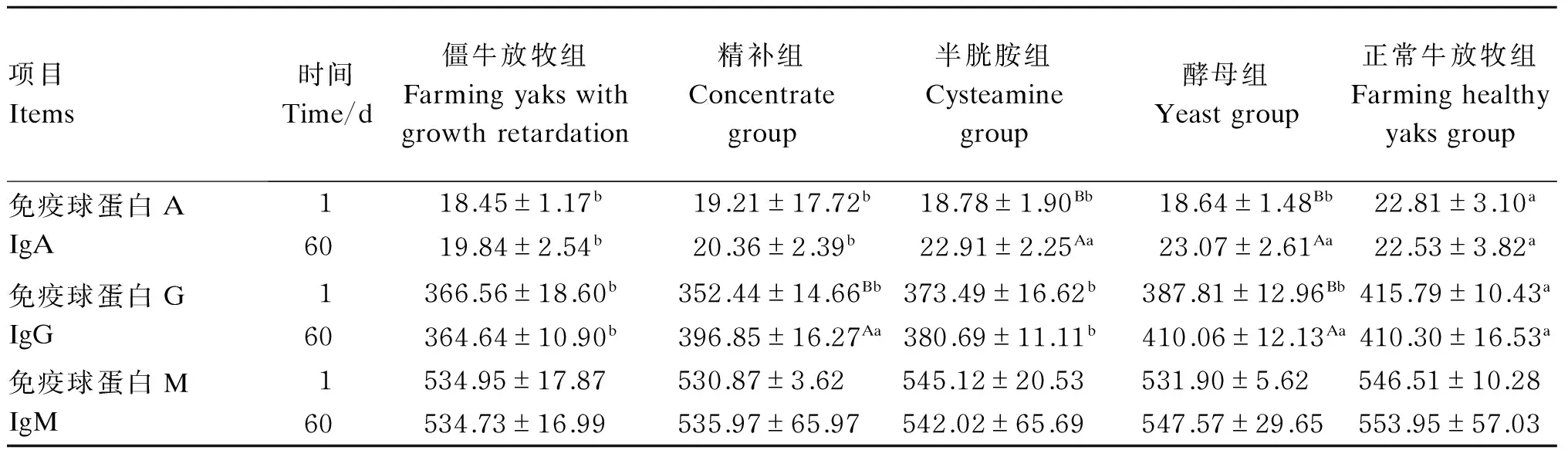
表5 不同营养调控方式对牦牛僵牛血浆免疫指标的影响
3 讨 论
3.1 不同营养调控方式对牦牛僵牛体尺的影响
体尺的变化可以反映出动物生长发育的变化,体尺也常常被作为衡量动物生长的指标,僵牛由于受到生长抑制,体尺远小于正常牛。补饲精料可以提供僵牛生长所需营养物质,弥补僵牛在营养摄入上的不足,促进其生长。但饲养60 d后精补组体斜长增长不显著,胸围、胸深、管围显著高于放牧僵牛,但均小于正常牦牛,说明仅提高营养摄入量不能使僵牛恢复到正常牛生长水平。在补饲精料基础上添加半胱胺和活性干酵母可进一步促进牦牛僵牛体尺增长。动物的生长与生长激素密切相关,生长抑素会抑制生长激素的分泌,而半胱胺则能降低生长抑素的活性,并且还能提高反刍动物体内微生物蛋白合成率,增强瘤胃消化代谢水平,从而促进动物机体生长发育[13]。湖羊十二指肠瘘管灌注半胱胺,5 d后血浆生长激素含量升高124.2%,机体生长速度显著提高[14]。给绵羊口服半胱胺,6 d内血液生长激素含量升高56.20%,从而促进绵羊机体生长[15]。而活性干酵母可以提高瘤胃内环境稳定性,促进瘤胃微生物发酵,维持瘤胃健康,并促进小肠发育,从而提高营养物质的消化吸收效率,并促进机体生长[16]。本试验结果显示,补饲精料基础上添加活性干酵母后僵牛体尺增幅最大,促生长效果最佳。
3.2 不同营养调控方式对牦牛僵牛血常规的影响
血常规指标可以反映出机体的营养及健康状况。红细胞的功能是运输氧气、二氧化碳、电解质,葡萄糖以及氨基酸等机体新陈代谢所必需的物质,此外还在酸碱平衡中起一定的缓冲作用。这2项功能都是通过红细胞中的血红蛋白来实现的[17]。僵牛和正常牛放牧组的血液红细胞计数在第60天显著低于第1天,可能是由于高原放牧条件恶劣所致。精补组和半胱胺组血液红细胞计数显著高于僵牛放牧组和正常牛对照组,精补组、半胱胺组和酵母组血液血红蛋白含量显著高于放牧的僵牛和正常牦牛。该结果表明,补饲精料以及在精料中添加半胱胺和活性干酵母增强了机体的运输氧气和其他代谢产物的功能,有助于增强机体代谢及物质的运输,改善机体营养状况,促进机体生长。白细胞能吞噬异物、浆细胞而产生抗体,它们在机体损伤治愈、抵御病原体入侵和疾病的免疫方面起重要作用[18]。在传统放牧饲养下,由于不利环境因素的刺激,僵牛机体健康状况低于正常牛,僵牛放牧组血液白细胞计数显著高于其他4组,可能是机体产生炎症反应。而添加半胱胺和活性干酵母后僵牛血液白细胞计数与正常牛相比无显著变化,维持在健康稳定状态,说明半胱胺和活性干酵母有助于增强僵牛免疫力,促进机体健康高效生长。
3.3 不同营养调控方式对牦牛僵牛血浆抗氧化指标的影响
细胞功能的发挥及其活力在很大程度上依赖于机体中氧化还原状态的平衡,当机体内的活性氧自由基(ROS)和自由基过量时,便会破坏机体氧化还原的平衡,从而导致细胞内的大分子物质(脂质、蛋白质、DNA)过度氧化,最终造成细胞的功能退化甚至细胞凋亡[19]。MDA是机体代谢过程中自由基攻击生物膜产生的不饱和脂肪酸引发的脂质过氧化反应而形成的物质,其含量能反映出机体内脂质过氧化程度,与此同时,也能间接反映出细胞受损伤的程度[20]。动物机体内的GSH-Px可将谷胱甘肽(GSH)作为还原剂,促进氧化氢、有机氢氧化物以及脂质氢氧化物的还原,有助于帮助细胞抵抗氧化损伤[21]。细胞可以通过CAT、超氧化物歧化酶(SOD)等发挥自身的内源性保护作用以对抗氧化应激。T-AOC是反映机体酶及非酶促系统抗氧化能力的综合指标[22]。从本试验结果可以看出,僵牛放牧组与正常放牧组相比有显著的氧化应激现象,氧化应激是否会抑制犊牛的生长,有待进一步研究[23]。僵牛放牧组在第60天血浆T-AOC显著降低,可能是由于僵牛自身抗氧化能力差加上高原放牧环境所致。本试验中,补饲精料同时添加半胱胺显著提高了僵牛血浆T-SOD活性,并且显著降低了僵牛血浆中MDA的含量,增强了僵牛的抗氧化能力。有研究表明,半胱胺分子中含有游离的羟基,具有抗氧化作用,能清除机体内产生的自由基,提高血液GSH含量和SOD活性,从而清除体内自由基[24]。本试验结果表明,补饲精料同时添加活性干酵母可以显著提高僵牛的血浆T-SOD、GSH-Px活性和T-AOC,并且显著降低僵牛血浆内MDA的含量,其机制有待进一步研究。刘大程等[25]研究表明,饲粮中补充酵母具有提高隐性乳房炎奶牛的抗氧化能力的作用。因此,补饲精料同时添加半胱胺和活性干酵母可以提高僵牛的抗氧化能力,缓解僵牛氧化应激。
3.4 不同营养调控方式对牦牛僵牛机体免疫的影响
本试验结果表明,僵牛放牧组与正常牛放牧组相比,免疫能力显著低于后者。对僵牛进行精料补饲后,显著增加其血浆中IgG的含量,其原因可能是僵牛机体得到了营养补充。大量研究表明,半胱胺可以直接或间接通过激素改变来影响机体的免疫功能。一方面,免疫功能与体内生长轴密切相关,由于半胱胺可以直接与生长抑素作用,通过改变生长抑素的构型来耗竭其体内免疫活性,从而解除生长抑素对机体免疫的抑制作用[26];另一方面,通过半胱胺解除生长抑素与消化相关的激素或酶对营养物质的抑制作用,来促进机体对营养物质的吸收和利用,从而提高机体免疫功能[27]。本试验结果证明,在补饲精料同时添加半胱胺可以显著提高僵牛的血浆IgA含量,从而提高其免疫能力。酵母菌有很好的生存能力,其通过瘤胃可能对肠道菌群平衡产生有益的影响,因此可能影响免疫系统及动物的健康[28]。除此之外,酵母菌代谢产生的有机酸也可以降低胃肠道pH,有效抑制病原菌的入侵[29]。目前关于活性干酵母能提高反刍动物免疫能力的报道很少。有试验表明,饲喂酵母菌制剂可以增加山羊粪便中乳酸杆菌数量,降低大肠杆菌的数量[30];除此以外,还可以显著增加绒山羊血清中IgA和IgG含量[31]。本试验结果表明,补饲精料同时添加活性干酵母可以显著提高僵牛血浆中IgA和IgG的含量,进而提高僵牛机体免疫能力。
4 结 论
僵牛的生长发育、抗氧化及免疫能力显著低于正常牛,补饲精料及精料中添加80 mg/kg BW半胱胺或0.3%活性干酵母可提高牦牛僵牛抗氧化和免疫能力,促进僵牛补偿生长,其中补饲精料同时添加0.3%活性干酵母效果最佳。
参考文献:
[1] 王以鑫,胡瑞,王鸿泽,等.不同营养调控方式对牦牛僵牛体尺和胃肠道发育的影响[J].动物营养学报,2015,27(6):1690-1697.
[2] 吴发莉.不同区域和季节对高寒天然牧草品质的影响[D].硕士学位论文.雅安:四川农业大学,2014.
[3] GRUMMER R R,HOFFMAN P C,LUCK M L,et al.Effect of prepartum and postpartum dietary energy on growth and lactation of primiparous cows[J].Journal of Dairy Science,1995,78(1):172-180.
[4] 姬秋梅,达娃央拉,张成福,等.西藏牦犊牛早期生长发育潜力研究[J].草食家畜,2010(4):54-57.
[5] 吴发莉,王之盛,杨勤,等.甘南碌曲和合作地区冬夏季高寒天然牧草生产特性、营养成分和饲用价值分析[J].草业学报,2014,23(4):31-38.
[6] 胡瑞.GHRP-2与半胱胺对生长迟缓牦牛的促生长作用机理研究[D].硕士学位论文.雅安:四川农业大学,2015.
[7] ASKEW E W.Environmental and physical stress and nutrient requirements[J].American Journal of Clinical Nutrition,1995,61(3S):631S-637S.
[8] 洪军,胡建业.半胱胺对动物机体的免疫调节及抗氧化作用的研究进展[J].广东畜牧兽医科技,2009,34(5):20-22.
[9] 李陵,戴晋军.日粮中添加活性干酵母对反刍动物的影响[J].饲料研究,2009(3):38-39.
[10] XU R J,MELLOR D J,BIRTLES M J,et al.Impact of intrauterine growth retardation on the gastrointestinal tract and the pancreas in newborn pigs[J].Journal of Pediatric Gastroenterology and Nutrition,1994,18(2):231-240.
[11] 杨佳栋.半胱胺及复合蛋白对肉牛生产性能和血液指标影响的研究[D].硕士学位论文.保定:河北农业大学,2004.
[12] 张翔飞.活性干酵母对肉牛瘤胃发酵、纤维降解及微生物菌群的影响[D].硕士学位论文.雅安:四川农业大学,2014.
[13] 冯志华,张义明,刘观忠等.半胱胺在反刍动物营养中的作用[J].动物科学与动物医学,2004,21(6):38-39.
[14] 韩正康,刘宗柱,沈延法.半胱胺引起绵羊外周血液β-内啡肽和几种主要代谢激素的变化[J].畜牧兽医学报,1996,27(3):193-198.
[15] 刘皙洁,韩正康,刘丽梅,等.口服半胱胺颗粒料或粉料对羔羊瘤胃pH值、总脱氢酶及TVFA的影响[J].东北农业大学学报2000,31(4):375-380.
[16] 杨小萍,李玉斌,张自力.活性干酵母在畜禽生产中的应用[J].饲料博览,2010(11):19-20.
[17] 熊年年,陈亚宁,周君,等.皖东黄牛部分血液生理生化指标的测定[J].安徽科技学院学报,2014,28(1):19-22.
[18] 麻延峰,傅春泉,王宏艳,等.金华地区奶牛子宫内膜炎的血常规变化研究[J].中国奶牛,2007(4):29-32.
[19] Majambu M.Therapeutic potential ofMoringaoleiferaleaves in chronic hyperglycemia and dyslipidemia:a review[J].Frontiers in Pharmacology,2012,3:24.
[20] 张培松,周玉香,王洁.三种日粮添加物对滩羊血液抗氧化性能的影响[J].家畜生态学报,2013,34(6):44-47.
[21] FLOHÉ L,GÜNZLER W A.Assays of glutathione peroxidase.[J].Methods in Enzymology,1984,105:114-120.
[22] 王兰惠.回肠灌注酵母培养物对绵羊血液生化指标、免疫及抗氧化功能的影响[D].硕士学位论文.长春:吉林农业大学,2015.
[23] YUAN S B,CHEN D W,ZHANG K Y,et al.Effects of oxidative stress on growth performance,nutrient digestibilities and activities of antioxidative enzymes of weanling pigs[J].Asian-Australasian Journal of Animal Sciences,2007,20(10):1600-1605.
[24] HOBER S,LJUNG J L,UHLÉN M,et al.Insulin-like growth factors Ⅰ and Ⅱ are unable to form and maintain their native disulfides under in vivo redox conditions[J].FEBS Letters,1999,443(3):271-276.
[25] 刘大程,程艳,卢德勋.酵母培养物对隐性乳房炎奶牛免疫功能和抗氧化功能的影响[J].畜牧与饲料科学,2011,32(9/10):82-84.
[26] 刘均利.半胱胺耗竭体内生长抑素及其机制[J].生理科学进展,1990(3):271-274.
[27] 刘贵莲,王之盛,周安国.新型饲料添加剂——半胱胺[J].饲料工业,2006,27(22):4-8.
[28] 刘丽,刘倩.酵母及其培养物在动物生产中的应用[J].上海畜牧兽医通讯,2012(4):57-58.
[29] 王学东,李彪,戴晋军.活性干酵母在养猪中的应用[J].养猪,2009(4):9-10.
[30] BEAUCHEMIN K A,KREHBIEL C R,NEWBOLD C J,et al.Enzymes,bacterial direct-fed microbials and yeast:principles for use in ruminant nutrition[J].Biology of Growing Animals,2006,4:251-284.
[31] 张爱忠,卢德勋,刘大程,等.酵母培养物对绒山羊机体免疫指标的影响[J].动物营养学报,2008,20(2):163-169.
