不同来源豆粕对大恒肉鸡的能量和氨基酸营养价值评定
2018-04-20张婵娟王建萍丁雪梅曾秋凤白世平张克英
张婵娟 王建萍 丁雪梅 曾秋凤 白世平 张克英
(四川农业大学动物营养研究所,动物抗病营养教育部重点实验室,雅安 625014)
随着生活水平的逐渐提高,人们对畜禽产品品质特别是风味品质的要求也随之提高,更多消费者青睐于优质的地方畜禽产品。大恒肉鸡便是由四川大恒家禽育种有限公司等培育的一种地方性黄羽肉鸡配套系。在饲料营养价值评定方面,McNab等[1]提出的真代谢能(TME)法,具有快速测定、分析方法简便重复率高和准确评定单一原料等优点,且随着测定条件和用途等因素逐步改善,TME法目前已被30多个国家广泛使用,并从原料代谢能扩展到营养成分的消化率等方面,进而延伸到氨基酸利用率测定[2]。而Parsons[3]提出的在TME法基础上切除盲肠测定原料氨基酸真利用率(TAAA)的方法,使评定更具灵活性和实效性。对于不同的禽类,其消化道结构、生长速度和体型等方面的差异均会影响营养价值的评定[4-5]。赵佳[6]评定了30种不同来源玉米对于大恒肉鸡的代谢能,得到30种玉米对大恒肉鸡的表观代谢能(AME)为(14.624±0.469) MJ/kg,氮校正表观代谢能(AMEn)为(14.646±0.462) MJ/kg,TME为(16.062±0.488) MJ/kg,氮校正真代谢能(TMEn)为(16.083±0.481) MJ/kg。但目前尚无关于豆粕对大恒肉鸡的营养价值评定方面的报道。因此,本试验拟评定不同来源豆粕对于大恒肉鸡的代谢能和TAAA,在此基础上建立适合大恒肉鸡或其他优质地方肉鸡的评定方法,构建大恒肉鸡饲料数据库,为有效配制大恒肉鸡饲料和推动优质肉鸡产业链的发展提供数据支撑。
1 材料与方法
1.1 试验设计
大恒肉鸡适宜强饲量的设置:选用40只18周龄以上大恒肉公鸡进行强饲,分成5组,强饲量分别为鸡只体重的0、1.0%、1.5%、2.0%和2.5%。每组8个重复,每个重复1只鸡。每组强饲量为0的作为对照组,测定内源氮和能量的损失。
代谢能评定:分3批进行,每批选用48只正常健康的成年大恒肉公鸡,平均体重为4 kg,随机分为6个组,其中1个为禁食对照组,1个为玉米淀粉组,4个为待测饲粮组。每组8个重复,每个重复1只鸡。玉米淀粉代谢能测定是直接强饲,重复测定3次。
TAAA评定:分3批进行,每批选取正常健康的去盲肠大恒肉公鸡36只,随机分为6组,其中1个为禁食对照组,5个为待测饲粮组。每组6个重复,每个重复1只鸡。
1.2 试验饲粮
饲粮参照NRC(1994)配制,其中确定大恒肉鸡适宜强饲量的饲粮为基础饲粮;测定代谢能和TAAA的饲粮为待测饲粮,粗蛋白质(CP)含量用玉米淀粉将豆粕稀释到17%。饲粮组成及营养水平见表1。12个豆粕采样于四川省的饲料企业,采样信息见表2。
1.3 代谢试验
试验在四川农业大学动物营养研究所科研试验基地进行。代谢鸡只依照McNab等[1]的TME法进行强饲:泄殖腔缝合集粪瓶盖后适应1周的时间,对代谢鸡只称重,记录重量。禁食48 h后,进行强饲,旋上集粪袋,记录时间,收集48 h排泄物。强饲使用的是内直径为8 mm、长为26 cm的不锈钢管,在其顶端融合为漏斗样式,通过食道把食物输入嗉囊,饲料采用过40目粉碎机粉碎而成。每只鸡单笼(长30 cm×宽57 cm×高50 cm)饲养,自由饮水,光照为16 h。

表1 饲粮组成及营养水平(干物质基础)
1)多维为每千克饲粮提供 The multi-vitamin provided the following per kg of diets:VA 10 000 IU,VD32 000 IU,VE 30 IU,VK33 mg,VB14 mg,VB28 mg,VB64 mg,VB120.02 mg,烟酸 nicotinic acid 50 mg,泛酸钙 calcium pantothenate 13 mg,叶酸 folic acid 1 mg。
2)矿物质预混料为每千克饲粮提供 Mineral premix provided the following per kg of diets:Cu (CuSO4·5H2O) 8 mg,Fe (FeSO4·H2O) 80 mg,Mn (MnSO4·H2O) 80 mg,Zn (ZnSO4·H2O) 100 mg,Se (Na2SeO4) 0.3 mg,I (KI) 0.4 mg。
3)营养水平为计算值。Nutrient levels were calculated values.

表2 豆粕采样信息
去盲肠方法:依据Poppema等[7]提出的方法进行,术前试验鸡饥饿24 h,拔掉腹部龙骨至泄殖腔10 cm×5 cm左右范围的鸡毛,消毒后麻醉。用手术刀下划约4 cm的长度,在十二指肠下方位置找出盲肠,使用标准缝合线缝合并剪断盲肠,收缩切除端后用沙布清洗腹腔内血水及血凝块,注入青霉素,依次缝合腹膜、腹肌,最后缝合皮肤。手术后试验鸡进行6周恢复期。
全收粪法收集排泄物按照Adeola等[8]的方法,在强饲后4、8、16、32和48 h时,分别换取新的集粪袋。待收集完毕后,将每只鸡48 h的排泄物均匀混在一起,先在65 ℃烘箱烘干72 h,再在空气中回潮24 h。称重,记录,粉粹过40目,-20 ℃保存,用于粪样成分测定。
1.4 测定指标及方法
1.4.1 体重
禁食前记录鸡正常体重为强饲前体重,收集48 h排泄物后,记录体重为强饲后体重。体重损失为强饲前后体重之差。
1.4.2 饲粮和排泄物氮含量及能量
氮含量测定用福斯全自动蛋白质测定仪Kjeltec 8400。能量依据氧弹式量热法测定,仪器为Parr 1281自动绝热式热量计:
食入饲粮的总能=饲粮能量×食入饲粮总量;排泄物的总能=排泄物能量×排泄物总量。
1.4.3 氮沉积
鸡氮沉积参照呙于明[9]的公式:
内源氮沉积量(ERN0)=-禁食鸡排泄物氮;RN1=(食入饲粮总氮-排泄物氮)/
(食入饲粮干物质的质量);RN2=(食入饲粮总氮-排泄物氮+内源排泄物氮)/(食入饲粮干物质的质量)。
式中:RN1为家禽每摄入1 kg饲粮干物质沉积的氮量;RN2为家禽每摄入1 kg饲粮干物质去除内源部分真正沉积的氮量。
1.4.4 豆粕营养成分
豆粕中干物质、CP、粗纤维(CF)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、粗脂肪(EE)和粗灰分(Ash)含量的测定参照张丽英[10]的方法。
1.4.5 饲粮代谢能
饲粮代谢能计算方法参照Adeola等[8],以重复为单位计算内源能损失(EEL)、AME、AMEn、TME和TMEn,以干物质为基础,计算公式:
EEL=禁食鸡排泄物总能;AME=(食入饲粮总能-排泄物总能)/食入饲粮干物质的质量;豆粕AME=(饲粮AME-饲粮中玉米淀粉含量×玉米淀粉AME)/饲粮中豆粕含量;AMEn=AME-RN1×34.39;TME=(食入饲粮总能-排泄物总能+内源总能排现量)/食入饲粮干物质的质量;豆粕TME=(饲粮TME-饲粮中玉米淀粉含量×玉米淀粉TME)/饲粮中豆粕含量;TMEn=TME-RN2×34.39。
式中:34.39为在鸡上每克尿氮的产热量,单位为MJ/kg。
能量利用率=(排泄物总能/食入饲粮总能)×100。
1.4.6 氨基酸含量
运用高效液相色谱法采用全自动氨基酸分析仪(日立L-8900)测定饲粮样品或粪中CP水解后氨基酸的含量,含硫氨基酸含量单独测定。
1.4.7 豆粕TAAA
依照Likuski等[11]的计算公式:
TAAA=[食入饲粮氨基酸总量-(排泄物氨基酸总量-内源氨基酸总量)/食入饲粮氨基酸总量]×100;食入饲粮氨基酸总量=饲粮干物质总量×饲粮中氨基酸含量;排泄物氨基酸总量=排泄物干物质总量×排泄物中氨基酸含量。
因为混合饲粮中的豆粕是单一提供蛋白质的原料,所以豆粕TAAA等于饲粮TAAA。
1.5 数据统计与分析
数据按照单因素完全随机设计分析(one-way ANOVA和LSD法),运用SAS 9.3中的ANOVA模块统计,差异显著用Duncan氏法进行多重比较。P<0.05表示差异显著。
2 结果与分析
2.1 不同强饲量对大恒肉鸡代谢体重损失和氮沉积的影响
本试验在一定的绝食排空条件下,研究不同强饲量对大恒肉鸡的体重损失、氮平衡、代谢能和能量利用率的影响。整个试验中鸡只没有出现呛料和呕吐等不良反应,强饲2.5%难度较大。表3结果显示,各组体重损失和氮沉积差异显著(P<0.05)。强饲前,肉鸡处于饥饿状态,所以随着强饲量的增加,肉鸡体重损失和氮沉积减少,且各强饲组与对照组相比差异显著(P<0.05)。随着强饲量的增加,氮沉积的绝对值有降低的趋势。本试验中ERN0为-0.541 g/kg BW,略高于赵佳[6]用禁食法测定成年大恒肉鸡的ERN0平均值(-0.609 g/kg BW),而与Askbran[12]测定值0.29~0.36 g/kg BW差异较大,可能是与其他试验的内源对照组饲喂葡萄糖和淀粉有关。

表3 不同强饲量对大恒肉鸡代谢体重损失和氮沉积的影响(干物质基础)
同列数据肩标相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。表4、表5、表6、表7和表8同。
In the same column, values with the same small letter or no letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as Table 4, Table 5, Table 6, Table 7 and Table 8.
2.2 不同强饲量对大恒肉鸡代谢能和能量利用率的影响
试验中禁食组作为对照组,测定的EEL为24.941 MJ/kg BW,基本等同于赵佳[6]测定成年大恒肉鸡的EEL平均值24.878 MJ/kg BW,而低于Askbran[12]测定值29.748~31.380 MJ/kg BW,其测定鸡为2.9~4.9 kg的罗得岛红鸡,品种和鸡的年龄等可能会与本试验产生差异。Ren等[13]测得黄羽肉鸡EEL为25.355~27.070 MJ/kg BW,本试验结果与之基本一致。
由表4可知,基础饲粮的AME和AMEn随着强饲量的增加呈升高的趋势,但各个组间差异不显著(P>0.05),而TME和TMEn随着强饲量的增加而显著降低(P<0.05)。各组的能量利用率差异不显著(P>0.05),随着强饲量的增加有增大的趋势。
本试验中强饲量不同,TME和TMEn在各组间差异显著(P<0.05),与Sibbald[5]所提出的假设不一致,可能由于EEL和氮沉积的数值在采食鸡和禁食鸡上不同所引起。强饲1.5%和2.0%组的AME、AMEn、TME和TMEn差异不显著(P>0.05),说明此时能量利用率达到稳定状态,且强饲2.5%组的TMEn与强饲2.0%组差异都不显著(P>0.05),说明2.0%强饲水平饲粮充分代谢。研究报道,评定肉骨粉和鱼粉的TME,当收集排泄物
时间由24 h延长到48 h时,其TME值有稍微降低,而苜蓿的排泄物收集时间延长到48 h时,TME值显著下降,说明肉骨粉和鱼粉可以在24 h排空,苜蓿排空时间为48 h[14]。禁食鸡通过嗉囊强饲的饲粮的排空时间取决于强饲的量以及强饲饲粮在胃中的储藏消化过程,富含NDF的饲料的排空时间要高于含NDF较低的饲料[15]。虽然降低强饲量能降低其排空的时间,但是会增加平均数的标准误,影响测定的TME法的精确度。前人报道研究成年单冠白来航肉鸡时,强饲量由10 g增加到30 g时,标准误下降[5]。观察本试验可以得到:强饲2.0%的代谢能值的标准误是低于其他组的。总体表明,大恒肉鸡上强饲体重的2.0%为适宜水平。

表4 不同强饲量对大恒肉鸡代谢能和能量利用率的影响(干物质基础)
2.3 豆粕营养成分
由表5可知,12个豆粕的干物质、CP、NDF、ADF、CF、EE和Ash含量和总能平均值分别为85.74%、52.81%、13.61%、6.47%、6.67%、1.52%和6.63%以及19.790 MJ/kg。NDF、CF和EE的变异系数(CV)大于15%,以EE为最大。总能变化范围为19.414~20.041 MJ/kg,CV值最低,为0.82。豆粕3的CF含量(4.78%)低于其他豆粕。豆粕1的总能(19.414 MJ/kg)和EE(1.10%)含量低于其他豆粕。EE的最高值(豆粕9,2.46%)和最低值(豆粕1,1.10%)相差1.36百分点。豆粕5和豆粕6的CP、EE含量和GE较低,而NDF、ADF和CF含量较高;而豆粕7、9和10的CP、EE含量和GE值较高,NDF、ADF和CF的含量都较低。
2.4 豆粕代谢能
由表6可知,3个批次的48 h ERN0分别为-0.468、-0.408和-0.402 g/kg BW,48 h EEL分别为26.229、19.853和20.456 MJ/kg BW,差异均不显著(P>0.05)。由表7可知,3个批次重复的试验测定的玉米淀粉的AME、AMEn、TME和TMEn平均值分别为14.393、15.251、16.372和16.108 MJ/kg。由表8可知,12个豆粕的AME、AMEn、TME和TMEn的平均值为12.523、12.933、12.795和12.339 MJ/kg,变化范围分别为:11.439~14.305 MJ/kg、11.916~14.790 MJ/kg、11.422~14.410 MJ/kg和11.221~14.042 MJ/kg,不同品种的豆粕之间差异显著(P<0.05)。AME、AMEn、TME和TMEn有同样的变化趋势。豆粕8和豆粕9的代谢能高于其他豆粕,豆粕2的AMEn低于其他豆粕,而豆粕6的AME、TME和TMEn低于其他豆粕。

表5 豆粕营养成分(干物质基础)

表6 内源氮沉积和内源能损失
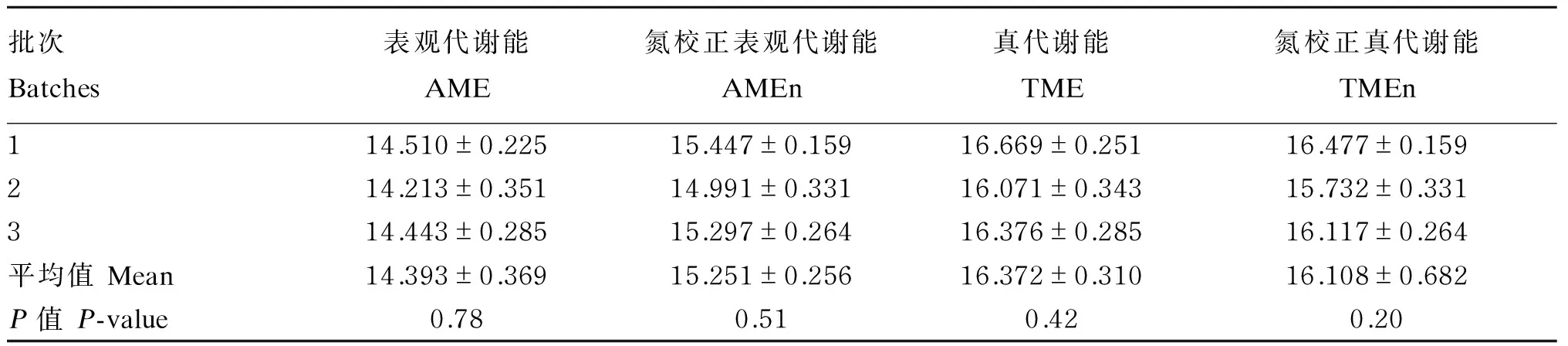
表7 玉米淀粉代谢能(干物质基础)

表8 豆粕代谢能(干物质基础)
2.5 豆粕氨基酸含量
由表9可知,12个豆粕的17种氨基酸含量的CV变化范围为6.36%~10.94%,以甘氨酸(Gly)的CV最小为6.36%,脯氨酸(Pro)的CV最大为10.94%。17种氨基酸含量平均值的变化范围为0.56%~7.99%。除蛋氨酸(Met)、Gly、半胱氨酸(Cys)和Pro外,其余13种氨基酸含量变化基本一致,豆粕8的氨基酸含量最低,豆粕9的含量最高。对于Met、Gly和Cys 3种氨基酸含量,豆粕11含量最高,豆粕3含量最低;豆粕8 Pro的含量也是最低,豆粕10的含量最高,稍高于豆粕9。
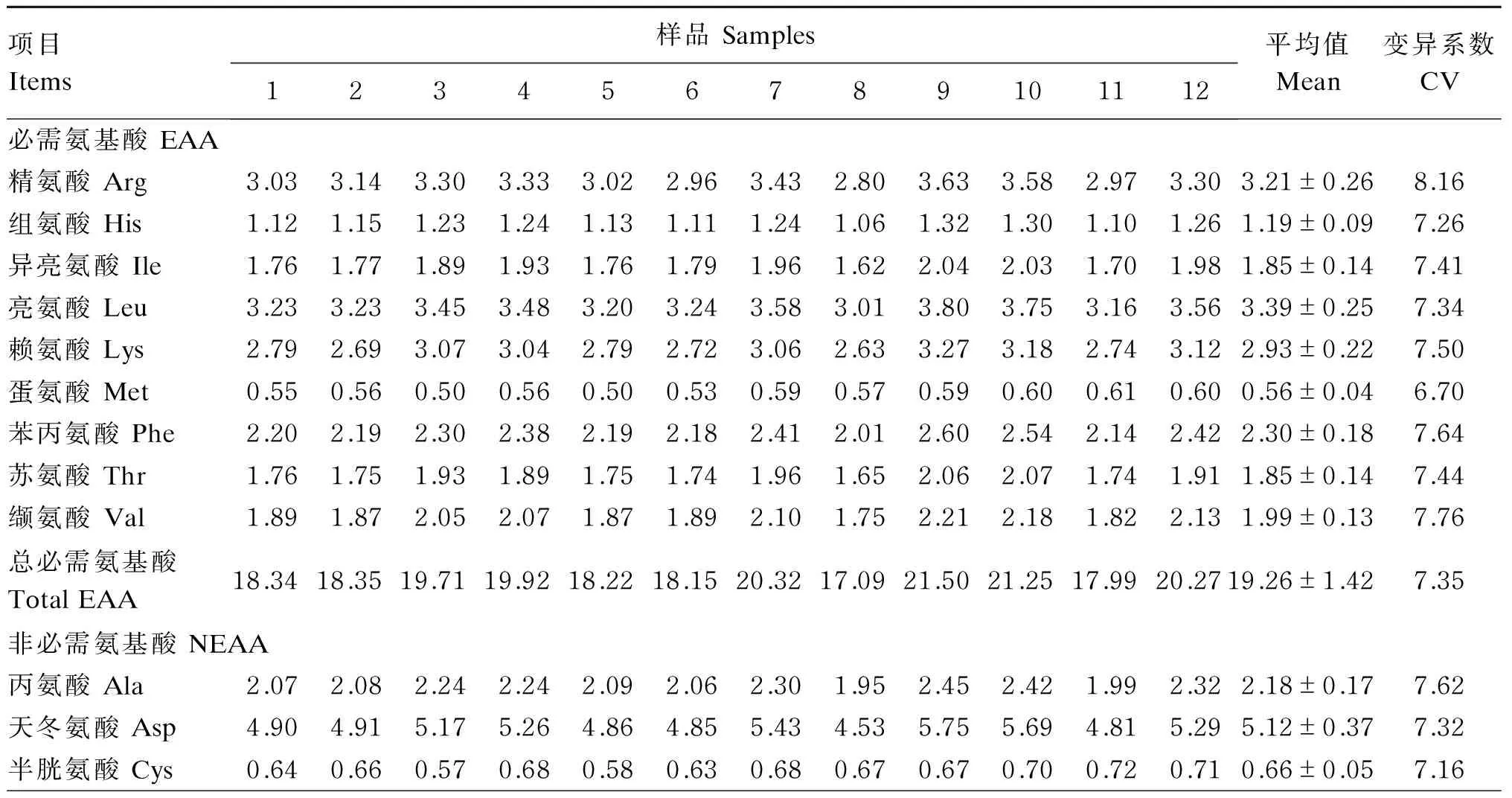
表9 豆粕氨基酸含量(干物质基础)

续表9项目Items样品Samples123456789101112平均值Mean变异系数CV谷氨酸Glu7.557.558.058.047.617.688.577.119.088.947.528.187.99±0.617.63脯氨酸Pro2.462.743.132.722.482.462.862.332.943.272.452.622.71±0.2910.94丝氨酸Ser2.332.312.432.472.292.282.532.132.702.682.242.472.41±0.177.24酪氨酸Tyr1.501.541.601.631.531.541.741.431.831.821.441.711.61±0.148.58甘氨酸Gly1.991.981.692.001.801.952.071.992.042.102.112.101.99±0.136.36总非必需氨基酸TotalNEAA23.4423.7724.8925.0323.2423.4526.1822.1427.4727.6123.2725.4024.66±1.757.10总氨基酸TotalAA41.7842.1244.6044.9541.4641.6046.5039.2348.9748.8641.2645.6643.92±3.157.18
同行数据肩标相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。表10同。
In the same row, values with the same small letter or no letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as Table 10.
2.6 豆粕TAAA
由表10可知,12个豆粕的17种氨基酸精氨酸(Arg)、组氨酸(His)、异亮氨酸(Ile)、亮氨酸(Leu)、赖氨酸(Lys)、Met、苯丙氨酸(Phe)、苏氨酸(Thr)、缬氨酸(Val)、丙氨酸(Ala)、天冬氨酸(Asp)、Cys、谷氨酸(Glu)、Pro、丝氨酸(Ser)、酪氨酸(Tyr)和Gly真利用率的均值依次为94.38%、84.76%、85.75%、87.56%、89.13%、78.16%、89.27%、82.93%、84.04%、79.04%、84.50%、81.85%、88.52%、87.22%、86.61%、89.17%和80.30%,且不同样品间TAAA差异显著(P<0.05)。除Met、Gly、Cys、Pro和Ser外,豆粕9的TAAA均高于其他豆粕。除Met、Gly、Cys和Ser外,豆粕1的TAAA均低于其他豆粕。豆粕2的Gly和Ser的真利用率值均低于其他豆粕,此外豆粕8的Arg、His、Leu、Phe、Ala和Tyr以及豆粕3的Ile、Lys和Val的真利用率是除豆粕9外均高于其他豆粕。反之,豆粕2的Thr、Ala、Glu、Pro和Tyr以及豆粕5的Arg、His、Leu、Phe和Gly的真利用率是除豆粕1外低于其他豆粕。
3 讨 论
3.1 不同来源豆粕能量营养价值
本试验豆粕营养成分测定值与Dale等[16]以及NRC(1994)公布的数据相一致。本试验EE的CV最大(28.66%),这主要与豆粕压榨或浸出油脂的方式有关。豆粕总能的CV最小,说明总能并不随单一营养成分的高低而变化,是受多种因素影响的。De Coca-Sinova等[17]测定的6种来自南美和美国的不同地区豆粕的干物质、CP、NDF、EE和ash含量及总能分别为88.93%、47.20%、9.02%、1.52%和6.17%及19.790 MJ/kg,稍低于本试验的结果,可能由于豆粕产地、品种、加工和储藏条件不同导致。
本试验中,豆粕2的AMEn和豆粕6的AME、TME和TMEn均低于其他豆粕,可能是由于豆粕2和豆粕6的NDF、ADF和CF含量较高,EE含量和总能较低。对于代谢能比较高的豆粕8和豆粕9,其总能和EE含量高于其他豆粕,而且NDF和ADF的含量均低于平均值,这与Baker[18]的结果一致。Coon等[19]测定不同低聚糖含量的豆粕的代谢能,正常豆粕(CP含量为46.1%)和不含低聚糖豆粕(CP含量为64.4%)TMEn分别为11.690和14.092 MJ/kg。Baker等[20]用TME法,强饲前禁食24 h后,强饲30 g的单一的豆粕,收集48 h排泄物测定,而本试验禁食48 h,强饲对应体重2.0%的饲粮,得到白羽单冠肉鸡的TMEn在高蛋白、低聚糖以及传统豆粕的代谢能值分别为12.987、12.485和12.397 MJ/kg,与之略有差异,可能是由于试验条件和豆粕的加工方式不同所导致的。
3.2 不同来源豆粕氨基酸营养价值
De Coca-Sinova等[17]评定了来自阿根廷、巴西、西班牙和美国的不同来源豆粕的氨基酸时,结果表示,粗蛋白质含量较高的豆粕的含硫氨基酸及氨基酸利用率均高于其他豆粕。Chen等[21]测定传统豆粕和低聚糖豆粕的氨基酸含量,报道可能由于低聚糖豆粕的粗蛋白质含量高,使氨基酸含量也都高于传统豆粕。本试验豆粕9和豆粕10的大部分氨基酸含量高于其他豆粕,这可能与其粗蛋白质含量和加工是否去皮有关。不同豆粕氨基酸含量存在差异,与之前报道的不同来源豆粕Lys含量为2.09%~3.04%和2.87%~3.20%范围基本一致[17,22]。
Dozier等[23]总结不同研究测定的豆粕的氨基酸利用率范围为82%~93%。本试验中Met(78.16%)、Gly(80.30%)、Ala(79.04%)、Cys(81.85%)和Arg(94.38%)与其有一定差异。豆粕9大部分TAAA高于其他豆粕,结合营养成分,其总能(20.041 MJ/kg)和EE含量(2.46%)最高,NDF含量(10.92%)除高于豆粕10(10.80%)和豆粕7(10.84%)外则最低。豆粕1的TAAA低于大部分豆粕,总能(19.414 MJ/kg)和EE含量(1.10%)最低,NDF除低于豆粕6(18.24%)外高于其他豆粕。豆粕9的加工工艺为一浸去皮,豆粕1的加工工艺为二浸带皮,表明TAAA与加工工艺密切相关。此外,此结果与前人报道的豆粕氨基酸利用率与NDF含量呈显著负相关[24]的结果一致。本试验Met(78.16%)的真利用率明显低于Baker等[18]和贾刚等[25]的测定值93.15%,其余TAAA也略低,这可能与试验测定原料和排泄物中氨基酸含量测定方法不一致有关。
4 结 论
① 运用排空强饲法(TME法),禁食48 h+排泄物收集48 h,强饲量为体重2%,可以准确评定成年大恒肉鸡饲粮的代谢能和TAAA。
② 12个不同来源豆粕营养成分差异很大,以EE、CF、NDF和ADF的CV最大,干物质、CP、总能和Ash的差异不明显。
③ 12个不同来源豆粕对于大恒肉鸡的AME、AMEn、TME、TMEn的平均值为12.523、12.933、12.795和12.339 MJ/kg,不同来源差异显著;TAAA平均值:Arg、His、Ile、Leu、Lys、Met、Phe、Thr、Val、Ala、Asp、Cys、Glu、Pro、Ser、Tyr和Gly的真利用率的平均值依次为94.38%、84.76%、85.75%、87.56%、89.13%、78.16%、89.27%、82.93%、84.04%、79.04%、84.50%、81.85%、88.52%、87.22%、86.61%、89.17%和80.30%,不同来源差异显著。总必需氨基酸的TAAA平均值为84.32%,总非必需氨基酸的TAAA平均值为82.29%,总氨基酸的TAAA平均值为82.88%。
参考文献:
[1] MCNAB J M,BLAIR J C.Modified assay for true and apparent metabolisable energy based on tube feeding[J].British Poultry Science,1988,29(4):697-707.
[2] DUDLEY-CASH W A.A landmark contribution to poultry science—a bioassay for true metabolizable energy in feedingstuffs[J].Poultry Science,2009,88(4):832-834.
[3] PARSONS C M.Determination of digestible and available amino acids in meat meal using conventional and caecectomized cockerels or chick growth assays[J].British Journal of Nutrition,1986,56(1):227-240.
[4] SIREGAR A P,FARRELL D J.A comparison of the energy and nitrogen metabolism of fed ducklings and chickens[J].British Poultry Science,1980,21(3):213-227.
[5] SIBBALD I R.The effect of level of feed input on true metabolizable energy values[J].Poultry Science,1977,56(5):1662-1663.
[6] 赵佳.优质肉鸡的玉米代谢能评定及近红外预测模型的构建[D].硕士学位论文.雅安:四川农业大学,2014.
[7] POPPEMA T F,DUKE G E.The effectiveness of ligating or detaching ceca as an alternative to cecectomy[J].Poultry Science,1992,71(8):1384-1390.
[8] ADEOLA O,RAGLAND D,KING D.Feeding and excreta collection techniques in metabolizable energy assays for ducks[J].Poultry Science,1997,76(5):728-732.
[9] 呙于明.家禽营养[M].2版.北京:中国农业大学出版社,2004:403-404.
[10] 张丽英.饲料分析及饲料质量检测技术[M].2版.中国农业大学出版社,2003:48-135.
[11] LIKUSKI H J A,DORRELL H G.A bioassay for rapid determinations of amino acid availability values[J].Poultry Science,1978,57(6):1658-1660.
[12] ASKBRANT S U S.Metabolisable energy content of rapeseed meal,soyabean meal and white-flowered peas determined with laying hens and adult cockerels[J].British Poultry Science,1988,29(3):445-455.
[13] REN L Q,TAN H Z,ZHAO F,et al.Using corn starch as basal diet to determine the true metabolizable energy of protein feedstuffs in Chinese Yellow chickens[J].Poultry Science,2012,91(6):1394-1399.
[14] 丁耿芝.鸡内源能的估测方法与影响因素[J].饲料博览,2011(4):16-17.
[15] SIBBALD I R.Effects of level of feed input,dilution of test material,and duration of excreta collection on true metabolizable energy values[J].Poultry Science,1979,58(5):1325-1329.
[16] DALE N M,FULLER H L.Repeatability of true metabolizable energy versus nitrogen corrected true metabolizable energy values[J].Poultry Science,1986,65(2):352-354.
[17] DE COCA-SINOVA A,VALENCIA D G,JIMÉNEZ-MORENO E,et al.Apparent ileal digestibility of energy,nitrogen,and amino acids of soybean meals of different origin in broilers[J].Poultry Science,2008,87(12):2613-2623.
[18] BAKER K M.Nutritional value of high-protein and low oligosaccharide varieties of soybeans fed to pigs and poultry[D].Master Thesis.Urbana:University of Illinois at Urbana-Champaign,2009.
[19] COON C N,LESKE K L,AKAVANICHAN O,et al.Effect of oligosaccharide-free soybean meal on true metabolizable energy and fiber digestion in adult roosters[J].Poultry Science,1990,69(5):787-793.
[20] BAKER K M,UTTERBACK P L,PARSONS C M,et al.Nutritional value of soybean meal produced from conventional,high-protein,or low-oligosaccharide varieties of soybeans and fed to broiler chicks[J].Poultry Science,2011,90(2):390-395.
[21] CHEN X,PARSONS C M,BAJJALIEH N.Nutritional evaluation of new reduced oligosaccharide soybean meal in poultry[J].Poultry Science,2013,92(7):1830-1836.
[22] VAN KEMPEN T A T G,KIM I B,JANSMAN A J M,et al.Regional and processor variation in the ileal digestible amino acid content of soybean meals measured in growing swine[J].Journal of Animal Science,2002,80(2):429-439.
[23] DOZIER W A,HESS J B.Soybean meal quality and analytical techniques[M].Rijeka:Intech Open Access Publisher,2011.
[24] VAN KEMPEN T A T G,SIMMINS P H.Near-infrared reflectance spectroscopy in precision feed formulation[J].The Journal of Applied Poultry Research,1997,6(4):471-477.
[25] 贾刚,王康宁,黄兰.畜禽可消化氨基酸的测定及应用中应注意的问题[J].湖北农业科学,2010,49(8):2020-2023.
