青稞麸皮阿拉伯木聚糖的提取工艺优化及结构分析
2018-04-20徐中香李季楠
徐中香,胡 浩,李季楠,吴 艳*
青稞(Hordeum vulgare Linn. var. nudum Hook. F.),又称裸大麦、元麦,禾本科大麦属,是我国西北高寒地区极为重要的一种高原谷类作物[1-2]。青稞营养价值丰富,富含β-葡聚糖和阿拉伯木聚糖(arabinoxylan,AX)等非淀粉多糖,具有高蛋白质、高维生素、高纤维、低糖、低脂等特点[2-3]。AX主要存在于谷物麸皮中,质量分数可达干基的20%~25%,而胚乳及籽粒中含量相对较低,质量分数分别为1.5%~2.5%及4%~8%[4]。麸皮AX因与纤维素、木质素等存在共价结合[5],水法提取效果较差,多采用碱法NaOH溶液、饱和Ba(OH)2、Ca(OH)2溶液等提取[6-9],而使用阿拉伯木聚糖酶法亦可提高AX提取率[6]。李雪等[10]比较了不同碱性提取剂对小麦麸皮水不溶性AX的提取效果,发现以NaOH溶液为提取溶剂时,AX得率虽然不如饱和Ba(OH)2溶液提取得率高,但是提取时间短、成本低、工艺简单。Wang Jing等[11]采用超声波辅助酶法优化了小麦麸皮AX的提取工艺,其中得率为14.26%,超声波提高了酶处理效率,进而得率提高。Gong等[12]研究了3 种青稞麸皮中AX质量分数分别为14.21%、18.18%及21.06%,阿拉伯糖与木糖物质的量比值分别为0.83、0.76及0.58。国内外对AX的研究多集中于小麦、大麦及其加工副产物,而对青稞乃至青稞麸皮AX的研究还较少。
本研究采用碱法提取青稞麸皮AX,研究料液比、提取温度、提取时间、NaOH质量浓度对青稞麸皮AX提取的影响,通过响应面法优化AX的最佳提取工艺。采用高效凝胶渗透色谱(high-performance gel permeation chromatography,HPGPC)对青稞麸皮AX进行纯度鉴定,紫外吸收光谱、红外吸收光谱和高效阴离子色谱法对其结构进行初步分析,旨在为青稞麸皮AX的进一步开发应用提供理论依据。
1 材料与方法
1.1 材料与试剂
青稞麸皮(品种:肚里黄)产地为青海省贵南市,青稞麸皮粉碎后过40 目筛备用。
考马斯亮蓝试剂盒、耐高温α-淀粉酶、透析袋上海源叶生物科技有限公司;氢氧化钠、乙酸钠、硝酸钠、盐酸、硫酸、苯酚、三氟乙酸、乙醇、葡萄糖均为国产分析纯。
1.2 仪器与设备
SF-2000高速粉碎机 上海市药材有限公司;R206B旋转蒸发仪 上海申生科技有限公司;SHB-III循环水式真空泵 上海诚育仪器设备有限公司;TD5A-WS台式低速离心机 湖南湘仪实验室仪器开发有限公司;U1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;HWS24型电热恒温水浴锅 上海恒科学仪器有限公司;冷冻干燥机 上海比朗仪器制造有限公司;MDF-U52V超低温冰箱 日本Sanyo公司;Mili-Q超纯水系统 美国Millipore公司;PL203电子天平梅特勒-托利多仪器(上海)有限公司;ICS-5000离子色谱仪 美国戴安公司;Waters E2695高效液相色谱仪美国沃特世公司。
1.3 方法
1.3.1 青稞麸皮预处理
青稞麸皮粉中加入10 倍体积的体积分数95%乙醇溶液,不断搅拌,浸泡1 d,除去小分子、低聚糖、挥发油等物质[13]。将除去乙醇的青稞麸皮于60 ℃烘箱中过夜干燥。向脱脂后的青稞麸皮去离子水体系中(料液比1∶10(g/mL))加入耐高温α-淀粉酶,95 ℃水浴30 min[14]。60 ℃烘箱中过夜干燥得到脱脂除淀粉的青稞麸皮粉。
1.3.2 碱提工艺
青稞麸皮预处理粉→加入NaOH溶液→水浴振荡→离心→等电点除蛋白[15]→旋转蒸发浓缩→去离子水透析→乙醇沉淀→离心后水复溶→冷冻干燥→青稞麸皮AX。
1.3.3 AX得率计算
采用苯酚-硫酸比色法测定多糖的含量[16],以葡萄糖制作标准曲线,测得提取液中多糖含量后,按下式计算样品中多糖得率(以预处理粉计):

式中:C为提取液中多糖质量浓度/(μg/mL);V为提取液体积/mL;n为提取液稀释倍数;m为预处理粉质量/g。
1.3.4 单因素试验
固定基本提取参数为料液比1∶15(g/mL)、提取温度25 ℃、提取时间2 h、NaOH质量浓度10 g/L。在基本提取参数下,分别考察料液比(1∶10、1∶15、1∶20、1∶25、1∶30(g/mL))、提取温度(25、35、45、55、65 ℃)、提取时间(1、2、3、4、5 h)、NaOH质量浓度(1、5、10、15、25 g/L)4 个单因素对AX得率的影响。
1.3.5 响应面试验
在单因素试验的基础上,以料液比、提取温度、提取时间、NaOH质量浓度为自变量,以AX得率为响应值,采用Box-Behnken响应面设计原理[17],以青稞麸皮AX得率为指标,采用SAS V8.0分析软件设计四因素三水平响应面组合设计,对碱法提取AX工艺参数进行优化。试验因素与水平设计见表1。
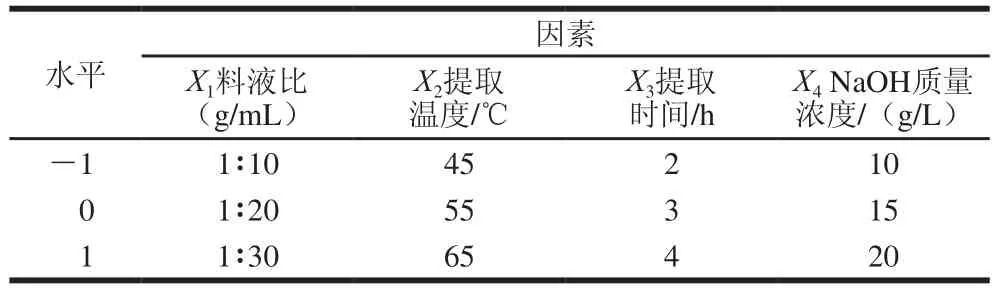
表1 AX提取工艺优化响应面分析试验因素与水平Table 1 Independent variables and their coded values tested in response surface analysis
1.3.6 青稞麸皮AX纯度鉴定
青稞麸皮AX经过多次乙醇沉淀后,采用HPGPC法对其进行纯度鉴定。色谱条件:Ultrahydrogel liner柱(7.8 mm×300 mm),示差折光检测器,柱温、检测器温度35 ℃,0.10 mol/L NaNO3溶液为流动相,流速0.6 mL/min。流动相溶解样品,配制青稞麸皮AX溶液2 mg/mL,过0.45 µm微孔过滤膜后,供进样分析。
1.3.7 青稞麸皮AX紫外光谱分析
配制青稞麸皮AX溶液0.5 mg/mL,于紫外-可见分光光度计中进行波长190~400 nm范围内紫外光谱扫描。
1.3.8 青稞麸皮AX红外光谱分析
将2.0 mg多糖干燥样品,与200 mg KBr研磨后压片,在4 000~400 cm-1区域内进行红外光谱扫描。
1.3.9 青稞麸皮AX单糖组成分析
采用带有脉冲安培检测器的高效离子交换色谱系统测定单糖组成[18]。取多糖样品5 mg于具塞管中,加入2 mol/L的三氟乙酸溶液2 mL于121 ℃水解2 h,氮吹除去过量的三氟乙酸,加水溶解定容后过0.45 µm微孔过滤膜,供进样分析[19]。
色谱柱:CarboPac PA20;流动相A:H2O;B:250 mmol/L NaOH溶液;C:1 mol/L CH3COONa溶液,三元梯度洗脱程序见表2;流速:0.5 mL/min;积分脉冲安培检测器。
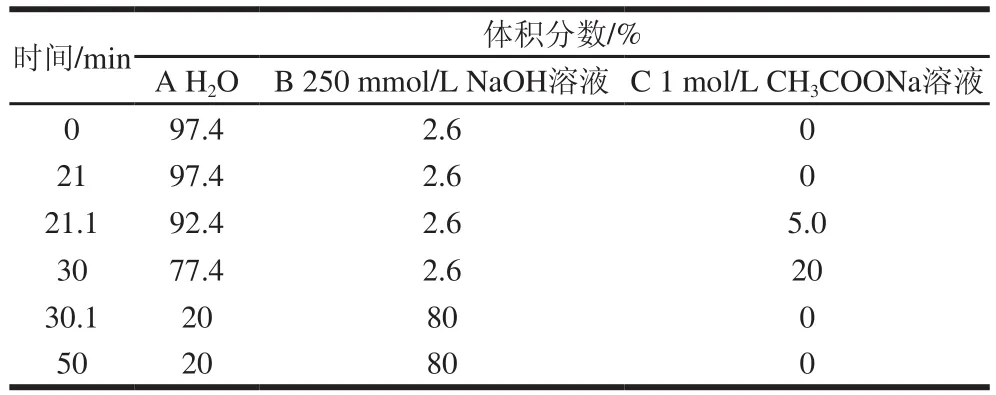
表2 AX单糖组成分析梯度淋洗程序Table 2 Gradient elution procedure for monosaccharide composition analysis of AX
2 结果与分析
2.1 青稞麸皮AX提取单因素试验结果
2.1.1 料液比对青稞麸皮AX得率的影响
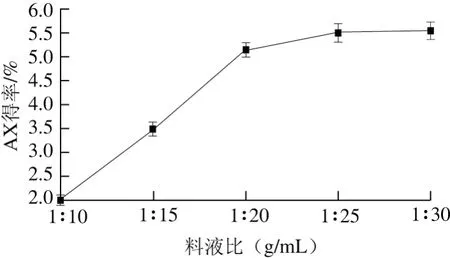
图1 料液比对青稞麸皮AX得率的影响Fig. 1 Effect of solid to solvent ratio on the extraction efficiency of AX
由图1可知,低溶剂用量时料液呈糊状,不利于AX的溶出,因而AX得率较低。随着溶剂用量的增加,麸皮粉与溶剂充分接触,加速AX的溶出。料液比1∶20(g/mL)前,AX得率随着溶剂用量的提高快速增大,料液比1∶20(g/mL)后得率增加趋于平缓,提高不再明显。鉴于后续旋蒸浓缩的易操作性及经济角度,确定最佳料液比为1∶20(g/mL)。
2.1.2 提取温度对青稞麸皮AX得率的影响

图2 提取温度对青稞麸皮AX得率的影响Fig. 2 Effect of extraction temperature on the extraction efficiency of AX
由图2可知,青稞AX得率对提取温度依赖性较高,提取温度的升高显著提高了AX得率,低于55 ℃前随着温度的升高得率快速上升,高于55 ℃后得率趋于平缓。虽然较高温度利于AX的提取,但高温下得到的AX颜色明显加深,其中色素等杂质较高,不利于后续的纯化,此外,高温会导致多糖的降解。因此确定最佳提取温度为55 ℃。
2.1.3 提取时间对青稞麸皮AX得率的影响
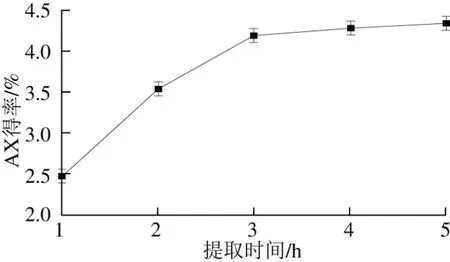
图3 提取时间对青稞麸皮AX得率的影响Fig. 3 Effect of extraction time on the extraction efficiency of AX
由图3可知,提取时间较短时,青稞麸皮中的AX尚未充分溶解出来,随着提取时间的延长,AX得率总体呈现上升趋势,但3 h后增速较慢,渐趋于平缓。因此从提取周期及能耗角度,确定最佳提取时间为3 h。
2.1.4 NaOH质量浓度对青稞麸皮AX得率的影响
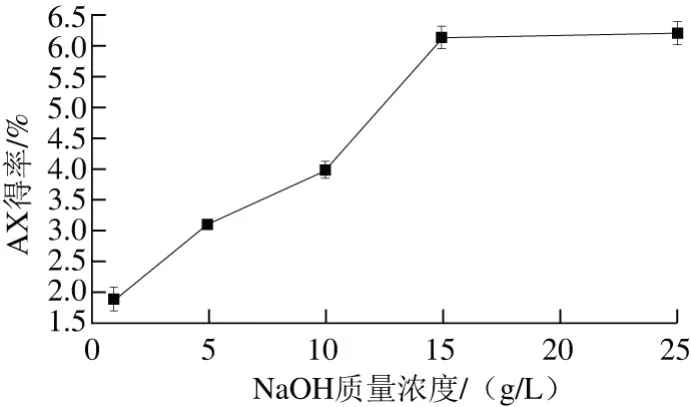
图4 NaOH质量浓度对青稞麸皮AX得率的影响Fig. 4 Effect of sodium hydroxide concentration on the extraction efficiency of AX
由图4可知,AX作为植物细胞壁多糖,不仅与材料中的木质素、纤维素等存在复杂的物理缠绕,与多糖、蛋白质之间还存在着以阿魏酰相连的共价键[20],因而在极低的碱浓度下,绝大部分AX无法溶出,得率极低,这也是AX一般均采用碱提法提取的主要原因。NaOH的质量浓度为1~5 g/L时,AX得率增速较低,质量浓度为15 g/L时,得率显著提高,此后得率有所提高但较平缓。虽然溶剂浓度越大越利于物质的溶出,但因麸皮中含有较多色素物质,AX得率提高的同时也伴随着其他杂质(色素、蛋白、木质素等)的溶出。因此从后续除杂及经济角度,确定最佳NaOH质量浓度为15 g/L。
2.2 青稞麸皮AX提取的响应面分析
2.2.1 响应面试验设计与结果
响应面试验设计及结果见表3,共27 个试验点,其中包括24 个析因试验点,其自变量取值在各因素构成三维顶点,3 个中心试验点,用于估计试验误差。采用SAS V8.0软件对试验数据进行分析,得到青稞麸皮AX得率与各变量的二次多项方程的数学回归模型为:Y=14.256 67+1.810 833X1+0.22X2+0.695X3+0.269 167X4-2.138 333X12-0.307 083X22-0.932 083X32-0.858 333X42-0.122 5X1X2-0.137 5X1X3+0.217 5X1X4-0.145X2X3-0.137 5X2X4-0.242 5X3X4。
由表4可知,该回归模型P值小于0.000 1,说明该模型极显著,其响应值与各试验因素之间存在显著的线性相关性;R2值为0.998 3,R2Adj值为0.996 3,说明该模型与试验值拟合较好,能很好地表述青稞麸皮AX提取过程中其得率随提取条件的变化规律;失拟项P值为0.332 4,不显著,同样确定了模型的可行性;自变量X1、X2、X3、X4的P值均小于0.000 1,说明它们对AX得率都有极显著的影响,而据自变量的F值可判断各因素对AX得率的影响由大到小依次为:X1>X3>X4>X2;交互项X1X2、X1X3、X1X4、X2X3、X2X4、X3X4P值小于0.05,均影响显著,说明各因素对AX得率均有显著的交互作用。
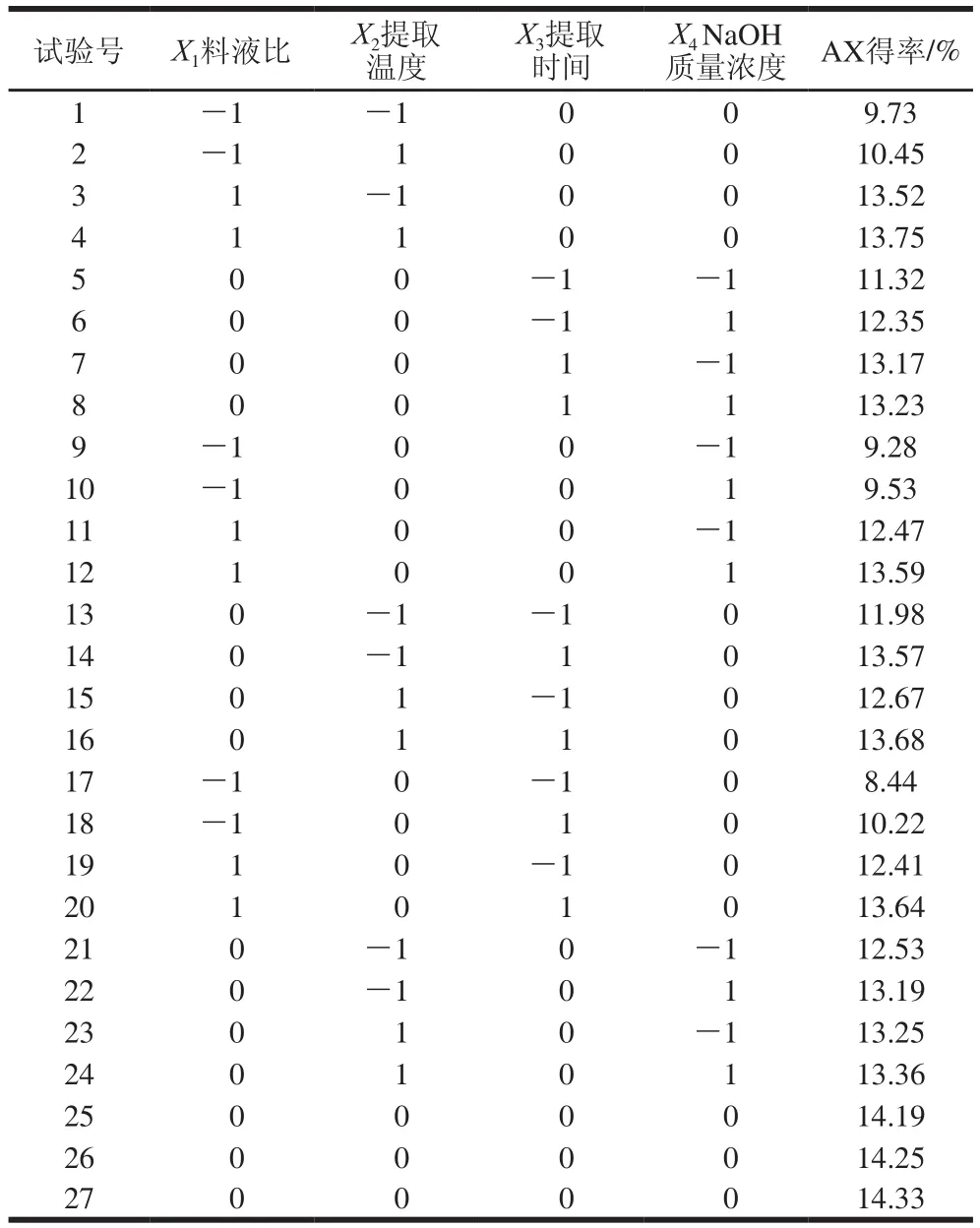
表3 青稞麸皮AX提取工艺优化响应面分析试验设计及结果Table 3 Experimental design and corresponding results for response surface analysis
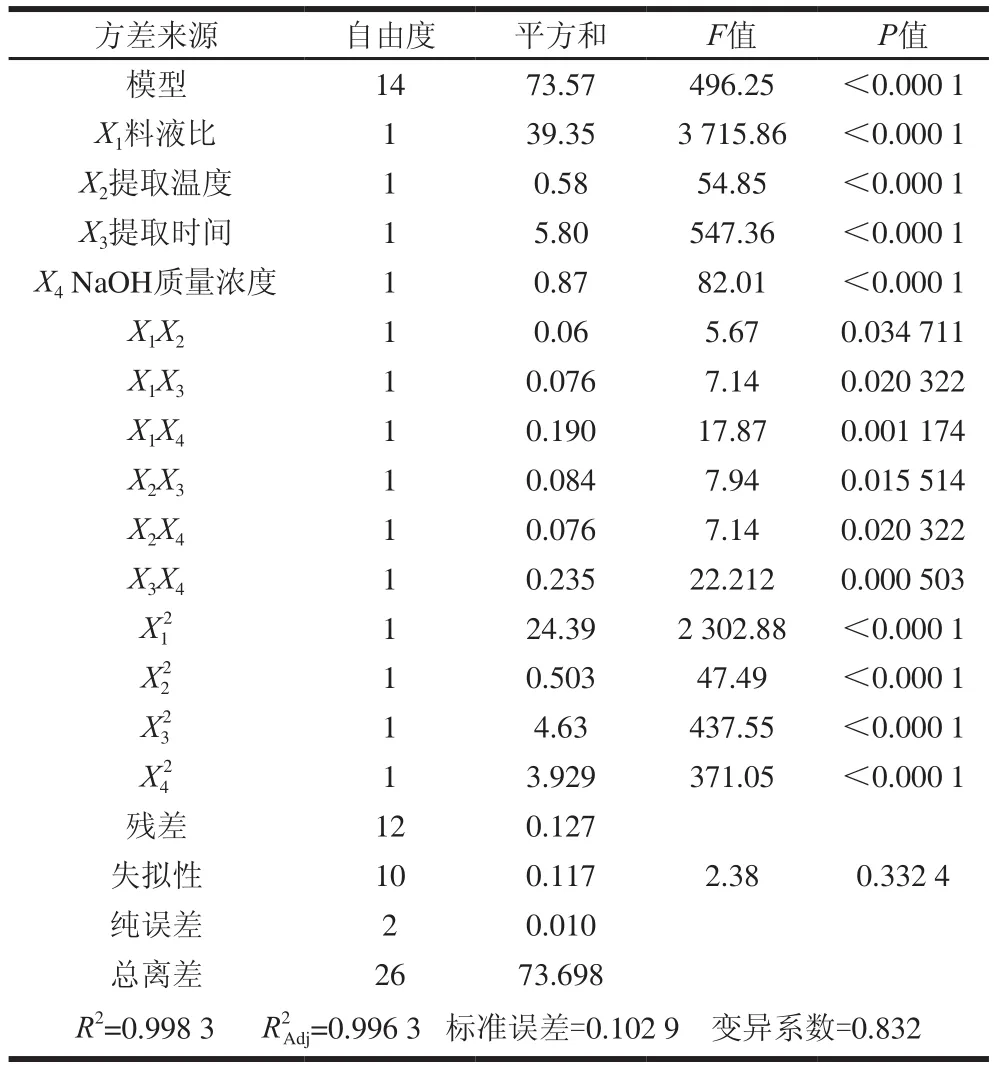
表4 响应面模型方差分析Table 4 Analysis of variance (ANOVA) for response surface quadratic regression model
2.2.2 响应面交互作用分析
响应面及等高线图可分析因素对AX得率的交互作用并确定最佳提取参数。等高线形状可反映各因素间交互作用的强弱,椭圆形表示两因素交互作用显著,圆形则相反[11]。
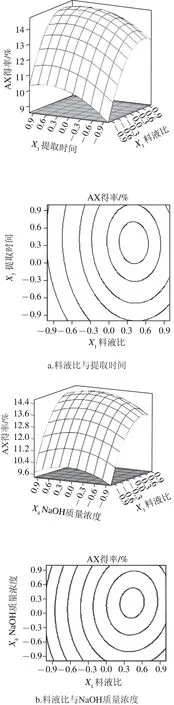
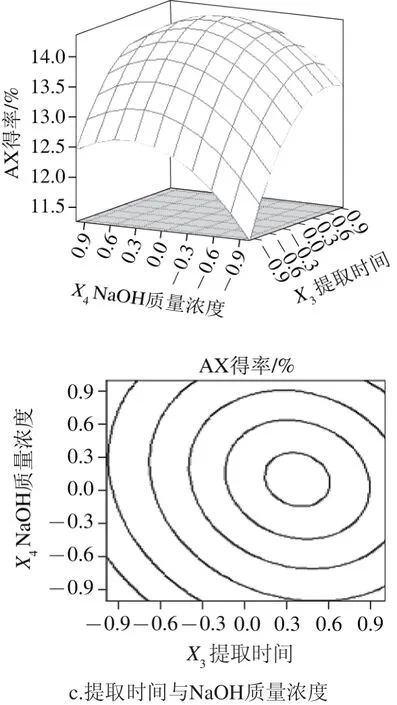
图5 两因素交互作用对提取效果影响的响应面及等高线图Fig. 5 Response surface and contour plots showing the interactive effects of factors on extraction efficiency
选取3 组交互作用作响应面图,其他两因素水平取0。由图5a可知,AX得率随着料液比和提取时间水平的增大而提高,但当两者达到一定组合后,AX得率趋于平缓,两者交互作用显著。可能是当料液比和提取时间达到一定值后,AX得到了充分提取,再之后水平提高AX得率增加不再显著。由图5b可知,在一定范围内,AX得率随着料液比及NaOH质量浓度水平的增加显著提高,而当两者达到一定组合后,AX得率随着组合条件的提高而呈缓慢下降趋势。可能是过高的NaOH质量浓度造成了部分多糖的降解。由图5c可知,在一定范围内,随着提取时间的延长,AX得率不断增加,当提取时间超过3.5 h后,AX得率趋于稳定;此条件下NaOH质量浓度对AX得率的影响与图5b类似,两者交互作用显著。
2.2.3 最佳工艺条件的确定及模型验证
回归模型预测的青稞麸皮AX最佳提取工艺参数为料液比1∶25(g/mL)、提取温度55 ℃、提取时间3 h、NaOH质量浓度15 g/L,在此条件下,AX得率可达14.27%。以确定的最佳工艺参数进行3 次青稞麸皮AX提取的平行实验,得到AX得率平均值为14.31%,接近回归方程所得AX得率的预测值。说明回归方程能较真实地反映各因素对青稞麸皮AX得率的影响,采用响应面分析方法优化得到的提取工艺参数准确可靠。
2.3 青稞麸皮AX的纯度鉴定
HPGPC因其快速、简便和高分辨率等优点,是目前多糖纯度鉴定最常用的方法。青稞麸皮AX的高效液相色谱图如图6所示,在其纯度检测中,只有一个对称的信号峰,可见其均一性较好,可以认为该青稞麸皮AX为单一组分的多糖聚合物。

图6 青稞麸皮AX HPGPC法纯度测定Fig. 6 HPGPC analysis of AX
2.4 青稞麸皮AX的紫外光谱分析
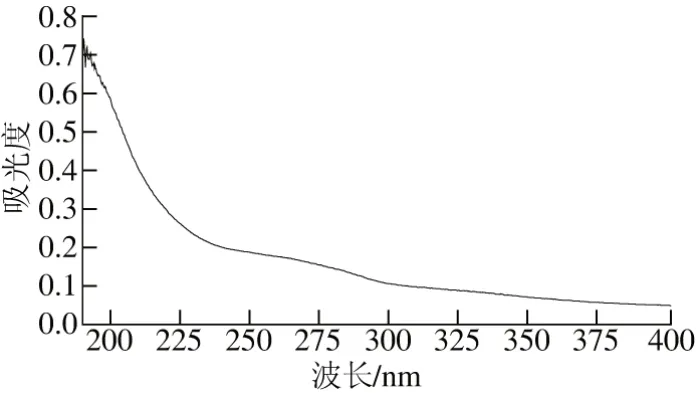
图7 青稞麸皮AX紫外吸收光谱图Fig. 7 UV absorption spectrum of AX
由图7可知,青稞麸皮AX在192 nm波长处有一个较强的吸收峰,这是多糖的特征吸收峰,在280 nm波长处有微弱的吸收,说明青稞麸皮AX中含有少量蛋白质,而在260 nm波长处无吸收峰,说明该多糖中不含核酸[20]。
2.5 青稞麸皮AX的红外光谱分析
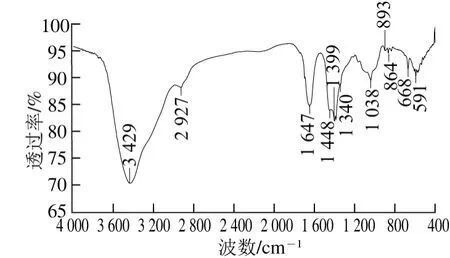
图8 青稞麸皮AX红外吸收光谱图Fig. 8 Fourier transform infrared spectrum of AX
由图8可知,3 429 cm-1处的吸收峰是—OH的伸缩振动吸收峰,宽吸收峰说明存在分子内和分子间氢键;2 927 cm-1处的吸收峰是—CH的伸缩振动吸收峰;1 647 cm-1处的吸收峰是—C=O的伸缩振动;1 448 cm-1、1 399 cm-1处吸收峰是—CH2的变形吸收峰;1 340 cm-1处吸收峰是—CH弯曲振动吸收峰;1 038 cm-1处的则是醇羟基—OH的变角振动吸收峰。在893 cm-1处存在β-糖苷键的特征吸收峰,该多糖结构中存在β-多糖[12,21-24],在864 cm-1处存在α-糖苷键的特征吸收峰,该多糖结构中存在α-多糖[25-26]。而据文献报道,AX结构的主链是由β-D-吡喃木糖残基经β-(1→4)糖苷键连接而成的木聚糖,在C2和C3位β-D-木糖残基可被α-L-呋喃阿拉伯糖取代,形成多分支结构[27]。说明青稞麸皮中提取的多糖符合AX的结构特征。
2.6 青稞麸皮AX的单糖组成
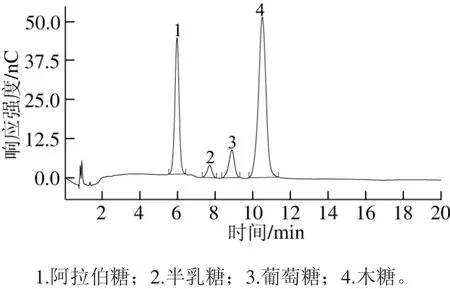
图9 AX的高效阴离子交换色谱Fig. 9 High performance anion exchange chromatogram of AX
根据各单糖标样与多糖样品的保留时间确定其单糖的种类,根据各峰面积计算样品中各单糖的物质的量比。由图9可得,青稞麸皮AX主要由阿拉伯糖、半乳糖、葡萄糖、木糖4 种单糖组成,单糖对应的物质的量比为11.61∶1∶3.62∶18,可以确定提取的青稞麸皮多糖中主要物质为AX,且杂质糖含量较低,阿拉伯糖与木糖物质的量比值为0.645。Izydorczyk等[28]对一种加拿大蜡质裸大麦糊粉层组织中AX的研究显示,阿拉伯糖-半乳糖-葡萄糖-木糖物质的量比为13.43∶1∶12.86∶20.33,阿拉伯糖与木糖物质的量比值为0.66,该实验中阿拉伯糖与木糖物质的量比值与本实验比值相近,但其中葡萄糖含量较高。Skendi等[29]发现,小麦中提取的多糖阿拉伯糖与木糖物质的量比值在0.57~0.71之间,而Rattan等[30]发现,小麦粉中阿拉伯糖与木糖物质的量比值在0.61~0.68之间,可见来源不同时其值会有不同。
3 结 论
本实验通过Box-Behnken试验设计建立了料液比、提取温度、提取时间及NaOH质量浓度4个影响因素与响应值青稞麸皮AX得率相互作用的数学模型,并对试验结果进行了模拟和预测,优化后的最佳提取工艺为料液比1∶25(g/mL)、提取温度55 ℃、提取时间3 h、NaOH质量浓度15 g/L。在此条件下AX得率为14.31%,与理论值14.27%无显著差异。提取工艺的优化为青稞麸皮AX的进一步理化研究奠定了基础。对青稞麸皮AX的结构做了初步分析,HPGPC结果表明青稞麸皮AX均一性较好,可认为其为单一组分的多糖聚合物;紫外光谱检测结果表明青稞麸皮AX中含有微量蛋白质,不含核酸;红外光谱分析结果表明该多糖具有多糖特征吸收,并且含有α、β-糖苷键结构;高效离子交换色谱结果表明青稞麸皮AX的主要单糖组成为阿拉伯糖、半乳糖、葡萄糖、木糖,阿拉伯糖-半乳糖-葡萄糖-木糖物质的量比为11.61∶1∶3.62∶18,阿拉伯糖与木糖物质的量比值为0.645。阿拉伯糖与木糖物质的量比值一定程度上反映了多糖结构分支程度,谷物中该比值在0.3~1.1之间,而大麦糊粉层中阿拉伯糖与木糖物质的量比值在大麦AX提取物中最低,在0.56~0.66之间,反映了大麦糊粉层AX的分支度低[31]。本实验中青稞麸皮AX主要单糖组成为阿拉伯糖和木糖,分支度较低,与前人对大麦中AX的研究结果基本一致。
参考文献:
[1] 姚豪颖叶. 青稞中β-葡聚糖与阿拉伯木聚糖的分离纯化与结构表征[D].南昌: 南昌大学, 2016.
[2] 吕远平, 熊茉君, 贾利蓉, 等. 青稞特性及在食品中的应用[J]. 食品科学, 2005, 26(7): 266-270. DOI:10.3321/j.issn:1002-6630.2005.07.065.
[3] 姜忠杰, 李国明, 周明, 等. 青稞麸皮可溶性粗多糖的提取及其抗氧化性研究[J]. 中国食品添加剂, 2012(6): 70-77. DOI:10.3969/j.issn.1006-2513.2012.06.002.
[4] 苏东民, 李雪, 苏东海, 等. 小麦阿拉伯木聚糖及其功能性质研究进展[J]. 河南工业大学学报(自然科学版), 2012(4): 85-90.
[5] IZYDORCZYK M S. 23-Arabinoxylans[M]//Woodhead Publishing Series in Food Science, Technology and Nutrition. Woodhead Publishing, 2009: 653-692. DOI:10.1533/9781845695873.653.
[6] 张晓娜, 王世平, 周素梅, 等. 小麦麸皮阿拉伯木聚糖碱提工艺条件优化研究[J]. 核农学报, 2008(1): 60-64.
[7] ZHANG Z, SMITH C, LI W. Extraction and modification technology of arabinoxylans from cereal by-products: a critical review[J].Food Research International, 2014, 65: 423-436. DOI:10.1016/j.foodres.2014.05.068.
[8] 牟振坤. 不同小麦品种阿拉伯木聚糖基本构成及性能的研究[D].内蒙古: 内蒙古农业大学, 2010.
[9] 周素梅, 王强, 张晓娜. 小麦中功能性多糖-阿拉伯木聚糖研究进展[J].核农学报, 2009(2): 297-301.
[10] 李雪, 苏东民, 苏东海, 等. 不同碱性提取剂对小麦麸皮水不溶性阿拉伯木聚糖提取效果的比较研究[J]. 中国农学通报, 2012(21): 272-276. DOI:10.3969/j.issn.1000-6850.2012.21.049.
[11] WANG J, SUN B, LIU Y, et al. Optimisation of ultrasoundassisted enzymatic extraction of arabinoxylan from wheat bran[J]. Food Chemistry, 2014, 150: 482-488. DOI:10.1016/j.foodchem.2013.10.121.
[12] GONG L, JIN C, WU X, et al. Determination of arabinoxylans in Tibetan hull-less barley bran[J]. Procedia Engineering, 2012, 37: 218-222. DOI:10.1016/j.proeng.2012.04.230.
[13] PAVLOVICH-ABRIL A, ROUZAUD-SÁNDEZ O, CARVAJALMILLÁN E, et al. Molecular characterization of water extractable arabinoxylans isolated from wheat fine bran and their effect on dough viscosity[J]. LWT-Food Science and Technology, 2016, 74: 484-492.DOI:10.1016/j.lwt.2016.08.007.
[14] AGUEDO M, FOUGNIES C, DERMIENCE M, et al. Extraction by three processes of arabinoxylans from wheat bran and characterization of the fractions obtained[J]. Carbohydrate Polymers, 2014, 105: 317-324. DOI:10.1016/j.carbpol.2014.01.096.
[15] 王珊, 黄胜阳. 植物多糖提取液脱蛋白方法的研究进展[J]. 食品科技, 2012(9): 188-191.
[16] WU Y, CUI S W, TANG J, et al. Optimization of extraction process of crude polysaccharides from boat-fruited sterculia seeds by response surface methodology[J]. Food Chemistry, 2007, 105(4): 1599-1605.DOI:10.1016/j.foodchem.2007.03.066.
[17] 马栋, 邹妍, 龚倩云, 等. 响应面法优化青稞β-葡聚糖提取条件的研究[J]. 食品工业科技, 2012(1): 204-206.
[18] 牟世芬, 于泓, 蔡亚岐. 糖的高效阴离子交换色谱-脉冲安培检测法分析[J]. 色谱, 2009, 27(5): 667-674. DOI:10.3321/j.issn:1000-8713.2009.05.019.
[19] 戴军, 梁丽娜, 尹鸿萍, 等. 高效阴离子交换色谱法分析杜氏盐藻多糖的单糖组成[J]. 食品与发酵工业, 2006, 32(11): 131-135.DOI:10.3321/j.issn:0253-990X.2006.11.033.
[20] FAUROT A, SAULNIER L, BÉROT S, et al. Large scale isolation of water-soluble and water-insoluble pentosans from wheat flour[J].LWT-Food Science and Technology, 1995, 28(4): 436-441.DOI:10.1016/0023-6438(95)90028-4.
[21] CHEN R, LI H, LI S, et al. Extraction optimization, preliminary characterization and immunological activity of polysaccharides from figs[J]. International Journal of Biological Macromolecules, 2015, 72:185-194. DOI:10.1016/j.ijbiomac.2014.08.021.
[22] 王海, 李里特, 石波. 玉米芯木聚糖和桦木木聚糖组成成分及结构的研究[J]. 食品科学, 2004, 25(S1): 38-44. DOI:10.3321/j.issn:1002-6630.2004.z1.008.
[23] ESCARNOT E, AGUEDO M, AGNEESSENS R, et al. Extraction and characterization of water-extractable and water-unextractable arabinoxylans from spelt bran: study of the hydrolysis conditions for monosaccharides analysis[J]. Journal of Cereal Science, 2011, 53(1):45-52. DOI:10.1016/j.jcs.2010.09.002.
[24] SÁROSSY Z, TENKANEN M, PITKÄNEN L, et al. Extraction and chemical characterization of rye arabinoxylan and the effect of β-glucan on the mechanical and barrier properties of cast arabinoxylan films[J]. Food Hydrocolloids, 2013, 30(1): 206-216. DOI:10.1016/j.foodhyd.2012.05.022.
[25] 夏朝红, 戴奇, 房韦, 等. 几种多糖的红外光谱研究[J]. 武汉理工大学学报, 2007(1): 45-47. DOI:10.3321/j.issn:1671-4431.2007.01.012.
[26] SUN Y, CUI S W, GU X, et al. Isolation and structural characterization of water unextractable arabinoxylans from Chinese black-grained wheat bran[J]. Carbohydrate Polymers, 2011, 85(3): 615-621.DOI:10.1016/j.carbpol.2011.03.021.
[27] COELHO E, ROCHA M A M, MOREIRA A S P, et al. Revisiting the structural features of arabinoxylans from brewers’ spent grain[J].Carbohydrate Polymers, 2016, 139: 167-176. DOI:10.1016/j.carbpol.2015.12.006.
[28] IZYDORCZYK M S, DEXTER J E. Barley β-glucans and arabinoxylans: molecular structure, physicochemical properties, and uses in food products: a review[J]. Food Research International, 2008,41(9): 850-868. DOI:10.1016/j.foodres.2008.04.001.
[29] SKENDI A, BILIADERIS C G, IZYDORCZYK M S, et al. Structural variation and rheological properties of water-extractable arabinoxylans from six Greek wheat cultivars[J]. Food Chemistry, 2011, 126(2): 526-536. DOI:10.1016/j.foodchem.2010.11.038.
[30] RATTAN O, IZYDORCZYK M S, BILIADERIS C G. Structure and rheological behaviour of arabinoxylans from Canadian bread wheat flours[J]. LWT-Food Science and Technology, 1994, 27(6): 550-555.DOI:10.1006/fstl.1994.1108.
[31] IZYDORCZYK M S. Variations in content and molecular structure of barley nonstarch polysaccharides associated with genotypic and cellular origin[J]. Cereal Chemistry, 2010, 87(4): 376-384.DOI:10.1094/CCHEM-87-4-0376.
