羟基氧化钴长余辉纳米探针用于食品中VC的检测
2018-04-20刘瑶瑶刘敬民张咚咚方国臻
刘瑶瑶,刘敬民,张咚咚,葛 琨,方国臻,*,王 硕
VC,又名L-抗坏血酸,是一种天然抗氧化的水溶性维生素,存在于许多水果和蔬菜中[1-2]。由于人体内缺乏合成VC所需的古洛糖酸内酯氧化酶,所以自身并不能合成VC,必须从外界食物中获取[3-4]。VC具有强的还原性,可保护其他抗氧化剂,如VE、谷胱甘肽(glutathione,GSH)、不饱和脂肪酸、酶以抵御自由基对人体的损害[5-6]。当从外界摄入VC不足时,可导致坏血病,造成机体内血管系统崩溃、皮下及肌肉出血、牙齿脱落及各种心脏和血管疾病[7-10]。目前,VC每日推荐摄入量为70~90 mg,活体内的代谢动力学和医学研究表明,每人每天VC摄入超过400 mg后没有明显的生物价值,每日的安全剂量应少于1 000 mg,摄入过量时也会引起胃酸、腹泻、草酸及尿酸结石及皮疹等不良反应[11]。近年来,VC是果蔬及食品贮藏过程中的营养衡量指标,因此其研究检测越来越受到关注。目前普遍的检测技术如2,6-二氯靛酚钠法、碘量滴定法[12]、高效液相色谱法[13]、电化学法[14]、毛细管电泳法[15]和荧光法[16]已被用于定量食品、药物和植物中的VC的含量。在以上方法中,荧光分析法由于快速、灵敏度高,逐渐成为检测VC最具潜在发展的方法之一。
长余辉纳米材料(persistent luminescent nanomaterials,PLNPs)是一种被高能激发(可见光、紫外光、X射线、γ射线、电子束等)后可产生可见或者近红外区域长时间发光的特殊纳米材料,这样的发光从激发停止后可以持续几秒、几小时甚至是几天[17]。PLNPs作为一种荧光纳米材料具有超强且稳定的发光性能,可避免光漂白现象,用于生物活性分子的光学检测。其次,PLNPs作为光致发光材料,能够有效贮存激发能量延迟发光用于生物成像[18-19]。与目前检测VC已报道的金、银及一些纳米复合材料相比[20-22],PLNPs性质稳定,成本低。此外,由于制备的PLNPs具有持久的近红外(nearinfrared,NIR)余辉性能,可在生物检测分析之前进行体外激发,避免原位激发带来的背景噪音,可显著提高检测灵敏度[23-24]。本研究为PLNPs进一步用于细胞及活体内VC的监测与成像进行了探索,对拓展基于先进功能纳米材料在食品营养学中的研究手段具有重要意义。
本实验以制备的NIR发光的ZGGO∶Cr3+, Yb3+, Er3+PLNPs作为光学信号单元,羟基氧化钴(CoOOH)作为猝灭剂,构建了一种CoOOH-PLNPs光学探针,基于VC对CoOOH的氧化还原反应原理,实现快速对食品中VC的检测。
1 材料与方法
1.1 材料与试剂
猕猴桃、柠檬、草莓 市购;氧化镓、氧化锗、硝酸铬、硝酸锌、硝酸镱、硝酸铒(均为分析纯) 上海Aladdin生化科技股份有限公司;油酸、甲苯、氯化钴(均为分析纯) 阿尔法爱莎有限公司;氢氧化钠、次氯酸钠、叔丁胺、乙醇(均为分析纯) 国药集团化学试剂有限公司;VC标品 美国Sigma-Aldrich公司。
1.2 仪器与设备
Luminence荧光分光光度计 美国Thermo Fisher Scientific公司;Cary 50-Bio UV-Vis紫外-可见分光光度计 美国Varian公司;VECTOR-22傅里叶变换红外光谱仪 德国Bruker公司;2010 FEF透射电镜 日本JEOL公司;D8 Venture X-射线多晶衍射 日本PHI公司。
1.3 方法
1.3.1 材料的合成和制备
1.3.1.1 Zn2.75Ge0.25O4∶0.5%Cr3+, 2.5%Yb3+, 0.25%Er3+PLNPs的制备
Zn2.75Ge0.25O4∶0.5%Cr3+, 2.5%Yb3+, 0.25%Er3+PLNPs的制备参照Li Yujie等[25]的方法。合成过程如下:在100 mL圆底烧瓶中,依次加入10 mL 0.6 mol/L Zn(NO3)2溶液和20 mL 0.6 mol/L Ga(NO3)3溶液,磁力搅拌10 min使其混合均匀后依次加入300 μL 0.1 mol/L Cr(NO3)3溶液、1 500 μL 0.1 mol/L Yb(NO3)3·5H2O,150 μL 0.1 mol/L Er(NO3)3·5H2O和10 mL 0.1 mol/L的GeO2混合搅拌1 h。用叔丁胺调节pH值至8进行共沉淀,加入适量油酸和甲苯,继续搅拌2 h。搅拌结束后,经超声处理,将形成的白色乳浊液转移到反应釜中,置于160 ℃的烘箱中进行水热反应24 h。待自然冷却至室温后,加入大量无水乙醇,产生沉淀,7 000 r/min离心10 min收取沉淀物,用无水乙醇洗涤3 次。将离心好的沉淀置于80 ℃烘箱中干燥3 h后,研磨,放于马弗炉中1 000 ℃煅烧1 h。
将制备好的PLNPs,用乙醇湿研2~3 遍,重新悬浮于5 mmol/L的NaOH溶液中搅拌过夜。于4 500 r/min离心取上层液体,冷冻干燥备用。以上所有使用的玻璃器皿在实验前用新鲜配制的王水(HCl-HNO3(3∶1,V/V))浸泡,并用超纯水彻底冲洗干净并干燥后使用。
1.3.1.2 CoOOH纳米粒子的制备
CoOOH纳米粒子的制备参照Li Na等[26]的方法。各取预先配制好的100 μL 0.8 mol/L的NaOH溶液,100 μL 1 mol/L的NaClO溶液混合均匀,加入一定量5 mmol/L的CoCl2溶液,超声反应1 min后,反应混合物10 000 r/min离心10 min弃去上清得到CoOOH。用超纯水洗涤CoOOH 3 次,最终分散至1 mL超纯水中。
1.3.1.3 CoOOH-PLNPs的制备
将上述合成的羟基化PLNPs用超纯水配制成5 mg/mL悬浮液,超声30 min以分散均匀。取100 μL 5 mg/mL的PLNPs于1.5 mL离心管中,在超声中加入30 μL 5 mmol/L预先配制好的CoCl2,0.8 mol/L NaOH和1 mol/L NaClO溶液各100 μL,超声2 min,即得到CoOOH-PLNPs。将CoOOH-PLNPs洗涤3 次,重悬于1 mL超纯水中,使探针的最终质量浓度为0.5 mg/mL。
1.3.2 合成材料的表征
为了更加充分地考察Zn2.75Ge0.25O4∶0.5%Cr3+,2.5%Yb3+, 0.25%Er3+PLNPs(ZGGO∶Cr3+, Yb3+, Er3+PLNPs)、CoOOH和CoOOH-PLNPs材料的发光性能、晶体结构、相貌尺寸和元素及结构组成等特征,本实验对制备的材料进行一系列表征。
1.3.2.1 紫外及荧光光谱分析
实验分别对ZGGO∶Cr3+, Yb3+, Er3+PLNPs、CoOOH和CoOOH-PLNPs 3 种粒子进行了紫外吸收光谱扫描,对PLNPs进行了荧光光谱扫描。紫外分析条件:扫描速率240 nm/min,扫描波长范围200~900 nm。PLNPs荧光测定条件:激发波长260 nm,最大发射波长694 nm,激发和发射狭缝宽度均为10 nm、激发电压700 V。
1.3.2.2 扫描电子显微镜表征
用扫描电子显微镜对纳米粒子表面的微观形貌进行扫描。将制备的ZGGO∶Cr3+, Yb3+, Er3+PLNPs和CoOOH-PLNPs纳米粒子经真空干燥去除水分,得到的粉末样品涂覆在导电胶带上,直接固定在样品台上喷金,进行观察。
1.3.2.3 透射电子显微镜表征
本实验通过透射电子显微镜观察记录制备的纳米颗粒晶体的组成、形态和尺寸。将一滴超声分散在无水乙醇中的纳米颗粒样品液滴滴涂在附着有碳膜的200 目的Cu网上,室温条件下自然晾干,进行观察。
1.3.2.4 傅里叶红外光谱表征
对纳米粒子进行傅里叶红外光谱分析,称取150 mg已在110 ℃干燥的KBr晶体与1.0 mg真空干燥的样品在研钵中研磨混匀,压制成均匀透明的薄片,放入仪器中进行扫描。扫描范围4 000~400 cm-1,扫描次数32。
1.3.2.5 X射线衍射分析
采用X射线衍射分析研究纳米粒子形成的晶体结构,采用Cu-Kα辐射(λ=1.541 8 Å),管压40 kV,管流40 mV,扫描范围为10°~80°,扫描速度为2°/min。
1.3.3 VC含量的检测
取1 mL终质量浓度为0.5 mg/mL新鲜制备的CoOOHPLNPs探针,加入100 μL现配制稀释好的不同质量浓度(0~100 mg/L)的VC溶液(4 ℃,避光),待混和均匀后立即放入荧光分光光度计内检测所得混合溶液在波长694 nm处的荧光强度。
1.3.4 实际样品的前处理
本实验选取了3 种应季的果蔬猕猴桃、柠檬、草莓作为检测样品。样品前处理方法参照GB 5009.86—2016《食品中抗坏血酸的测定》中VC的测定。取约100 g的样品加入等质量20 g/L的偏磷酸溶液,经均质机均质成浆状。称取相对于样品约1 g(精确至0.001 g)的上述浆状试样于50 mL离心管中,超声提取5 min,于4 000 r/min离心5 min,取上清液用20 g/L的偏磷酸溶液将试样转移至50 mL容量瓶中,振荡溶解并定容,摇匀,过0.45 μm水相滤膜,滤液立即进行高效液相色谱分析检测。
1.3.5 高效液相色谱验证实验
采用Thermo C18色谱柱(250 mm×4.6 mm,5 μm)进行分离,紫外检测器检测,检测波长为245 nm。流动相为pH值为2.5~2.8含有十六烷基三甲基溴化铵的磷酸二氢钾溶液-甲醇(95∶5,V/V)溶液。柱温25 ℃,流速0.7 mL/min,进样量20 μL。计算得到样品中VC的含量,并与荧光检测结果进行比对。
1.4 统计分析
实验所有表征数据均采用Excel 2007软件进行整理,Origin 9.0软件进行分析作图,SPSS 19.0软件进行方差分析,显著性水平为0.05。
2 结果与分析
2.1 ZGGO∶Cr3+, Yb3+, Er3+ PLNPs的表征
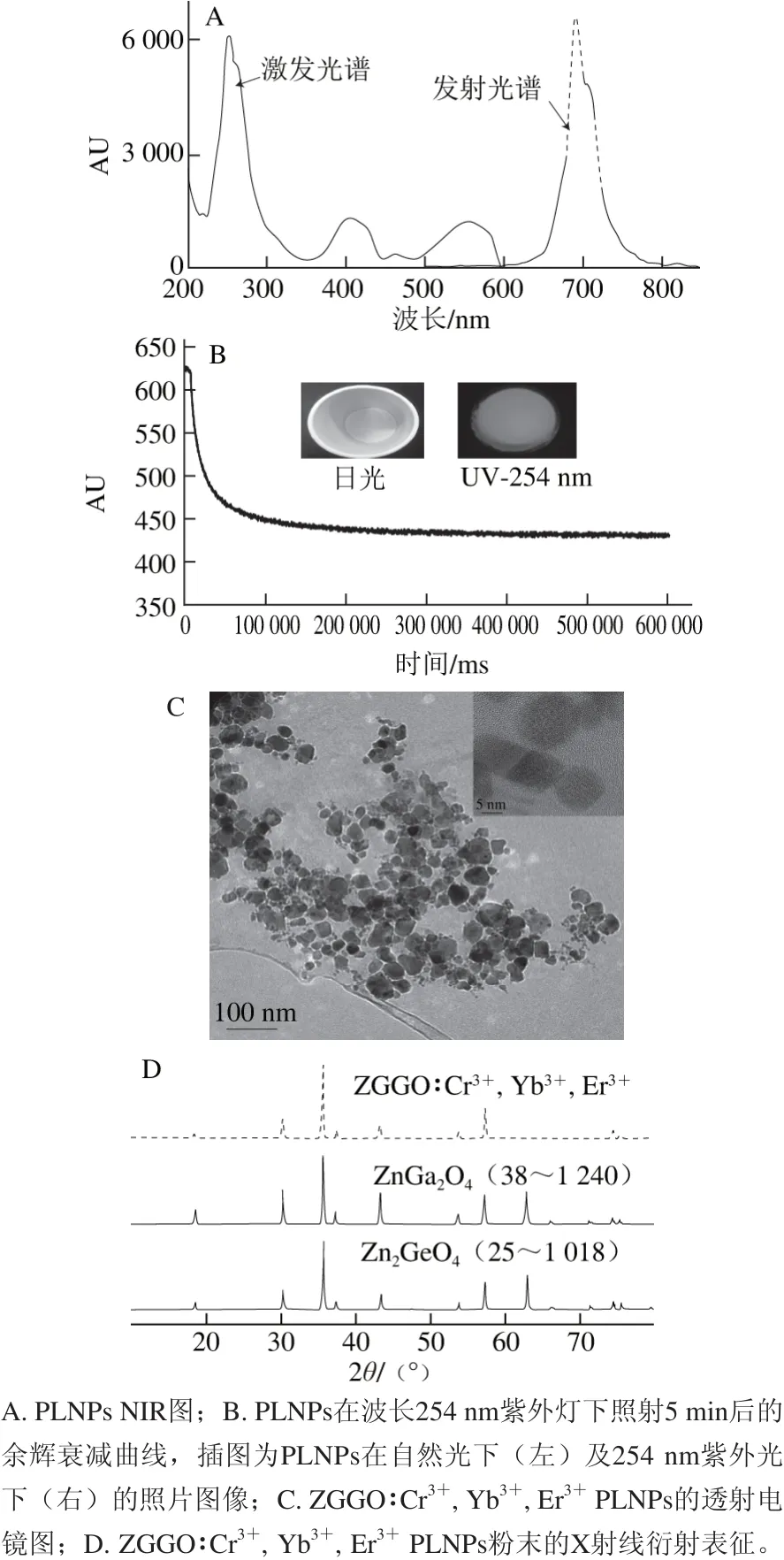
图1 ZGGO∶Cr3+, Yb3+, Er3+ PLNPs的表征Fig. 1 Structural characterization and persistent luminescence properties of ZGGO∶Cr3+, Yb3+, Er3+
为了使PLNPs具有更优异的光学性能和单分散性,本实验参考Li Yujie等[25]报道的基于表面活性剂辅助水热法结合短时煅烧,以镓锗酸锌作为基质材料、Cr3+作为激活剂,共同掺杂了Yb3+和Er3+,合成制备了在NIR发光、超亮、超长余辉时间的ZGGO∶Cr3+, Yb3+, Er3+三掺杂的PLNPs。
图1A显示了ZGGO∶Cr3+, Yb3+, Er3+粉末在室温条件下的激发、发射光谱。制备的ZGGO∶Cr3+, Yb3+,Er3+PLNPs由于内部掺杂的过渡金属Cr3+离子在200~600 nm波长范围内具有4 个激发峰,分别位于260、405、463 nm和557 nm,其中波长260 nm为主要激发峰。材料在260 nm波长激发条件下,在NIR区的694 nm波长处具有很强的发射。除了强烈的NIR荧光发光外,由余辉衰减曲线可知(图1B),ZGGO∶Cr3+, Yb3+, Er3+纳米粒子具有超长的余辉寿命。由图1C可以看出,基于表面活性剂处理,合成的ZGGO∶Cr3+, Yb3+, Er3+PLNPs是一些具有一定不同纵横比的非球面形的纳米结构晶体,可以看出PLNPs晶体中晶石结构的晶格条纹。与传统的高温固体煅烧相比,所合成的PLNPs具有较好的单分散性。PLNPs的X射线衍射特征峰与具有尖晶石晶体结构的ZnGa2O4和Zn2GeO4标准物质的晶型模式非常相似,如图1D所示。在合成的ZGGO∶Cr3+, Yb3+, Er3+纳米晶体结构中并没有ZnO、GeO2或Ga2O3的特征峰出现,表明合成的PLNPs是具有纯尖晶石物相的镓锗酸锌固溶体。
2.2 CoOOH的表征
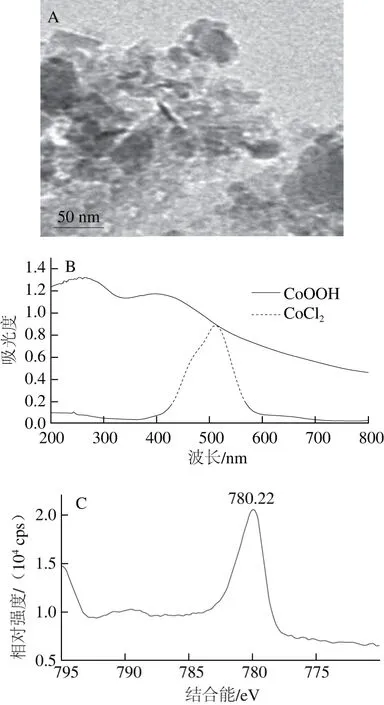
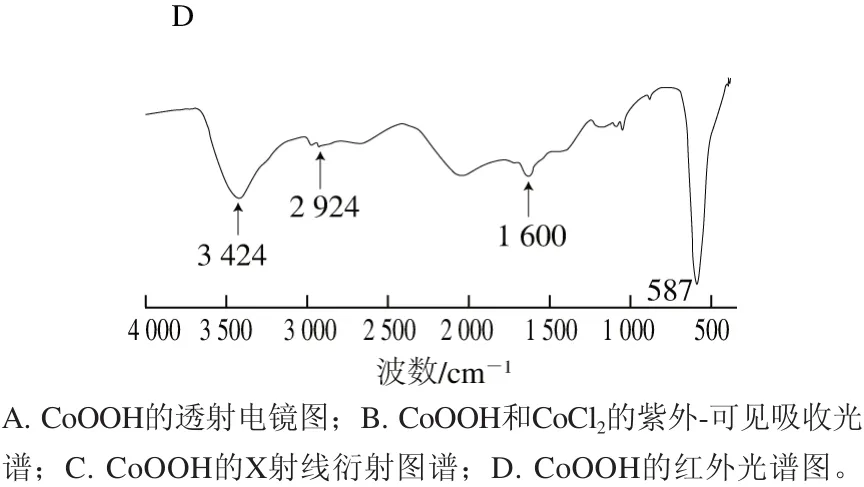
图2 CoOOH的合成表征Fig. 2 Structural characterization of CoOOH
图2 A显示的是通过氢氧化钠和次氯酸钠与Co2+超声混合法制备的CoOOH在高分辨率透镜下的形态结构。CoOOH呈现出纳米级的片状,没有特定的形态结构。如图2B所示,图中虚线表示Co2+离子的紫外-可见吸收,其最大吸收峰在波长512 nm处。当Co2+与氢氧化钠和次氯酸钠形成CoOOH后,其吸收峰发生了明显的变化,出现了较宽的吸收峰,并在波长260 nm和400 nm处有较大吸收,表明了CoOOH的生成。如图2C所示,Co元素在780.22 eV处具有特征结合能,这种Co元素的存在形式与Li Na[26]和Tan[27]等报道的CoOOH中Co元素的存在状态一致。由图2D可以看出,在3 424 cm-1处的吸收峰对应的是H2O中OH上氢键的伸缩振动形成;2 924 cm-1处的吸收峰为Co2+与附近的O—H键相互作用。1 600 cm-1处的特征吸收峰为CoOOH结构中Co—O双键振动;在587 cm-1处有一个强烈的吸收峰,是Co—O2-与周围氧化物相互作用的峰,属于CoOOH的特征吸收峰。
2.3 CoOOH-PLNPs纳米探针的表征
2.3.1 CoOOH-PLNPs扫描电子显微镜及紫外-可见吸收光谱表征
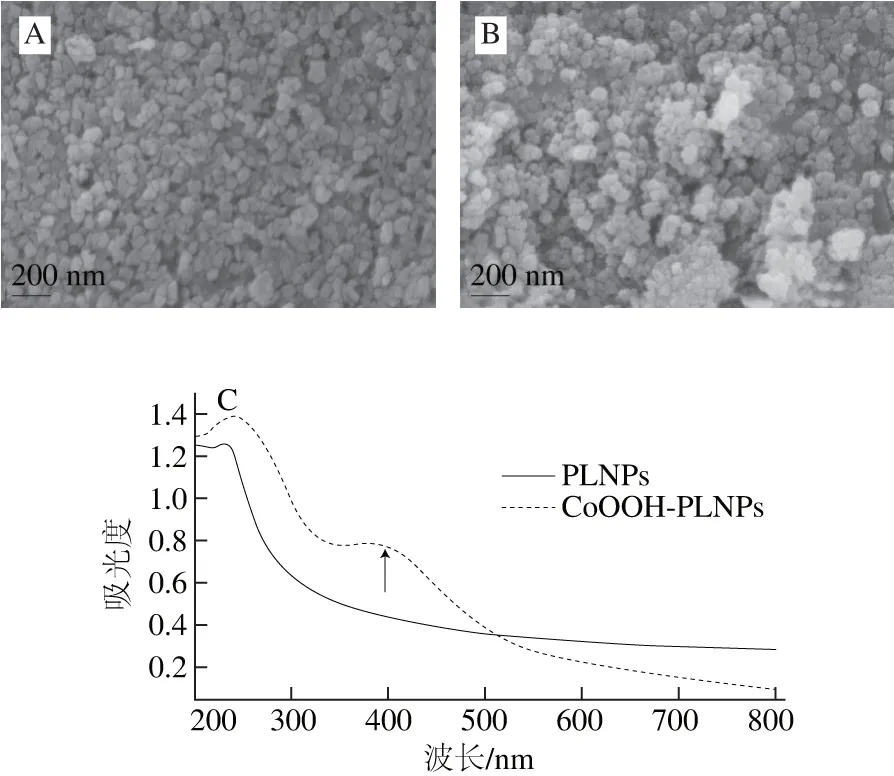

图3 CoOOH-PLNPs的合成表征Fig. 3 Structural characterization of CoOOH-PLNPs
图3 A、B显示了PLNPs和CoOOH-PLNPs的形貌,单纯的PLNPs呈现出不同纵横比的纳米颗粒,外表面较为平整。而CoOOH-PLNPs外表面由于CoOOH的形成,可清晰的看出PLNPs表面聚集的片层结构,较为粗糙,表明在PLNPs周围形成了CoOOH。由图3C可知,单纯的PLNPs紫外-可见吸收光谱,可以看出ZGGO∶Cr3+,Yb3+,Er3+PLNP最大吸收波长在260 nm处。而CoOOH-PLNPs不仅在260 nm波长有最大吸收,同时在波长400 nm左右处也有紫外吸收,这与CoOOH在波长400 nm处的吸收相符,进一步说明在PLNPs表面及周围形成了CoOOH。如图3D所示,CoOOH分布在PLNPs表面与周围。
2.3.2 CoOOH- PLNPs的XPS表征和荧光稳定性
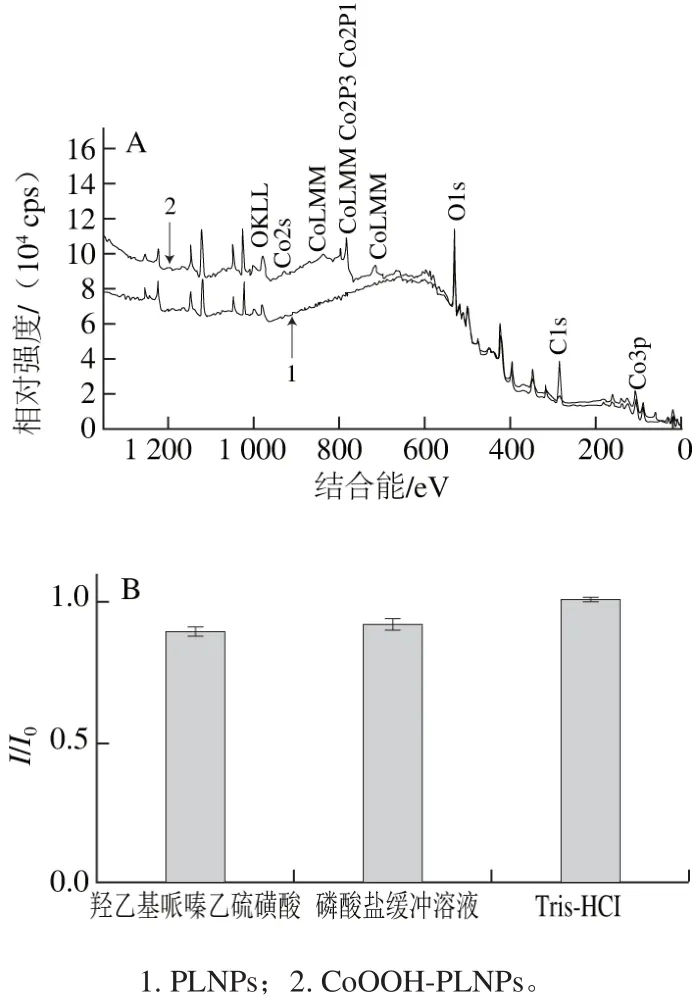
图4 CoOOH- PLNPs的XPS表征(A)和不同缓冲介质光学稳定性(B)Fig. 4 XPS characterization of CoOOH-PLNPs (A), and evaluation of photostability of CoOOH-PLNPs in different buffers (B)
由图4A可以看出,谱线1显示Zn2p3在1 022.21 eV、Ga3d在20.41 eV、Ge3d在32.70 eV、O1s在531.56 eV处,表明实验所合成的近红外PLNPs主要有Zn、Ga、Ge、O元素组成。谱线2中不仅显示了Zn、Ga、Ge、O的结合能,还显示出Co2p3在780.22 eV处特征结合能,再次表明了CoOOH-PLNPs的形成。
为了评估合成的CoOOH-PLNPs探针的光学稳定性,将制备好的探针分散于羟乙基哌嗪乙硫磺酸(pH 7.5)、Tris-HCl(pH 8.0)、磷酸盐(pH 6.5)缓冲溶液中,以水溶液为对照,测定其荧光。由图4B可知,在3 种缓冲溶液中的CoOOH-PLNPs探针的发光并没有显著变化,说明制备的纳米探针具有良好的光学稳定性。
2.3.3 CoOOH对PLNPs的猝灭机理

图5 长余辉纳米粒子光致发光的激发(a)和发射(b)光谱与CoOOH的紫外吸收(c)光谱Fig. 5 Photoluminescence excitation (a) and emission (b) spectra of PLNPs and UV-vis absorption spectrum of CoOOH (c)
由于ZGGO∶Cr3+, Yb3+, Er3+PLNPs在NIR的发光强度会随着CoOOH生成量的改变而发生不同程度的猝灭,为了更好地研究CoOOH对PLNPs的猝灭机理,本实验分别对PLNPs的激发、发射光谱与CoOOH的紫外-可见吸收光谱进行了扫描叠加。如图5所示,ZGGO∶Cr3+, Yb3+,Er3+PLNPs在波长200~600 nm区间具有4 个激发峰,其中波长260 nm为主要激发峰(曲线a),且PLNPs在650~1 000 nm NIR区间的发射峰位于波长694 nm处(曲线b)。而CoOOH在波长200~800 nm之间具有非常宽的紫外吸收,并在波长260 nm和400 nm处有最大吸收峰(曲线c)。ZGGO∶Cr3+, Yb3+, Er3+PLNPs材料的激发和发射光谱均处于CoOOH的整个紫外吸收区间,尤其是PLNPs的4 个激发峰恰好与CoOOH的最大紫外吸收峰具有良好的光谱重叠。因此,PLNPs材料与CoOOH之间可能产生了荧光内滤效应(inner filter effect,IFE),CoOOH不仅可以屏蔽PLNPs的激发光,还可以吸收PLNPs的发射光,并将CoOOH的吸收成功的转化为对PLNPs发光的猝灭,从而保障了PLNPs与CoOOH之间形成高效的IFE[28-30]。
2.4 CoOOH对PLNPs的猝灭曲线
通过调节不同CoCl2的添加量以改变在PLNPs表面及周围形成CoOOH的量,基于IFE达到对PLNPs溶液荧光的猝灭。由图6A可以看出,随着CoCl2添加量的增加,在PLNPs周围形成的CoOOH增加,PLNPs的荧光强度逐渐降低,最大猝灭效率可达到95.07%。当CoCl2添加至200 μL时,PLNPs的荧光强度达到最低值,继续增加CoCl2,猝灭程度不再发生变化。图6B显示的是不同CoCl2添加量对PLNPs的猝灭效果。
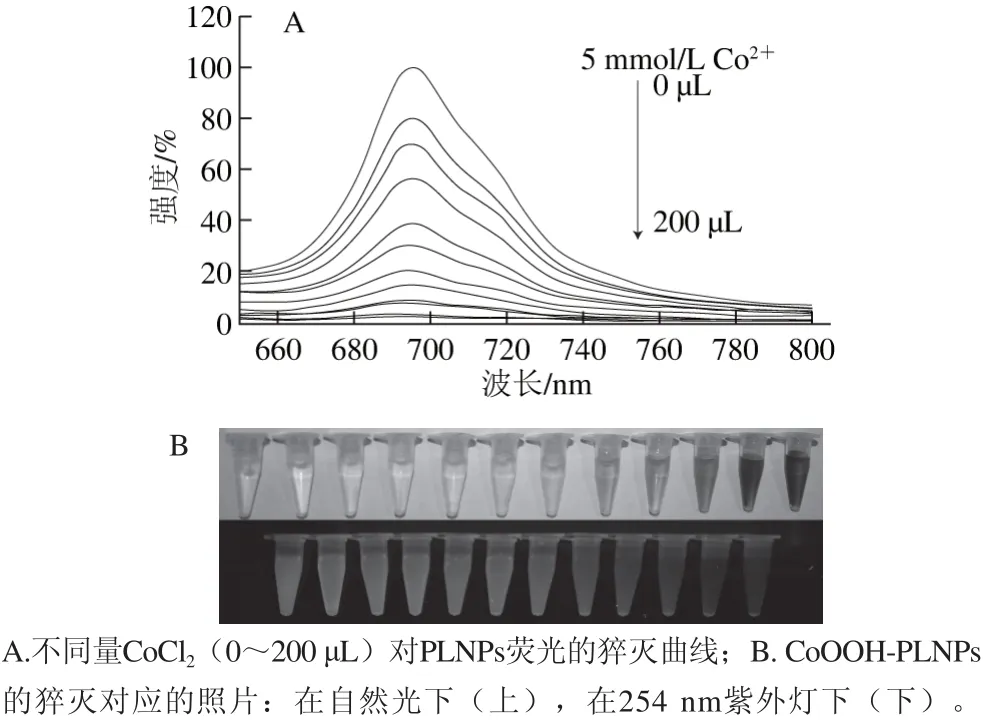
图6 CoOOH对PLNPs的猝灭及对应的照片Fig. 6 Quenching effect of CoOOH on the luminescence of PLNPs and corresponding photographs
2.5 CoOOH-PLNPs荧光探针的恢复曲线

图7 CoOOH-PLNPs探针对VC的响应Fig. 7 Responses of CoOOH-PLNPs probes to vitamin C
由于VC能够将CoOOH还原为Co2+,使得CoOOH从PLNPs表面及周围脱离下来,消除了CoOOH对PLNPs产生的IFE效应。因此,当向探针中分别加入不同含量的VC时,PLNPs的荧光强度逐渐得到恢复(图7A)。由图7A中的插图可知,F/F0与VC的质量浓度之间存在有良好的线性相关(R2=0.993 15),线性范围为0~100 mg/kg。线性方程为F/F0=0.012[VC]+1.022 28,根据3 倍信噪比得到检出限为1.18 mg/kg。以上实验结果表明,CoOOH可以通过VC还原成Co2+消除IFE效应,使PLNPs的荧光强度得到恢复。将CoOOH-PLNPs离心后的上清液进行紫外-可见光谱扫描,如图7B可知,无吸收峰产生。将上述沉淀CoOOH-PLNPs重新分散在超纯水中加入适量VC后离心,取其上清液,进行紫外-可见光谱扫描,发现出现Co2+的特征吸收峰,可见VC可将PLNPs表面及周围的CoOOH还原为Co2+。
2.6 选择性实验
在实际应用中,由于食品样品的基质较为复杂,CoOOH-PLNPs探针的灵敏度也可能会受到基质中其他物质的干扰。因此,考察探针的选择性是非常必要的。通过监测基质中存在的各种干扰剂对CoOOH-PLNPs光学的影响,来评估CoOOH-PLNPs探针对VC的选择性。
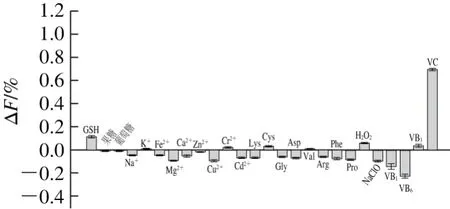
图8 CoOOH-PLNPs探针对不同金属离子和生物分子的响应Fig. 8 Response of CoOOH-PLNPs nanoprobe to different metal ions and biomolecules
实验测定了样品基质中可能与VC共存的一些干扰物质对CoOOH-PLNPs探针的响应情况,如图8所示。CoOOH-PLNPs探针对金属离子(Na+、K+、Fe2+、Mg2+、Ca2+、Zn2+、Cu2+、Cr2+和Cd2+)、氨基酸(Lys、Cys、Gly、Asp、Val、Arg、Phe和Pro)、还原性小分子物质(GSH、葡萄糖、果糖、NaClO和H2O2)和B族水溶性维生素(VB1、VB3、VB6)没有产生明显的光学响应。说明CoOOH-PLNPs探针对VC具有较高的选择性,能够应用于实际样品的检测。
2.7 CoOOH-PLNPs探针的实际应用
为了验证方法的实用性和准确性,将所建立的CoOOH-PLNPs纳米探针传感检测方法用于实际果蔬样品中VC的检测,并用GB 5009.86—2016《食品中抗坏血酸的测定》中的高效液相色谱检测方法进行验证,测定结果如表1所示。

表1 实际样品中VC的测定结果Table 1 Vitamin C contents in real samples mg/kg
从表1可知,与高效液相色谱检测结果对比,2 种检测结果具有较好的一致性,无显著性差异(P<0.05),说明所建立的方法具有很好的实用性。
3 结 论
本实验采用水热两相法结合高温短时煅烧,以镓锗酸锌作为基质材料、铬离子作为激活剂,共同掺杂了镱和铒离子,合成制备了一种粒径可控,且在NIR(694 nm)具有稳定发光,超长余辉寿命的ZGGO∶Cr3+,Yb3+, Er3+三掺杂镓锗酸锌长余辉纳米材料。以CoOOH为猝灭剂,基于荧光内滤效应,可有效猝灭ZGGO∶Cr3+,Yb3+, Er3+PLNPs的发光,并通过CoOOH与VC之间的特异性氧化还原反应,构建出一种可“Turn-Off”和“Turn-On”的荧光探针,实现对VC的快速测定。实验构建的探针荧光恢复与VC之间呈现出良好的线性关系,检出限为1.18 mg/kg。此外,合成的ZGGO∶Cr3+,Yb3+, Er3+PLNPs在NIR超长的余辉性能,可进一步用于活体内VC的监测与成像,对基于先进功能材料的化学分析方法在食品科学中的应用具有重大意义。
参考文献:
[1] GHEIBI S, KARIMI-MALEH H, KHALILZADEH M A, et al. A new voltammetric sensor for electrocatalytic determination of vitamin C in fruit juices and fresh vegetable juice using modified multi-wall carbon nanotubes paste electrode[J]. Journal of Food Science and Technology,2015, 52(1): 276-284. DOI:10.1007/s13197-013-1026-7.
[2] TEMPLE N J. Antioxidants and disease: more questions than answers[J]. Nutrition Research, 2000, 20(3): 449-459. DOI:10.1016/S0271-5317(00)00138-X.
[3] KIM W S, DAHLGREN R L, MOROZ L L, et al. Ascorbic acid assays of individual neurons and neuronal tissues using capillary electrophoresis with laser-induced fluorescence detection[J]. Analytical Chemistry, 2002, 74(21): 5614-5620. DOI:10.1021/ac025917q.
[4] DU J, CULLEN J J, BUETTNER G R. Ascorbic acid: chemistry,biology and the treatment of cancer[J]. Biochimica et Biophysica Acta(BBA)-Reviews on Cancer, 2012, 1826(2): 443-457. DOI:10.1016/j.bbcan.2012.06.003.
[5] ARRIGONI O, DE TULLIO M C. Ascorbic acid: much more than just an antioxidant[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2002, 1569(1): 1-9. DOI:10.1016/S0304-4165(01)00235-5.
[6] SIES H W A R. Antioxidant functions of vitamins[J]. Annals of the New York Academy of Science, 1992, 669(1): 7-21. DOI:10.1111/j.1749-6632.1992.tb17085.x.
[7] JUNG S A, LEE D H, MOON J H, et al. L-ascorbic acid can abrogate SVCT-2-dependent cetuximab resistance mediated by mutant KRAS in human colon cancer cells[J]. Free Radical Biology and Medicine,2016, 95: 200-208. DOI:10.1016/j.freeradbiomed.2016.03.009.
[8] DAVIS J L, PARIS H L, BEAL J W, et al. Liposomal-encapsulated ascorbic acid: influence on vitamin C bioavailability and capacity to protect against ischemia-reperfusion injury[J]. Nutrition and Metabolic Insights, 2016, 9: 25-30. DOI:10.4137/NMI.S39764.
[9] SARTOR Z, KESEY J, DISSANAIKE S. The effects of intravenous vitamin C on point-of-care glucose monitoring[J]. Journal of Burn Care & Research, 2015, 36(1): 50-56. DOI:10.1097/bcr.0000000000000142.
[10] ESTEBAN M A P D. Vitamin C improves the quality of somatic cell reprogramming[J]. Nature Genettics, 2012, 44(4): 366-368.DOI:10.1038/ng.2222.
[11] 朱晓明. 过量使用维生素C的不良反应[J]. 中国社区医师(医学专业), 2011, 13(10): 11.
[12] SPÍNOLA V, MENDES B, CÂMARA J S, et al. Effect of time and tempe rature on vitamin C stability in horticultural extracts. UHPLCPDA vs iodometric titration as analytical methods[J]. LWT-Food Science and Technology, 2013, 50(2): 489-495. DOI:10.1016/j.lwt.2012.08.020.
[13] KLIMCZAK I, GLISZCZYÑSKA-ŚWIGłO A. Comparison of UPLC and HPLC methods for determination of vitamin C[J]. Food Chemistry,2015, 175: 100-105. DOI:10.1016/j.foodchem.2014.11.104.
[14] WU G, WU Y, LIU X, et al. An electrochemical ascorbic acid sensor based on palladium nanoparticles supported on graphene oxide[J]. Analytica Chimica Acta, 2012, 745: 33-37. DOI:10.1016/j.aca.2012.07.034.
[15] WU T, GUAN Y, YE J. Determination of flavonoids and ascorbic acid in grapefruit peel and juice by capillary electrophoresis with electrochemical detection[J]. Food Chemistry, 2007, 100(4): 1573-1579. DOI:10.1016/j.foodchem.2005.12.042.
[16] WU X, DIAO Y, SUN C, et al. Fluorimetric determination of ascorbic acid with o-phenylenediamine[J]. Talanta, 2003, 59(1): 95-99.DOI:10.1016/S0039-9140(02)00475-7.
[17] SINGH S K. Red and near infrared persistent luminescence nanoprobes for bioimaging and targeting applications[J]. RSC Advance,102: 58674-58698. DOI:10.1039/C4RA08847F.
[18] JIN Y, HU Y, FU Y, et al. Preparation, design, and characterization of the novel long persistent phosphors: Na2ZnGeO4and Na2ZnGeO4:Mn2+[J]. Journal of American Ceramic Society, 2015, 98(5): 1555-1561. DOI:10.1111/jace.13503.
[19] LI Z, ZHANG Y, WU X, et al. Direct aqueous-phase synthesis of sub-10 nm “luminous pearls” with enhanced in vivo renewable nearinfrared persistent luminescence[J]. Journal of American Chemical Society, 2015, 137(16): 5304-5307. DOI:10.1021/jacs.5b00872.
[20] PENG J, LING J, ZHANG X Q, et al. A rapid, sensitive and selective colorimetric method for detection of ascorbic acid[J]. Sensors and Actuators B: Chemical, 2015, 221(31): 708-716. DOI:10.1016/j.snb.2015.07.002.
[21] TAN H, MA C, GAO L, et al. Metal-organic framework-derived copper nanoparticle@carbon nanocomposites as peroxidase mimics for colorimetric sensing of ascorbic acid[J]. Chemistry-a European Journal, 2014, 20(49): 16377-16383. DOI:10.1002/chem.201404960.
[22] WANG Y, ZHANG P, MAO X, et al. Seed-mediated growth of bimetallic nanoparticles as an effective strategy for sensitive detection of vitamin C[J]. Sensors and Actuators B: Chemical, 2016, 231: 95-101. DOI:10.1016/j.snb.2016.03.010.
[23] MALDINEY T, BESSIÈRE A, SEGUIN J, et al. The in vivo activation of persistent nanophosphors for optical imaging of vascularization,tumours and grafted cells[J]. Nature Materials, 2014, 13(4): 418-426.
[24] PAN Z, LU Y Y, LIU F. Sunlight-activated long-persistent luminescence in the near-infrared from Cr3+-doped zinc gallogermanates[J]. Nature Materials, 2012, 11(1): 58-63.
[25] LI Y J, YAN X P. Synthesis of functionalized triple-doped zinc gallogermanate nanoparticles with super-long near-infrared persistent luminescence for long-term orally administrated bioimaging[J].Nanoscale, 2016, 8(32): 14965-14970. DOI:10.1039/C6NR04950H.
[26] LI N, LI Y, HAN Y, et al. A highly selective and instantaneous nanoprobe for detection and imaging of ascorbic acid in living cells and in vivo[J]. Analytical Chemistry, 2014, 86(8): 3924-3930.DOI:10.1021/ac5000587 (2014).
[27] TAN B J, KLABUNDE K J, SHERWOOD P M A. XPS studies of solvated metal atom dispersed (SMAD) catalysts. Evidence for layered cobalt-manganese particles on alumina and silica[J]. Joural of American Chemical Society, 1991, 113(3): 855-861. DOI:10.1021/ja00003a019.
[28] YAN X, LI H, HAN X, et al. A ratiometric fluorescent quantum dots based biosensor for organophosphorus pesticides detection by inner-filter effect[J]. Biosensors Bioelectronics, 2015, 74: 277-283.DOI:10.1016/j.bios.2015.06.020.
[29] ZHENG M, XIE Z, QU D, et al. On-Off-On fluorescent carbon dot nanosensor for recognition of chromium (VI) and ascorbic acid based on the inner filter effect[J]. ACS Applied Materials and Interfaces,2013, 5(24): 13242-13247. DOI:10.1021/am4042355.
[30] KONG W, WU D, XIA L, et al. Carbon dots for fluorescent detection of α-glucosidase activity using enzyme activated inner filter effect and its application to anti-diabetic drug discovery[J]. Analytical Chimica Acta, 2017, 973: 91-99. DOI:10.1016/j.aca.2017.03.050.
