miR-34a调控MSR1蛋白对前列腺癌细胞迁移和侵袭的影响*
2018-04-20韩兴涛杨凌博魏澎涛李小辉孙建涛杨锦建
韩兴涛 杨凌博 魏澎涛 李小辉 孙建涛 杨锦建
(洛阳市中心医院泌尿外科,洛阳 471000)
前列腺癌是男性泌尿系统中发病率最高的原发性肿瘤,发病率为 8/10万,大约占所有泌外系统所有肿瘤类型的18%[1]。目前主要的治疗方案是手术或手术后化疗,然而,即便有手术机会,术后患者的平均生存期只有为5~6个月。且复发率也相对较高[2]。随着前列腺癌发病相关基因和对分子机制认识的进展,寻求调控前列腺癌的分子已经成为肿瘤治疗和改善预后的新方向。MicroRNA(miRNA)是一种保守的非编码的小RNA,其可以调节基因和蛋白质的表达。通过结合mRNA下游的相关蛋白调控其降解或翻译过程[3,4]。miRNA可调节多种肿瘤的生物学行为,包括细胞分化和增殖,以及迁移过程[5,6]。最近新出现的研究证据表明,miRNA在前列腺癌细胞自我更新和分化中负调节某些蛋白表达,进而促进其行为。最近,发现了miR-34可以作为肿瘤抑制剂在前列腺癌中有潜在作用,但是其具体机制尚未研究明确[7]。
巨噬细胞清道夫受体1(MSR1)基因定位在16q23,可以编码下游相关转录因子,广泛存在肿瘤细胞的基因序列中[8]。MSR1作为一种转录抑制因子,可以和蛋白修饰酶结合形成复合物,通过与启动子结合,调控细胞分化和器官形成过程。到目前为止,一些研究结果证实MSR1在乳腺癌、前列腺癌等恶性肿瘤中表达上升,而且在乳腺癌、前列腺癌中已经证实MSR1与肿瘤的发生及发展密切相关[9]。
在前列腺癌中,miR-34a和MSR1相互关系的研究鲜有报道。本研究阐明miR-34a和MSR1在前列腺癌中表达作用及相应作用机制,对前列腺癌的诊断和治疗具有极其重要的意义。
1 材料与方法
1.1细胞株与主要试剂 人前列腺癌细胞LNCap、PC3、DU145和22RV1购买自上海细胞研究所。细胞培养条件:含10%胎牛血清的1640RPMI培养基,37℃、5%CO2条件下培养。MSR1兔单克隆抗体购自Abcam(ab123946)。Transwell小室购自美国Millipore公司,Matrigel购自美国BD公司。miR-34a-mimic和LV5-MSR1慢病毒购自上海吉凯基因有限公司。
1.2方法
1.2.1qPCR 荧光定量PCR检测miR-34a、MSR1的表达 用Trozel(Gibco) 抽提前列腺癌细胞的总RNA,通过逆转录扩增miR-34a和MSR1,MSR1用GAPDH作为内参物,miR-34a使用U6作为内参。反应条件:以200 ng总RNA为模版,通过逆转录获取cDNA,在37℃中孵育15 min,然后在95℃中退火5 min。后根据Kapa PCR试剂盒说明书进行PCR反应。获得数据以公式RQ=2-ΔΔCT计算mRNA表达量。实验重复3次。
1.2.2Western blot检测MSR1蛋白水平 按照说明书配制10%SDS-PAGE分离胶,每孔加入20 μg蛋白样品。使用湿转法将蛋白移至PVDF膜上,使用5%脱脂奶粉室温下封闭2 h,TBST充分冲洗后,使用1∶1 000稀释一抗孵育(兔单克隆MSR1抗体),4℃过夜;加入辣根过氧化酶物标记羊抗兔IgG(1∶2 500) 稀释,室温孵育2 h;ECL显影后检测。实验重复3次。
1.2.3双荧光素酶报告基因实验 从人类基因组DNA产生全长MSR1-3′UTR,并通过退火合成的信号寡核苷酸产生突变体MSR1-3′UTR。将这些DNA片段克隆到ph-TK载体(肾脏荧光素酶)中,preporter-MSR1-3′UTR代表野生型质粒载体和miR-133结合共转染,preporter-MSR1-3′UTRm代表突变型质粒载体和miR-133结合共转染,同时使用pGL-3.0(荧光素酶)作为内参照,检测NC组和miR-34a-mimic组中MSR1的荧光活性相对值。根据制造商试剂说明书使用Dual Luciferase Reporter Assay System试剂盒(Promega)测量萤火虫和海肾荧光素酶活性,通过双荧光素酶检测miR-34a对MSR1的表达活性的调控能力。
1.2.4Transwell侵袭实验检测前列腺癌细胞的侵袭能力 所有试剂及器材均于冰块上预冷处理,将Transwell小室置于24孔板内,将Transwell小室内膜均匀涂抹Matrigel胶100 μl,37℃孵育20 min,胶凝固后进行细胞操作;逐步消化、离心、计数细胞后,按照2.5×104ml-1浓度用无血清培养基将前列腺癌细胞稀释,制成细胞悬液;按照每孔200 μl的细胞悬液加入Transwell上室,同时在Transwell下室加入10%FBS+培养基500 μl,放入37℃孵箱培养;孵育24 h后使用甲醛固定细胞,结晶紫染色15 min,使用棉签去除小室内膜上的细胞,然后于显微镜下计数,观察4个高倍视野下(×40)穿过滤膜的细胞数。实验重复3次。
1.2.5划痕实验检测前列腺癌细胞的迁移能力 划痕实验:将前列腺癌细胞接种于6孔板,待细胞融合度生长在90%时,用200 μl消毒枪头垂直划线,并在显微镜下测量划痕的初始距离(0 time),然会孵育24 h、48 h、72 h后,分别测量划痕的距离,并计算细胞的迁移率。实验重复3次。细胞迁移率的计算公式=[迁移距离D(0 h)-迁移距离D(24 h、48 h、72 h)]/ 迁移距离D(0 h)。

2 结果
2.1miR-34a和MSR1在人前列腺癌细胞株中的表达情况 如图1A所示,MSR1在前列腺癌细胞株中呈现表达不一的水平,我们选取MSR1蛋白水平相对较高的前列腺癌细胞株PC3,用于后续试验过表达MSR1的实验。如图1B显示,miR-34a的表达水平在不同类型的前列腺癌细胞株中表达水平不同,miR-34a在PC3中表达情况相对较低,因此,选取PC3细胞株作为本实验的实验细胞株。
2.2双荧光素酶检测miR-34a和MSR1相关关系 我们通过TargetScan生物信息网站检测MSR1是miR-34a的下游相关靶标,通过双荧光素酶试验检测MSR1和miR-34a在前列腺癌细胞中的相互表达关系。我们发现miR-34a具有和MSR1相似的3′-UTR结合序列。转染miR-34a-mimic后检测miR-34a的表达水平相对增高(图2A)。然后将MSR1 3′-UTR克隆到miRNA报告载体中。miR-34a的过表达荧光素酶活性降低到对照组的70%水平,表明miR-34a可以有效抑制MSR1的荧光活性。双荧光素酶报告基因结果显示(图2B):miR-34a-mimic可以明显抑制MSR1的荧光素酶活性。表明miR-34a能与MSR1的3′UTR特异性结合,并可以调控MSR1的表达活性。
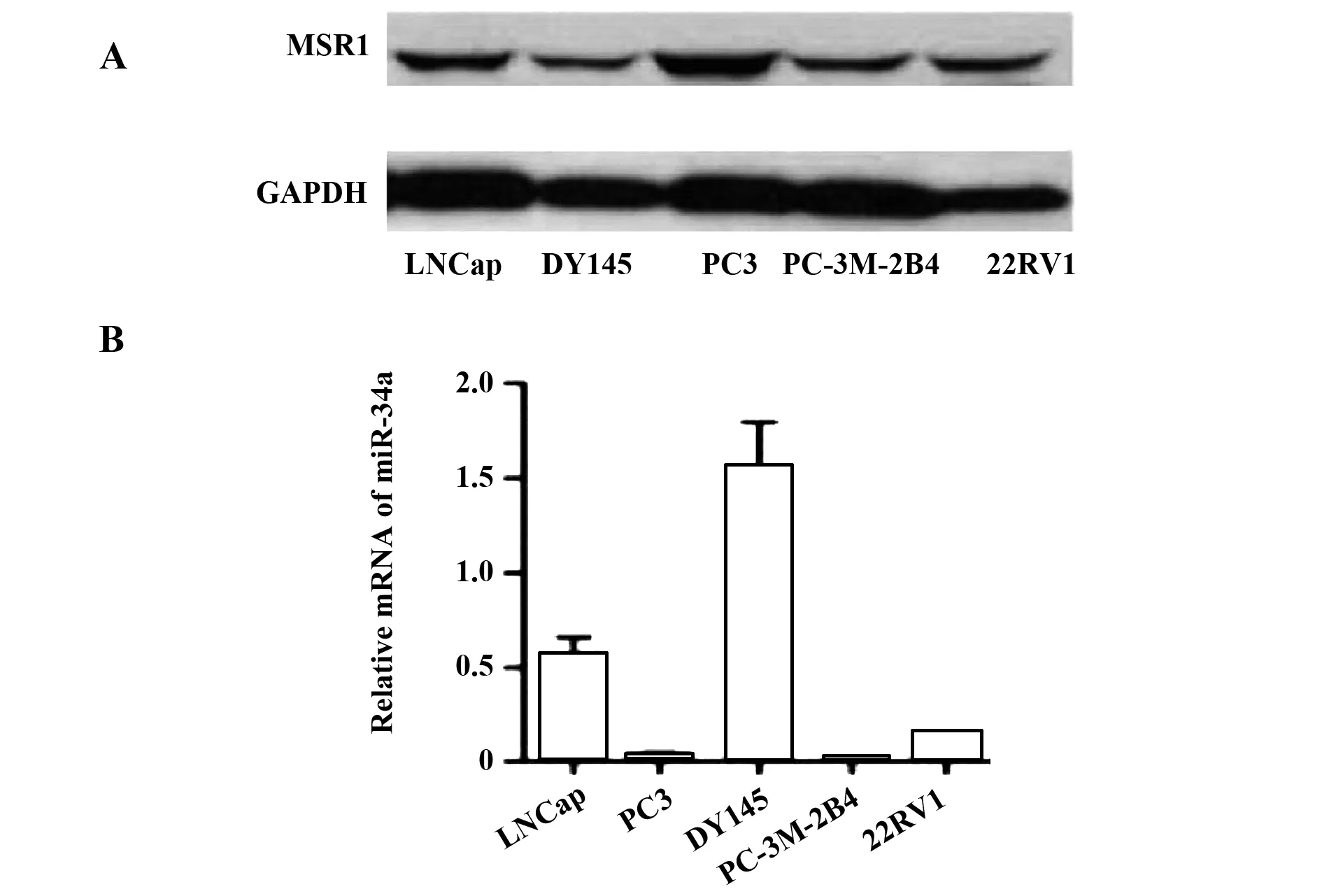
图1 miR-34a 和MSR1 在人前列腺癌细胞株中的表达情况Fig.1 Expression of miR-34a and MSR1 in human prost-ate cancer cell linesNote: A.Expression of MSR1 in prostate cancer cell lines;B.miR-34a expression in prostate cancer cell lines.
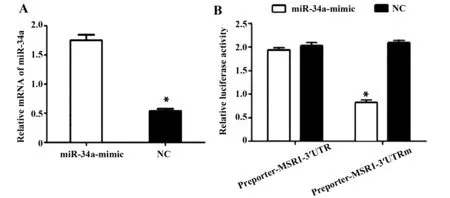
图2 双荧光素酶实验检测miR-34和MSR1之间的相互关系Fig.2 Dual luciferase assay examines the correlation between miR-34 and MSR1Note: A.Effect of miR-34a-mimic on miR-34a expression;B.Double luciferase assay to detect the effect of miR-34a on the activity of MSR1.*.P<0.05.
2.3miR-34的表达对前列腺癌细胞迁移和侵袭能力的影响 为了研究miR-34a对前列腺癌细胞迁移和侵袭能力的影响。使用PC3细胞株进行质粒转染以增加miR-34a的表达。通过Transwell侵袭实验检测miR-34a对PC3细胞侵袭情况的影响。如图3A所示,miR-34a-mimic组的细胞侵袭数目比对照组明显降低[(186.1±12.5) vs (89.3±8.2),P=0.021],差异具有统计学意义。通过划痕愈合实验检测miR-34a对PC3细胞迁移情况的影响。如图3B所示,miR-34a-mimic组的细胞迁移速度比其对照组明显减慢[24 h (0.38±0.02) vs (0.18±0.03),P=0.015;48 h (0.82±0.11) vs (0.51±0.08),P=0.009;72 h (1.25±0.19) vs (0.82±0.12),P=0.016],差异具有统计学意义。结果说明,miR-34a过表达后可以明显抑制PC3细胞的迁移和侵袭能力。
2.4MSR1的表达对前列腺癌细胞迁移和侵袭能力的逆转作用 为了研究MSR1的表达对miR-34a影响前列腺癌细胞迁移和侵袭能力的逆转作用。使用Transwell侵袭实验检测MSR1对PC3细胞侵袭能力逆转的影响。如图4A所示,miR-34a-mimic+LV5-MSR1组的细胞侵袭数目比miR-34a-mimic组明显增多[(192.1±11.4) vs (75.8±7.1),P=0.035], 差异具有统计学意义。通过划痕愈合实验检测MSR1对PC3细胞迁移情况的影响。如图4B所示,miR-34a-mimic+LV5-MSR1组的细胞迁移速度比miR-34a-mimic组明显增快[24 h (0.38±0.02) vs (0.18±0.03),P=0.015;48 h (0.82±0.11) vs (0.51±0.08),P=0.009;72 h (1.25±0.19) vs (0.82±0.12),P=0.016],差异具有统计学意义。结果说明,过表达MSR1后可以明显逆转miR-34a对前列腺癌细胞的迁移和侵袭能力。
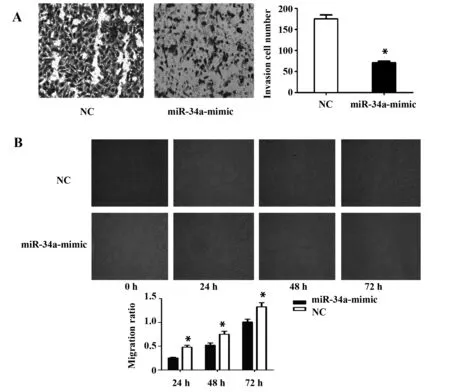
图3 miR-34 的表达对前列腺癌细胞迁移和侵袭能力的影响Fig.3 Effect of miR-34 expression on ability of prostate cancer cells to migrate and invadeNote: A.Transwell invasion test to detect the effect of miR-34a on invasive ability of prostate cancer cells;B.Scratch healing test to detect the effect of miR-34a on the migration of prostate cancer cells.*.P<0.05.
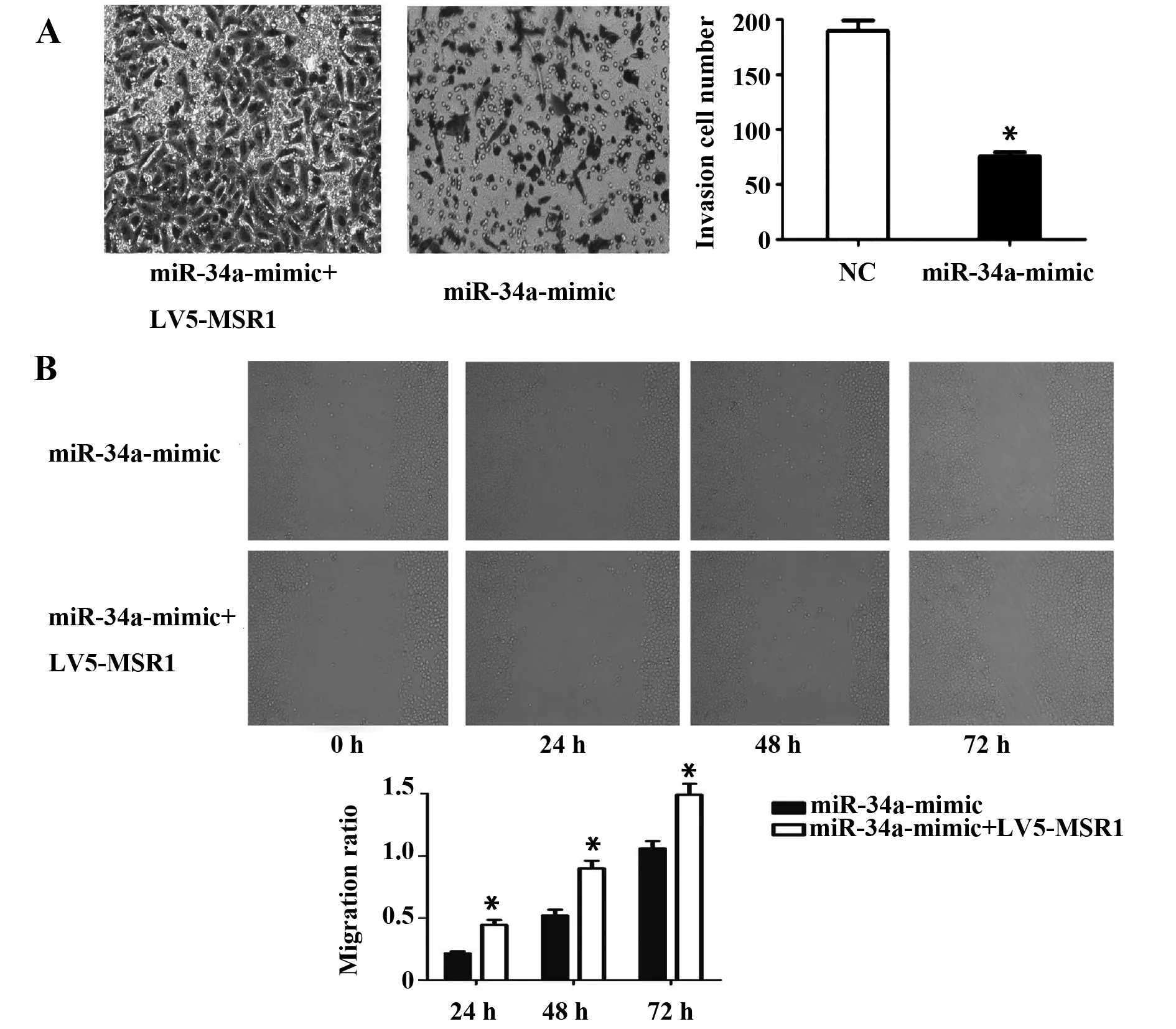
图4 MSR1 的表达对前列腺癌细胞迁移和侵袭能力的逆转作用Fig.4 Reversal of MSR1 expression on ability of prostate cancer cells to migrate and invadeNote: A.Transwell invasion test to detect the reversal effect of MSR1 on invasive ability of prostate cancer cells;B.Scratch healing test to detect the effect of MSR1 on the migration of prostate cancer cells.*.P<0.05.
3 讨论
前列腺癌目前在发展中国家发病率很高,相比发达国家来说,其发病率及死亡率都更高[10]。目前有研究报道,电离辐射、生活习惯(吸烟史等)和遗传易感性都是前列腺癌的主要病因和高危因素[11]。晚期的前列腺癌对周围组织侵袭情况比较严重,对周围组织的浸润和破坏是引起症状的主要原因,只能依靠手术切除治疗,往往也只能起到缓解作用,但是术后复发相当严重[12]。所以进一步研究前列腺癌的分子机制和疾病进展有利于改善前列腺癌的诊断和预后。
最近很多研究都报道miRNA在多种恶性肿瘤中充当很重要的调控作用[13]。通常来说,miRNA扮演肿瘤抑制因子的角色,通过下调促癌基因的表达或者促进抑癌基因的表达来实现抑制肿瘤的作用。同时有研究表明,miRNA可以同时调节多种信号通路,参与多种途径的信号传导[14]。在遗传性前列腺癌中,部分miRNA存在异常表达的现象,比如miR-14、miR-29、miR-573等[15,16]。miRNA的异常表达可以上调或者下调前列腺癌中的转录分子,影响前列腺癌细胞的增殖、分化以及凋亡等行为。miR-34a在多种类型的肿瘤组织中表达异常,如卵巢癌、肺癌、前列腺癌、胶质瘤等,miR-34a的表达失调能够改变肿瘤细胞的迁移和侵袭等恶性生物学行为。Dong等[17]在人卵巢癌细胞中发现miR-34a通过调节EMT达到抑制肿瘤细胞转移的作用。但是miR-34a在前列腺癌中的表达以及调控机制尚未有研究报道。
MSR1基因位于8p22,可以编码A 型巨噬细胞清道夫受体蛋白[18]。可以介导巨噬细胞膜表面具有吞噬功能的识别受体的表达,进而介导炎症的产生,影响细胞的部分生物学行为。最近研究显示,MSR1基因与前列腺癌、卵巢癌以及动脉粥样硬化等多种疾病有一定的相关性[19]。白立刚等[20]研究表明,在亚洲人群中MSR1基因的突变与前列腺癌的遗传易感性相关。而目前,在临床还没有完全明确MSR1在前列腺癌的发生发展过程中的具体机制,尤其是其上下游相关调控的miRNA的表达情况。
本研究通过检测前列腺癌中miR-34a和MSR1的表达情况及相关关系,抑制miR-34a后前列腺癌细胞的生物学行为的变化,再次探讨MSR1对前列腺癌细胞生物学行为的逆转作用。我们研究结果显示,过表达miR-34后,前列腺癌细胞的迁移和侵袭能力受到相应的抑制,这表明miR-34a可以有效抑制前列腺癌细胞的恶性生物学行为;而之后过表达MSR1后前列腺癌细胞的迁移和侵袭能力得到逆转,表明MSR1可以和miR-34a相互调控对前列腺癌细胞的迁移和侵袭能力进行干扰。
综上所述,前列腺癌中miR-34a的表达可以通过靶向调控MSR1影响前列腺癌细胞的迁移和侵袭能力,MSR1的过量表达可以逆转miR-34a在前列腺癌中的抑制能力,表明miR-34a和MSR1在前列腺癌的发生发展中可能扮演一个关键作用,可能成为前列腺癌的一个新的预防和治疗靶点,有效改善前列腺癌的诊断和预后情况。
参考文献:
[1] Catalona WJ,Richie JP,Ahmann FR,etal.Comparison of digital rectal examination and serum prostate specific antigen in the early detection of prostate cancer:results of a multicenter clinical trial of 6,630 men[J].J Urol,2017,197(2):S200-S207.
[2] Joniau S,Briganti A,Gontero P,etal.Stratification of high-risk prostate cancer into prognostic categories:a European multi-institutional study[J].Eur Urol,2015,67(1):157-164.
[3] Cancer Genome Atlas Research Network.The molecular taxonomy of primary prostate cancer[J].Cell,2015,163(4):1011-1025.
[4] 赵凯涛,杨 婷,郝明华,等.miR-185 与 Apba-1 在大鼠脑缺血再灌注损伤的表达变化及调控关系[J].解放军医药杂志,2016,28(3):13-17.
Zhao KT,Yang T,Hao MH,etal.Expression and regulation of miR-185 and Apba1 in focal cerebral ischemia-reperfusion injury in rats[J].Med J Chin People′s Liberation Army,2016,28 (3): 13-17.
[5] Li Y,Chan S C,Brand L J,etal.Androgen receptor splice variants mediate enzalutamide resistance in castration-resistant prostate cancer cell lines[J].Cancer Res,2013,73(2):483-489.
[6] 王沁易,张 煦.BTG1 蛋白在胃癌中的表达水平及临床意义[J].空军医学杂志,2016,32(3):171-174.
Wang QY,Zhang X.Expression level of BTG1 in gastric cancer and its clinical significance[J].J Air Force Medicine,2016,32 (3): 171.174.
[7] Corcoran C,Rani S,O′driscoll L.miR-34a is an intracellular and exosomal predictive biomarker for response to docetaxel with clinical relevance to prostate cancer progression[J].Prostate,2014,74(13):1320-1334.
[8] Beuten J,Gelfond JAL,Franke JL,etal.Single and multivariate associations of MSR1,ELAC2,and RNASEL with prostate cancer in an ethnic diverse cohort of men[J].Cancer Epidem Prevent Biom,2010,19(2):588-599.
[9] DePinho R A,Ding Z,Wu C J,etal.Signatures and determinants associated with prostate cancer progression and methods of use thereof:U.S.Patent 9,458,510[P].2016-10-4.
[10] 彭 薇,许永华.磁共振扩散加权成像与动态增强联合应用对乳腺病变的价值[J].中国 CT 和 MRI 杂志,2010,12(6):19-22.
Peng W,XU YH.Value of breast lesions by combined use of diffusion-weighted MR imaging and dynamic contrast enhancement[J].CTM China J,2010,12(6): 19-22.
[11] Bill-Axelson A,Holmberg L,Garmo H,etal.Radical prostatectomy or watchful waiting in early prostate cancer[J].New Eng J Med,2014,370(10):932-942.
[12] Ryan CJ,Smith MR,De Bono JS,etal.Abiraterone in metastatic prostate cancer without previous chemotherapy[J].New England J Med,2013,368(2):138-148.
[13] Casanova-Salas I,Rubio-Briones J,Calatrava A,etal.Identification of miR-187 and miR-182 as biomarkers of early diagnosis and prognosis in patients with prostate cancer treated with radical prostatectomy[J].J Urol,2014,192(1):252-259.
[14] Gezer U,Tiryakioglu D,Bilgin E,etal.Androgen stimulation of PCA3 and miR-141 and their release from prostate cancer cells[J].Cell J(Yakhteh),2015,16(4):488.
[15] 黄重发,付启梅,周 怿,等.miRNA-33a 抑制人结肠癌细胞 HCT-116 增殖的机制研究[J].解放军医学杂志,2016,41(9):725-729.
Huang CF,Fu QM,Zhou Y,etal.Mechanism of miRNA-33a inhibiting human colon cancer cell HCT-116 proliferation[J].Chin PLA J,2016,41 (9): 725-729.
[16] Wang L,Song G,Tan W,etal.MiR-573 inhibits prostate cancer metastasis by regulating epithelial-mesenchymal transition[J].Oncotarget,2015,6(34):35978.
[17] Dong P,Xiong Y,Watari H,etal.MiR-137 and miR-34a directly target Snail and inhibit EMT,invasion and sphere-forming ability of ovarian cancer cells[J].J Exp Clin Cancer Res,2016,35(1):132.
[18] Fair-mäkelä R,Kukkonen-Macchi A,Karikoski M,etal.Msr1-a new player in leukocyte trafficking via the lymphatics[J].Scandinavian J Immunol,2016,83(5):372-373.
[19] Wang X,Wang Q,Zhang Y,etal.Transcriptome analysis reveals physiological characteristics required for magnetosome formation in Magnetospirillum gryphiswaldense MSR-1[J].Environmental Microbiol Rep,2016,8(3):371-381.
[20] 白立刚,袁亚光,王国强.MSR1基因多态性与中国汉族人群前列腺癌易感性的关系[J].临床和实验医学杂志,2017,16(2):178-181.
Bai LG,Yuan YG,Wang GQ.The association between MSR1 gene polymorphisms and genetic susceptibility to prostate cancer in Chinese Han population[J].J Clin Exp Med,2017,16(2):178-181.