冻顶乌龙茶汤风味物质组分的电喷雾电离飞行时间质谱分析
2018-04-19
(1.北京大学公共卫生学院,北京 100191;2.浙江大学信息与电子工程学院,杭州 310027;3.北京大学天然及仿生药物国家重点实验室,北京 100191;4.北京大学药学院化学生物学系,北京 100191)
乌龙茶是一种几世纪前起源于中国的半发酵茶叶饮品,并且越来越受到全世界消费者的青睐。乌龙茶的独特品质主要在于它的半发酵加工工艺。冻顶乌龙茶产自台湾南投县,主要是以青心乌龙为原料制成的半发酵茶,是一种品质极高的乌龙茶,有“茶中圣品”之称。
乌龙茶的品质主要通过香味、风味和外观3个方面来进行评价,其中香味和风味是两个最重要的评价指标。乌龙茶的香味主要由乌龙茶中挥发性的香味成分决定,包括脂类、醇类和醛酮类物质等。乌龙茶茶汤的风味主要由乌龙茶溶于水中的有机成分决定,乌龙茶的保存和冲泡方式也会对其风味造成一定的影响。乌龙茶茶汤中的多种风味成分决定了乌龙茶的营养价值,例如儿茶素的抗氧化和抗肿瘤功能[1]。茶多酚、氨基酸、可溶性多糖和咖啡碱是乌龙茶茶汤中最重要的营养和风味物质。其中茶多酚一直是人们研究的热点,包括儿茶素类、黄酮类、酚酸类和花色素类等。乌龙茶中茶多酚中的主要组分是表没食子儿茶酸酯(EGCG)、表儿茶素没食子酸酯(ECG)、表没食子儿茶素(EGC)和表儿茶素(EC),占茶多酚总量的60%~80 %[2]。因此,本次对茶汤风味物质的研究将重点放在了茶多酚上。
目前针对茶汤营养成分的研究,主要采用高效液相色谱或和质谱联用的方法:茶多酚测定参照GB—8313测定方法(分光光度法)[3],儿茶素测定参照GB—8313(高效液相色谱法)[3],游离氨基酸测定参照GB—8314测定方法(水合茚三酮比色法)[4],咖啡碱测定参照GB—8312测定方法(高效液相色谱法、紫外分光光度法)[5]。因为茶汤含有复杂的混合组分,其物质种类远超过人们的想象,因此,针对茶汤风味物质的研究通常需要色谱的参与,从而使得这些物质得到分离和鉴定。面对混合物的质谱,研究者没有标准谱库的参考,单从质谱图的角度出发,研究者通常很难得到非常有效的结果和结论。目前针对混合物质谱检索方法的研究有很多,本研究也希望在这一方面做出自己的尝试。
研究尝试建立一套较为系统的、针对小分子量(600D以下)混合物质谱的快速定性分析方法。该方法以分子质谱的质荷比和同位素峰强度比为基础,利用计算机强大的计算功能,对自建化学品数据库进行检索,从而实现对质谱峰的定性解释。该方法毋需借助色谱或二级质谱,且对使用者的化学知识要求不高。当然,其准确性和普遍的适用性仍有待进一步实验证实。
1 实验方法
1.1 茶汤准备
本实验茶叶样本为产自台湾南投县鹿谷乡的冻顶乌龙茶。实验前,茶叶密封保存在4℃冰箱中。用分析天平称取0.3780±0.0016g茶叶6份。将超纯水加热到指定温度,分别将茶叶(各3份平行样)与加热到85℃和100℃的超纯水(电导率:14.30MΩ)各50.0mL混合得到茶汤,此过程模拟生活中冲茶的步骤。将茶汤在室温下冷却,冷却30min后接近室温时通过0.45μm的滤膜过滤得到所需的茶汤样品。
1.2 质谱条件
质谱测定使用Waters 公司 Xevo G2 Q-TOF 四极杆飞行时间质谱仪,电喷雾离子源(ESI),ES+和ES-两种模式对样品中化合物进行电离。
茶汤水溶液直接进样,每次进样量0.2μL。
ES+模式:喷雾电压为3.05kV;源温度100℃;脱溶剂气温度299℃;气帘气流量50L/h;脱溶剂气流量595L/h。
ES-模式:喷雾电压为-2.08kV;源温度100℃;脱溶剂气温度299℃;气帘气流量49L/h;脱溶剂气流量596L/h。
1.3 混合物的质谱分析方法
电喷雾电离(ESI)作为一种软电离技术,一般得到的都是样品组分中的分子离子,即一般是单电荷离子。因此,可以假定我们所关心的质谱峰皆为分子离子峰。
在没有色谱分离和标准物质参考的条件下,想要对混合物质谱进行解析是非常困难的,需要非常丰富的分析化学和有机化学知识。对于像茶汤这样非常复杂的混合物,仅靠简单的人工分析数据几乎不可能完成对于质谱峰的指认。因此,需要借助计算机和其他研究者的研究成果。各种乌龙茶茶汤中的风味成分大多是共有的,如果大量地检索乌龙茶相关研究文献,从文献中找到这些物质成分的质谱信息或同位素丰度得来的化学计量信息,再与实验所得到的混合物高分辨质谱数据进行比对,理论上就可以对某些数据吻合的质谱峰作出定性的解释,当然这种解释只能精确到分子式,对于每种分子式所对应的大量异构体,也只能参考文献进行解释。此外,对于通过质谱质量进行检索得到的结果,也通过同位素峰强度比和二级质谱的数据进行验证。由于数据库的来源为既往的文献研究,因此,检索结果也可以通过既往文献得到验证。本次试验采用了图1所示的混合物质谱解析策略。
1.3.1 化学品库的建立
在ScienceDirect数据库中检索“Oolong”和“MS”两个关键词,按关联度排序。对所得到的文献选取前50篇,通过全文的浏览分析,来选取合适的入库文献。文献选取的标准:

图1 混合物质谱解析策略
1)必须是针对乌龙茶茶汤风味物质的质谱研究或液质联用研究;
2)研究必须报告分离鉴定出物质的质谱信息,包括以下但并不是全部数据:该物质的精确分子量、[M+H]+或[M-H]-模式下质谱信息、分子式、化学名、相对误差等。
得到入库文献后,将各物质的质谱信息录入到Microsoft Office Excel 2010中,建立数据库。数据库中包含的信息有化学名、分子式、精确分子量、[M+H]+、[M+Na]+和[M-H]-模式下的质谱峰的质荷比,如果原文献有二级质谱信息,则包含二级质谱信息。最后按照精确分子量大小进行排序,化学品库建立完毕。
1.3.2 化学品库的检索
对每个测得的质谱峰(同位素峰除外,是否同位素峰通过观察质谱图得出)的质荷比在化学品库中进行遍历。分别寻找在[M+H]+、[M+Na]+和[M-H]-3种模式下与之匹配的分子式,如果ES+质谱峰的质荷比与某种物质的[M+H]+和[M+Na]+精确分子量相对误差小于0.0003%[6],则认为该物质所对应的分子式可能属于该质谱峰。如果有超过一种分子式对应的加氢或加纳质量误差小于0.0003%,将这些分子式都记录下来。同理,ES-模式下的质谱峰则与[M-H]-的质量进行比较。所有质量数据均保留到小数点后4位。
如果只有一种分子式对应该质谱峰,我们认为该分子式就是质谱峰的合理解释,而该分子式对应化学品库的物质,就是可能的被鉴定物质。
检索过程通过计算机编程实现,编程环境为Windows R x64 3.22。
1.3.3 分子式的验证
由于茶多酚、咖啡因、茶多糖等物质大多只含有C、H、O、N 4种元素,少量物质会含有P、S等元素以及一些金属元素。因此,此项研究中假设各质谱峰对应化合物只含C、H、O、N 4种元素。
基于上述假设,可以认为某质谱峰的质荷比所对应的分子式是由C、H、O、N 4种元素组合构成。将上一步所有能够在化学品库中得到匹配的质谱峰都带入这一步,验证是否有其他合理的分子式可以满足质谱峰的质量要求。质量要求仍然是误差小于0.0003%。
1.3.4 同位素峰强度比进行验证
质谱上分子离子峰理论质荷比,是按照丰度最高的同位素的精确分子量计算的。由于每种元素都存在同位素,因此,在谱图中出现了同位素异构体峰,同位素异构体峰的强度是根据各种同位素在自然界中的丰度确定的。对于只含有C、H、O、N 4种元素的物质来说其同位素峰强度比可以用下式表示,w、x、y、z分别为分子式中C、H、O、N 4种元素的化学计量数。

峰强度比的大小主要由C元素的个数来决定的,因此,在知道峰强度比的情况下可以计算出C元素的个数。在本研究中假定计算出C元素个数与相应检索得分子式中C元素个数相差小于等于2的话,该分子式的推测就是合理的。
1.3.5 二级质谱进行验证
如果在自编入库的文献中含有化学物质的二级质谱信息,就可以通过检索这些二级质谱对应的质谱峰,在我们所得的质谱图中是否出现,来验证该种化学物质是不是质谱峰的合理解释。我们知道,某种物质的二级质谱是相对特异的,因此可以用于对同一分子式不同物质的排除。
1.4 质谱图的比较以及实验可重复性评价
为了评价本套实验方法的可重复性,采用cosine相似度对平行样本的质谱图进行比较。选取峰强度最大的10个峰参与比较。假设两个质谱图的信号分别为X= (x1,x2,…,x10)和Y=(y1,y2,…,y10),X和Y包含了质荷比信息和峰强度信息。使用如下公式计算相似度SC[23]:
因为X中既包含质荷比信息又包含峰强度信息,因此对X和Y的定义如下:
质荷比为m,而峰强度比为x,参考既往文献,确定了峰强度和质荷比在这个公式中所占的权重,即a=0.5,b=1[7]。
2 结果
2.1 化学品库
在ScienceDirect数据库中检索关键词“Oolong”、“MS”共得到963篇文献,按照关联程度排序,选取其中与检索内容相关度最高的前50篇文献。通过人工浏览,从50篇文献中筛选得到14篇与本次研究内容相关的文献。其中大多数文献重点针对乌龙茶中的儿茶素类和黄酮类化合物进行了研究[8-15],一篇文献针以乌龙茶中的氨基酸为研究重点[16],部分文献则是对乌龙茶的多糖类物质进行了研究[17-21]。根据检索出的物质建立化学品库,所得物质共208种,精确分子质量在32.0262到898.1956之间。该化学品库中的物质涵盖了有机化学分类中的醇类、醛类、酸类、烷烃类等,并且包括儿茶素及其衍生物、黄酮类化合物、茶多糖、咖啡因等对茶汤的风味和营养价值影响最大的化合物。
2.2 85℃和100℃茶汤质谱测定结果
85℃和100℃冲泡所得到的茶汤分别在ES+和ES-模式下电离进行质谱分析,各重复3次共得到12张质谱图。为了简化处理,也为了避免噪音基线的干扰,选取了相对峰强度在前100的质谱峰,并且认为这些质谱峰所对应的化合物可能对茶汤的风味和营养价值有更大的贡献。我们希望比较85℃茶汤和100℃茶汤中所含风味营养物质的差别。
图2为85℃和100℃一组平行样在ES+和ES-模式下所得到的质谱图。
2.3 质谱峰的指认
如前述的方法,将质谱测定的结果带入到化学品库中进行检索,寻找与质谱峰质荷比相差小于0.0003%的物质。检索分为以下3种情况:
(1)[M+H]+的精确分子量与正离子质谱的结果进行比较;
(2)[M+Na]+的精确分子量与正离子质谱的结果进行比较;
(3)[M-H]-的精确分子量与负离子质谱的结果进行比较。
对正离子质谱图的5个质谱峰和负离子质谱图的12 个质谱峰做出了可能的解释。没有在[M+H]+模式下找到与化学品库匹配的结果。在[M+Na]+模式下5个质谱峰329.0643、365.1060、481.0747、633.1214、779.2018在化学品库找到了与之匹配的分子式,并且在化学品库中有且仅有一种分子式与相应的质谱峰对应。对应的物质共9种,其中同样的分子式可能对应不同的化合物(表1)。
对于负离子质谱图的检索,得到了更为丰富的结果。共有12个质谱峰在化学品库中找到了与之匹配的分子式, 并且每个质谱峰只找到了一种分子式与之对应。而找到对应的化学物质共有22种。大多数得到匹配的质谱峰,同时出现在85℃和100℃的实验组茶汤质谱中(表2)。
结合正负离子质谱的结果,共找到26种物质对17个质谱峰进行解释。儿茶素、表儿茶素、蔗糖以及儿茶素没食子酸酯,表儿茶素没食子酸酯,所对应的质谱峰分别出现在正负离子质谱图中。在这26种物质中绝大多数为儿茶素类和黄酮类物质,只有焦谷氨酸、奎宁酸、蔗糖3种物质非儿茶素和黄酮类化合物。非常遗憾的是,在正负离子模式的质谱图中,都没有找到咖啡因可能对应的质谱峰,而根据既往的研究和我们的经验,咖啡因在红茶和乌龙茶中的含量应该较高。我们认为在正离子质谱图中的m/z195质谱峰很有可能是咖啡因,但它的相对误差是0.0004%。因为本实验精度的要求,无法确认195质谱峰为咖啡因。
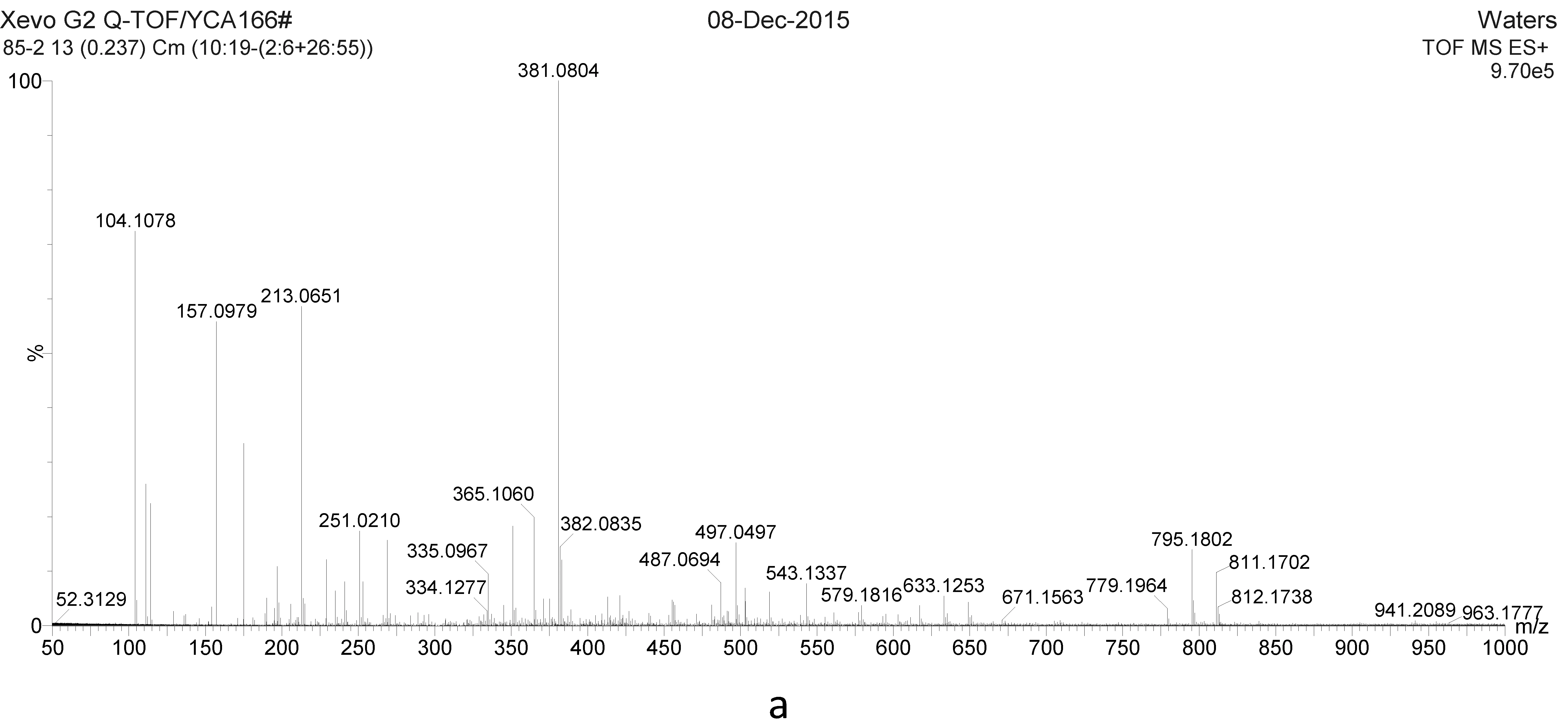



图2 85℃(a,b)和100℃(c,d)茶汤ES+、ES-模式质谱图

85℃100℃测量值(m/z)理论值误差(%)分子式对应化合物+-329064332906370.0002C15H14O7没食子酸儿茶素表没食子酸儿茶素+-365106036510600.0000C12H22O11蔗糖+-481075448107470.0002C22H18O11没食子儿茶素没食子酸酯表没食子儿茶素没食子酸酯-+633121463312200.0002C30H26O14棓儿茶酸二聚体+-779201877920110.0001C33H40O20山奈酚⁃3⁃氧⁃葡萄糖鼠李糖葡萄糖苷槲皮素⁃3⁃氧⁃二鼠李糖葡萄糖苷山奈酚⁃3⁃氧⁃葡萄糖芸香糖苷
ES+模式下[M+Na]+Na 原子精确质量=22.98977,+表示检出,-表示未检出

表2 ES-模式下指认物质
ES-模式下(M-H) H 原子精确质量=1.007825,+表示检出,-表示未检出
2.4 对指认结果的验证
由于物质指认方法仅根据分子式的精确分子量得出,因此存在一定的局限性,可能出现遗漏或指认错误,因此,实验采用了3种方法对指认分子式的唯一性以及合理性进行验证。
2.4.1 分子式的唯一性
对于具有同一精确分子量,可能存在多种分子式,也就是元素的随机组合形式与之对应。因此,首先需要验证该分子量的分子式仅对应于所找到的分子式,并不存在其他可能的元素组合形式。通过验证可以发现在分子量较小(<600D)的情况下,精确分子量与分子式基本上满足意义对应的关系(表3)。

表3 分子量400D以下元素随机组合验证结果

续表3
注:灰色底纹表示该组合与化学品库中分子式匹配;深灰色底纹表示该分子式对应物质存在,但不在化学品库中;白色底纹表示该种组合的分子式不存在;*表示该种分子式对应物质不稳定。
2.4.2 同位素峰强度比验证分子式
通过同位素峰强度比,计算分子式中的C元素化学计量数,并与化学品库中寻找到的分子式进行比较。负离子质谱图中的质谱峰128、191、305、341、457、463,755、771对应的同位素峰强度比结果与通过分子量检索所得结果较为一致(表4)。

表4 负离子模式下同位素峰强度比验证表
2.4.3 二级质谱信息验证分子式
二级质谱可以给我们的分子式提供更为详细的信息,然而遗憾的是,文献中所提供的二次质谱的质荷比信息,只精确到了整数,无法与实验所得的质谱图进行精确的比较。
最终,对负离子模式下的12个质谱峰进行检验,除593质谱峰外,其余质谱峰都得到了至少一种方法的验证。
2.5 实验结果的可重复性
通过比较组内相似度来验证该质谱方法的可重复性。组内和组间相似度基本上在80%到90%之间(表5)。组内的相似度所得到的结果并不是十分理想,可能源于茶汤本身并不稳定,也可能由于在茶汤制备和上样的操作难以按照完全一致的规范控制所致。
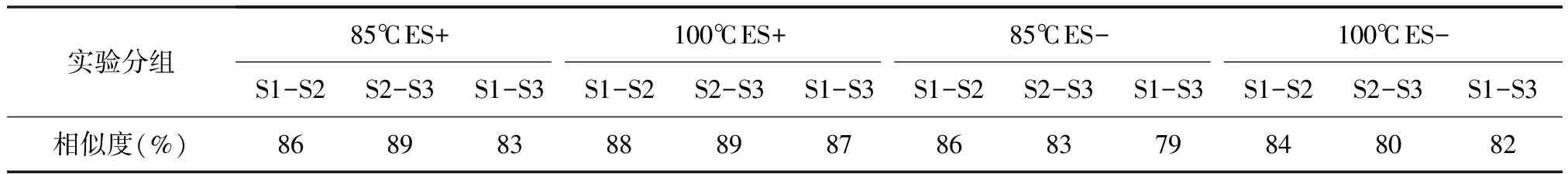
表5 组内相似度 请按示意排表
注:S1-S2表示组内平行1和平行2间的相似度
3 讨论与结论
3.1 冻顶乌龙茶质谱解析
分别在正负两种离子模式下对冻顶乌龙茶茶汤进行了质谱分析,正离子模式下有5个峰得出了唯一的分子式解释,负离子模式下有12个峰得出了唯一的分子式解释。其中几乎所有的分子式都得到了一种或两种方法的验证。只有质谱峰m/z593所对应的分子式没有得到任何一种方法的验证。在做出解释的质谱峰中,其相对峰强度大多较高,对应的物质主要为儿茶素和黄酮类物质。可以粗略地认为,冻顶乌龙茶中儿茶素类和黄酮类物质含量较高,此结果与既往的文献研究结果是一致的[8-23]。
既往文献中,大多数研究者对于茶汤的质谱分析都采用了负离子质谱图[8-23],结合我们的结果可以看出,负离子质谱应该更适合于乌龙茶茶汤的质谱分析。
3.2 混合物的质谱解析方法
本研究所建立的混合物质谱的分析方法,借助计算机的帮助,以质荷比为检索基础,适合于较小分子量的化合物分子式分析(<600D)。结合同位素峰强度比和元素随机组合的验证方法,可以保证所得结果在一定程度上的准确性。但因为缺少对照试验,无法进行更进一步的分析。在重复性方面,虽然质谱在峰强度方面的重复性存在着一定的缺陷,但对整体的检索工作并没有造成实质性的影响,该方法的重复性还是有非常好的保障。
研究之初曾提出了两种分析策略。第一种分析策略直接从化学品库中寻找质谱峰对应的分子式;第二种策略先得出每种质荷比的所有分子式组合,再从化学品库中寻找相应的分子式与化合物。两种方法的本质是相同的,但第一种更适合于快速而简单地分析,尤其是在化学品库较小的情况下。而第二种策略则更为完善,但对化学品库有较高的要求。当只对某个分子离子峰感兴趣时,第二种分析策略是一个非常好的选择。
3.3 方法的局限性
化学品库是影响工作质量的一个重要因素,它直接限制了所能找到的化合物的种类,同时也可能对分析工作带来较大的偏倚。研究在之后的工作中也进一步完善了化学品库,建立更全面、更准确和更少偏倚的化学品库,扩增使用了REAXYS数据库,该数据库含有大量天然产物的化学组分信息。在nature product目录下检索“tea”得到539个结果,来自于69349篇文献。批量导出后,经过人工筛选,总共将461种化合物纳入了本研究的化学品库。
本次实验的局限性还包括:缺乏其他标准方法的比照,质谱图无法进行绝对的定量分析,重复平行试验太少。只能为质谱峰找到对应的分子式,很难从质谱结果中得到所含物质的结构式,只能通过与既往文献的比较,对分子离子峰对应的化合物进行合理的推测。当然,在特定的研究领域,这方面的缺陷可以得到一定程度的弥补。
在本项研究中,建立了一套针对复杂混合物质谱的分析策略,并用该策略尝试了对冻顶乌龙茶茶汤风味成分的分析。为17个质谱峰寻找到可能对应的分子式与化合物,其中大多数化合物为儿茶素和黄酮类物质。最后对方法的可重复性进行了检验,此方法对于混合物质谱的初步解析将会有一定的应用参考价值。
[1] 郭晓娜,郭雅玲,廖泽明,等.食品安全质量检测学报,2014,(12):4115-4120.
[2] Zhu Q Y, Zhang A, Tsang D, et al .Journal of Agricultural and Food Chemistry, 1997, 45: 4624-4628.
[3] GB/T 8313-2008.茶 茶叶中茶多酚和儿茶素类含量的检测方法.
[4] GB/T 8314-2013.茶 游离氨基酸总量的测定.
[5] GB/T 8312-2013.茶 咖啡碱测定.
[6] Stein SE, Scott DR. Journal of the American Society for Mass Spectrometry. 1994; 5:859.
[7] Koo I, Kim S, Zhang X. J. Chromatography A, 2013; 1298: 132-138.
[8] Chen YJ, Kuo PC, Yang ML, et al. Food Research International, 2012, 53(2): 732-743.
[9] Hsieh SK, Lo YH, Wu CC, et al. Journal of food and drug analysis,2015, 23: 660-670.
[10] Svoboda P, Vlĉková H, Nováková L. Journal of Pharmaceutical and Biomedical Analysis, 2015, 114: 62-70.
[11] Juang YM, Chien HJ, Chen CJ, et al. Talanta, 2016, 153: 347-352.
[12] Huo YS, Zhang Q, Li Q, et al. Journal of Pharmaceutical and Biomedical Analysis, 2016, 125: 225-239.
[13] Zhu YT, Ren XY, Yuan L, et al. Food Chemistry, 2015, 173: 521-526.
[14] Bravo L, Goya L, Lecumberri E. Food Research International, 2007, 40: 393-405.
[15] Wang D, Lu JL, Miao AQ, et al. Journal of Food Composition and Analysis, 2008, 21: 361-369.
[16] Horanni R, Ulrich H. Journal of Food Composition and Analysis, 2013, 31: 94-100.
[17] López-Gutiérrez N, Romero-González R, Plaza-Bolaos P, et al. Food Chemistry, 2015, 173: 607-618.
[18] Zhao Y, Chen P, Lin L, et al. Food Chemistry, 2011, 126: 1269-1277.
[19] Dartora N, Lauro M, Arquimedes P, et al. Food Chemistry, 2011, 129: 1453-1461.
[20] Sine Yener, José A, Pablo M, et al. Talanta, 2016, 152: 45-53.
[21] Xu J, Hu FL,Wang W, et al. Food Chemistry, 2015, 186: 176-184.
[22] Karl Fraser, Geoff A, Don E, et al. Food Chemistry, 2014, 151: 394-403.
[23] Wu P, Wen C, Leng ZX, et al. Animal Feed Science and Technology, 2014, 194: 131-135.
