红壤侵蚀区芒萁对土壤微生物群落结构的影响
2018-04-19吕茂奎谢锦升
张 浩,吕茂奎,谢锦升,*
1 福建师范大学地理科学学院,福州 350007 2 湿润亚热带山地生态国家重点实验室培育基地,福州 350007
土壤微生物是陆地生态系统碳氮循环的驱动者,直接参与土壤物质循环和能量流动,深刻影响土壤肥力[1-2]。土壤微生物群落结构与生物量对土地覆被变化极为敏感,与土壤生态系统的稳定和健康息息相,故常作为土壤质量变化的重要指标[3-4]。有研究显示,植被恢复可显著改变土壤生态系统的许多生物化学过程[5],其中变化最快和最显著的是土壤微生物群落结构与功能[6]。植被恢复进程中土壤凋落物输入的质量和数量以及土壤的理化性质(土壤温度、土壤湿度、土壤pH等)不同,土壤的碳氮循环动态与微生物的联系也会随之发生改变[7]。相关研究表明,不同的耕作方式造成土壤扰动的强度不同,微生物的碳源结构随之改变,造成微生物群落结构和功能发生变化[8- 11],并且过程中如有有机肥料的使用,微生物的生物量和多样性会明显增加[12- 13];Guo等[3]研究也发现,土地覆被变化过程中,植被群落结构的变化和土壤理化性质的改变会引起土壤微生物群落结构的变化;在森林生态系统内研究也发现,气候因子(温度和降水量)和土壤环境(pH、土壤养分环境(C/N等)、土壤质地)以及立地生产量和植被多样性控制着土壤微生物群落结构的变化[1,14- 17]。
关于侵蚀地上植被恢复后微生物群落结构的变化,在黄土高原严重侵蚀退化地上已有大量研究[18- 20],结果表明植被恢复过程中土壤微生物群落结构的变化是因植被恢复的阶段不同导致植被的类型和生长方式不同而引起的。然而,在南方红壤侵蚀区在植被恢复过程中土壤微生物的变化主要集中在微生物生物量的变化和季节动态[21- 23],关于植被恢复过正中微生物群落结构的变化及其影响因子鲜有报道,尤其是林下植被对土壤微生物群落结构的影响研究更少。
人为破坏导致我国南方红壤区水土流失严重,随着经济快速发展,该区水土保持与生态恢复重建工作取得了极大进展,植被覆盖度提高,林下发育了大片芒萁群落,对土壤质量和土地生产力的改善作用明显,尤其是土壤微生物生物量变化明显[24- 26],然而植被恢复过程中,林下植被——芒萁是否控制着土壤微生物群落结构的变化以及引起这些变化的关键因素我们目前还并不清楚。鉴于此,本研究选取不同恢复年限的马尾松林(0年,13年,31年)为研究对象,利用磷脂脂肪酸(phospholipid fatty acid,PLFA)图谱分析法,通过比较不同恢复阶段芒萁覆盖(NRd)、去除芒萁(Rd)与林下裸地(CK)土壤微生物群落结构的差异,旨在揭示红壤侵蚀区植被恢复过程中微生物群落结构变化的规律和引起这种变化的关键因子,深入认识土壤质量的演变规律,为侵蚀退化红壤恢复与管理提供科学依据。
1 材料与方法
1.1 研究区和试验地概况
研究区位于福建西南部汀江上游的长汀县河田镇(116°18′—116°31′E,25°33′—25°48′N),海拔300—500m。该区属中亚热带季风气候区,年均降雨量1737mm,其中4—6月降水量约占全年的50%,年均蒸发量1403mm。年均气温17.5—19.2℃,平均无霜期260d,平均日照时数1924.6h,≥10℃积温为4100—4650℃。河田镇属河谷盆地,低山高丘环抱四周,土壤为燕山运动早期形成的中粗粒花岗岩发育的红壤,抗蚀抗冲性较差,地带性植被(常绿阔叶林)被破坏殆尽,现有植被主要以马尾松(Pinusmassoniana)次生林和人工林为主,林下植被以芒萁(Dicranopterisdichotoma)为主。河田镇是全国极强度水土流失区之一,许多地方表土层丧失殆尽,植被恢复困难。
采用时空代换方案,在红壤典型侵蚀区福建省长汀县河田镇选择土壤母岩均为花岗岩的未治理地(0年)、恢复13年和31年的马尾松林地(表1)组成植被恢复年限序列。恢复13a和恢复31a的马尾松林地治理前均为A层土壤流失殆尽,B层出露,本底条件与未治理地基本一致。
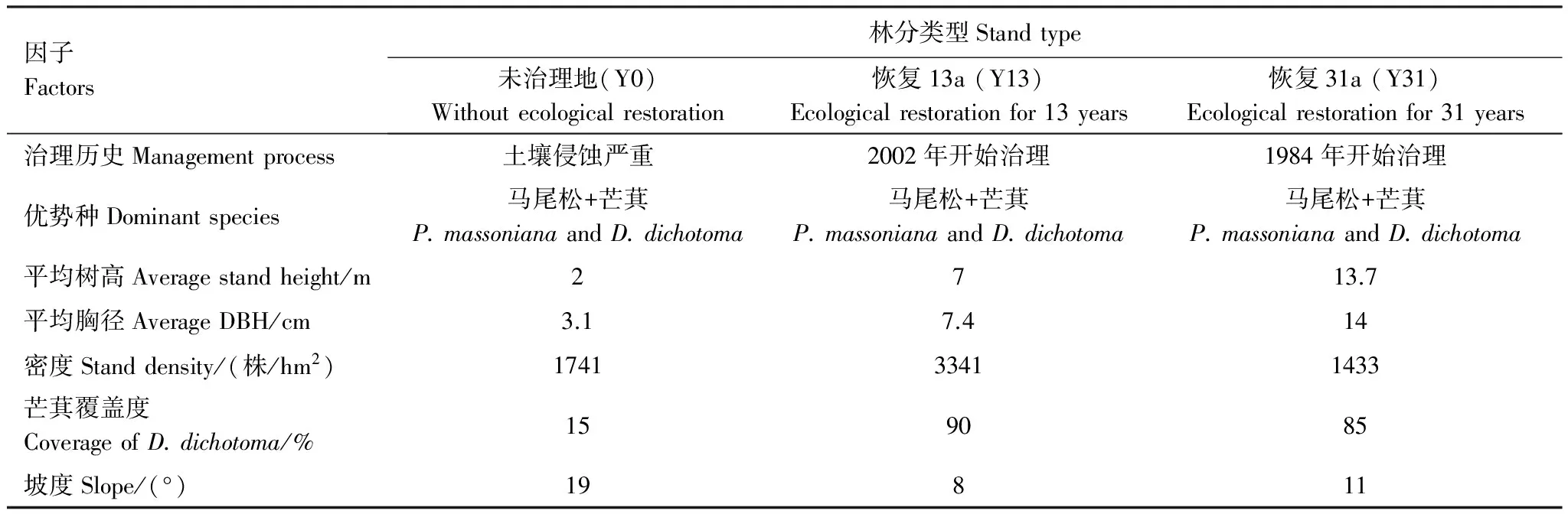
表1 样地基本概况
1.2 样地调查和样品采集处理
于2014年8月上旬,在每个林地设置3种处理:保留芒萁覆盖(NRd)、去除芒萁覆盖(Rd)以及与之毗邻的林下未生长芒萁的裸地(CK)。在每个林地内选择坡向和坡度基本一致,本底条件相似的坡地,设置3个20m×20m的标准样地,每个标准样地分成4个10m×10m的亚样方,随机选取1个亚样方作保留芒萁覆盖处理,1个亚样方作去除芒萁覆盖处理,与之毗邻的林下裸地作为对照,其面积和形状依每个样地实际裸露情况确定,面积不少于100m2。在芒萁去除4个月后,即2014年12月中旬,用取土钻(内径为5cm)在每个处理样地内,取0—10cm土层的土壤,按S型随机多点(15点)取样并混合。取回的部分新鲜土样在实验室拣去石砾、植物根系和大于2mm的碎屑,风干后过0.149mm土壤筛,存于密闭自封袋中,用于土壤理化性质和土壤有机碳的测定。剩余的新鲜土样过2mm土壤筛,冷冻于-20℃冰箱中,用于土壤微生物生物量和群落结构的测定。
1.3 实验方法
土壤有机碳(SOC)和土壤全氮(TN)采用碳氮元素分析仪(Vario EL Max CN, Elementar, Germany)测定;微生物量碳(MBC)和微生物量氮采用氯仿熏蒸浸提法测定,可溶性有机碳(DOC)采用去离子水浸提法提取浸提液,使用总有机碳分析仪(TOC-V CPH, Shimadzu, Japan)上机测定。
土壤微生物群落组成采用磷脂脂肪酸(PLFA)分析法,磷脂脂肪酸的提取简单操作步骤:称取相当于16g干土重的鲜土,依次加入5mL磷酸缓冲液、6mL三氯甲烷、12mL甲醇,振荡2h后离心(4000转/min,10min),转移上层清液到分液漏斗中,向剩余土壤中再加入12mL三氯甲烷和12ml磷酸缓冲液,振荡离心,转移上层清液,合并两次的上清液,黑暗环境下静置一夜;收集下层氯仿相,在氮气下吹干,通过硅胶柱分离出磷脂,加甲醇∶甲苯(1∶1,V/V)和0.2mol/L氢氧化钾溶液进行皂化和甲基化形成脂肪酸甲酯。每一个脂肪酸甲酯通过气象色谱仪(Agilent 6890 N, 美国),根据它们的停留时间结合MIDI微生物识别系统(MIDI Inc., Newark, DE)来进行鉴定。
不同学者关于磷脂脂肪酸标志物选择有不同见解,本研究参考Frostegård Å, Tunlid A, Bååth E等[27-28]等学者的观点,结果详见表2。

表2 检验土壤微生物种群的脂肪酸标志物
1.4 计算方法和数据处理
所有数据统计分析和作图均在Excel 2013、SPSS 19.0、Orange 9.0等软件上进行。采用二因素重复测量和单因素方差分析,并利用CANOCO 5.0软件进行冗余分析来确定植被恢复过程中微生物群落结构变化规律及其影响因子。
2 结果分析
2.1 土壤微生物生物量碳氮
Y0、Y13、Y31马尾松林芒萁覆盖地土壤MBC分别是林下裸地的2.34倍、1.97倍、2.70倍(P<0.05),去除芒萁4个月后,Y0土壤MBC降低不明显,但仍显著高于林下裸地,Y13和Y31土壤MBC降低明显,仍分别是林下裸地的1.32倍、2.06倍(P<0.05),土壤MBN的变化趋势与MBC基本一致,Y0、Y13、Y31马尾松林芒萁覆盖地土壤MBN分别是林下裸地的2.41倍、2.23倍、1.57倍(P<0.05),去除芒萁4个月后,Y0土壤MBN降低不明显,但仍高于林下裸地,Y13和Y31土壤MBN显著降低,已经接近林下裸地水平(P<0.05)。另外,随着植被恢复年限的增加,不论何种处理,土壤MBC和MBN含量均呈显著增加的趋势(P<0.05)。
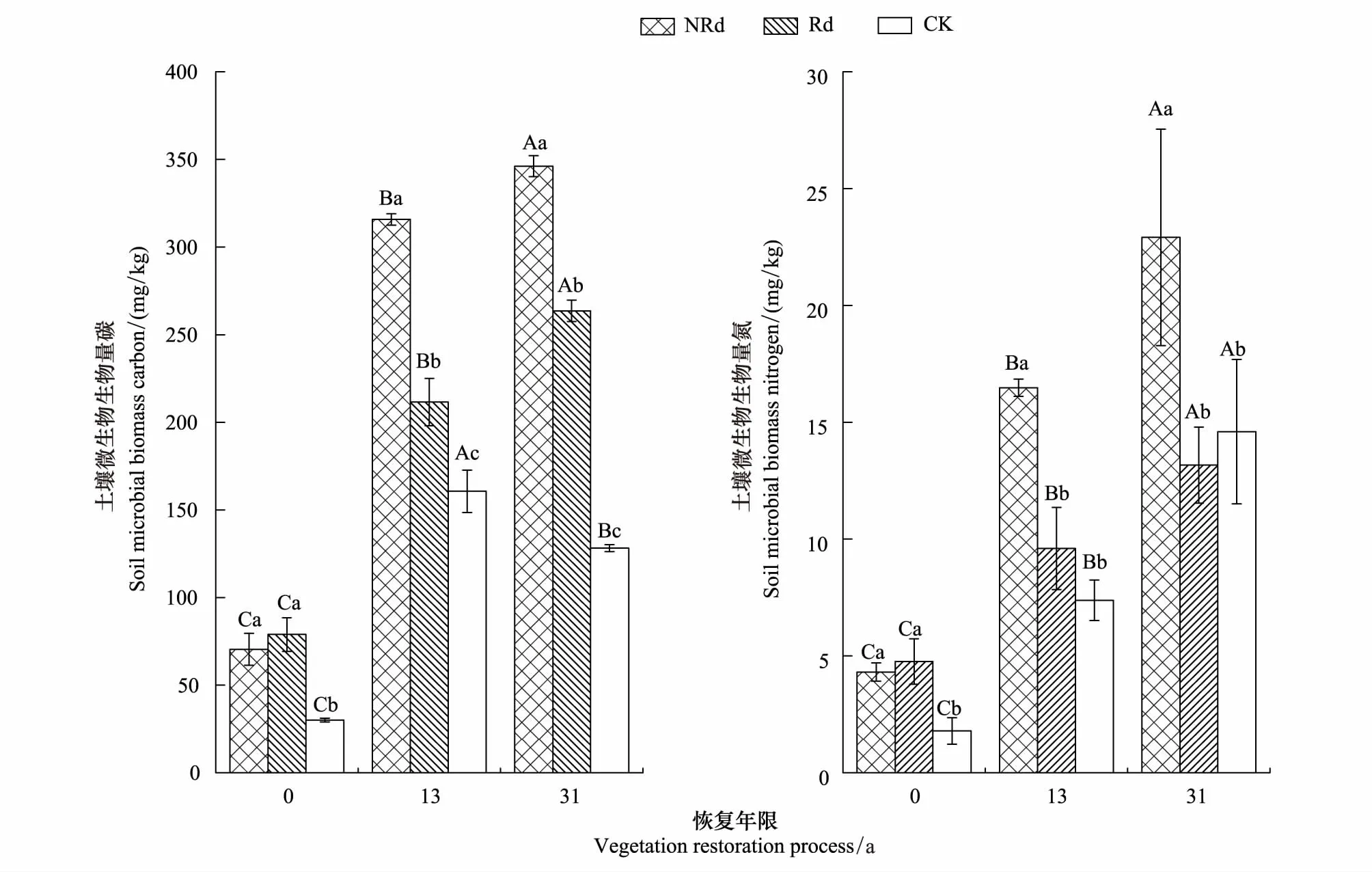
图1 土壤微生物生物量Fig.1 Soil microbial biomass in different treatmentsNRd,芒萁覆盖地,not removed D. dichotoma;Rd,去除芒萁覆盖地,removed D. dichotoma;CK,林下裸地,control;大写字母表示同一处理不同恢复年限间各指标的比较,小写字母表示同一恢复年限不同处理间各指标比较,有相同字母表示差异不显著,不同字母表示差异显著(P<0.05)
2.2 土壤磷脂脂肪酸标志物
利用PLFA分析技术,在不同恢复年限的马尾松林土壤层中总共监测到了42种土壤微生物种群的磷脂脂肪酸,其中选取18种作为标志土壤微生物类群的磷脂脂肪酸,其分为饱和直链脂肪酸(i14:0,i15:0,a15:0,i16:0,i17:0, a17:0,10Me16:0,10Me17:0,10Me18:0)、环丙基脂肪酸(cy17:0)、单不饱和脂肪酸(16:1ω5c,16:1ω9c,16:1ω7c,18:1ω7c,18:1ω5c,18:1ω9c)以及双不饱和脂肪酸(18:2ω6,9c),其中细菌PLFA标志物12种,真菌PLFA标志物2种,丛枝菌根真菌PLFA标志物1种,放线菌PLFA标志物3种(表2)。
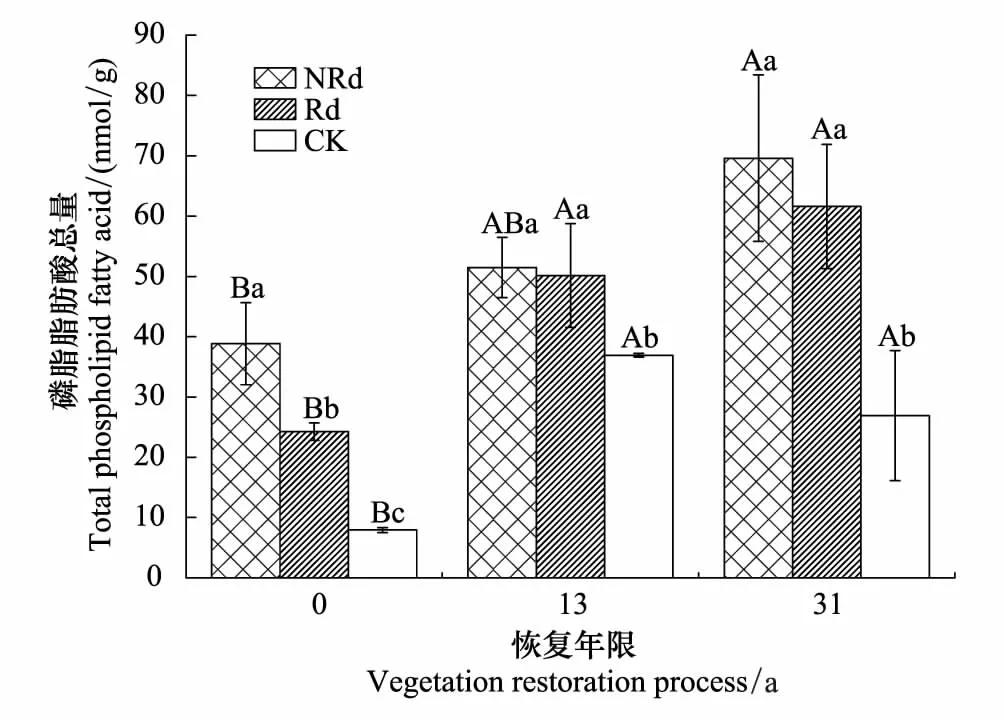
图2 土壤微生物磷脂脂肪酸总量 Fig.2 Total Phospholipid fatty acid (PLFAs) of soil microorganism PLFAs,磷脂脂肪酸总量,total phospholipid fatty acid
Y0、Y13和Y31马尾松林芒萁覆盖地磷脂脂肪酸总量(PLFAs)分别是林下裸地的4.89倍、1.36倍、2.58倍(图2),去除芒萁4个月后,Y0土壤PLFAs显著降低,但仍为林下裸地的3.05倍,Y13和Y31降低不明显,分别仍为林下裸地的1.36倍、2.29倍(P<0.05)。随着植被恢复年限的增加,土壤PLFAs含量均呈显著增加的趋势(P<0.05),表明植被恢复时间越长,土壤微生物生物量越多。
2.3 土壤微生物群落结构结构变化
Y0和Y31马尾松林芒萁覆盖地土壤GP的PLFAs分别是林下裸地的2.85倍、1.67倍,GN的PLFAs分别是林下裸地的2.44倍、2.75倍(图3),ACT的PLFAs分别是林下裸地的2.46倍、2.09倍(P<0.05),而Y13马尾松林芒萁覆盖地土壤GP、GN、ACT菌群的PLFAs与林下裸地并未形成明显差异,这可能与其林分正处于恢复的壮年期,林分密度大有关;Y13和Y31马尾松林芒萁覆盖地土壤Fungi的PLFAs分别是林下裸地的1.67倍、2.29倍(P<0.05),Y0马尾松林芒萁覆盖地土壤Fungi的PLFAs与裸地差异却不显著;Y0、Y13、Y31马尾松林芒萁覆盖地土壤VAM的PLFAs分别是林下裸地的3.91倍、1.71倍、2.76倍(P<0.05)。图中还表明去除芒萁4个月后,土壤各微生物菌群的PLFAs变化并未达到显著水平,但随着植被恢复年限的增加,土壤微生物各菌群的PLFAs均有显著增加(P<0.05),尤其是在马尾松林下芒萁覆盖地变现尤为明显。
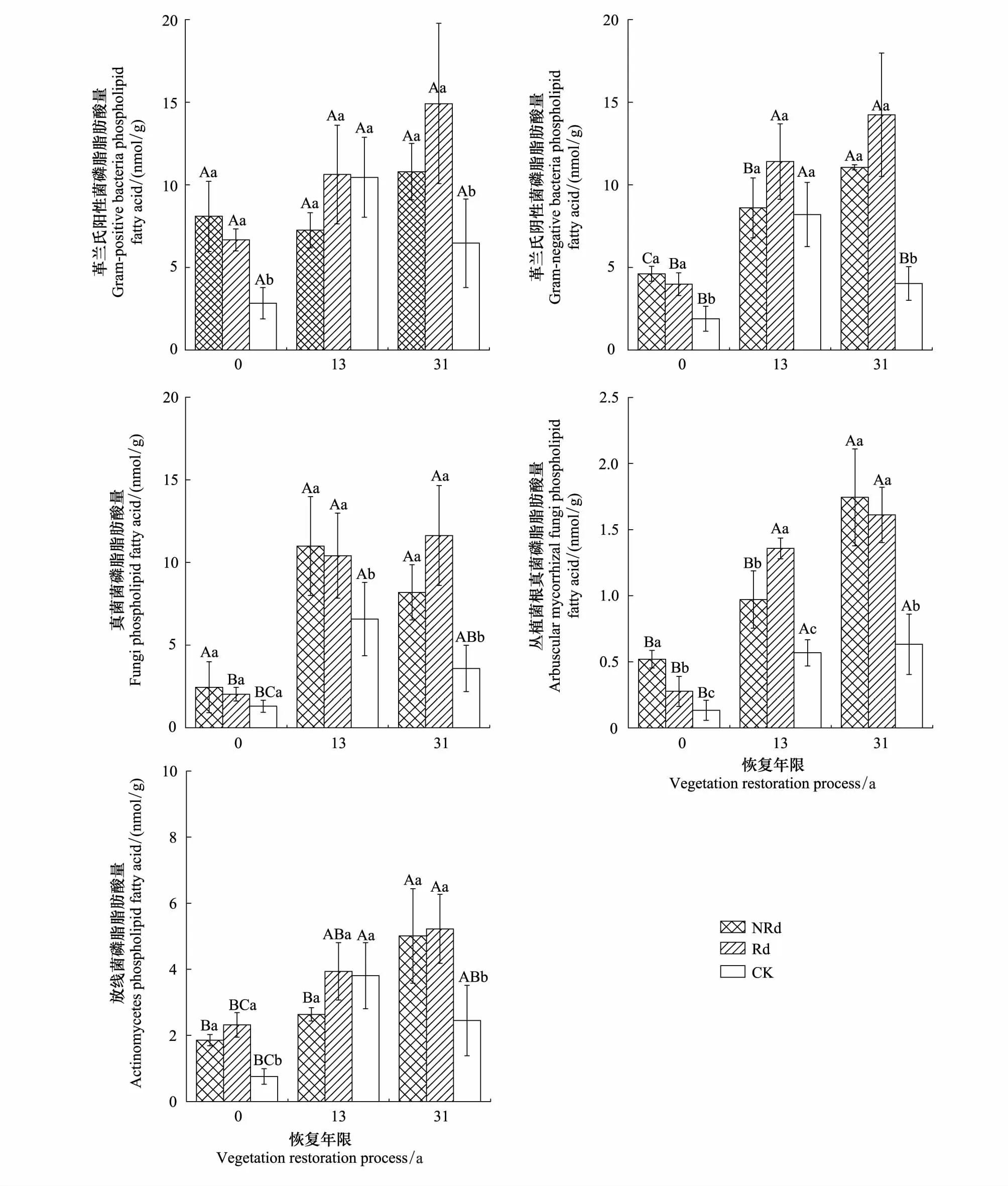
图3 土壤微生物菌群Fig.3 Soil microbial group
Y0马尾松林芒萁覆盖地cy/pre显著小于林下裸地(表3),Y13马尾松林GP/GN和sat/mono均显著小于林下裸地,Y31马尾松林GP/GN、sat/mono和cy/pre均显著小于林下裸地,不同恢复年限马尾松林芒萁覆盖地F/B显著高于林下裸地(P<0.05)。而去除芒萁4个月后,相比于芒萁覆盖地,Y0和Y31马尾松林土壤cy/pre显著升高,Y13马尾松林F/B显著降低(P<0.05),这意味着林下裸地养分胁迫较芒萁覆盖地高,而芒萁覆盖可增强土壤养分的可利用性,有利于土壤质量的提高。
此外,随着植被的不断恢复芒萁覆盖地土壤层中GP/GN值、cy/pre值和sat/mono的比值均有显著降低的趋势,而F/B值却显著升高(P<0.05),林下裸地土壤的各指标变化趋势并不明显,表明芒萁覆盖地土壤养分胁迫随植被恢复在不断减弱。
2.4 土壤微生物群落与土壤理化性质的关系

GP/GN,革兰氏阳性菌与革兰氏阴性菌的比值,Gram-positive bacteria/ Gram-negative bacteria;F/B,真菌与细菌的比值,the ratio of soil Gram-positive bacteria to Gram-negative bacteria;cy/pre,(cy17:0+cy19:0ω8c)/(16:1ω7c+18:1ω7c)的比值,the ratios of cyclopropyl to cyclopropyl precursor;sat/mono,饱和直链脂肪酸/单不饱和脂肪酸的比值,the ratios of saturated straight chain fatty acid to monounsaturated fatty acids
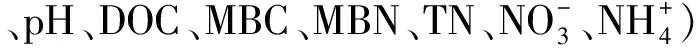

图4 未治理地、恢复13a和恢复31a马尾松林土壤微生物磷脂脂肪酸的冗余分析Fig.4 Redundancy analysis on the soil microbial phospholipid fatty acids of Y0、Y13、Y31

环境因子EnvironmentalfactorsSoilC/NPinusC/NDicraC/NpHDOC/(mg/kg)MBC/(mg/kg)MBN/(mg/kg)TN/(mg/kg)NO-3/(mg/kg)NH+4/(mg/kg)GP/GN-0.612∗∗-0.201-0.0180.513∗∗-0.528∗∗-0.758∗∗-0.686∗∗0.639∗∗0.550∗∗-0.494∗∗F/B0.584∗∗0.3330.506-0.503∗∗0.691∗∗0.905∗∗0.559∗0.450∗-0.449∗0.156VAM0.563∗∗0.301-0.327-0.417∗0.2740.510∗∗0.724∗∗0.810∗∗-0.728∗∗0.758∗∗ACT0.426∗0.372-0.339-0.3370.1180.3600.481∗0.653∗∗-0.685∗∗0.601∗∗cy/pre-0.669∗∗-0.463∗0.1170.073-0.404∗-0.500∗∗-0.441∗-0.2720.652∗∗-0.092sat/mono-0.728∗∗-0.422∗-0.1790.517∗∗-0.538∗∗-0.735∗∗-0.680∗∗-0.667∗∗0.784∗∗-0.455∗
**表示极显著相关(P<0.01),*表示显著相关(P<0.05);Soil C/N,土壤碳氮比,the ratio of soil carbon to nitrogen;Pinus C/N,马尾松凋落叶的碳氮比,the ratio ofP.massonianaleaf litter carbon to nitrogen;Dicra C/N,芒萁凋落叶的碳氮比,the ratio ofD.dichotomaleaf litter carbon to nitrogen
3 讨论
土壤微生物生物量和群落结构受土壤理化性质影响深刻,是土壤质量状况的灵敏监视器[2-3],而红壤侵蚀区植被恢复后,林下是否有芒萁覆盖,土壤质量状况差异显著[29],显然会引起土壤微生物生物量和群落结构的不同。研究发现,芒萁枯落物因其养分含量极低而分解速度缓慢[29],以致芒萁覆盖下的土壤上层常常有深厚的枯落物层积累,导致土壤的理化性质发生改变,例如降低土壤pH,降低土壤温度,提高土壤养分的可利用性[29],并且有利于固持水土和土壤碳氮积累。另有研究证实,由于缺少林下植被覆盖,马尾松林下裸地土壤侵蚀严重,并且缺乏土壤有机碳的输入,立地条件极差[25-26],因此造成林下裸地土壤MBC、MBN、总PLFAs均显著低于林下芒萁覆盖地(图2,图3),这表明芒萁对微生物生物量具重要影响。与林下裸地相比,芒萁覆盖下的土壤,凋落物输入的数量和种类更为丰富,并且土壤中遍布芒萁的根系,能够产生大量的根系分泌物和根系脱落物,可产生大量的活性有机碳,为微生物活动提供良好环境[30],故而芒萁覆盖下的土壤微生物生物量也就更多,而且随着植被年限的增加,土壤质量状况明显好转[25-26],微生物生物量也呈明显增加趋势。
如前所述,林下芒萁覆盖地土壤各菌类的PLFAs均显著高于林下裸地(图3),但恢复13年的马尾松林林下芒萁覆盖与否,各菌类的PLFAs变化并不明显,这可能与恢复13年的马尾松林正处于恢复的壮年期,林分密度大,林下裸地上接受的碳输入的质量和数量并不比林下芒萁覆盖地少有关。另有研究证实,土壤微生物磷脂脂肪酸标志物的比值不但能够较好刻画土壤养分胁迫状况,而且可以表征土壤微生物群落结构变化[29,31- 32]。显然,林下植被芒萁覆盖与否,土壤质量状况发生了明显的变化,那么土壤微生物群落结构必然随之发生变化。本研究发现,林下裸地F/B显著低于林下裸地,GP/GN、sat/mono和cy/pre显著高于芒萁覆盖地(P<0.05),去除芒萁4个月后,F/B、GP/GN、sat/mono和cy/pre有逐渐接近林下裸地的趋势(不同恢复年限的马尾松林各微生物类群比值变化未达到显著水平,但总体趋势一致),这意味着林下裸地养分胁迫较芒萁覆盖地强,证实芒萁覆盖地土壤养分的可利用行更强,微生物生物量和群落结构更丰富,活性更强。此外,本研究还发现,GP/GN、sat/mono和cy/pre随着恢复年限的增加而降低,而F/B会升高,尤其在芒萁覆盖地变现尤为明显,表明林分恢复年限的增加,土壤质量状况明显好转,土壤养分胁迫性逐渐降低,而芒萁覆盖在这一过程中具重要作用。
相关研究发现,GP自身具有较厚的细胞壁,而且可以形成孢子,对环境胁迫能力极强,而GN对环境胁迫的适应能力较差,因而环境胁迫不如裸地强的芒萁覆盖土壤就具有较低的GP/GN、sat/mono、cy/pre[33]。真菌的生活史对策属于K-型,而细菌是r-型,因而它们对不同质量的碳源具有不同的偏好,生活环境中活性碳源一旦被细菌大量消耗,那么真菌就会取得竞争的优势地位,鉴于真菌的碳源利用效率高于细菌,其对纤维素、木质素等高分子聚合物的分解效率较高,F/B值越高意味着土壤生态系统越稳定[30,33-34],然而,芒萁覆盖地覆被着大量的芒萁枯落物,其含有丰富的纤维素、木质素等高分子聚合物,并且土壤pH较低,恰好给真菌菌落提供了良好的酸性生活环境[35]和底物环境,因此就解释了芒萁覆盖地土壤F/B之所以会显著高于林下裸地。VAM常常与植物营养根系组成共生体而存在[36],植物根系分布和根系分泌物的多寡直接影响其数量的多少,而芒萁覆盖地土壤中芒萁根系密布,根系分泌物丰富,这就给VAM提供了良好的生活环境,从而导致芒萁覆盖下土壤中VAM的PLFAs要明显高于林下裸地。芒萁去除4个月后,土壤微生物各类菌群均有不同程度变化,但同林下芒萁覆盖地差异未达到显著水平,这可能因为去除芒萁处理只是去除了芒萁地上部分,降低了地上的可溶性有机碳输入土壤,然而土壤中仍密布着芒萁的活根系,显然根系分泌物及其周转会随着芒萁去除处理,芒萁的光合作用几近消失而显著降低,但去除芒萁4个月时,其仍可维持土壤中微生物的基本活动,从而保持微生物各菌群生物量在短时间变化微弱,本研究预测随着芒萁去除时间的增长,各微生物菌群生物量及其结构会逐渐接近林下裸地的状况。
4 结论
芒萁覆盖明显改变了土壤质量状况,土壤微生物生物量与群落结构随之发生改变。不同恢复年限马尾松林下芒萁覆盖地土壤MBC、MBN和总PLFAs显著高于林下裸地(P<0.05),去除芒萁4个月后,土壤MBC、MBN和PLFAs均有降低趋势,表明芒萁覆盖可维持土壤微生物生物量;与林下裸地相比,芒萁覆盖地土壤GP、GN、Fungi、ACT的含量明显较高(P<0.05),GP/GN、sat/mono和cy/pre明显较低(P<0.05),因此林下植被芒萁覆盖地土壤养分胁迫性不如林下裸地强,养分的可利用性明显高于林下裸地;而F/B和VAM却与之相反,芒萁覆盖地土壤明显高于林下裸地,证明了芒萁覆盖下土壤生态系统稳定,土壤有机碳稳定性更强;相关分析和冗余分析发现土壤理化性质与微生物生物量与群落结构关系密切,可以判断土壤C/N、pH和氮素水平是调控芒萁覆盖下土壤微生物生物量和群落结构的主要生态因子。
参考文献(References):
[1] Feng W T, Zou X M, Schaefer D. Above- and belowground carbon inputs affect seasonal variations of soil microbial biomass in a subtropical monsoon forest of southwest China. Soil Biology and Biochemistry, 2009, 41(5): 978- 983.
[2] Harris J A, Birch P. Soil microbial activity in opencast coal mine restorations. Soil Use and Management, 1989, 5(4): 155- 160.
[3] Guo X P, Chen H Y H, Meng M J, Biswas S R, Ye L X, Zhang J C. Effects of land use change on the composition of soil microbial communities in a managed subtropical forest. Forest Ecology and Management, 2016, 373: 93- 99.
[4] Deng Q, Cheng X L, Hui D F, Zhang Q, Li M, Zhang Q F. Soil microbial community and its interaction with soil carbon and nitrogen dynamics following afforestation in central China. Science of the Total Environment, 2016, 541: 230- 237.
[6] Fu X L, Yang F T, Wang J L, Di Y B, Dai X Q, Zhang X Y, Wang H M. Understory vegetation leads to changes in soil acidity and in microbial communities 27 years after reforestation. Science of the Total Environment, 2015, 502: 280- 286.
[7] Fierer N, Strickland M S, Liptzin D, Bradford M A, Cleveland C C. Global patterns in belowground communities. Ecology Letters, 2009, 12(11): 1238- 1249.
[8] 裴雪霞, 党建友, 张定一, 王姣爱, 张晶. 不同耕作方式对石灰性褐土磷脂脂肪酸及酶活性的影响. 应用生态学报, 2014, 25(8): 2275- 2280.
[9] 李忠佩, 吴晓晨, 陈碧云. 不同利用方式下土壤有机碳转化及微生物群落功能多样性变化. 中国农业科学, 2007, 40(8): 1712- 1721.
[10] 李锐, 刘瑜, 褚贵新. 不同种植方式对绿洲农田土壤酶活性与微生物多样性的影响. 应用生态学报, 2015, 26(2): 490- 496.
[11] Kramer C, Gleixner G. Variable use of plant- and soil-derived carbon by microorganisms in agricultural soils. Soil Biology and Biochemistry, 2006, 38(11): 3267- 3278.
[12] 李晨华, 贾仲君, 唐立松, 吴宇澄, 李彦. 不同施肥模式对绿洲农田土壤微生物群落丰度与酶活性的影响. 土壤学报, 2012, 49(3): 567- 574.
[13] 刘振香, 刘鹏, 贾绪存, 程乙, 董树亭, 赵斌, 张吉旺, 杨今胜. 不同水肥处理对夏玉米田土壤微生物特性的影响. 应用生态学报, 2015, 26(1): 113- 121.
[14] Wang Q K, He T X, Wang S L, Liu L. Carbon input manipulation affects soil respiration and microbial community composition in a subtropical coniferous forest. Agricultural and Forest Meteorology, 2013, 178- 179: 152- 160.
[15] 杨君珑, 付晓莉, 马泽清, 邸月宝, 刘琪璟, 王辉民. 中亚热带5种类型森林土壤微生物群落特征. 环境科学研究, 2015, 28(5): 720- 727.
[16] Malmivaara-Lämsä M, Fritze H. Effects of wear and above ground forest site type characteristics on the soil microbial community structure in an urban setting. Plant and Soil, 2003, 256(1): 187- 203.
[17] 李永春, 刘卜榕, 郭帅, 邬奇峰, 秦华, 吴家森, 徐秋芳. 亚热带不同林分土壤氨氧化菌群落特征. 应用生态学报, 2014, 25(1): 125- 131.
[18] 胡婵娟, 郭雷, 刘国华. 黄土丘陵沟壑区不同植被恢复格局下土壤微生物群落结构. 生态学报, 2014, 34(11): 2986- 2995.
[19] 薛萐, 刘国彬, 戴全厚, 李小利, 吴瑞俊. 黄土丘陵区人工灌木林恢复过程中的土壤微生物生物量演变. 应用生态学报, 2008, 19(3): 517- 523.
[20] 张燕燕, 曲来叶, 陈利顶, 卫伟. 黄土丘陵沟壑区不同植被类型土壤微生物特性. 应用生态学报, 2010, 21(1): 165- 173.
[21] 刘满强, 胡锋, 何园球, 李辉信. 退化红壤不同植被恢复下土壤微生物量季节动态及其指示意义. 土壤学报, 2003, 40(6): 937- 944.
[22] 王会利, 毕利东, 张斌. 退化红壤马尾松恢复林地土壤微生物生物量变化及其控制因素研究. 土壤学报, 2008, 45(2): 313- 320.
[23] 江玉梅, 陈成龙, 徐志红, 刘苑秋, 欧阳菁, 王芳. 退化红壤区人工林土壤的可溶性有机物、微生物生物量和酶活性. 应用生态学报, 2010, 21(9): 2273- 2278.
[24] Xie J S, Guo J F, Yang Z J, Huang Z Q, Chen G S, Yang Y S. Rapid accumulation of carbon on severely eroded red soils through afforestation in subtropical China. Forest Ecology and Management, 2013, 300: 53- 59.
[25] 谢锦升, 杨玉盛, 陈光水, 朱锦懋, 曾宏达, 杨智杰. 植被恢复对退化红壤团聚体稳定性及碳分布的影响. 生态学报, 2008, 28(2): 702- 709.
[26] 吕茂奎, 谢锦升, 周艳翔, 曾宏达, 江军, 陈细香, 胥超, 陈坦, 付林池. 红壤侵蚀地马尾松人工林恢复过程中土壤非保护性有机碳的变化. 应用生态学报, 2014, 25(1): 37- 44.
[27] Frostegård Å, Tunlid A, Bååth E. Use and misuse of PLFA measurements in soils. Soil Biology and Biochemistry, 2011, 43(8): 1621- 1625.
[28] Landesman W J, Dighton J. Response of soil microbial communities and the production of plant-available nitrogen to a two-year rainfall manipulation in the New Jersey Pinelands. Soil Biology and Biochemistry, 2010, 42(10): 1751- 1758.
[29] Zhao J, Wan S Z, Li Z A, Shao Y H, Xu G L, Liu Z F, Zhou L X, Fu S L.Dicranopteris-dominated understory as major driver of intensive forest ecosystem in humid subtropical and tropical region. Soil Biology and Biochemistry, 2012, 49: 78- 87.
[30] Bardgett R D, Lovell R D, Hobbs P J, Jarvis S C. Seasonal changes in soil microbial communities along a fertility gradient of temperate grasslands. Soil Biology and Biochemistry, 1999, 31(7): 1021- 1030.
[31] Xu X L, Li Q K, Wang J Y, Zhang L M, Tian S N, Zhi L, Li Q R, Sun Y. Inorganic and organic nitrogen acquisition by a fern Dicranopteris dichotoma in a subtropical forest in South China. PloS One, 2014, 9(5): e90075.
[32] 张圣喜, 陈法霖, 郑华. 土壤微生物群落结构对中亚热带三种典型阔叶树种凋落物分解过程的响应. 生态学报, 2011, 31(11): 3020- 3026.
[33] Thiet R K, Frey S D, Six J. Do growth yield efficiencies differ between soil microbial communities differing in fungal: bacterial ratios? Reality check and methodological issues. Soil Biology and Biochemistry, 2006, 38(4): 837- 844.
[34] Huang H L, Zhang S Z, Wu N Y, Luo L, Christie P. Influence ofGlomusetunicatum/Zeamaysmycorrhiza on atrazine degradation, soil phosphatase and dehydrogenase activities, and soil microbial community structure. Soil Biology and Biochemistry, 2009, 41(4): 726- 734.
[35] Wan X H, Huang Z Q, He Z M, Yu Z P, Wang M H, Davis M R, Yang Y S. Soil C:N ratio is the major determinant of soil microbial community structure in subtropical coniferous and broadleaf forest plantations. Plant and Soil, 2015, 387(1): 103- 116.
[36] 韦莉莉, 卢昌熠, 丁晶, 俞慎. 丛枝菌根真菌参与下植物-土壤系统的养分交流及调控. 生态学报, 2016, 36(14): 4233- 4243.
[37] 洪丕征, 刘世荣, 王晖, 于浩龙. 南亚热带红椎和格木人工幼龄林土壤微生物群落结构特征. 生态学报, 2016, 36(14): 4496- 4508.
