双硫-烯的光引发反应
2018-04-19刘光耀安泽胜
刘光耀,苗 苗,安泽胜
(上海大学环境与化学工程学院,上海200444)
点击化学(click chemistry)是化学家巴里·夏普莱斯(Barry Sharpless)在2001年提出的一个合成概念[1],主要是指通过小单元的拼接,快速可靠地完成各类分子的化学合成.值得注意的是,该方法是以碳-杂原子键(C—X—C)合成为基础的组合化学新方法,并且借助此类反应能简单高效地获得分子多样性.点击化学主要包括以下类型:环加成反应,例如最为常用的炔烃和叠氮化物的1,3-偶极环加成反应;碳碳多键加成反应;亲核开环反应;非醇醛的羰基化学反应.点击化学反应过程简单、快捷、高效、通用,相对于一般的有机合成过程,其反应原料易得、反应条件温和、对氧气和水不敏感、产物收率高、副反应极少甚至没有、选择性好,而且与一般有机反应产物的提纯需要过层析柱不同,点击化学反应的产物便于提纯.因此,这种稳定高效的化学反应得到了广泛应用,在高分子合成、药物合成与开发、材料化学、生物有机化学等领域已成为近年来最为常用的合成方法之一[2].
点击化学已在聚合物的多个研究方向得到广泛发展,如对聚合物主链进行修饰[3-6]、树状高分子的合成[7-8]和星形聚合物的制备[9-10]等.在日常生产和生活中特别受到关注的是炔烃和叠氮化物的点击化学,应用也最为广泛.以Cu(I)作为催化剂的炔烃和叠氮化物的点击化学,反应过程简单迅速,具有适用性广、产率高的优点,但是具有一个明显的缺点——需要使用金属催化剂Cu(I).Cu(I)会使反应体系对环境产生危害和污染,对生物体产生毒性;当用于纳米技术时,会引起纳米分散体系的聚集,在一定程度上限制了其在生物体内和纳米方面的应用[2].为了解决类似炔烃和叠氮化物1,3-偶极环加成存在的问题,硫醇-烯点击化学受到关注.
硫醇的使用已有百年历史,应用极其广泛.因为硫醇具有很强的反应活性,硫醇-烯点击化学不仅可以进行自由基过程[3],也可以进行亲核加成过程[11].硫醇-烯反应光引发自由基过程(见图1,图中hv指紫外光照射)是在光照条件下,光引发剂(photo-initiator,PI)引发反应开始,PI吸收紫外光能量形成自由基PI·与硫醇作用,使硫醇变为巯基自由基1(图1中的物质1)[12];巯基自由基与烯烃作用形成新的自由基2(图1中的物质2);新的自由基再与硫醇作用,夺取硫醇上的氢得到终产物3(图1中的物质3),硫醇变为巯基自由基继续参与反应[7,13-15].硫醇-烯自由基化学反应中常常要用到引发剂,常用的光引发剂分为裂解型光引发剂和夺氢型光引发剂.最常用的裂解型光引发剂是安息香双甲醚(UV-651,图2中的物质4);最常用的夺氢型光引发剂是二苯甲酮(diphenylmethanone,BP)(图2中的物质5),两种引发剂的引发机理如图2所示[16].

图1 硫醇-烯光引发自由基反应的机理Fig.1 Mechanism of photo-initiated thiol-ene reaction
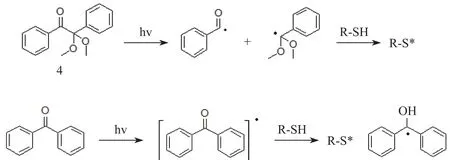
图2 不同类型光引发剂的引发机理Fig.2 Mechanism of initiated reaction with diあerent types of photo-initiator
硫醇-烯反应过程具有点击化学良好的优点,反应迅速、不需使用溶剂、反应条件温和、产率高,具有广泛的适用性[13],更重要的是硫醇-烯反应不使用1,3-偶极环加成反应中的Cu(I)等金属催化剂.但是,硫醇-烯反应同样存在弊端:硫醇类反应物具有刺鼻的气味,在使用过程中对人的伤害很大;硫醇在空气中易挥发并易被空气中的氧气氧化形成含有双硫键的双硫化合物,在硫醇的使用和储存方面带来不便.同时,硫醇-烯点击化学反应过程中有很多副反应,特别是在自由基终止过程中,容易产生副产物(见图1).本工作的研究目的就是在硫醇-烯光照自由基化学反应的基础上,找到一种比硫醇更稳定、反应副产物更少,但参与的反应具有硫醇-烯反应优点的反应物.
已有研究表明,双硫化物在光照条件下会直接发生双硫键的断裂[10],也可以由引发剂引发双键断裂[12],形成巯基自由基,由巯基自由基与烯发生反应.因此,选取硫醇的氧化物—–双硫化物与烯反应,形成双硫-烯光引发反应.双硫-烯反应中使用双硫化物可以有效避免硫醇氧化现象,也可以减少副反应的发生.
本工作就是在硫醇-烯的光照自由基化学基础上,研究二硫化物与烯的反应(双硫-烯反应).图3为双硫化物与烯烃的反应机理,双硫化物的双硫键经光引发剂引发形成两个巯基自由基加到烯烃的两端,得到目标产物.当发生硫醇-烯反应时,烯烃的活性、不同类型的反应引发剂、溶剂的极性都可能对实验速率产生影响,所以本实验研究了不同活性烯烃、不同类型引发剂、反应溶剂等对反应速率的影响.

图3 二硫化物与烯光反应机理Fig.3 Mechanism of photo-initiated disulf i de-ene reaction
1 实验部分
1.1 试剂与仪器
二苯甲酮(BP)、N,N’-二甲基甲酰胺(dimethylformamide,DMF)购于国药(上海)化学试剂有限公司,纯度为分析纯(analytical reagent,AR);安息香双甲醚(UV-651)购于百灵威公司,纯度为99%;二乙基二硫醚购于Alfa Aesar公司,纯度为99%;降冰片烯、3-丁烯-1-醇购于Sigma Aldrich公司,纯度均为99%.
Spectroline紫外灯UV-365 nm(SB-100P/F);BRUKER AV 500 MHz核磁共振波谱仪;Agilent 6890N/5975/EI气相色谱-质谱联用分析仪.
1.2 实验过程
双硫-烯反应过程中使用的双硫化物为二乙基二硫醚,结构为图4中的物质6.为了比较不同类型引发剂对反应的影响,使用裂解型光引发剂—–安息香双甲醚(UV-651)和夺氢型光引发剂二苯甲酮.为研究不同反应活性的烯烃对反应的影响,使用3-丁烯-1-醇(图4中的物质7)和降冰片烯(图5中的物质8),因为分子空间结构不同,降冰片烯的活性高于3-丁烯-1-醇[3].在选取极性溶剂时,由于引发剂和反应物不溶于水,故选取极性有机溶剂N,N’-二甲基甲酰胺(DMF).
实验均在避光条件下进行,具体实验步骤如下:称取二乙基二硫醚(0.82 g,6.7 mmol)、3-丁烯-1-醇(0.5 g,6.8 mmol)与安息香双甲醚(0.007 g,0.027 mmol),将三者混合均匀;实验组S1取100µL混合液,未除氧,紫外灯未预热,在室温下直接紫外光照15 min;实验组S2取100µL混合液,氮气除氧30 min,紫外灯未预热,在室温下通氮气保护,紫外光照15 min;对反应前后的样品进行核磁共振(nuclear magnetic resonance,NMR)测试1H NMR光谱.
称取二乙基二硫醚(0.82 g,6.7 mmol)、3-丁烯-1-醇(0.5 g,6.8 mmol)与二苯甲酮(0.061 g,0.34 mmol),将三者混合均匀.实验组S3取200µL混合液,氮气除氧30 min,紫外灯未预热,在室温下氮气保护,紫外光照2 h;实验组S4取160µL混合液,加入160µL DMF,V(反应物)∶V(DMF)=1∶1,氮气除氧30 min,紫外灯未预热,在室温下氮气保护,紫外光照2 h.测试反应前后样品的1H NMR光谱.
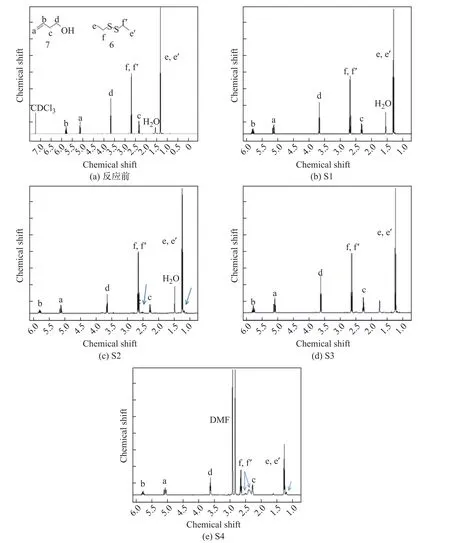
图4 S1~S4反应后的1H NMR光谱Fig.41H NMR spectra of S1~S4 reactions
称取二乙基二硫醚(0.41 g,3.3 mmol)、降冰片烯(0.4 g,3.3 mmol)与安息香双甲醚(0.041 g,0.16 mmol),将三者混合均匀.实验组S5取200µL混合液加入钳口瓶中,不加其他溶剂,氮气除氧30 min,预热紫外灯10 min,在室温下通氮气保护,紫外光照1 h.测试反应前后样品的1H NMR光谱.
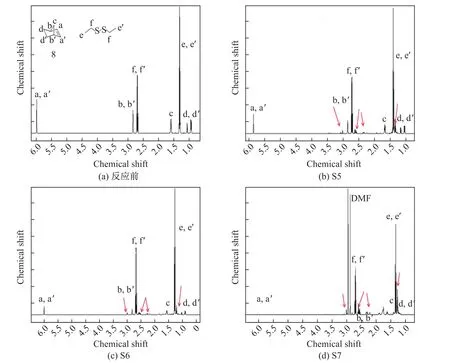
图5 S5~S7反应后的1H NMR光谱Fig.51H NMR spectra of S5~S7 reactions
称取二乙基二硫醚(0.41 g,3.3 mmol)、降冰片烯(0.41 g,3.3 mmol)与二苯甲酮(30 mg,0.16 mmol),将三者混合均匀.实验组S6取200µL混合液加入钳口瓶中,不加其他溶剂,氮气除氧30 min,预热紫外灯10 min,在室温下通氮气保护,紫外光照1 h.实验组S7取200µL混合液加入钳口瓶中,并加入200µL DMF,V(反应物)∶V(DMF)=1∶1,氮气除氧30 min,预热紫外灯10 min,在室温下通氮气保护,紫外光照1 h.测试反应前后样品的1H NMR光谱.
1.3 实验样品表征
对实验样品的NMR测试使用BRUKER AV 500 MHz核磁共振波谱仪,测试1H NMR光谱所使用的氘代试剂为氘代氯仿(CDCl3),使用美国Agilent 6890N/5975/EI气相色谱-质谱联用分析仪(gas chromatography-mass spectrometer,GC-MS)进行表征,溶剂为正己烷.
2 结果与讨论
2.1 双硫-烯反应可行性
为了证明双硫-烯光照反应的可行性,主要通过NMR和气相色谱质谱联用仪进行表征,实验结果如表1所示,[]表示物质的量.各实验组反应后的1H NMR光谱如图4和5所示,图中箭头所指的位置即为新产生物质的峰.新峰的生成可以证明实验组反应的发生,若没有新峰出现,则说明反应没有发生或者低于检测限.S1~S4这4组实验的反应物为二乙基二硫醚和3-丁烯-1-醇,发生反应的实验组为S2,S4,产物较为明显的峰在1.2,2.3和2.5处出现.S5~S7这3组实验的反应物为二乙基二硫醚和降冰片烯,3组反应全部发生,产物较为明显的峰出现在1.2,2.3,2.5和3.0的位置.NMR测试的表征结果可以说明双硫和烯烃发生反应.
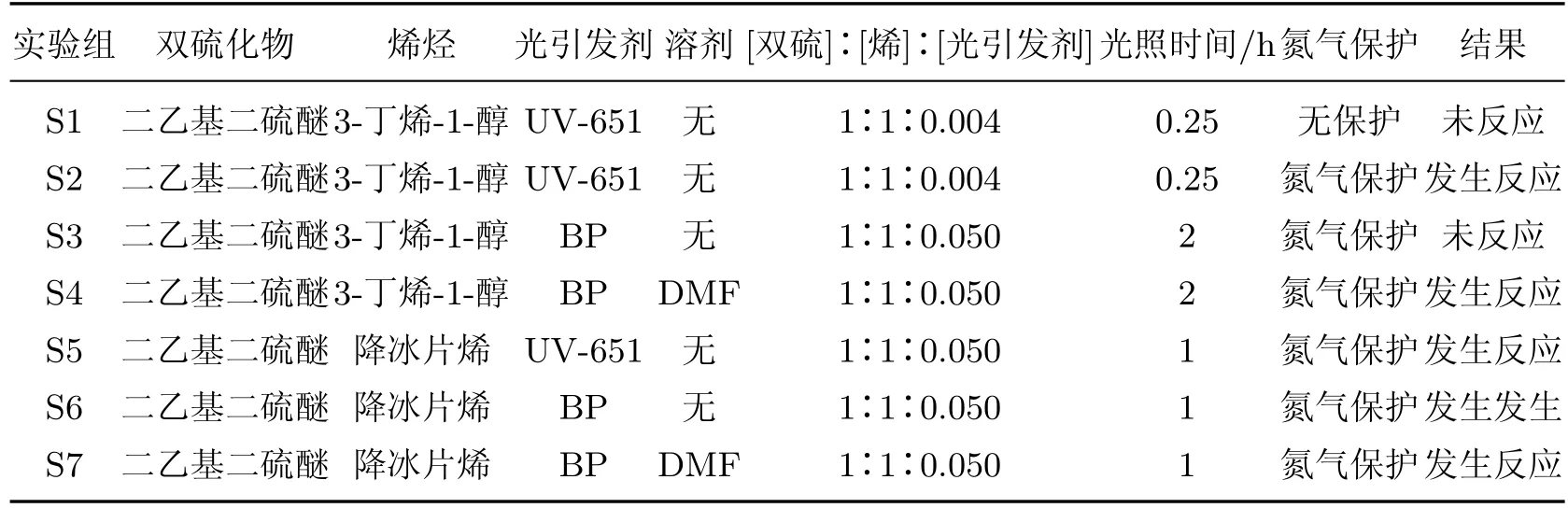
表1 双硫-烯光照实验总结Table 1 Summary of disulf i de-ene reactions
为了进一步证明双硫键断裂后所形成的巯基自由基加到了双键两端并得到目标产物,选取S5,S6进行GC-MS测试.S5,S6是二乙基二硫醚与降冰片烯之间的反应(见图6),光引发剂分别为安息香双甲醚和二苯甲酮,预计目标产物(图6中的物质9)的相对分子质量约为216.GC-MS测试结果如图7所示,图中TIC指的是总离子流图(total ion chromatogram).由图可见,12.587和13.370 min出现的峰为目标产物峰,相对分子质量都是216,进一步证明了双硫-烯反应的可行性,并且可以证明两种不同类型的光引发剂都可以引发反应的进行并得到目标产物.GC-MS测试中其他时间出现的峰是反应物和引发剂的峰.在两个不同时间出现目标产物的峰,原因可能是发生了同分异构现象,即目标产物(物质9)产生了结构上的同分异构体.
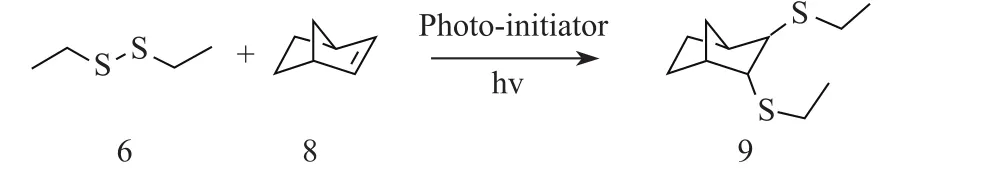
图6 二乙基二硫醚与降冰片烯的反应方程式Fig.6 Experiment reaction equation of diethyl disulf i de and norbornene
2.2 双硫-烯反应动力学过程
为探究二乙基二硫醚与降冰片烯转化率随时间的变化,本工作选取S7作为研究对象,研究双硫-烯光照反应的动力学过程.分别在实验组S7反应0,10,20,30,40,50,60 min时取样测试的1H NMR光谱,得到转化率随时间变化的关系(见图8).图8中[二乙基二硫醚]∶[降冰片烯]∶[光引发剂]=1∶1∶0.050,V(反应物)∶V(DMF)=1∶1. 可以看出,在反应的开始阶段转化率变化不大,这是因为反应开始是引发阶段,之后是线性增加阶段,随着光照时间的增加,转换率越来越高,所以增加光照时间可以提高转化率.当反应转化率达到一定值时,转化率变化变慢,因为自由基浓度降使转化率下降.
2.3 双硫-烯反应的影响因素
研究氧气对反应的影响时,将表1中的实验组S1与S2对比,无氮气保护的S1没有发生反应,在氮气保护下S2反应可以发生,说明在双硫-烯反应过程中需要氮气保护.原因可能是在光照下,光引发剂形成自由基空气中的氧气作用,失去了引发作用.
研究光引发剂类型对反应的影响时,得到裂解型光引发剂和夺氢型光引发剂都可以引发反应发生的结论.将表1中的实验组S2与S3对比,S3中所使用的光引发剂是S2的12.5倍,且S3光照时间更久,但是反应依旧未发生.两次实验使用的光引发剂不同,S2使用的是裂解型光引发剂安息香双甲醚(UV-651),S3使用的是夺氢型光引发剂二苯甲酮(BP),因此可得:虽然裂解型光引发剂和夺氢型光引发剂都可以引发反应,但是不同类型的光引发剂对双硫-烯反应会产生一定影响.当其他条件一致时,裂解型光引发剂的光引发效果优于夺氢型光引发剂.

图7 S5和S6反应后进行GC-MS测试结果Fig.7 GC-MS results of S5 and S6 reactions
烯烃的活性对硫醇-烯反应的影响很大,为了证明烯烃对双硫-烯反应也会产生一定的影响,进行了实验S3和S6.表1中的实验组S3和S6使用相同的引发剂,而且反应物以及光引发剂的使用量均相同,唯一的不同是使用了不同活性的烯烃,S3反应物中烯烃是3-丁烯-1-醇,S6中是降冰片烯.S6光照1 h就发生反应,S3光照2 h仍没有发生反应,原因是降冰片烯的反应活性强于3-丁烯-1-醇,所以反应物的活性对双硫-烯反应也会产生影响,反应物活性越强,反应越容易发生.

图8 双硫-烯光照反应动力学过程Fig.8 Kinetics of photo-ininitated reaction between disulf i de and enes
将S3与S4对比,S4中加入DMF后,反应实现,而S3未反应.将S6和S7对比,如图5(c),(d)所示,S6尚有反应物降冰片烯特征峰的剩余(见图5(c)中的d,d’),而S7完全反应,明显可见DMF的加入可以加快反应的进行,使反应更容易发生,说明加入一定量极性溶剂有利于双硫-烯反应的发生.
3 结束语
本实验已经证明了双硫-烯反应可以在紫外光照射和无氧条件下,由光引发剂引发反应发生.研究发现:反应物活性越强,越有利于反应的发生;裂解型光引发剂相较于夺氢型光引发剂,更有利于反应的发生;一定量极性溶剂的存在会促进反应的发生.但是本阶段研究中双硫-烯反应的转化率不高,不能达到100%,并且反应物的类型较为单一.接下来的研究将通过改变反应的影响因素来提高反应的转化率和产率,增加反应物种类,并发展双硫化物与炔烃等其他不饱和烃的反应,以及扩展双硫-烯点击化学在高分子化学领域中的应用.
致谢 感谢邓红梅老师对本工作的大力支持!
参考文献:
[1]KOLB H C,FINN M G,SHARPLESS K B.Click chemistry:diverse chemical function from a few good reactions[J].Angewandte Chemie International Edition,2001,40:2004-2021.
[2]张涛,郑朝晖,成煦,等.材料科学中的点击化学[J].化学进展,2008,20(7/8):1091-1101.
[3]YU B,JUSTIN W C,CHARLES E H, et al.Sequential thiol-ene/thiol-ene and thiolene/thiol-yne reactions as a route to well-def i ned mono and bis end-functionalized poly(N-isopropylacrylamide)[J].Journal of Polymer Science.Part A:Polymer Chemistry,2009,47:3544-3557.
[4]POUNDER R J,STANFORD M J,BROOKS P,et al.Metal free thiol-maleimide“Click” reaction as a mild functionalization strategy for degradable polymers[J].Chemical Communications,2008,41:5158-5160.
[5]LUTZ J F,B¨ORNER H G,WEICHENHAN K.Combining ATRP and“Click”chemistry:a promising platform toward functional biocompatible polymers and polymer bioconjugates[J].Macromolecules,2006,39:6376-6383.
[6]HARVISON M A,LOWE A B.Nucleophile-initiated thiol-michael reactions:eあect of organocatalyst,thiol,and ene[J].Macromolecules Rapid Communications,2011,32:779-800.
[7]ALESSANDRO D.The emergence of thiol-ene coupling as a click process for materials and bioorganic chemistry[J].Angewandte Chemie International Edition,2008,47:2-5.
[8]KILLOPS K L,CAMPOS L M,HAWKER C J.Robust,eきcient,and orthogonal synthesis of dendrimers via thiol-ene“Click” chemistry[J].Journal of the American Chemical Society,2008,130:5062-5064.
[9]ALTINTAS O,HIZAL G,TUNCA U.ABC-type hetero-arm star terpolymers through “Click”chemistry[J].Journal of Polymer Science.Part A:Polymer Chemistry,2006,44:5699-5707.
[10]OTSUKA H,NAGANO S,KOBASHI Y,et al.A dynamic covalent polymer driven by disulf i de metathesis under photoirradiation[J].Chemical Communications,2010,46:1150-1152.
[11]CHAN J W,HOYLE C E,LOWE A B,et al.Nucleophile-initiated thiol-michael reactions:eあect of organocatalyst,thiol,and ene[J].Macromolecules,2010,43:6381-6388.
[12]LALEV´EE J,FABRICE M S,MOHAMAD E R,et al.Thiyl radical generation in thiol or disulf i de containing photosensitive systems[J].Macromolecular Chemistry and Physics,2010,211(1):103-110.
[13]HOYLE C E,LEE T Y,ROPER T.Thiol-enes:chemistry of the past with promise for the future[J].Journal of Polymer Science.Part A:Polymer Chemistry,2004,42:5301-5338.
[14]HOYLE C E,BOWMAN C N.Thiol-ene click chemistry[J].Angewandte Chemie International Edition,2010,49:1540-1573.
[15]CAMPOS L M,MEINEL I,GUINO R G,et al.Highly versatile and robust materials for soft imprint lithography based on thiol-ene click chemistry[J].Advanced Materials,2008,20:1-6.
[16]UYGUN M,TASDELEN M A,YAGCI Y.Inf l uence of type of initiation on thiol-ene “Click”chemistry[J].Macromolecular Chemistry and Physics,2010,211(1):103-110.
