间质瘤的MRI征象及免疫组化与其危险度相关性分析*
2018-04-18阎岚闫康鹏
阎岚,闫康鹏
(江西省肿瘤医院放射科,南昌 330029)
间质瘤是一种具有恶性潜能的非定向分化的间叶源性肿瘤,按发生部位分为胃肠道间质瘤(gastrointestinal stromal tumor,GIST)和胃肠道外的间质瘤(extra-gastrointestinal stromal tumor,EGIST)两类。随着病程的延长,肿瘤会逐渐表现出恶性生物学行为,但目前仍然没有可靠的金标准来全方面分析及准确评估间质瘤的生物学侵袭度,大部分学者认为间质瘤的恶性风险度与肿瘤大小以及核分裂象有关,多采用2008年美国国立卫生署(NHI)危险度分级标准[1],危险度分级越高、预后越差。本研究回顾性分析56例间质瘤的临床表现、MRI征象、病理学特点及免疫标记物指标,旨在探讨间质瘤的MRI表现对其生物学危险度的评估价值,分析免疫组化中P53、ki67表达与间质瘤生物学行为的相关性,为影像学医师的诊断提供依据,已期在治疗前初步了解间质瘤的恶性风险度,为临床医生制定合理手术提供参考,同时有效的指导术后化疗和靶向治疗、分析预后。
1 材料与方法
1.1研究对象回归性分析2015年1月至2017年5月江西省肿瘤医院经手术及病理证实的间质瘤患者,共56例纳入本研究。男31例,女25例,年龄25-82岁,平均年龄(56.8±1.79)岁。临床症状:腹部不适和(或)腹痛、腹胀32例,腹部包块11例,消化道出血2例,大便性状改变4例,健康体检发现7例。
1.2扫描方案所以研究对象均在GE 1.5T磁共振扫描仪上进行腹部平扫及增强检查,检查前禁食8h,取仰卧位,训练呼吸。扫描序列包括T1WI序列、T2WI脂肪抑制序列、DWI序列(扩散加权成像)以及多期动态增强扫描序列。增强扫描时注入对比剂钆喷替酸葡甲胺(Gd-DTPA),剂量为15ml,速率为 2.5ml/s, 分别在 25s、60s、90s时行动脉期、静脉期和延迟期扫描。
1.3影像学分析应用图像后处理软件对采集到的MRI图像进行分析,包括肿瘤部位、大小、形态、信号特点(是否有囊变坏死)、边界(周围脂肪间隙是否清晰)、强化方式、瘤内或瘤周的粗大血管,等内容。后处理工作站自动生成的DWI图,选取病变范围最大层面,测量实性部分ADC值,尽量避开囊变坏死区、钙化灶、出血以及容积效应。比较低危、中危、高危间质瘤各组间病灶的ADC值。
1.4免疫组化及病理学分析免疫组织化学染色:用罗氏公司试剂盒,二步法染色,每例均行ki67、P53抗体标记肿瘤组织。染色标记定位ki67、P53在瘤细胞核上,当相应抗体染色显现出棕色时为阳性,其中ki67计算阳性百分比。将ki67染色结果按增值指数(阳性细胞数)<1%,1%-5%,>5%划分为3组,将P53染色结果阳性和阴性划分为2组。病理诊断标准:采用2008年美国国立卫生研究院(NIH)发布的新标准[1],如表1所示。
1.5统计学分析应用SPSS 19.0统计软件进行数据分析,对不同危险度肿瘤的平均ADC值采用方差分析,其他MRI征象及免疫组化指标P53、ki67与各危险度组之间的相关性分析采用Fisher精确概率法。P<0.05可以认为差异有统计学意义。
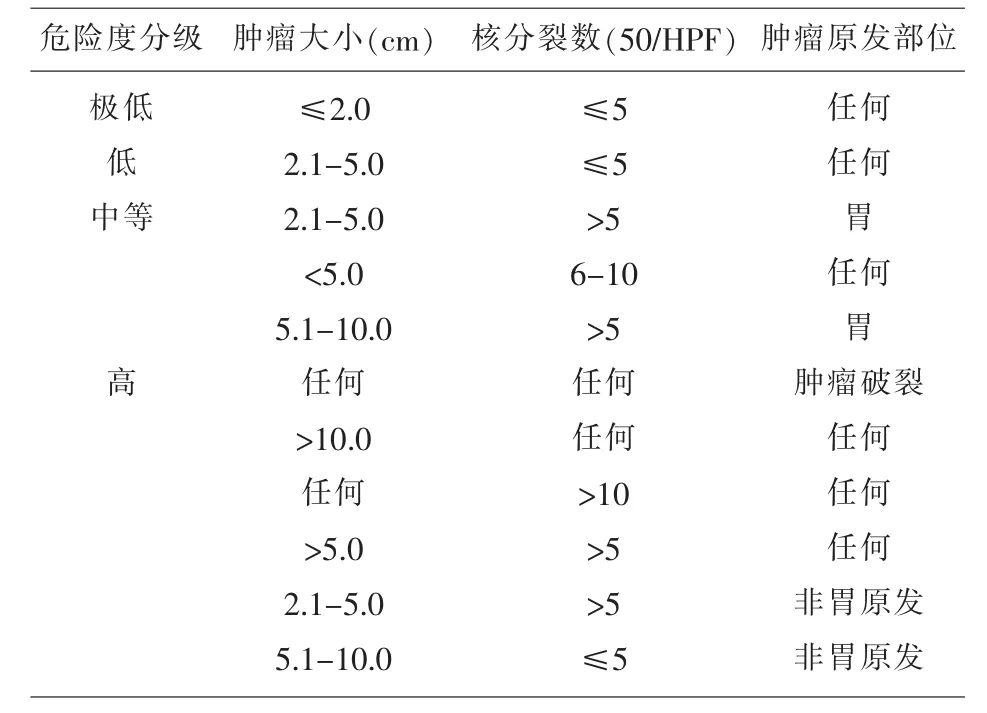
表1 间质瘤危险度分级
2 结果
2.1手术及病理结果56例患者中,胃间质瘤29例,占52%,小肠间质瘤18例,占32%,直肠间质瘤4例,占7%,胃肠外间质瘤5例(其中1例位于腹膜后,4例位于腹盆腔系膜),占9%。病理分级低危险组7例,占13%,中危险组13例,占23%,高危险组36例,占64%。
2.2MRI影像征象及其与病变危险度的关系56例间质瘤患者中,病灶直径1.6-23.5cm不等,在MRI上表现为稍长T1稍长T2信号,低危组病变大多直径<5cm,形态规则,边界清楚,信号大部分较均匀,强化程度以轻度强化为主,少许低危患者肿块也可呈明显强化。中高危组直径多>5cm,肿块>10cm的病灶中95%是高危患者,高危组形态多不规则,边界多不清楚,信号多数不均匀,强化程度以中度及明显强化为主,仅1例表现为轻度强化。
采用Fisher精确概率法分析MRI形态特征与间质瘤危险度之间的相关性(表2),发现不同部位的肿瘤危险度无统计学差异,P>0.05;而直径、形态、边界清晰度、信号是否均匀及强化程度、瘤内外是否有粗大血管等指标在不同危险度肿瘤中存在统计学差异,P<0.05。直径越大,肿瘤高危险度的概率越高;形态不规则的肿瘤危险性越高;边界不清的肿瘤危险程度更高;信号不均匀的肿瘤,危险程度越高;瘤周及/或瘤内有增粗供血血管的肿瘤危险度越高。
2.3ADC值与病变危险度的关系采用方差分析比较3组危险患者间ADC值有统计学差异 (表3),再进行两两比较发现低危组与高危险度组ADC值有统计学差异(P<0.05);低危险度组与中危险度组相比ADC值无统计学差异 (P>0.05);中危险度组与高危险度组相比,ADC取值无统计学差异(P>0.05)。

表2 不同危险度间质瘤的MRI形态学特征比较[n(%)]
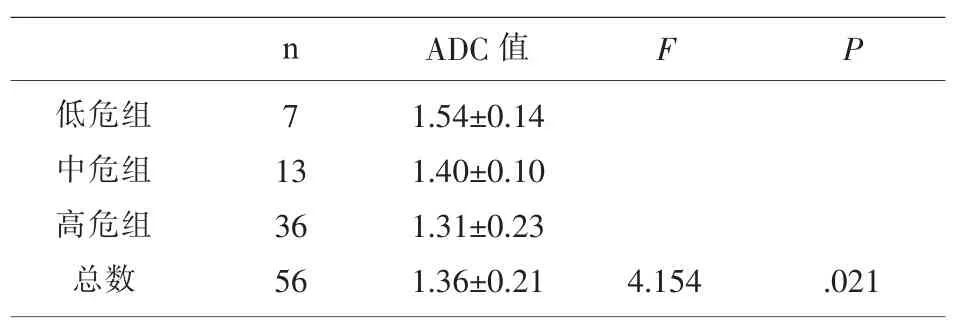
表3 不同危险度间质瘤的ADC值比较
2.4免疫组化中P53及KI67表达与病变危险度的关系免疫组化中KI67表达在不同危险度间质瘤中差异无统计学意义(P>0.05);免疫组化中P53表达在不同危险度间质瘤中差异有统计学意义(P<0.05),危险度越高,P53阳性概率越高。(表4)
3 讨论
间质瘤是来源于胃肠道原始间叶组织、网膜及肠系膜间质组织的一种非定向分化的肿瘤,好发于50岁以上的中老年人群,均存在潜在恶性,主要发生在胃(60%-70%)及小肠(20%左右),发生在直肠部分的较为罕见(<5%)[2,3],胃肠外间质瘤一般发生于肠系膜、大网膜或腹膜后,占腹部软组织肿瘤的4%-7%[4]。本研究56例间质瘤患者中,发生于胃的29例,占52%,位于小肠18例,占32%,位于直肠4例,占7%,胃肠外5例(其中1例位于腹膜后,4例位于腹盆腔系膜),占9%,结肠未发现;并且经统计分析表明发生于不同部分的间质瘤危险度无显著差异。

表4 不同危险度肿瘤ki67及p53表达比较[n(%)]
Caterino等[5]研究发现间质瘤危险度等级越高,患者发生转移的比例越高,复发率、死亡率也越高。术前间质瘤危险度的准确判断对临床治疗及预后有重要意义,目前检查手段主要依赖于CT及MRI成像技术。关于间质瘤的MRI报道较少,间质瘤MRI征象与生物危险度相关性尚未达成共识。本研究显示肿瘤危险度与肿瘤最大径、形态、边界、信号、强化程度以及瘤周或瘤内血管样强化影之间差异有统计学意义。Miettinen[6]认为,间质瘤直径越大,其恶性可能性越大,这与间质瘤生长过程中c-kit和血小板源性生长因子受体(PDGFRA)基因突变增加有关;肿瘤的形态不规则、瘤内或瘤周的血管样强化,可能与肿瘤恶性程度高、肿瘤血管增多、细胞生长活跃有关。本组56例间质瘤患者中在中高危组直径>5cm的肿瘤比例明显增多,统计结果显示肿瘤直径越大、形态越不规则、瘤内或瘤周出现增粗血管影,提示恶性可能性越高,这与文献报道相符。肿瘤的生长依赖于其内部的供血血管,当肿瘤生长过快时,新生血管对其供血不足,容易导致肿瘤内部囊变,使肿瘤在T1WI及T2WI呈不均匀信号,本研究56例间质瘤患者,其中信号不均匀者低危组占4.44%,中危组占20%,高危组占75.56%,随着肿瘤危险度的增高,信号更趋向不均匀。Tateishi等[7]研究认为胃肠道间质瘤呈腔外、生长边界不清楚,是评估肿瘤的恶性风险度最有意义的指标。本研究显示相对于边界清楚的肿瘤,边界不清的肿瘤危险程度更高。关于间质瘤强化特征与肿瘤危险度的相关性,国内外报道不一;Chourmouzi等认为[8]间质瘤为富血供肿瘤,大多数病灶表现为不均匀渐进性强化,但强化方式与恶性风险度没有明显的相关性;高桂花等[9]对胃肠道间质瘤采取MRI动态强化方式,通过统计分析得出肿瘤危险分级与强化方式不具有统计学意义;林黛英等[10]通过胃肠道间质瘤CT强化方式进行统计分析并与病理分级做对比,他们认为肿瘤的强化方式与肿瘤的危险程度有统计学意义。本研究显示,肿瘤强化程度不同危险度间质瘤间差异有统计学意义,明显强化在高危组所占比例高于低危组,可能与低危组病例数较少、强化程度分组方式较为主观,等因素有关。今后可以通过MRI后处理软件获得病变时间-信号强度曲线类型 (渐增型、延迟期流出型),更加客观的分析肿瘤的强化特征与危险度分级的相关性,从而为临床术前诊断提供帮助,这有待于进一步研究。
MRI扩散加权成像(DWl)技术利用组织内水分子的布朗运动进行成像,通过细胞外水分子运动和血流灌注的不同引起宏观扩散状态的改变,提供了DWI图、(扩散系数)ADC图和定量ADC值,可以无创获得组织内部微观信息,为病变诊断提供更多的影像学信息。近年来有一些学者在肿瘤风险度的诊断评估中应用了DWI技术,Yamamura等认为[11]随着肿瘤恶性程度的增高,其繁殖能力增强、生长速度加快,肿瘤内部细胞间距缩小、密度增高,这些因素共同作用,限制了水分子的扩散,从而导致肿瘤在DWI上表现为高信号,ADC值较低。Matsui研究[12]指出十二指肠高危险度间质瘤病灶,在DWI图像上表现为明显高信号肿块,测量其ADC值显示,恶性度越高ADC值越低。本组资料显示56例间质瘤在DWI上均呈高信号,ADC值在低危组与高危险度组间有统计学差异,低危组平均ADC值1.54±0.14,高于高危组平均ADC值1.31±0.23,ADC值越低提示肿瘤恶性程度较高,这与文献报道基本相符。
术后间质瘤危险度分级的定性诊断对于临床患者术后是否进一步放化疗、靶向治疗,以及治疗方案的选择起关键的指导作用。目前术后定性诊断的金标准是组织病理结果及免疫组化[13],随着组织病理学、免疫组织化学及基因检测的不断提高,间质瘤风险分级方案不断修改,很多研究人员试图借助分子生物学指标来进一步完善间质瘤危险度评估。本组资料主要针对Ki-67及P53两种免疫组化标记物指标进行统计分析,其中Ki-67指数是肿瘤细胞增殖标记物,其阳性表达标志这肿瘤细胞进入增殖期[14],大部分学者认为该指标能够提示预后。P53基因是生物体内一种抑制细胞转变为癌细胞的基因,与肿瘤的发生发展联系紧密,大约50%的人类肿瘤都中存在P53突变。P53基因有野生型和突变型,免疫组合检测突变型,该型失去了野生型P53的抑癌基因功能,获得一系列类似癌基因的特性,如抑制癌细胞调亡、促进癌细胞增殖等[13]。目前,P53基因及其产物P53蛋白已经成为肿瘤生物学行为判断的重要手段。有学者认为[16,17]胃肠道间质瘤的发生和发展可能与P53基因突变有重要关系,可以作为良恶性的辅助诊断。本研究结果显示Ki-67增值指数在低、中、高危险度间质瘤中无统计学差异意义;而P53阳性表达在不同危险度间质瘤中有统计学差异(P<0.05),危险度越高,P53阳性概率越高,提示P53阳性表达可能是判断危险度和预测预后的有效指标。
综上所述,间质瘤的MRI表现具有一定的特征,高危间质瘤肿块多>5cm、形态多不规则、信号多不均匀、边界不清楚易侵犯周围结构、瘤内外易粗大血管、强化明显、ADC值相对较低;低危间质瘤肿块多<5cm、形态规则、信号较均匀、边界清楚、强化相对较弱、ADC值相对较高。通过对间质瘤病灶的一系列影像学征象的分析可以对其危险度分级做出初步判断,这有助于术前评估肿瘤的恶性程度,指导手术方案的制定。术后标本免疫组化检测中P53的表达对肿瘤危险度的进一步准确评价有重要价值,有助于临床医生制定术后化疗或靶向治疗的方案,为患者预后的分析提供了重要的依据。
[1]Joensuu H.Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J].Hum Pathol,2008,39(10):1411-1419.
[2]Valsangkar N,Sehdev A,Misra S,et al.Current management of gastrointestinalstromaltumors:surgery,currentbiomarkers,mutations,and therapy[J].Surgery,2015,158(5):1149-1164.
[3]何蓉,陈建萍,李艳.胃肠道间质瘤42例临床病理分析[J].江西医药,2014,49(2):177-185.
[4]封俊,高德培,谭静,等.胃肠道内外间质瘤影像表现与病理危险级别相关分析[J].现代肿瘤医学,2015,23(14):2019-2023.
[5]CaterinoS,LorenzonL,PetruecianiN,etal.Gastrointestinal stromal tumors:correlation between symptoms at presentation,tumor location and prognostic factors in 47 consecutive patients[J].World J Sug Oncol,2011,9(10):13.
[6]Miettinen M,Sobin LH,Lasota J.Gastrointestinal stromal tumors of thestomach:aclinicopathologic,immunohistochemical,and molecular genetic study of 1765 cases with long-term follow.up.Am J Surg Pathol,2005,29(1):52-68.
[7]Tateishi U,Hasegawa T,Satake M,et al.Gastron intestinalstromal tumors.Correlation of computed tomography findings with tumor grade and mortality[J].J Comput Assist Tomogr,2003,27(5):792-798.
[8]Chourmouzi D,Sinakos E,PaPalavrentios L,et al.Gastrointestinal stromal tumors:a pictorial review[J].J Gastrointestin Livel Dis,2009,18(3):379-383.
[9]高桂花,夏梦莹,王淑艳,等.胃肠道间质瘤危险度分级的磁共振表现与病理对照分析[J].医学影像学杂志,2017,27(3):492-496.
[10]林黛英,吴先衡,汪丹凤,等.胃肠道间质瘤CT表现与肿瘤危险程度的相关性评价 [J].医学影像学杂志,2014,24(8):1342-1345.
[11]Yamamura J,Salomon G,Buchert R,et al.Magnetic resonance imagingofprostatecancer:diffusion-weightedimagingin comparison with sextant biopsy[J].J Comput Assist Tomogr,2011,35(2):223-228.
[12]Matsui T,Mitsui H,Sekigawa K,et al.A case of aduodenal gastrointestinal stromal tumor diagnosed with the aid of diffusionweighted magnetic resonance imaging[J].Clin J Gastroenterol,2009,2(10):384-387.
[13]杜舜颖,施旻,曹丽华.胃肠道间质瘤的临床病理及免疫组化观察(附 28 例报告)[J].江西医药,2006,41(8):600-601.
[14]Booth DG,Takagi M,Sanchez-Pulido L,et al.Ki-67 is a PP1-interacting protein that organises the mitotic chromosome periphery[J].Elife,2014,3:e01641.
[15]Ryu MH,Kang YK,Jang SJ,et al.Prognostic significance of p53 genemutationsandproteinoverexpressioninlocalized gastrointestinal stromal tumors[J].Histopathology,2007,51(3):379-389.
[16]邹静.胃肠道间质瘤危险度与MSCT表现、免疫组化相关性研究[D].大连医科大学,2014.
[17]Zong L,Chen P,Jiang J,et al.Predictive value of p53 expression in the risk of malignant gastrointestinal stromal tumors:evidence from 19 studies[J].Exp The Med,2012,3(1):87-92.
