植物蛋白质饲料中添加巨大芽孢杆菌对杂交鲟幼鱼组织抗氧化能力和血清生化指标的影响
2018-04-17王金革王连生王常安李晋南赵志刚李伟忠徐奇友
王金革, 王连生, 王常安, 李晋南, 赵志刚, 罗 亮, 都 雪, 李伟忠, 徐奇友
(1. 中国水产科学研究院 黑龙江水产研究所, 哈尔滨 150070; 2. 上海海洋大 学水产与生命学院, 上海 201306; 3. 潍坊学院, 潍坊 261061)
芽孢杆菌(Bacillus)是活菌制剂,不利环境条件下可以孢子形式存在,具有耐高温、耐挤压和耐温度变化等特点,可经受配合饲料的制作条件,非常适合应用于饲料的工业化生产,而且其代谢产物中含有许多消化酶类和多种抑菌活性物质,使其逐渐成为营养学和免疫学等学科的研究热点。沈文英等[1]对草鱼(Ctenopharyngodonidellus),Nayak等[2]对南亚黑鲮(Labeorohita),刘克琳等[3]对鲤鱼(Cyprinuscarpio)及胡毅等[4]对凡纳滨对虾的研究,Gatesoupe等[5]对大菱鲆(Scophthatmusmaximus)的研究及高欣等[6]、刘晓勇等[7]对鲟鱼的研究表明,将芽孢杆菌添加到饲料中既能改善水产动物蛋白质利用率,还能增强机体免疫功能和抗氧化能力。20世纪中期,我国就有学者开始研究巨大芽孢杆菌的应用,但以前的研究主要集中在菌株的筛选及氮的代谢能力等方面[8-9],随着对巨大芽孢杆菌更深入地了解,逐渐把其作为益生菌应用到了水产养殖水体中调节水质[10-11],但把其作为饲料添加剂的研究较少。前人研究表明,高植物蛋白质的饲料会影响水产动物的抗氧化能力和生长性能[12],而在饲料中添加适量芽孢杆菌可以提高养殖动物的抗氧化能力并促进其健康生长[13]。因此本试验拟通过在植物蛋白质饲料基础上添加不同水平的巨大芽孢杆菌,研究其对杂交鲟幼鱼组织抗氧化能力和血清生化指标的影响,并与鱼粉蛋白源饲料组比较,为巨大芽孢杆菌在鲟鱼植物蛋白源饲料养殖中的应用提供科学依据。
1 材料与方法
1.1 试验材料
巨大芽孢杆菌制剂:由本实验室从水产养殖底泥中分离获得的巨大芽孢杆菌菌株,经30℃、180 r/min振荡培养后的菌液。使用前采用平板计数法获得制剂中巨大芽孢杆菌数目。
1.2 试验设计及饲料
挑选体格健壮、规格整齐的杂交鲟幼鱼(购自中国水产科学研究院鲟鱼繁育技术工程中心)1500尾,暂养并驯化2周,暂养期间饲喂植物蛋白质饲料,2周后选用初体质量为(12.87 ± 0.65)g的杂交鲟幼鱼625尾,随机分成5组,每组设5个平行,试验周期为56 d。以褐鱼粉、豆粕、豆油和鱼油等为主要原料配制鱼粉蛋白源饲料(FM组),以大豆浓缩蛋白、豆粕、豆油和鱼油等为主要原料配制植物蛋白质饲料(PM组),其配方的原料组成见表1;在植物蛋白质饲料的基础上,分别加入105(Ⅰ组)、106(Ⅱ组)、107cfu/g(Ⅲ组)巨大芽孢杆菌配制5种试验用饲料。先将饲料原料粉碎过40目筛,按配方比例称重后用混合机混合均匀,然后加入混合好的油脂再与原料充分混合,最后再与水或巨大芽孢杆菌与水的混合物充分混匀,用制粒机做成粒径大小适宜的饲料,室温风干,装袋后保存于-20℃冰箱中。
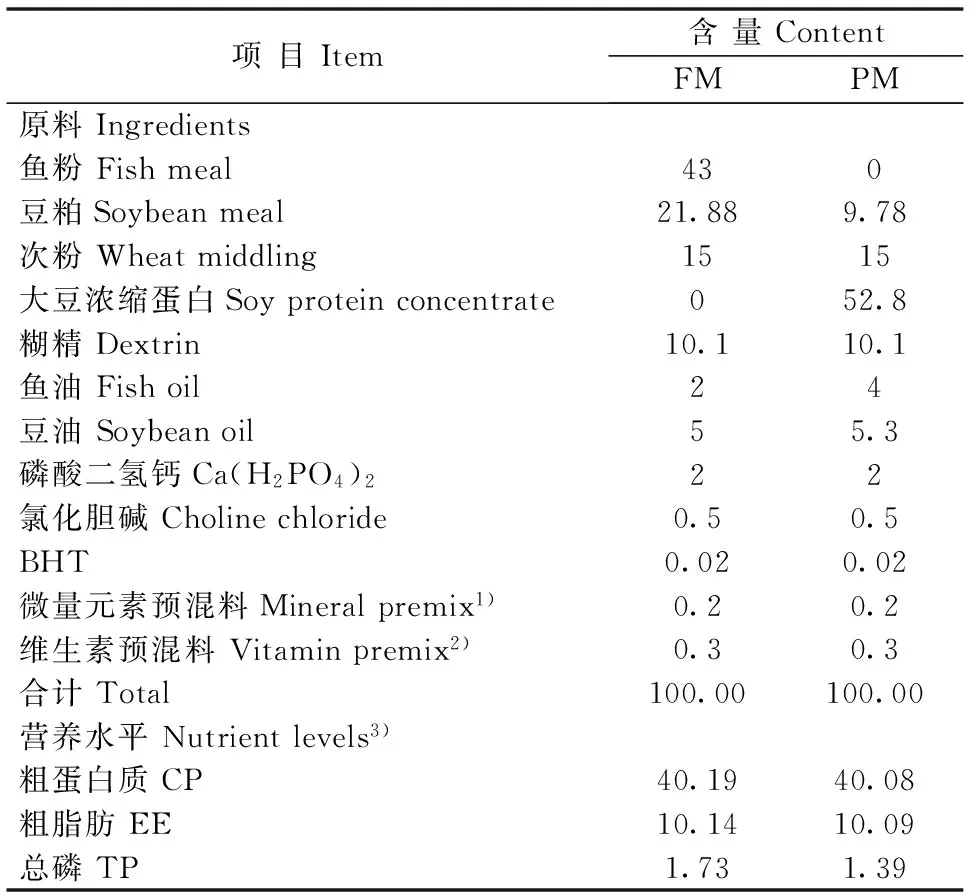
表1 基础饲料组成及营养水平(干物质基础)
注:1)微量元素预混料为每千克饲料提供Fe 25 mg,Zn 25 mg,Mn 15 mg,Cu 3 mg,I 0.6 mg,Se 0.4 mg,Co 0.1 mg;2)维生素预混料为每千克饲料提供:VD33 000 IU,VA 8 000 IU,VC 500 mg,VB230 mg,VE 60 mg,VK35 mg,VB615 mg,VB120.5 mg,烟酸nicotinic acid 175 mg,泛酸 pantothenic acid 50 mg,叶酸 folic acid 5 mg,D-生物素 D-biotin 2.5 mg; 3) 粗蛋白质、粗脂肪和总磷为实测值
1.3 饲养管理
在25只容积为160 L可控温循环式水族箱内进行饲养试验,水温控制为(21±0.5)℃,试验期间每天7:00、12:00、17:00饱食投喂,及时吸取残饵和粪便,每周换去水族箱内2/3水并注入已曝气的水,每隔2天检测水质,溶氧大于5 mg/L,pH 7.9~8.3,氨氮浓度不高于0.05 mg/L。自然光照,记录每天杂交鲟幼鱼摄食和死亡情况。
1.4 样品采集和指标测定
1.4.1样品采集
将试验鱼饥饿24 h后采样,每缸随机取出3尾鱼用丁香油麻醉完全后,在尾静脉处采血,分离血清(3500 r/min,15 min),分离后将血清样品保存于-80℃冰箱中。将采血后的鱼置于冰盘上解剖,分别取出肝脏和幽门盲囊与预冷过的0.86%氯化钠溶液按1∶9的比例(质量体积比)稀释,匀浆,然后按不同检测指标所需条件及试剂盒要求的速度和时间进行离心,离心后取组织上清液样品保存在-20℃冰箱中待测。
1.4.2指标测定
血清、肝脏和幽门盲囊中还原型谷胱甘肽(GSH)和丙二醛(MDA)含量、黄嘌呤氧化酶(XOD)、抗超氧阴离子自由基(ASAFR)、总抗氧化能力(T-AOC)和超氧化物歧化酶(SOD)活性均采用南京建成生物工程研究所的试剂盒测定;葡萄糖(Glu)、血磷(P)、总蛋白(TB)、白蛋白(ALB)、球蛋白(GLB)、尿素氮(BUN)、尿酸(UA)含量、谷丙转氨酶(ALT)及谷草转氨酶(AST)活性等血清生化指标采用全自动生化分析仪(贝克曼ProCX4,德国)测定。
1.5 统计分析
试验数据采用平均值±标准差表示,采用SPSS19.0软件中的单因素方差分析(one-way ANOVA)对数据进行方差分析,并用Duncan氏法对数据进行显著性检验,差异显著性水平设为P<0.05。
2 结果
2.1 巨大芽孢杆菌对杂交鲟幼鱼血清蛋白代谢指标的影响
巨大芽孢杆菌对杂交鲟幼鱼血清蛋白代谢指标的影响见表2。结果表明:各试验组TP和GLB含量显著高于PM组(P<0.05),试验Ⅰ组UA含量显著低于PM组(P<0.05),且与FM组相比差异均不显著(P>0.05);各试验组BUN含量显著低于PM组和FM组(P<0.05)。
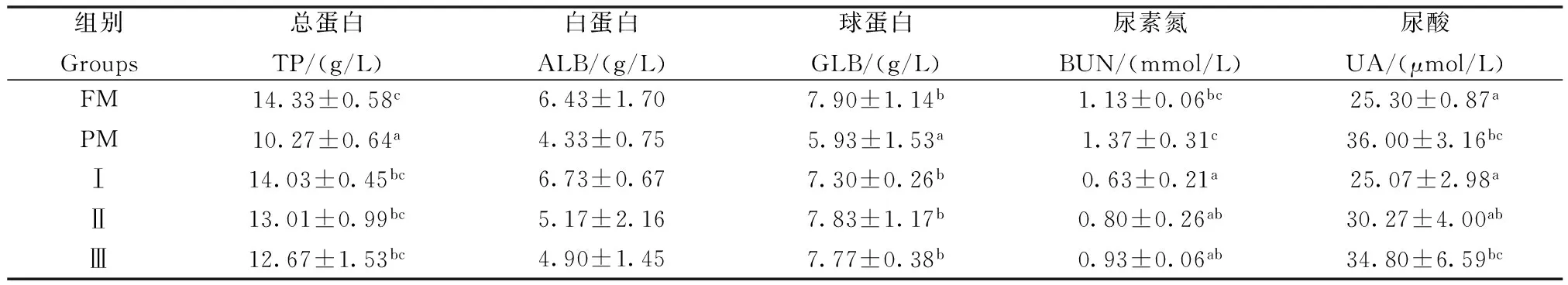
表2 巨大芽孢杆菌对杂交鲟幼鱼血清蛋白代谢指标的影响
同列中标有不同小写字母者表示组间有显著性差异(P<0.05);标有相同或没有小写字母者表示组间无显著性差异(P>0.05),下同
2.2 巨大芽孢杆菌对杂交鲟幼鱼血磷、血糖和转氨酶指标的影响
巨大芽孢杆菌对杂交鲟幼鱼血磷、血糖和转氨酶指标的影响见表3。结果表明:试验Ⅱ组血糖含量和ALT活性显著低于PM组(P<0.05),试验Ⅰ组和Ⅱ组AST活性显著低于PM组(P<0.05),且与FM组相比差异均不显著(P>0.05);各试验组血磷含量与PM组无显著差异性(P>0.05),但有升高趋势。
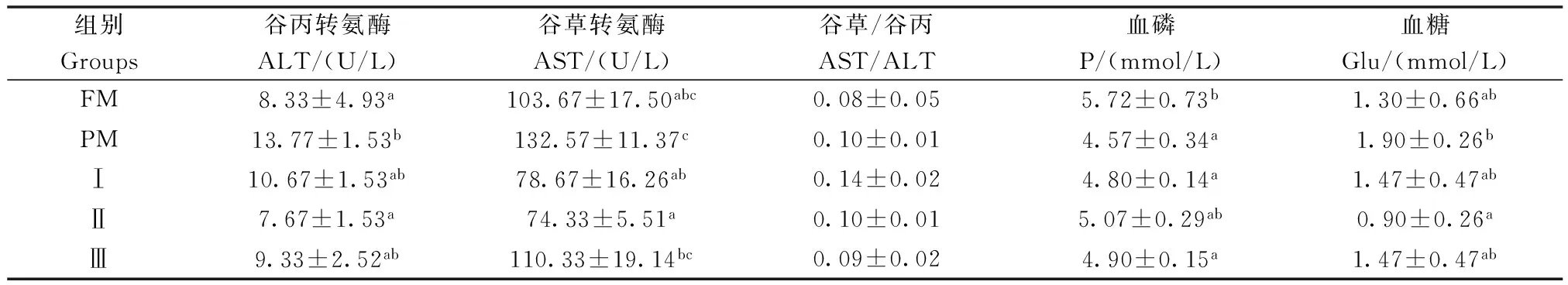
表3 巨大芽孢杆菌对杂交鲟幼鱼血磷、血糖和转氨酶指标的影响
2.3 巨大芽孢杆菌对杂交鲟幼鱼血清抗氧化指标的影响
巨大芽孢杆菌对杂交鲟幼鱼血清抗氧化指标的影响见表4,结果表明:试验Ⅰ组、Ⅱ组血清GSH含量和ASAFR活性显著高于PM组(P<0.05),试验Ⅱ组和Ⅲ组血清XOD活性显著低于PM组(P<0.05),且与FM组相比差异均不显著(P>0.05)。
2.4 巨大芽孢杆菌对杂交鲟幼鱼肝脏抗氧化指标的影响
巨大芽孢杆菌对杂交鲟幼鱼肝脏抗氧化指标的影响见表5。结果表明:试验Ⅰ组肝脏GSH含量和ASAFR活性显著高于PM组(P<0.05),试验Ⅱ组和Ⅲ组肝脏XOD活性显著低于PM组(P<0.05),且与FM组相比差异均不显著(P>0.05)。
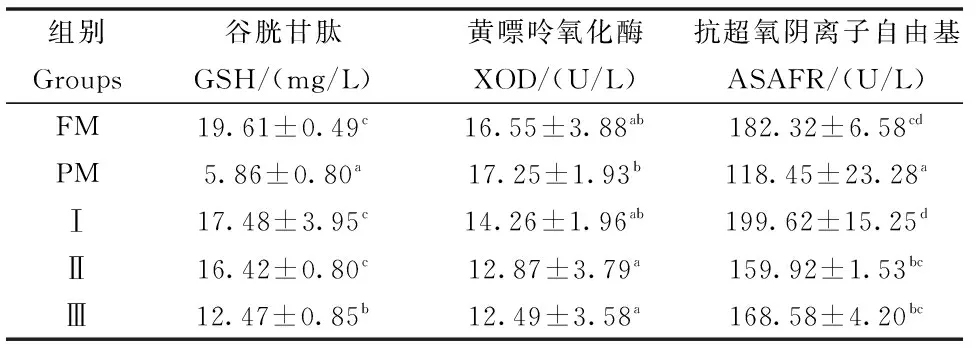
表4 巨大芽孢杆菌对杂交鲟幼鱼血清抗氧化指标的影响
2.5 巨大芽孢杆菌对杂交鲟幼鱼幽门盲囊抗氧化指标的影响
巨大芽孢杆菌对杂交鲟幼鱼幽门盲囊抗氧化指标的影响见表6,结果表明:试验Ⅰ组、Ⅱ组T-AOC活性和SOD活性显著高于PM组(P<0.05),且与FM组相比差异不显著(P>0.05);试验Ⅰ组、Ⅱ组和Ⅲ组GSH含量显著高于PM组和FM组(P<0.05);各试验组MDA含量和ASAFR活性差异均不显著(P>0.05)。
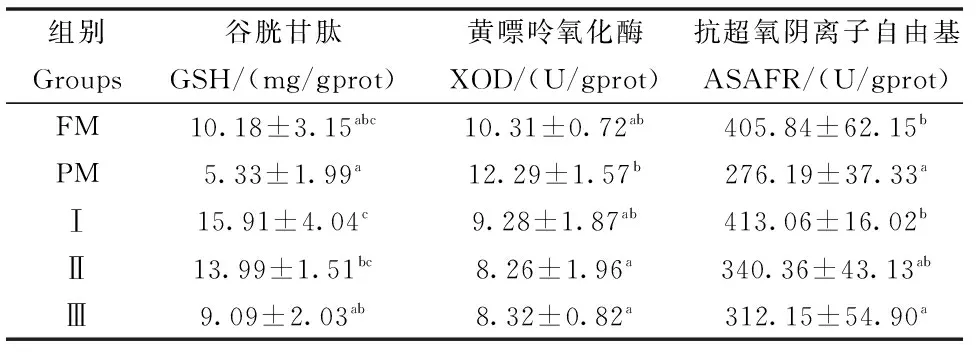
表5 巨大芽孢杆菌对杂交鲟幼鱼肝脏抗氧化指标的影响
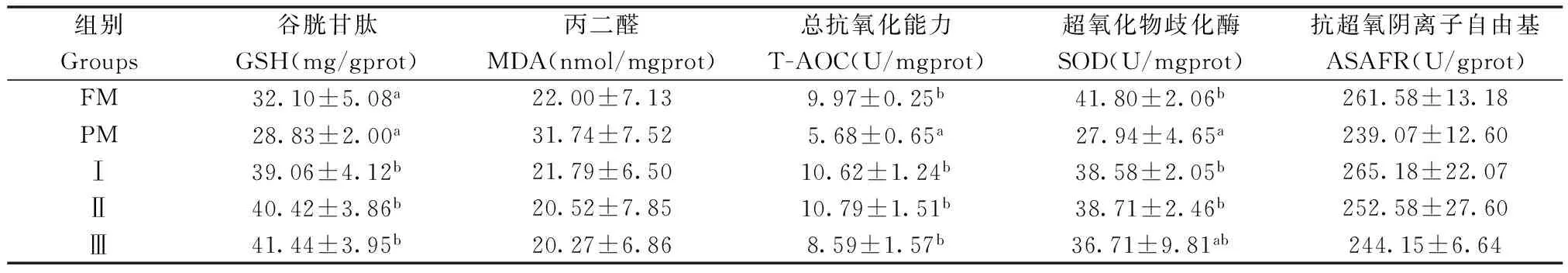
表6 植物蛋白质饲料中添加巨大芽孢杆菌对杂交鲟幼鱼幽门盲囊抗氧化指标的影响
3 讨论
3.1 巨大芽孢杆菌对杂交鲟幼鱼血清生化指标的影响
测定血清生化指标可以反映动物机体新陈代谢的情况[14]。血清TP可以让血管内酸碱度和渗透压保持在正常范围内,还可以保障动物机体内的正常运输[15]。血清球蛋白会通过与外来的特异性抗原起免疫反应而保护机体,因此动物的免疫水平可以通过血清球蛋白含量高低在一定程度上得到反映[16]。本试验中各试验组杂交鲟幼鱼血清TP和GLB含量均显著高于PM组。究其原因,芽孢杆菌代谢过程中能产生丰富的蛋白酶,从而促进对营养物质的消化,一定程度上为血清蛋白质的合成提供了丰富的原料[17],而且在其代谢过程中还可以产生如脂多糖等具有免疫原性的活性物质,从而刺激机体提高血清球蛋白含量,血清球蛋白含量升高也可引起总蛋白含量上升[18]。Tagari等[19]研究表明,血清BUN含量降低和蛋白氮的体内沉积增加密切相关,从而提高饲料中蛋白质利用率,因此血清BUN可以反映动物体内蛋白质的代谢情况。本试验中各试验组杂交鲟幼鱼血清BUN含量均显著低于PM组和FM组,说明将巨大芽孢杆菌添加到饲料中可以改善杂交鲟幼鱼体内蛋白质代谢情况,一方面巨大芽孢杆菌自身分泌的蛋白酶促进了蛋白质的消化吸收,另一方面通过降低XOD活性,抑制UA的生成,提高机体蛋白质利用率。ALT和AST是机体内转氨基作用过程中非常重要的酶,机体代谢正常的情况下在血清中含量很低,但是当肝脏受到破坏时,就会使血清中的ALT活性升高,AST活性也会随之升高[20]。本试验中试验组的AST和ALT活性均低于PM组,表明巨大芽孢杆菌对杂交鲟幼鱼肝脏无损伤,与其他学者研究结果一致[21-22]。本试验中,试验组的血磷含量有升高的趋势,可能由于巨大芽孢杆菌代谢过程中产生了植酸酶,促进了植酸磷水解[23];试验组血糖含量低于PM组,在正常生理范围内,同一条件下血糖含量低,表明其组织细胞的代谢加强[24]。
3.2 巨大芽孢杆菌对杂交鲟幼鱼组织抗氧化能力的影响

4 结论
杂交鲟幼鱼植物蛋白质饲料中添加一定量的巨大芽孢杆菌能够提高组织抗氧化能力并改善血清生化指标,适宜添加量为105~106cfu/g。
[1]沈文英,李卫芬,梁 权,等.饲料中添加枯草芽孢杆菌对草鱼生长性能、免疫和抗氧化功能的影响[J].动物营养学报,2011,23(5):881-886.
[2]NAYAK S K, SWAIN P, MUKHERIEE S C. Effect of dietary supplementation of probiotic and vitamin C on the immune response of Indian major carp,Labeorohita[J].Fish Shellfish Immun, 2007, 23(4):892-896.
[3]刘克琳,何明清.益生菌对鲤鱼免疫功能影响的研究[J].饲料工业,2000,21(6):24-25.
[4]胡 毅,谭北平,麦康森,等.饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响[J].中国水产科学,2008,15(2):244-251.
[5]GATESOUPE F J. Lactic acid bacteria increase the resistance of turbot larvae,Scophthalnusmaximus, against pathogenic Vibrio[J]. Aquat Living Resour, 1994, 7:277-282.
[6]高 欣.芽孢杆菌对西伯利亚幼鱼摄食生长及肠道菌群的影响[D].石家庄:河北师范大学, 2008:1-82.
[7]刘晓勇,张 颖,齐 茜,等.枯草芽孢杆菌对杂交鲟幼鱼生长性能、消化酶活性及非特异性免疫的影响[J].中国水产科学,2011,18(6):1315-1320.
[8]THAVASI R, JAYALAKSHMI S, BANAT I M. Effect of biosurfactant and fertilizer on biodegradation of crude oil by marine isolates ofBacillusmegaterium,CorynebacteriumkutscheriandPseudomonasaeruginosa[J].Bioresour Technol, 2011, 102(2):772-778.
[9]VARY P S, BIEDENDIECK R, FUERCH T, et al.Bacillusmegateriumfrom simple soil bacterium to industrial protein production host[J]. Appl Microbiol Biot, 2007, 76(5):957-967.
[10]匡 群,孙 梅,张维娜,等.巨大芽孢杆菌JSSW-JD的生物学特性及对养殖水体氮磷的影响[J].江苏农业科学,2013,41(4):222-225.
[11]张艳云,霍永久,戴承墉,等.巨大芽孢杆菌制剂对蛋鸡舍氨和硫化氢产生量的影响[C].第二届全国畜禽和水产养殖污染监测与控制治理技术交流研讨会,2008.
[12]马恒甲,叶金云,郭建林,等.全植物蛋白饲料中添加植酸酶对草鱼生长、非特异性免疫及消化酶活力的影响[J].浙江海洋学院学报(自然科学版),2011,30(2):119-125.
[13]刘晓勇,张 颖,齐 茜,等.枯草芽孢杆菌对杂交鲟幼鱼生长性能、消化酶活性及非特异性免疫的影响[J].中国水产科学,2011,18(6):1315-1320.
[14]WANG J P, YOO J S, KIM H J, et al. Nutrient digestibility, blood profiles and fecal microbiota are influenced by chitooligosaccharide supplementation of growing pigs[J]. Livest Sci, 2009, 125(2-3):298-303.
[15]王建红,刁其玉,许先查,等.日粮Lys、Met和Thr添加模式对0~2月龄犊牛生长性能、消化代谢与血清学生化指标的影响[J].中国农业科学,2011,44(9):1898-1907.
[16]林 谦,戴求仲,宾石玉,等.益生菌与酶制剂对黄羽肉鸡血液生化指标和免疫性能影响的协同效应研究[J].饲料工业,2012,33(14):31-36.
[17]丁 贤,李卓佳,陈永青,等.芽孢杆菌对凡纳滨对虾生长和消化酶活性的影响[J].中国水产科学,2004,11(6):580-584.
[18]孙翠慈,王安利,王素芬,等.活性多糖对水产动物免疫功能的调节[J].海洋通报,2003,22(3):81-88.
[19]TAGARI H. Studies on relation between blood urea nitrogen and nitrogen retention of pigs [J].Brit J Nutr, 1964, 18:333-342.
[20]赖红娥,吴莉芳,秦贵信,等.大豆抗原蛋白Glycinin对鲤稚鱼和幼鱼血液主要生化指标的影响[J].吉林农业大学学报,2013,35(6):736-741.
[21]朱学芝,郑石轩,潘庆军,等.芽孢杆菌对凡纳滨对虾免疫和生化指标的影响[J].饲料研究,2007(4):56-59.
[22]李晓刚.巨大芽孢杆菌降低蛋鸡排泄物中氨和硫化氢机理的研究[D].扬州:扬州大学,2012.
[23]徐海燕,曹 斌,张志焱,等.芽孢杆菌发酵代谢产物的研究[J].饲料广角,2006(9):22-23.
[24]袁丰华,林黑着,李卓佳,等.地衣芽孢杆菌对尖吻鲈血液生理生化指标的影响[J].南方水产,2009,5(2):45-50.
[25]宋芳杰,王连生,徐奇友.谷氨酰胺及其前体物对松浦镜鲤组织抗氧化能力及血清生化指标的影响[J].动物营养学报,2016,28(2):627-634.
[26]李卫芬,张小平,宋文辉,等.养殖水体中添加芽孢杆菌对草鱼免疫和抗氧化功能的影响[J].中国水产科学,2012,19(6):1027-1033.
[27]许丹丹,黄燕华,曹俊明,等.饲料中添加核苷酸混合物对凡纳滨对虾幼虾非特异性免疫和抗氧化指标的影响[J].动物营养学报,2011,23(5):828-835.
[28]尹惠霖.纳豆芽袍杆菌对草鱼幼鱼生理生化指标和肠道功能的影响[D].长沙:湖南农业大学,2014.
[29]冯广朋,庄 平,章龙珍,等.温度对中华鲟幼鱼代谢酶和抗氧化酶活性的影响[J].水生生物学报,2012,36(1):137-142.
[30]付天玺,许国焕,吴月嫦,等.凝结芽孢杆菌对奥尼罗非鱼消化酶活性、消化率及生长性能的影响[J].淡水渔业,2008,38(4):30-35.
[31]SHEN W Y, FU L L, LI W F, et al. Effect of dietary supplementation withBacillussubtilison the growth, performance, immune response and antioxidant activities of the shrimps(Litopenaeusvannamei) [J]. Aquac Res, 2010, 41(11):1691-1698.
[32]李 源,温安祥,骆美琳.谷氨酰胺促泥鳅生长机理的初步研究[J].饲料工业,2014,35(2):37-43.
[33]黄俊文,林映才,冯定远,等.益生菌、甘露寡糖对早期断奶仔猪生长、免疫和抗氧化机能的影响[J].动物营养学报, 2005, 17(4):16-20.
