环磷酰胺对大鼠卵巢结构与功能的影响及机制
2018-04-17魏天琴凌丽冯秀山张文倩熊正爱
魏天琴,凌丽,冯秀山,张文倩,熊正爱
早发性卵巢功能不全(premature ovarian insufficiency,POI)是指女性年龄<40岁,出现月经紊乱(月经稀发4个月或闭经),伴有低雌激素和高促性腺激素[连续2次间隔4周促卵泡激素(FSH)>25U/L[1]]等卵巢活动衰退的临床综合征[2-3]。 POI的病因复杂,发病机制尚不清楚,可能与染色体缺陷、感染、自身免疫性损伤及医源性因素等相关[3-4]。育龄妇女中POI的发病率较高,且随着恶性肿瘤年轻化及发病率的增加,因化疗导致的POI呈逐年上升趋势,因此与POI相关的基础研究尤为重要。环磷酰胺(cyclophosphamide,CTX)属烷化剂类抗肿瘤药,卵巢是其生殖毒性作用的主要靶器官。本研究采用CTX建立化疗所致POI大鼠模型,动态观察大鼠卵巢的组织病理学和内分泌功能改变,初步探讨POI的发病机制,以期为临床治疗POI提供实验支持。
1 材料与方法
1.1 实验动物 10~12周龄健康雌性SD大鼠,体重220~260g,购自重庆医科大学实验动物中心,代养于重庆医科大学动物中心SPF级实验室,相对湿度50%~60%,室温23±1℃,明暗周期12h,自由饮食和饮水。每日上午8:00~9:00行阴道脱落细胞涂片,观察动情周期,连续观察7d,筛选50只动情周期正常大鼠进行实验。本实验经重庆医科大学附属第二医院伦理委员会的批准(编号:2016-044)。
1.2 主要试剂 CTX(江苏盛迪医药有限公司);雌激素(E2)、抗苗勒管激素(AMH)、FSH、肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、白介素-6(IL-6)和血管内皮生长因子-α(VEGF-α)ELISA试剂盒(武汉优尔生商贸有限公司);Bax/Bcl-2单克隆抗体(Proteintech武汉三鹰生物技术有限公司);山羊抗鼠抗体二抗(北京中杉金桥生物技术有限公司)。
1.3 方法
1.3.1 POI模型的建立 参考文献[5-6]方法建立POI模型。将50只动情周期正常的健康雌性SD大鼠随机分为模型组及对照组,每组25只。模型组:无菌条件下,将200mg CTX溶于100ml生理盐水,配制成浓度为2mg/ml的溶液,现配现用。首日以50mg/kg 负荷剂量腹腔注射,随后以8mg/(kg·d)维持剂量连续腹腔注射上述溶液14d。对照组每日腹腔注射等量生理盐水。建模完成24h及1、2、4、8周采用3%戊巴比妥钠溶液腹腔注射麻醉大鼠,心脏采血法分批处死,每次每组处死5只,采集相关实验材料。
1.3.2 观察指标 ①动情周期观察:从两组大鼠中随机筛选10只,每日上午8:00~9:00行阴道脱落细胞涂片,HE染色,光镜下观察大鼠动情周期[7]。②血清性激素检测:收集建模完成24h及1、2、4、8周大鼠血清,严格按照ELISA检测试剂盒说明书操作流程检测血清AMH、E2及FSH的水平。③大鼠体重变化及卵巢器官指数测定:记录大鼠每日体重。摘取大鼠双侧卵巢称湿重,测定卵巢脏器指数。卵巢脏器指数=卵巢湿重/体重。④卵巢组织形态学观察及卵泡计数:摘取建模完成24h及1、2、4、8周大鼠新鲜卵巢,4%多聚甲醛固定72h,常规石蜡包埋,连续切片,厚度5μm,行HE染色,光镜下观察卵巢组织病理学变化并进行原始卵泡、初级卵泡、次级卵泡及成熟卵泡计数。⑤其他脏器组织形态学观察:摘取建模完成24h及1、2、4、8周大鼠新鲜心脏、肝脏、脾、肺、肾脏和子宫,4%多聚甲醛固定72h,常规方法制备石蜡切片,HE染色,光镜下观察并摄片。
1.3.3 POI发生机制的研究 ①卵泡内颗粒细胞凋亡检测:取建模完成24h及1、2、4、8周大鼠卵巢石蜡切片,常规脱蜡处理,按照TUNEL检测试剂盒方法操作,光镜下观察棕色阳性细胞。②卵巢组织凋亡相关蛋白检测:提取建模完成24h及1、2、4、8周大鼠卵巢组织总蛋白,分别检测样品蛋白含量,SDS-PAGE凝胶电泳分离,转膜,5%脱脂奶粉封闭2h,洗膜,加入Bax、Bcl-2、β-actin一抗4℃孵育过夜,TBST洗膜3次,加入二抗室温孵育2h,TBST洗膜3次,ECL化学发光,X线片曝光。Image J软件计算目的蛋白与内参蛋白β-actin灰度值比值。③卵巢组织匀浆中TNF-α、IL-1β、IL-6和VEGF-α含量检测:摘取建模完成24h及1、2、4、8周大鼠卵巢,液氮研磨卵巢组织样本,4℃下12 000r/min离心15min,收集匀浆上清液,BCA蛋白浓度测定试剂盒检测各组上清液的蛋白浓度。严格按照ELISA检测试剂盒说明书操作流程检测卵巢组织匀浆中TNF-α、IL-1β、IL-6和VEGF-α的含量。
1.4 统计学处理 采用SPSS 24.0软件进行统计分析。计量资料以±s表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组大鼠一般情况比较 与对照组比较,CTX诱导的POI模型组大鼠毛色暗淡无光,日常活动减少,部分出现腹泻。模型组大鼠体重于注射CTX后即开始下降,注射8周结束后较对照组明显下降,且于建模完成时降至最低(P<0.05,或P<0.01,图1),停药后体重缓慢增加。
2.2 动情周期的改变 HE染色结果显示,正常大鼠动情周期(图2A)分为动情间期(以白细胞为主)、动情前期(以椭圆形有核上皮细胞为主)、动情期(以片状、树叶状堆积的无核角化上皮细胞为主)及动情后期(白细胞、无核角化上皮细胞及有核上皮细胞同时存在,且比例相当)。对阴道脱落细胞HE染色结果行统计分析显示:CTX诱导的POI模型组大鼠动情周期紊乱,表现为动情间期延长、持续动情间期、无动情期及动情后期(图2B)。
2.3 大鼠血清性激素水平的比较 ELISA检测结果显示:CTX诱导的POI模型组大鼠血清各时间点AMH、E2水平较对照组明显下降(P<0.01),而FSH水平较对照组明显升高(P<0.01,图3)。
2.4 大鼠卵巢形态学及各级卵泡计数比较 模型组大鼠卵巢脏器指数[(2.38±0.22)×10–4]与对照组[(2.41±0.20)×10–4]比较差异无统计学意义(P>0.05)。与对照组比较,CTX诱导的POI模型组大鼠卵巢间质增生和纤维化明显,生长卵泡闭锁增多,次级卵泡数及成熟卵泡数明显减少(P<0.05),原始卵泡及初级卵泡数量稍减少,但差异无统计学意义(图4)。
2.5 大鼠其他重要脏器的组织形态学改变 与对照组比较,CTX诱导的POI模型组大鼠子宫腺体萎缩,子宫壁变薄,组织较正常致密,子宫腔缩小(图5A、B);心脏、肝脏、脾、肺及肾脏组织无明显病理学改变(图5C)。

图1 CTX对大鼠体重的影响Fig.1 Effect of CTX on rat's body weight

图2 CTX对大鼠动情周期的影响Fig.2 Effect of CTX on rat's estrous cycle
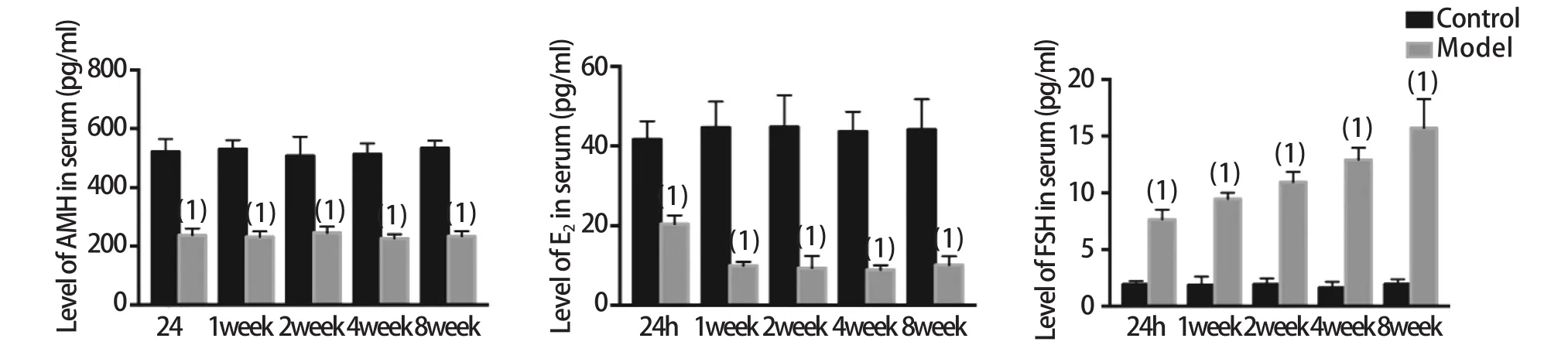
图3 CTX注射后各时间点大鼠血清AMH、E2、FSH水平的比较Fig.3 Serum AMH, E2, FSH levels at different time points after CTX injection
2.6 CTX对大鼠卵泡内颗粒细胞凋亡的影响TUNEL染色显示,对照组卵泡内仅见少量TUNEL染色呈弱阳性的凋亡细胞,而CTX诱导的POI模型组TUNEL染色阳性的凋亡细胞明显增加(图6)。
2.7 两组凋亡相关蛋白表达水平比较 Western blotting检测结果显示CTX诱导的POI模型组大鼠卵巢内Bax表达水平较对照组明显升高(P<0.01),而Bcl-2表达水平较对照组明显下降(P<0.01,图7)。
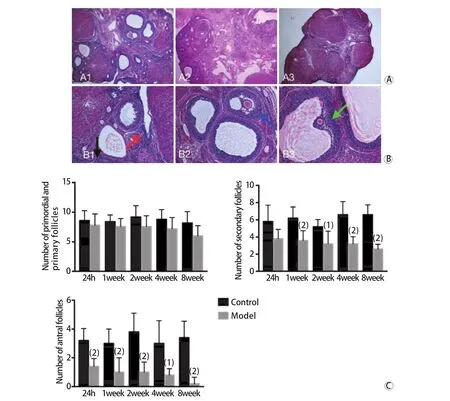
图4 CTX诱导的POI大鼠卵巢组织形态学改变及各级卵泡计数情况Fig.4 Ovarian morphology and follicle count of rats with CTX-induced POI

图5 CTX诱导的POI模型组大鼠与对照组大鼠重要脏器组织形态学比较Fig.5 Comparison of the uterus and other organs in model and control group
2.8 大鼠卵巢组织匀浆中TNF-α、IL-1β、IL-6及VEGF-α含量比较 ELISA检测结果显示,与对照组比较,CTX诱导的POI大鼠卵巢组织匀浆中TNF-α、IL-1β、IL-6水平明显上升(P<0.01),VEGF-α水平明显下降(P<0.01,图8)。

图6 CTX诱导的POI大鼠与正常大鼠卵泡内颗粒细胞凋亡比较(TUNEL×200)Fig.6 Comparison of the apoptosis of granulose cells in model and control group (TUNEL ×200)

图7 CTX诱导的POI大鼠与正常大鼠卵巢内凋亡相关蛋白Bax和Bcl-2表达水平Fig.7 Comparison of the levels of Bcl-2 and Bax protein in model and control group
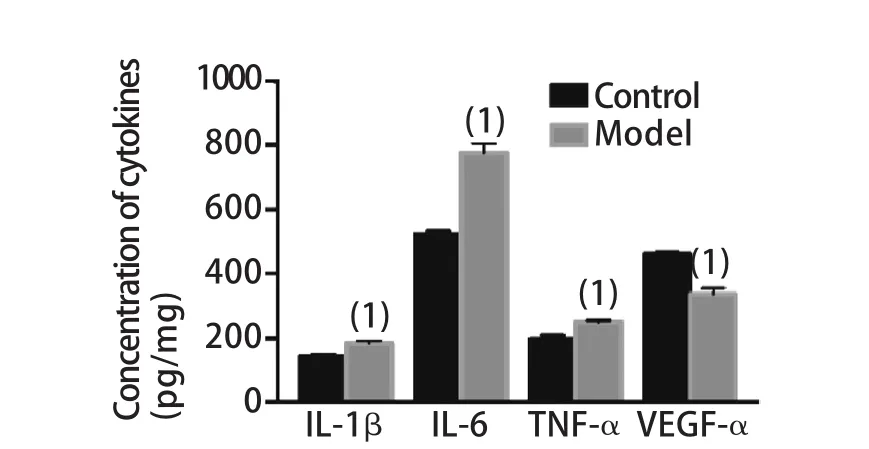
图8 两组大鼠卵巢组织匀浆中炎症因子含量比较(n=25)Fig.8 Comparison of the concentration of inflammatory cytokines in model and control group (n=25)
3 讨 论
POI临床表现多样,病因复杂,且呈进行性发展,患者常以月经改变为先兆,主要表现为月经稀发或闭经,也可表现为雌激素缺乏相关症状,如血管舒缩症状、精神神经系统症状、泌尿生殖道症状及骨质疏松等。POI在一般人群中的发病率为1%~3%[8],也有研究报道在40岁前的发病率约为1%,20岁前的发病率为1‰[9],其中化疗药物引发的POI占POI总数的25%[10]。化疗所致卵巢功能受损的程度与接受化疗时患者的年龄、化疗药物的种类及剂量有关。目前临床常用的化疗药物按作用机制主要分为5大类[11]:铂类、烷化剂、抗代谢药、植物碱及抗生素。CTX属于双功能烷化剂及细胞非特异性药物,被广泛用于抗肿瘤、免疫抑制治疗等,卵巢是其雌性生殖毒性作用的主要靶器官[12]。
良好的POI模型需满足下列几个条件:①动情周期改变;②血清性激素水平变化;③卵泡数量减少;④造模所用药物对其他重要脏器无明显损伤。大鼠的动情周期一般为4~5d,动情周期中阴道脱落细胞形态结构的变化主要受雌激素变化的影响,可间接地反映卵巢功能[13]。因此阴道脱落细胞涂片法可以较准确地区分大鼠动情周期的每个阶段。本研究发现模型组大鼠动情周期紊乱,血清AMH、E2水平明显下降,FSH水平明显升高,与临床POI患者的内分泌变化一致,且卵巢内各级卵泡数量均不同程度减少,子宫病理呈低雌激素改变,其他重要脏器无明显器质性损害,表明CTX诱导的POI模型建立成功。其中卵巢内各级卵泡数量均不同程度减少,尤以成熟卵泡数量减少最为明显,表明成熟卵泡比原始卵泡对CTX更敏感,这也是青春期前的女性在接受化疗时,其卵巢对化疗药物的耐受性相对较好的原因[14]。有研究表明,曾经接受过化疗的女性,随着时间延长,多数会出现卵巢功能受损表 现[15-16]。部分临床化疗患者的卵巢功能在停用化疗药后有一定程度的恢复,而在本实验观察时间内,模型组大鼠卵巢间质增生和纤维化明显,卵巢功能无明显恢复,可能与观察时间不够长有关。在下一步的实验中,本课题组计划进一步延长观察时间,并与雄鼠合笼,更直观地观察卵巢的生殖功能情况。
POI的发生机制尚不十分清楚,一般认为与始基卵泡池储备不足、卵泡闭锁加速、优势卵泡募集改变、卵泡成熟障碍等相关。有研究表明,CTX引起卵巢结构及功能改变的主要机制是细胞凋亡,其中颗粒细胞的凋亡最早发生[17],而颗粒细胞凋亡受Bax及Bcl-2调控。Bcl-2基因是一种癌基因,具有抑制细胞凋亡的作用;Bax基因与Bcl-2基因同源,具有促进细胞凋亡的作用。TUNEL法染色显示,模型组卵泡内颗粒细胞凋亡增加;Western blotting结果显示,模型组大鼠卵巢组织中凋亡蛋白Bax表达上调,而抗凋亡蛋白Bcl-2表达下调,均表明CTX可促进卵巢内颗粒细胞的凋亡,并进一步引起卵巢结构和功能的改变。
相关研究表明,多种细胞因子参与了POI的发生发展过程[18-20]。其中,CTX作用于机体,诱发机体的氧化应激反应,释放相关细胞因子,如TNF-α、IL-1β和IL-6,这些细胞因子可通过多种路径作用于颗粒细胞,调控颗粒细胞的凋亡[18]。此外,VEGF参与维持卵巢的正常功能,且其时间分布与雌激素水平有关。VEGF mRNA在原始卵泡、初级卵泡、闭锁卵泡中无表达[21],在卵泡期的卵母细胞中呈弱表达,并随卵子成熟表达渐强,至排卵、黄体形成时达最强,黄体萎缩后表达渐弱。VEGF能促进血管内皮细胞的分裂、增生和游走,参与卵巢周期性血管生成,调节卵巢的血供[22]。本研究发现,模型组卵巢组织匀浆上清中TNF-α、IL-1β和IL-6含量上升,VEGF-α含量下降,说明CTX诱导的POI大鼠卵巢处于慢性炎症反应状态,局部微环境改变,卵泡不能发育成熟或不能排卵,与临床POI患者的卵巢有卵泡丢失、闭锁、无排卵相符。
综上所述,CTX可致卵巢结构及功能改变,且与临床POI患者的表现类似。POI的发病机制尚不清楚,本实验只是初步探讨其发病机制,检测指标尚不完善,需要进行进一步研究。
【参考文献】
[1] European Society for Human Reproduction and Embryology (ESHRE) Guideline Group on POI, Webber L, Davies M, et al.ESHRE Guideline: management of women with premature ovarian insufficiency[J].Hum Reprod, 2016, 31(5): 926-937.
[2] Goswami D, Arif A, Saxena A, et al.Idiopathic primary ovarian insufficiency: a study of serial hormonal profiles to assess ovarian follicular activity[J].Hum Reprod, 2011, 26(8): 2218-2225.
[3] Menopause Subgroup, Chinese Society of Obstetrics and Gynocology, Chinese Medical Association.Consensus of hormone replacement therapy for premature ovarian insufficiency[J].Chin J Obstet Gynecol, 2016, 51(12): 881-886.[中华医学会妇产科学分会绝经学组.早发性卵巢功能不全的激素补充治疗专家共识[J].中华妇产科杂志, 2016, 51(12): 881-886.]
[4] Vujovic S.Aetiology of premature ovarian failure[J].Menopause Int, 2009, 15(2): 72-75.
[5] Ataya KM, McKanna JA, Weintraub AM, et al.A luteinizing hormone-releasing hormone agonist for the prevention of chemotherapy-induced ovarian follicular loss in rats[J].Cancer Res, 1985, 45(8): 3651-3656.
[6] Song D, Zhong Y, Qian C, et al.Human umbilical cord mesenchymal stem cells therapy in cyclophosphamide-induced premature ovarian failure rat model[J].Biomed Res Int, 2016, 2016: 2517514.
[7] White YA, Woods DC, Takai Y, et al.Oocyte formation by mitotically active germ cells purified from ovaries of reproductive-age women[J].Nat Med, 2012, 18(3): 413-421.
[8] Kovanci E, Schutt AK.Premature ovarian failure: clinical presentation and treatment[J].Obstet Gynecol Clin North Am, 2015, 42(1): 153-161.
[9] Patrizio P, Vaiarelli A, Levi Setti PE, et al.How to define, diagnose and treat poor responders? Responses from a worldwide survey of IVF clinics[J].Reprod Biomed Online, 2015, 30(6): 581-592.
[10] Fu XF, He YL.Establishment of rat model of chemotherapyinduced premature ovarian failure[J].Guangdong Med J, 2008, 29(12): 1952-1954.[付霞霏, 何援利.化疗所致卵巢早衰动物模型的建立[J].广东医学, 2008, 29(12): 1952-1954.]
[11] Zhao XJ, Huang YH, Yu YC, et al.GnRH antagonist cetrorelix inhibits mitochondria-dependent apoptosis triggered by chemotherapy in granulosa cells of rats[J].Gynecol Oncol, 2010, 118(1): 69-75.
[12] De Flora S, Ferguson LR.Overview of mechanisms of cancer chemopreventive agents[J].Mutat Res, 2005, 591(1-2): 8-15.
[13] Li CX, Wang FY, Li YY, et al.Establishment of mouse model of premature ovarian failure[J].J Third Mil Med Univ, 2008, 30(6): 506-509.[李彩霞, 王凤英, 李玉艳, 等.小鼠卵巢早衰动物模型的构建[J].第三军医大学学报, 2008, 30(6): 506-509.]
[14] Lawrenz B, Rothmund R, Neunhoeffer E, et al.Fertility preservation in prepubertal girls prior to chemotherapy and radiotherapy-review of the literature[J].J Pediatr Adolesc Gynecol, 2012, 25(5): 284-288.
[15] De Vos M, Devroey P, Fauser BC.Primary ovarian insufficiency[J].Lancet, 2010, 376(9744): 911-921.
[16] Fu XF, He YL, Wang XF, et al.Changes of serum miR-21 level in animal model and patients with chemotherapy-induced premature ovarian failure[J].Med J Chin PLA, 2016, 41(11): 915-918.[付霞霏, 何援利, 王雪峰, 等.化疗性卵巢功能早衰动物模型及患者血清miR-21水平的变化[J].解放军医学杂志, 2016, 41(11): 915-918.]
[17] Gracia CR, Sammel MD, Freeman E, et al.Impact of cancer therapies on ovarian reserve[J].Fertil Steril, 2012, 97(1): 134-140.e1.
[18] Mcfee RM, Rozell TG, Cupp AS.The balance of proangiogenic and antiangiogenic VEGFA isoforms regulate follicle development[J].Cell Tissue Res, 2012, 349(3): 635-647.
[19] Qiu Y, Seager M, Osman A, et al.Ovarian VEGF (165) b expression regulates follicular development, corpus luteum function and fertility[J].Reprod, 2012, 143(4): 501-511.
[20] Ye N, Dong XY, Li DH.The progress in apoptotic mechanism of ovarian granulosa cells involved in premature ovarian failure[J].J Cap Med Univ, 2014, 35(3): 379-383.[叶娜, 董晓英, 李冬华.卵巢早衰的颗粒细胞凋亡机制研究进展[J].首都医科大学学报, 2014, 35(3): 379-383.]
[21] Yamamoto S, Konishi I, Tsuruta Y, et al.Expression of vascular endothelial growth factor (VEGF) during folliculogenesis and corpus luteum formation in the human ovary[J].Gynecol Endocrinol, 1997, 11(6): 371-381.
[22] Zhang RP.Study progress of vascular endothelial growth factor[J].Med Recapit, 2008, 14(15): 2258-2260.[张瑞鹏.血管内皮生长因子最新研究进展[J].医学综述, 2008, 14(15): 2258-2260.]
