2型糖尿病合并急性心肌梗死患者心率减速力与变异性的相关性分析
2018-04-16易尚亨孟文全
易尚亨,孟文全
(广东省深圳市龙华区中心医院功能检查科 518110)
糖尿病是一种慢性非传染性疾病,给人类健康造成严重威胁,统计数据显示其病死率已仅次于肿瘤与心血管疾病[1]。截至目前,由糖尿病高患病率及其所导致的大血管、微血管并发症在全球已普遍引起了广泛关注,糖尿病患者比非糖尿病患者急性心肌梗死(AMI)的病死率高2~5倍[2]。2006年SCHMIDT等首次提出了心率减速力(DC)的概念,可通过24 h动态心电图监测进行测定;心率变异性(HRV)时域分析在评价心脏自主神经系统功能方面十分有效,且具有非侵入性、灵敏度高的特点[2]。为此,本研究选择2015年3月至2017年3月本院收治的30例2型糖尿病(T2DM)合并急性心肌梗死(AMI)患者作为研究对象,对T2DM+AMI患者DC与HRV指标的相关性进行探讨,现报道如下。
1 资料与方法
1.1一般资料选取2015年3月至2017年3月本院收治的30例T2DM+AMI患者作为T2DM+AMI组,其中男18例,女12例,平均年龄(61.79±7.95)岁。所有研究对象经临床诊断均符合T2DM+AMI的诊断标准。另选取本院同期收治的30例单纯T2DM患者作为T2DM组,其中男19例,女11例,平均年龄(62.08±7.05)岁;并以同期30例作健康体检者作为对照组,其中男17例,女13例,平均年龄(61.24±7.54)岁。所有研究对象性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2纳入及排除标准
1.2.1纳入标准[3](1)以中华医学会心血管病学分会制定的《急性心肌梗死诊断和治疗指南2012》作为本研究诊断标准,且入院后行冠状动脉造影检查与超声心动图检查加以确诊,均经头颅CT或者MRI影像学检查确诊;(2)发病至入院时间<48 h;(3)患者均为T2DM患者,患者空腹血糖≥6.1 mmol/L或餐后2 h血糖≥7.8 mmol/L;(4)所有研究对象均接受DC与HRV检查;(5)所有研究对象及家属均知情同意并签署知情同意书且经本院伦理委员会批准。
1.2.2排除标准[4](1)患者有既往冠状动脉搭桥、冠状动脉内支架置入术或冠状动脉腔内成形术史;(2)患者存在心、肝、肾等主要脏器先天畸形或严重感染;(3)患者存在近30 d抗菌药物或激素使用史。
1.3观察指标观察三组研究对象一般资料、DC与HRV时域指标[相邻窦性心率正常R-R间期差值均方根(rMSSD)、相邻正常R-R间期差值≥50 ms所占百分比(PNN50%)、24 h内每5 min节段R-R间期均值标准差(SDANN)以及24 h内R-R间期标准差(SDNN)]。
1.4方法冠状动脉造影检查:采用Judkins法、多体位投照分别对左、右冠状动脉进行造影,对冠状动脉病变严重程度进行评价,采集冠状动脉造影图像并记录检查结果。冠状动脉狭窄的判断:目测狭窄处血管直径减少的百分比是临床上判断冠状动脉病变狭窄程度的常用方法。冠心病相应诊断标准:(1)主要冠状动脉(包括左主干、左前降支、回旋支、右冠状动脉)及其主要分支中任何1支狭窄≥50%为冠状动脉造影阳性即可确诊;(2)主要冠状动脉及主要分支中任何1支狭窄<50%者为冠脉造影阴性即可排除。对冠状动脉病变程度按照病变支数以及Gensini积分标准进行评价。所有研究对象均行选择性冠状动脉造影,冠状动脉病变血管支数以冠状动脉造影结果阳性的血管计入;冠状动脉狭窄程度的评价:采用修正Gensini评分系统评价。
超声心动图检查:对所有入院患者在1周内进行超声心动图检查[型号:飞利普Affiniti70,购自飞利浦(中国)投资有限公司(上海)],探头频率为2.5 Hz,测量过程采用重复性检验使其测量误差≤5%。并根据检查结果计算左心室射血分数。动态心电图监测:入院后用动态心电图监测仪(型号:博英BI9800,购自深圳市博英医疗科技有限公司)对所有研究对象进行24 h心电监测,以心肌缺血发作时间间隔超过1 min,持续时间超过1 min,ST段的水平型或下斜型压低超过0.1 mV作为缺血性ST段下移阳性的参考标准。详细记录并计算所有研究对象DC与rMSSD、PNN50%、SDANN、SDNN值。
2 结 果
2.1三组研究对象一般资料比较各组间各指标比较差异均无统计学意义(P>0.05),具有可比性。见表1。
2.2三组研究对象DC与HRV时域指标比较T2DM组与T2DM+AMI组DC、rMSSD、PNN50%、SDANN、SDNN均明显低于对照组,差异有统计学意义(P<0.05);T2DM+AMI组DC、rMSSD、PNN50%、SDANN、SDNN均明显低于与T2DM组,差异有统计学意义(P<0.05)。见表2。
2.3三组研究对象DC<4.5 ms发生情况比较对照组、T2DM组、T2DM+AMI组DC<4.5 ms的发生率分别为3.33%(1/30)、16.67%(5/30)、26.67%(8/30)。其中,T2DM组与T2DM+AMI组DC<4.5 ms的发生率均明显高于对照组,差异有统计学意义(χ2=5.937、3.751,P<0.05);T2DM+AMI组DC<4.5 ms的发生率均明显高于T2DM组,差异有统计学意义(χ2=3.744,P<0.05)。
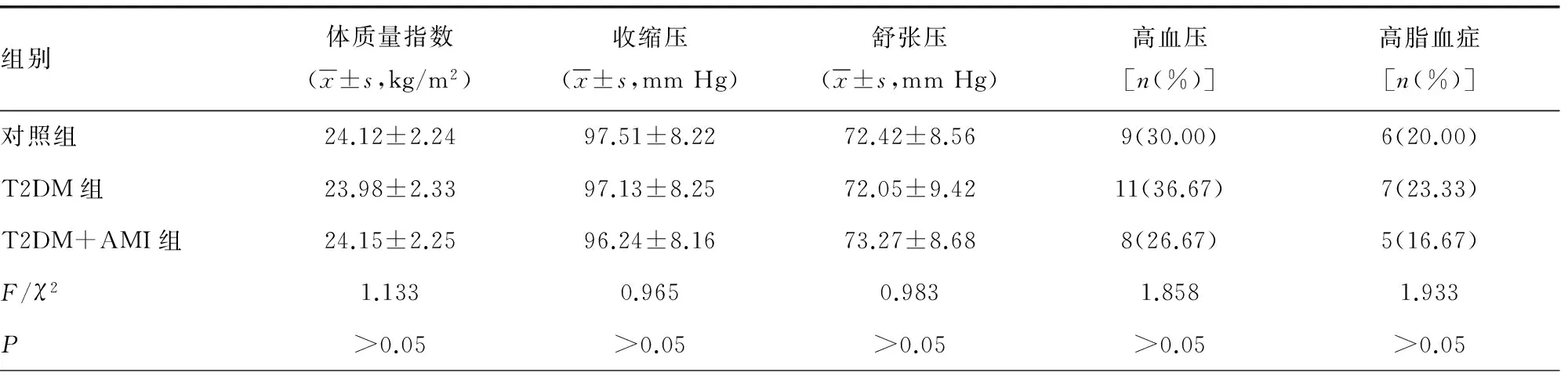
表1 三组研究对象一般资料比较(n=30)
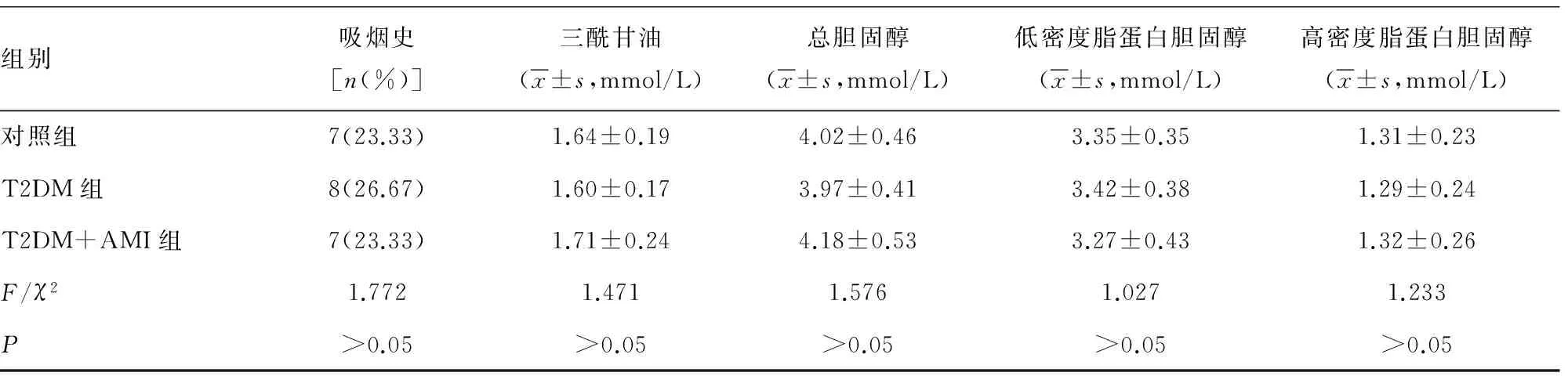
组别吸烟史[n(%)]三酰甘油(x±s,mmol/L)总胆固醇(x±s,mmol/L)低密度脂蛋白胆固醇(x±s,mmol/L)高密度脂蛋白胆固醇(x±s,mmol/L)对照组7(23.33)1.64±0.194.02±0.463.35±0.351.31±0.23T2DM组8(26.67)1.60±0.173.97±0.413.42±0.381.29±0.24T2DM+AMI组7(23.33)1.71±0.244.18±0.533.27±0.431.32±0.26F/χ21.7721.4711.5761.0271.233P>0.05>0.05>0.05>0.05>0.05
表2 三组研究对象DC与HRV时域指标比较
注:与对照组比较,*P<0.05;与T2DM组比较,#P<0.05
2.4T2DM组、T2DM+AMI组DC与HRV时域指标相关性分析相关性分析结果表明,T2DM组、T2DM+AMI组DC与rMSSD、PNN50%、SDANN、SDNN均呈正相关(P<0.05),见表3。
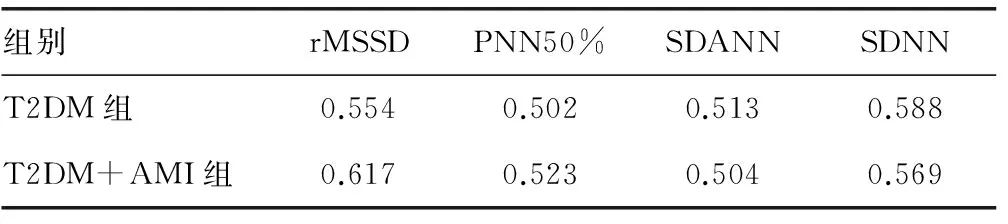
表3 DC与HRV时域指标相关性分析(n=30)
3 讨 论
近年来越来越多的研究指出,心率和心血管疾病的发生密切相关,心率过快成为心血管病患者死亡的一个重要因素[5]。而且国外学者认为,心动过速为交感神经兴奋性增强、自主神经调节异常的标志[6]。T2DM患者发病早期,交感神经活性会明显增强,极易造成心动过速,增加了AMI的发生风险。
心脏受到自主神经的支配,在自主神经中迷走神经与交感神经互相协调,从而维持着机体正常心跳节律和心脏正常活动,如果相互协调作用一旦失去平衡,将会造成心功能紊乱及心律改变[7]。心脏节律能够随着昼夜时间和人体状况而发生变化,这种心率的规则性变化即被称为HRV,起到间接评价心脏植物神经调节功能,是一项能定量、重复判断机体自主神经功能的检查手段[8]。HRV可反映机体自主神经系统对窦房结起博细胞固有节律的调节效果,交感神经兴奋可增强其激动,增加心率。HRV可分为频域分析和时域分析[9-10],频域分析法为迷走神经的动态活动变化常用分析方法,其中主要指标包括低频功率、高频功率以及低频功率/高频功率;高频功率反映了机体迷走神经的活性,为分析心脏副交感神经支配的一项定量指标;低频功率的生理基础目前尚未完全明确,部分学者认为,低频功率可能反映了机体迷走神经、交感神经的双重活性;而低频功率/高频功率则反映了机体迷走神经与交感神经平衡状态。时域分析可以整体性评估自主神经系统对机体心率的调控作用,其中SDNN反映了迷走神经与交感神经的总张力。目前已有不少关于DC与HRV的研究,均对HRV评价心脏自主神经系统功能的效果进行了肯定[11-12]。本研究在过往研究[13-14]的基础上,对T2DM+AMI患者DC与HRV指标的相关性进行探讨,T2DM组与T2DM+AMI组DC、rMSSD、PNN50%、SDANN、SDNN均明显低于对照组,而T2DM+AMI组DC、rMSSD、PNN50%、SDANN、SDNN均明显低于T2DM组,表明T2DM与T2DM+AMI患者自主神经功能均有不同程度损害,但T2DM+AMI患者受损害更为严重;T2DM组与T2DM+AMI组DC<4.5 ms的发生率16.67%(5/30)、26.67%(8/30)均明显高于对照组3.33%(1/30)。相关性分析结果表明,T2DM+AMI组DC与rMSSD、PNN50%、SDANN、SDNN均呈正相关(P<0.05),表明DC与T2DM+AMI患者机体的自主神经功能与迷走神经张力密切相关。
综上所述,T2DM+AMI患者DC及HRV均明显降低,且DC与HRV时域指标呈正相关,DC可定量评估T2DM+AMI患者迷走神经张力,可作为反映自主神经系统损害的有效指标。
[1]郑春娜,黄丽红.冠心病患者心率减速力与心率变异性的关联性探讨[J].医学与哲学,2015,36(3):36-37.
[2]PAN Q,ZHOU G Z,WANG R F,et al.The degree of heart rate asymmetry is crucial for the validity of the deceleration and acceleration capacity indices of heart rate:A model-based study[J].Comput Biol Med,2016,76(4):39-49.
[3]肖慧敏,黄美琴,李青.2型糖尿病合并冠心病患者心率变异性分析[J].中华全科医学,2013,11(7):1116-1117.
[4]WANG Y P,KUO T B,LI J Y,et al.The relationships between heart rate deceleration capacity and spectral indices of heart rate variability during different breathing frequencies[J].Eur J Appl Physiol,2016,116(7):1281-1287.
[5]靳晶,黄丽红.2型糖尿病患者的心率变异性、心率减速力及连续心率减速力分析[J].医学与哲学,2016,37(8):36-37.
[6]DEMMING T,SANDROCK S,KUHN C,et al.Deceleration capacity:A novel predictor for total mortality in patients with non-ischemic dilated cardiomyopathy[J].Int J Cardiol,2016,221(5):289-293.
[7]万建平,高虹,杨泽福,等.不同ST段形态早复极人群心率变异性、心率减速力及心室复极离散度的研究[J].临床医学,2014,34(10):4-6.
[8]孙巍,郑黎晖,姚焰,等.血管迷走性晕厥患者的心率减速力和心率变异性特征[J].中国循环杂志,2015,30(11):1067-1070.
[9]虞春宜.2型糖尿病合并周围神经病变患者心率减速力与心率变异性的相关性分析[J].蚌埠医学院学报,2017,42(2):243-245.
[10]齐连芬,刘忻,方业明,等.心率减速力评估2型糖尿病患者自主神经功能的价值[J].中国循证心血管医学杂志,2017,9(3):356-359.
[11]徐春芳,黄芬,杨晓云,等.急性脑梗死伴高血压患者的心率减速力与心率变异性研究[J].中国心脏起搏与心电生理杂志,2015,29(2):139-142.
[12]薛妮娜,岳平.糖尿病患者心率减速力与心率变异性分析[J].岭南心血管病杂志,2012,18(3):227-229.
[13]金铃胆,翁志远,徐丽娟,等.糖尿病患者心率减速力和心率变异性等指标的检测分析[J].福建医药杂志,2015,37(6):131-133.
[14]吴丽华.心率减速力预测老年糖尿病患者心血管事件[J].临床心电学杂志,2015,24(6):429-430.
