3 种组织保存方法在进行流式细胞倍性分析和DNA 含量测定中影响比较研究
2018-04-16茆安婷尹玉伟郭曦尧李月红
茆安婷, 尹玉伟, 代 静, 郭曦尧, 程 义, 李 东, 李月红
(吉林农业大学, 吉林 长春130118)
多倍体是具有3 套或更多染色体组的生物体,在植物中最为常见,约95%的蕨类植物和所有的被子植物均为多倍体[1-2]。 近年来,通过对鲫鱼的DMRT1 保守基因的分析,发现其存在额外两轮的多倍化。 虽然多倍体存在着一些如导致细胞结构变化,造成细胞减数分裂困难和表观遗传不稳定等缺点,但是一旦其成功适应这些变化,可能促进生物进化成功并丰富物种多样性[3]。 多倍体在全球分布广泛,其中寒冷地区生物频率高于温带地区,说明多倍体更能抵御恶劣的环境。 简言之,多倍体的产生为个体和种群带来巨大优势,也正是这些优势成为多倍体水产动物的优良性状,从而使多倍体成为水产养殖中一类重要的物种[4-10]。
流式细胞仪为检测手段的技术称为流式细胞术,具有检测速度快、纯度高、变异系数小、可多参数测量、灵敏度高且操作简便等特点。 该研究选用低温冻存组织、乙醇固定组织和活体组织采样直接检测3 种方法,运用流式细胞术进行花羔红点鲑DNA 含量和倍性分析的效果进行对比,探究不同方法对样品检测结果的影响,优化实验条件,减小误差,便于更好的开展鱼类遗传育种及保护利用研究。
1 材料与方法
1.1 材料
花羔红点鲑(Salvelinus malma)采自吉林省白山市森源冷水鱼场,暂养于实验室9 ℃水中。 EPC细胞系为实验室保存。
1.2 样品制备 低温冻存组织的采集:花羔红点鲑经乙二醇苯醚麻醉后液氮速冻30 min,后移至-80 ℃保存36 h,于自封袋中蒸馏水解冻,融化后剪取胸鳍装于干净的自封袋中,置于冰上备用。
乙醇固定组织的采集:花羔红点鲑经乙二醇苯醚麻醉,剪取胸鳍置于70%乙醇离心管中4 ℃保存36 h 备用。
活体组织采集:花羔红点鲑经乙二醇苯醚麻醉后,剪取胸鳍装于干净自封袋中,置于冰上备用。
细胞染色:将鳍条组织放入平皿后加入1 mL PBS,用两大小眼科镊子磨成匀浆状,200 目筛网过滤到1.5 mL 离心管内,1 000 r/min 离心15 min。PBS 洗涤两次,弃去上清液。 加入1 mL 冰浴预冷的70%乙醇,轻轻吹打混匀,4 ℃固定2 h,之后离心弃去上清液。 加入1 mL 冰浴预冷的PBS 重悬细胞,再次离心弃去上清液,轻弹离心管分散细胞。 向每管中依次加入染色缓冲液、碘化丙啶染色液(PI)和RNaseA。 37 ℃避光温浴30 min。 使用EPC 作为内参,染色方法相同。
1.3 细胞检测和数据分析 染色后的细胞使用流式细胞仪(BD FACSCalibur)进行检测,激光波长488 nm,依据样品情况设置参数Height-FSC 等。 花羔红点鲑倍性测定采用EPC 细胞系作为内参,流速控制在每秒150 ~300 个细胞,每次检测10 000 个细胞,每个样品检测3 次。 检测结果由流式细胞仪的FlwoJo 软件对数据进行分析。
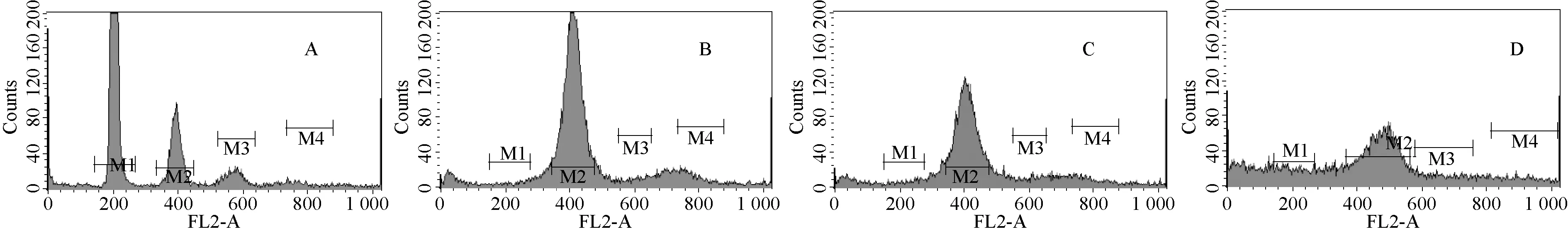
图1 EPC(A)、活体组织(B)、70%乙醇固定(C)、低温冻存组织(D)流式检测直方图

图2 EPC(A)、活体组织(B)、70%乙醇固定(C)、低温冻存组织(D)流式检测散点图

图3 EPC(A)、活体组织(B)、70%乙醇固定(C)、低温冻存组织(D)FL2 A-FL2 W 宽度图
2 结果与分析
2.1 不同方法保存鳍条组织流式结果分析 花羔红点鲑鳍条组织3 种不同保存方法的检测结果见图1,流式检测直方图中横坐标代表荧光面积,纵坐标为细胞数量。 图1A 为EPC(鲤鱼上皮细胞),由图像可见明显单峰,细胞数量足且分裂旺盛,周期明显,二倍体波峰对称性好,可以作为样品的可信内参。 图1B 为活体组织细胞,四倍体波峰处有明显单峰,波峰左右对称性好,重复试验时结果稳定,表明实验效果理想。 图1C 为70%乙醇固定组织细胞,四倍体处有明显单峰,但从纵坐标来看细胞数量相对较少,表明该方法在试验中形成了细胞碎片导致检测结果不理想,重复试验时结果不及活体样品,但在条件限制的情况下,该方法可作为实验材料短期保存的手段之一。 图1D 为冻存组织细胞,出现细胞粘连,细胞数量少,杂峰较多,从图中已经无法分辨细胞周期,该方法结果不理想,不适合作为组织保存方案。 图3 的FL2A -FL2W 宽度图中FL2 -A 为荧光峰面积,反映DNA 含量,FL2 -W 代表荧光的脉冲宽度,可以区分单个细胞和细胞粘连体。 该图中反映样品倍性信息,R2 门中富集的细胞为二倍体,R3 门中富集的细胞为四倍体,R4 为六倍体,依此规律类推。 被检测样品细胞富集在R3 中,圈门时应注意去除FL2 -A 相同而脉冲宽度较大的呈梯形分布的细胞粘连体。
2.2 不同方法保存鳍条组织DNA 含量和倍性分析 以鲤鱼上皮细胞DNA 含量为参比,3 种保存方法后测得DNA 相对含量如图4 所示,结果见表1。 3 种保存方法测得的DNA 含量大小为活体组织<乙醇固定<低温冻存。 每种方法均进行3 次重复试验以减小试验误差。 在3 种被测的样品中,经过低温保存的样品出现较多杂峰,表明这种保存方法不能保证细胞的完整性,在制备细胞悬液时破碎的细胞较多,并形成粘连体,得出结果可信度不高。
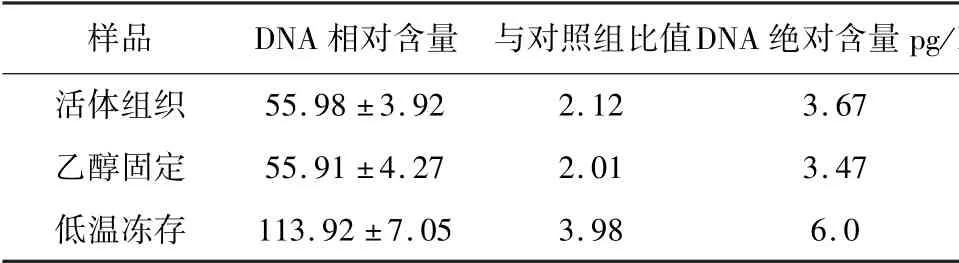
表1 3 种保存方法测得DNA 含量
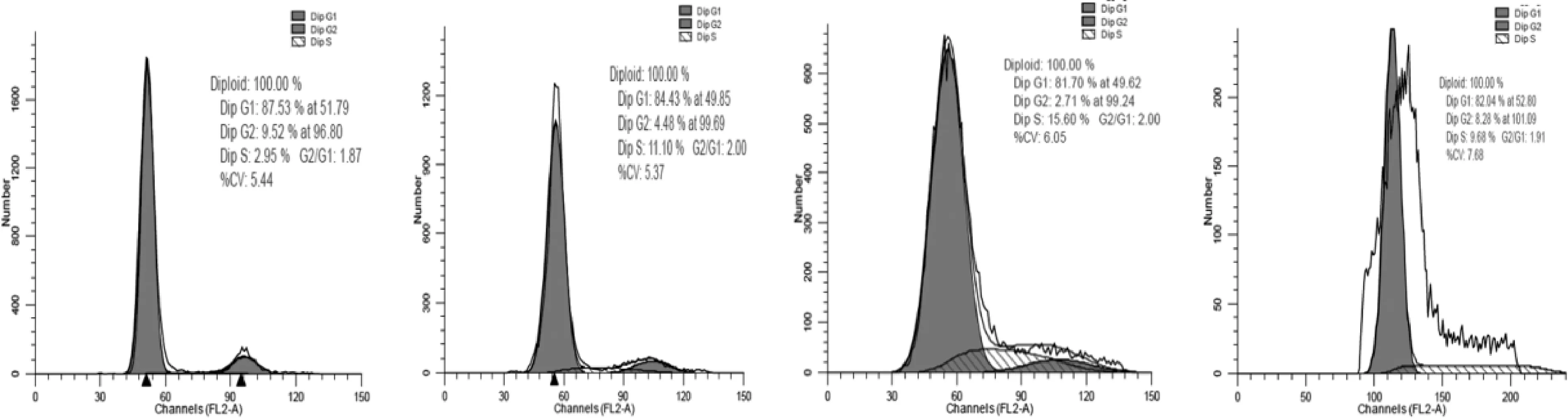
图4 EPC(A)、活体组织(B)、70%乙醇固定(C)、低温冻存组织(D)相对DNA 含量直方图
2.3 多倍体流式结果分析 所有检测样品中,测得1 例样品为多倍体(图5)。 采用活体组织处理的方法,在EPC 作为内参的条件下,六体波峰间有较明显单峰,但由于样品多次重复试验细胞数量不足。在DNA 含量方面,六倍体个体比四倍体具有稍多的DNA 含量,猜测在进化程度上较四倍体高级。
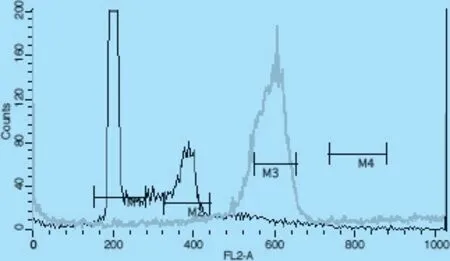
图5 六倍体流式细胞检测直方图
3 讨论
鲑鱼中的染色体数目存在广泛变异,基于其基因组大小和染色体臂数接近二倍体鱼类的两倍,鲑科鱼类同源四倍体起源学说已被提出[11-13]。 随着基因组复制或外来基因的整合,包括基因组与原始基因组结合的诸多生物学问题,都有待于进一步探究重复的基因在这些水生生物后代中产生的作用。花羔红点鲑属我国吉林与黑龙江省特产的冷水鱼类,对环境要求极高。 由于气候、环境、人为因素干扰等原因已处于濒危状态,被列入《中国东北地区珍稀濒危动物志》。 除自然产生的多倍体外,也可以考虑人工诱导花羔红点鲑多倍体以提高抗逆性能,丰富其物种数量,挽救濒危物种。
文章通过3 种不同花羔红点鲑鳍条组织保存方法流式实验发现,活体采集的新鲜鳍条组织在进行实验时效果最好,在制备单细胞悬液时效果理想,细胞数量充足,数据分析过程中可见明显峰图,重复试验时结果稳定。 70%乙醇4 ℃短期保存的鳍条组织波峰明显,最高峰对称性良好,图像可见细胞周期分明,DNA 含量与新鲜组织相比结果接近,在制备单细胞悬液时出现的少量粘连体可以通过设门进行有效剔除,排除其对实验结果的影响。 低温冻存鳍条组织的方法不能较好的保证细胞的完整性,出现大量细胞碎片,不能给实验提供可信结果。
近年流式细胞实验的选材多选血液,而鳍条组织在样品采集过程中简单易得,制备过程难度较小,所得细胞数量充足,杨红喜等[14]以鳍条组织作为实验材料能够作为流式细胞分析的替代材料并且获得良好的实验结果。 本研究首次利用流式细胞技术,探究了花羔红点鲑在DNA 含量及倍性方面的信息,为开展该物种染色体组工程组学的研究提供了基础资料,同时实验有待于充实多倍体生物样本,深入探究花羔红点鲑四倍体与多倍体之间生长性能、免疫能力上的差异,更广泛而确切的揭示基因组和基因变化特征的问题,建立良好的模型支持,为多倍体形成的普遍规律提供有利数据和理论基础。
